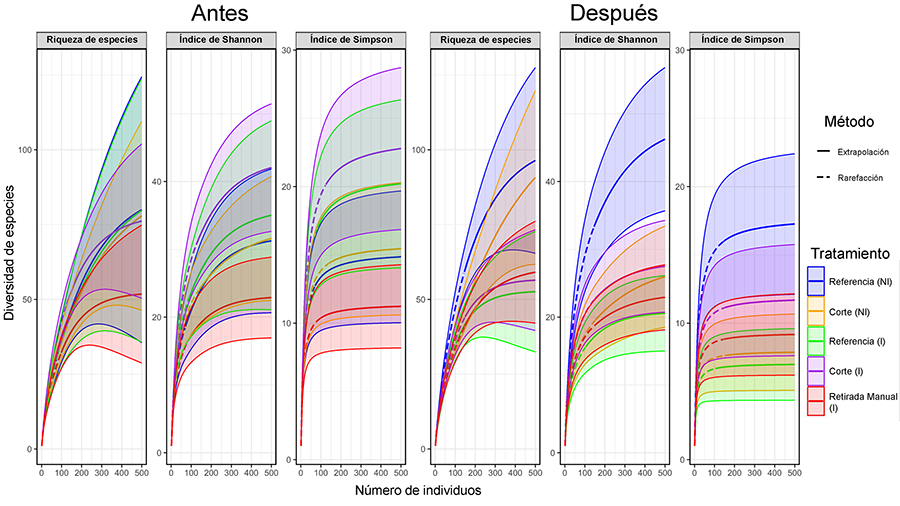
Figura 4. Curvas de acumulación (rarefacción y
extrapolación) con un 95 % de intervalo de confianza (sombreado) para la
riqueza de artrópodos según varios métodos antes y después de la aplicación de
los tratamientos. Representadas con abreviaturas NI (No Invadida) e I
(Invadida). Representada en azul las parcelas referencia no invadidas, en
amarillo, las de corte no invadidas, en verde, las de referencia
invadidas, en morado, las de corte invadidas y en rojo, las de
retirada manual invadidas.
Figure 4. Accumulation curves (rarefaction and
extrapolation) with a 95% confidence interval (shaded) for arthropod richness
according to various methods before and after treatment application. Represented
with the abbreviations NI (Non-Invaded) and I (Invaded). Represented in blue
the non-invaded reference plots, yellow the non-invaded cut, green the invaded
reference, purple the invaded cut and pink the invaded uprooting.
Discusión
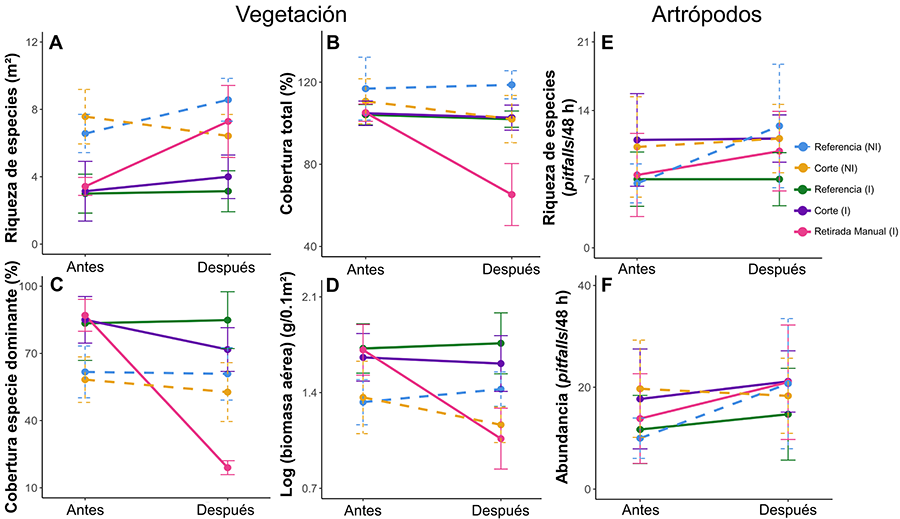
Nuestros resultados evidencian el impacto de T.
fluminensis sobre la comunidad vegetal, tal como han demostrado diversos
estudios previos en las últimas décadas mediante distintos enfoques (Standish et al. 2001; McAlpine
et al. 2015). En nuestro caso, este efecto se aprecia claramente al
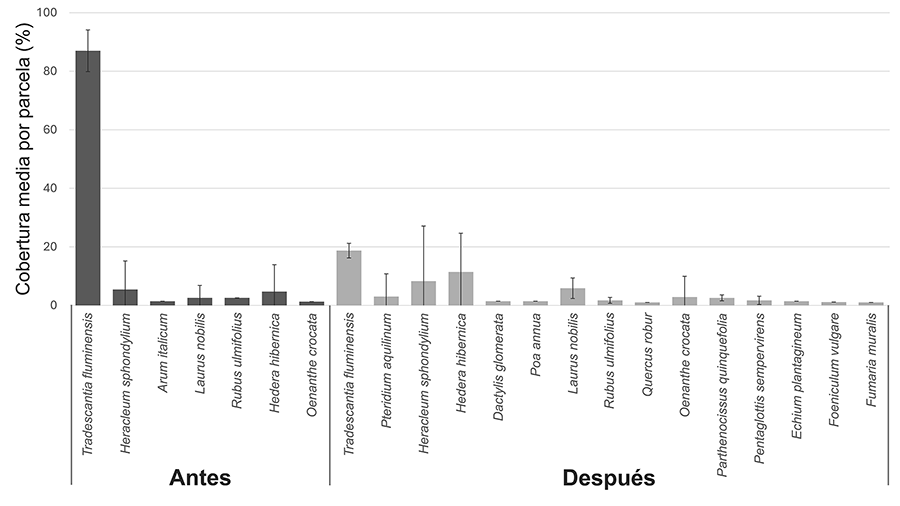
analizar los datos de cobertura de la especie dominante en cada parcela, ya que
la parte aérea en las zonas invadidas está completamente dominada por T.
fluminensis, con valores que oscilan entre el 75 % y el 100 % en
la mayoría de las parcelas estudiadas. Estos valores se correlacionan
positivamente con los elevados niveles de biomasa aérea registrados en zonas
invadidas, que triplican los obtenidos en zonas no invadidas. Las formaciones
vegetales densas generadas por la invasora reducen la irradiancia y la
disponibilidad de recursos en los estratos inferiores, dificultando el
establecimiento de especies típicas de comunidades riparias. De hecho,
observamos que T. fluminensis desplaza principalmente especies nativas
de gramíneas, helechos, algunas compuestas y ciertas umbelíferas, alterando y
empobreciendo la composición de especies propias del sotobosque de ribera.
En cuanto a los tratamientos, la retirada manual resultó ser
el método más eficaz, tanto en términos de erradicación como de sucesión
secundaria temprana. No solo se logró reducir la cobertura de T. fluminensis
en torno a un 70 %, sino que varias especies nativas recuperaron espacio
en estos suelos. Además, este tratamiento permitió mantener, dos meses después,
una cobertura de T. fluminensis inferior al 25 %, umbral por debajo
del cual sus impactos son menores (O’Loughlin et al. 2021). Grupos generalmente
desplazados por T. fluminensis, como gramíneas y helechos han aparecido
en zonas donde no estaban presentes con anterioridad (p. ej., D. glomerata,
P. annua, Pteridium aquilinum (L.) Kuhn). Las especies de sotobosque
ripario capaces de convivir con T. fluminensis incrementaron su
cobertura tras la retirada (p. ej., H. hibernica, Heracleum
sphondylium L. u Oenanthe crocata L.). Esta retirada completa de la
biomasa de T. fluminensis deja un suelo inicialmente desnudo que, lejos
de permanecer así, favorece la regeneración de vegetación nativa, la cual comienza
a crecer gracias a la mayor disponibilidad de luz solar y a la menor
competencia por el espacio.
Estudios previos señalan que la retirada manual, realizada
de forma pormenorizada y con seguimiento en el tiempo, aumenta la riqueza de
plantas y reduce la cobertura de T. fluminensis (Clarkson et al. 2023). Por ello, resulta prioritario identificar
qué especies herbáceas perennes pueden ocupar este espacio y competir con la
invasora en el caso de que hubiera rebrotes. Algunas candidatas podrían ser las
que logran convivir con la invasora, como H. hibernica o H.
sphondylium, o especies propias de hábitats similares que, por altura y
porte resulten difícilmente desplazables, como Pentaglottis
sempervirens (L.) Tausch ex L.H.Bailey o Filipendula
ulmaria (L.) Maxim. Además, la retirada regular puede frenar el
establecimiento de otras plantas invasoras como C. x crocosmiiflora u
Oxalis pes-caprae L., observadas en algunas parcelas de retirada manual.
También reduciría la probabilidad de recolonización de T. fluminensis a
partir de zonas colindantes a través de fragmentos de la invasora que lleguen a
esas zonas.
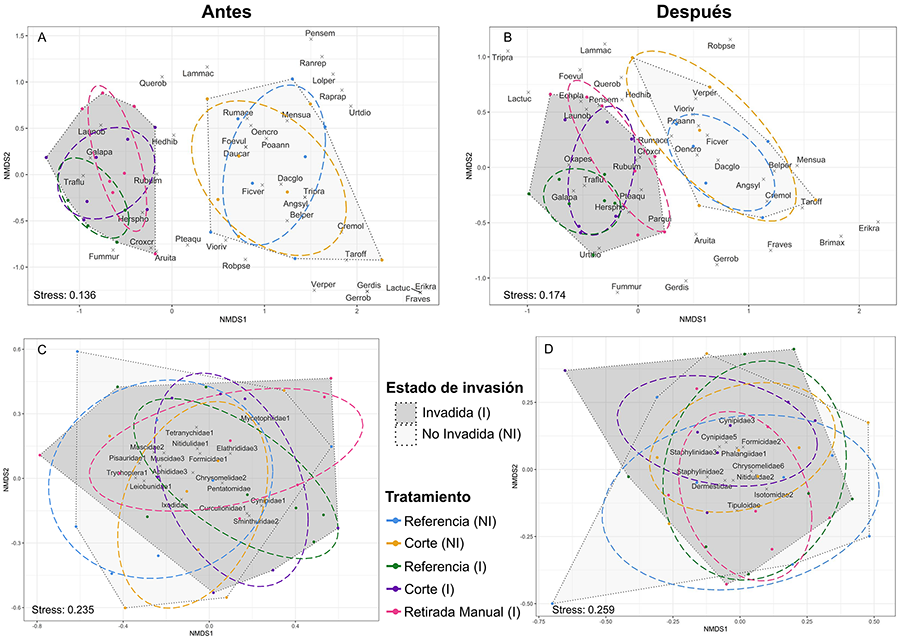
Nuestros análisis de diversidad beta y composición de
especies confirman la recuperación parcial de la comunidad vegetal en las zonas
donde se realizó la retirada manual de T. fluminensis. Si bien este
método requiere un esfuerzo inicial considerable, retirando manualmente la
biomasa aérea de la invasora, ofrece resultados evidentes a corto plazo. Otros
métodos, como el sombreado artificial, también han mostrado eficacia en el
control de T. fluminensis (Standish 2002); método que incluso ha sido aplicado para
otras plantas invasoras formadoras de matas, como las del género Carpobrotus
(Lazzaro et al. 2023). El uso de herbicidas también es
efectivo para eliminar a la invasora, pero al no ser selectivo afecta a la
vegetación nativa, reduciendo el éxito de una posible recuperación (Lusk et al. 2012). Hay que tener en cuenta que ambos
métodos presentan limitaciones en entornos fluviales: las mallas de sombreo pueden
ser arrastradas por crecidas e inundaciones, introduciendo residuos en el curso
del río, y los herbicidas pueden llegar a las masas de agua, generando riesgos
de contaminación química.
Actualmente, el corte con maquinaria sigue siendo el método
más habitual para reducir la presencia de T. fluminensis (observación
personal). Sin embargo, nuestros resultados demuestran que es un método
ineficiente, pues en apenas 2 meses la especie recupera su cobertura previa y
vuelve a tapizar la superficie donde se aplicó el corte. La dispersión y
crecimiento de otras plantas invasoras con reproducción sexual pueden verse
controladas mediante el corte en determinados momentos de su fenología (Valliere et al. 2019; Fagúndez
y Sánchez 2024), pero en T. fluminensis no es efectivo, al no utilizar este tipo de reproducción fuera de su
distribución nativa y tener un comportamiento perenne. Al cortarla se
liberan numerosos fragmentos de la planta, que tienen capacidad de enraizar y
continuar creciendo (Kelly y Skipworth 1984), por lo que mantener
esta práctica como habitual resulta contraproducente.
Otro punto a destacar es que, gracias a la recolonización de
gramíneas y otras herbáceas derivada de la retirada manual de T. fluminensis,
se generó una estructura vegetal favorable para los artrópodos epígeos. Este
efecto también se ha documentado tras la retirada de otras invasoras tapizantes,
como Carpobrotus spp. (Braschi et al. 2021). Sin
embargo, no observamos esto en las parcelas donde aplicamos el corte. El
desbroce de vegetación suele ir ligado al empleo de metodologías más agresivas
y mecanizadas, con efectos perjudiciales para los insectos (Steidle et al. 2022; Berger et
al. 2024). Incluso empleando un método menos agresivo (cuchilla de mano), observamos
impactos negativos en comparación con las zonas referencia, donde la emergencia
de individuos con el avance de la primavera fue mayor. El corte de vegetación
puede disminuir la aptitud biológica de las poblaciones de artrópodos, ya sea
por la muerte directa de individuos, la disrupción de las interacciones
tróficas o la reducción de zonas de cobijo que estos organismos encuentran en
la vegetación (Hess et al. 2024). En nuestro caso, el corte de vegetación
en las zonas invadidas y no invadidas produjo un movimiento inicial de
artrópodos, lo que derivó en una mayor recolección de individuos en marzo y
favoreció la presencia de ciertos grupos capaces de refugiarse entre la hojarasca
tras el corte (Porcellonidae, Formicidae o Armadillidae). Sin embargo, con el
rebrote de la vegetación, dos meses después, no se produjo una mayor
recolección de artrópodos epígeos, corroborando lo observado por Berger
et al. (2024). Aun así, esta actuación resultó más beneficiosa que la
inacción en las zonas invadidas, ya que se obtuvieron valores de riqueza y
abundancia superiores a los registrados en las parcelas referencia invadidas.
Aunque el impacto de las herbáceas invasoras sobre los artrópodos epígeos suele
ser menor que el de especies arbóreas invasoras (Van Hengstum et al. 2013), estos organismos son
sensibles a múltiples variables ambientales, y el corto periodo transcurrido
podría no haber sido suficiente para evidenciar cambios en la composición de
las comunidades. De hecho, otros estudios han necesitado varios años para
detectar procesos de recuperación ecológica de la comunidad de artrópodos tras
la eliminación de especies invasoras (Heleno et al. 2010; Maoela et al.
2016).
Las plantas invasoras representan una de las principales
amenazas asociadas al declive de insectos (Núñez-González et al. 2024). Sus impactos no solo
son evidentes para los estratos de vegetación o en el suelo, sino que también
pueden conllevar una reducción de la diversidad taxonómica de los insectos y
una alteración en la composición de las comunidades (Rodríguez et al.
2024). Estudios previos sobre el impacto de T. fluminensis en la
entomofauna destacaron que, debido a su invasión, se produce una reducción en la
abundancia y riqueza de especies de artrópodos epígeos (Standish 2004). Nuestros datos muestran que este impacto
solo fue evidente en el segundo muestreo (Después), donde observamos que las
zonas referencia invadidas presentaban una menor abundancia y riqueza de
especies en comparación con las zonas no invadidas o aquellas invadidas donde
se aplicaron los tratamientos. En cambio, en ninguna de las dos fechas
observamos un impacto sobre la composición de especies en las zonas invadidas;
a diferencia de lo observado para otras plantas invasoras en latitudes
similares de la península ibérica (Rodríguez et al. 2020a; Rodríguez
et al. 2021). En esta línea, enfocándose en grupos concretos como coleópteros
y dípteros, Toft
et al. (2001) no lograron documentar un efecto claro debido a la
invasión de T. fluminensis. Por tanto, sería de interés explorar otras
metodologías de muestreo en futuros trabajos, con el fin de complementar el
conocimiento actual y determinar si existen impactos aún no documentados.
Resulta importante mencionar la limitación temporal y
espacial de este estudio. En futuras aproximaciones a la respuesta de las
comunidades vegetales y de artrópodos ante mecanismos de control para T.
fluminensis, sería recomendable ampliar las localizaciones (p. ej.,
incluyendo muestreos en diferentes ríos), así como aumentar el número de
muestreos y/o aplicaciones de los tratamientos. De este modo, se podría
prolongar el periodo de seguimiento y evaluar con mayor precisión la respuesta
a largo plazo de estos organismos. Otra opción a considerar sería aplicar la
retirada manual de la especie dominante en zonas no invadidas, lo que
permitiría comparar cómo la retirada de gramíneas, umbelíferas o H.
hibernica (especies dominantes en nuestras parcelas no invadidas) afecta a
la regeneración de otras plantas, así como a la composición de la comunidad de
artrópodos.
Este estudio arroja luz sobre la dinámica de regeneración de
la vegetación y las posibles estrategias de gestión en zonas invadidas por T.
fluminensis. Sin embargo, para reducir de manera efectiva su cobertura y
fomentar la restauración pasiva a largo plazo, es necesario continuar
investigando esta especie en distintos niveles ecológicos. En las zonas
invadidas parece existir un banco de semillas diverso, compuesto por especies
que, en presencia de T. fluminensis, son incapaces de establecerse
debido a la falta de luz y espacio (datos no publicados). La elevada densidad y
el porte de las manchas de la invasora probablemente impiden que las especies
capaces de germinar alcancen estratos superiores donde les llegue la luz solar,
siendo muy pocas las que consiguen sobrepasarla (Jäger et al. 2024). Además, hay que tener en cuenta que T.
fluminensis podría estar liberando substancias alelopáticas al medio que
dificulten la germinación de otras plantas, como se ha observado en Tradescantia
spathacea (Kyaw y Kato-Noguchi 2021). La erradicación completa
de este tipo de especies suele ser una quimera, pero podría bastar con reducir
de forma estable su cobertura por debajo de un 20-25 %, umbral a partir
del cual sus impactos negativos sobre la vegetación se disparan (O’Loughlin et al. 2021). Estos impactos son más
severos en zonas fluviales que en el resto de ambientes que consigue colonizar (Zeil-Rolfe et al. 2024). Por ello, los ecosistemas de
ribera deben ser las zonas prioritarias de control sobre T. fluminensis.
Identificar especies perennes propias de ribera, con hábito tapizante, porte
intermedio y buenas cualidades competidoras podría ayudar a evitar que supere
ese umbral de cobertura. Esto ayudaría a frenar su expansión y permitir el
establecimiento de especies autóctonas propias de estos ambientes sombríos y
húmedos.
Conclusiones
La presencia de T. fluminensis afecta negativamente a
las comunidades vegetales, provocando un descenso en la riqueza de plantas
debido a la gran cantidad de biomasa aérea que produce. Este impacto se
extiende también a la riqueza y abundancia de artrópodos en los muestreos
realizados en la primavera tardía en mayo. En cuanto a los métodos de control,
nuestros resultados sugieren que la retirada manual es una estrategia adecuada
para controlar T. fluminensis. Esto favorece la sucesión secundaria
temprana, ya que numerosas especies vegetales son capaces de emerger en pocas
semanas y establecerse en zonas previamente invadidas. La gran reducción en
cobertura de T. fluminensis conseguida con la retirada manual facilita
este proceso. En cambio, el corte mecánico no favorece la reducción de la
cobertura de T. fluminensis ni genera el espacio necesario para la
recolonización de otras especies de plantas. En base a esto, consideramos
necesario establecer seguimientos a largo plazo para evaluar la evolución de las
comunidades vegetales en el contexto de una restauración ecológica exitosa.
Esto requiere de monitorizaciones periódicas y la retirada de posibles
rebrotes. Además, los futuros trabajos deberían abordar el estudio de grupos
concretos de artrópodos, dada su gran diversidad morfológica y funcional.
También sería conveniente explorar metodologías de muestreo complementarias que
permitan detectar posibles diferencias en las comunidades de artrópodos aéreos
o incluir análisis de la microbiota del suelo, con el fin de evaluar
alteraciones en el ciclo de nutrientes, la diversidad funcional y las
relaciones tróficas. Estos aspectos son clave para comprender y promover una
posible restauración ecológica de los espacios invadidos por T. fluminensis.
Contribución de los autores
Felipe González-Outeiriño: Conceptualización,
Metodología, Investigación, Análisis, Redacción – borrador original, Redacción
– revisión y edición. Aarón Loira-García: Investigación y Revisión. Rubén
Retuerto: Administración del proyecto y Revisión. Jonatan Rodríguez:
Conceptualización, Metodología, Investigación, Análisis, Revisión y Adquisición
de Fondos.
Disponibilidad de datos y código
Todos los datos generados o analizados durante este estudio
se encuentran disponibles en el repositorio: https://doi.org/10.6084/m9.figshare.29597924
Financiación, permisos requeridos, potenciales
conflictos de interés y agradecimientos
Los autores declaran no tener ningún conflicto de interés.
Este trabajo es resultado del proyecto RENATUR_OUTES
‘Renaturalización fluvial del Río Tines a su paso por el municipio de Outes –
Actuaciones dirigidas a la restauración de ecosistemas fluviales’ con el apoyo
de la Fundación Biodiversidad en la convocatoria de ayudas para el fomento de
actuaciones dirigidas a la restauración de ecosistemas fluviales y a la
reducción del riesgo de inundación en los entornos urbanos españoles a través
de soluciones basadas en la naturaleza, correspondiente al año 2021 en el marco
del Plan de Recuperación, Transformación y Resiliencia (PRTR), financiado por
la Unión Europea – NextGenerationEU.
Referencias
Barrientos, J.A. 2004. Curso
Práctico de Entomología. Manuals de la Universitat Autònoma de Barcelona.
41. Entomologia. Asociación Española de Entomología, CIBIO-Centro
Iberoamericano de Biodiversidad y Universitat Autònoma de Barcelona, Barcelona,
España. 947 pp.
Bartoń, K. 2025. MuMIn: Multi-Model Inference. https://doi.org/10.32614/CRAN.package.MuMIn
Baselga, A.,
Orme, C.D.L. 2012. betapart: an R package for the
study of beta diversity. Methods in Ecology and Evolution 3: 808-812. https://doi.org/10.1111/j.2041-210X.2012.00224.x
Bates, D., Mächler, M., Walker, S. 2015. Fitting Linear Mixed-Effects
Models Using lme4. Journal of Statistical Software 67: 1-48. https://doi.org/doi:10.18637/jss.v067.i01
Bellot, F. 1951. Adiciones a la
flora gallega. Anales del Jardín Botánico de Madrid 10: 383-387.
Berger, J.L., Staab, M., Hartlieb, M., Simons, N.K., Wells, K., Gossner,
M.M., Vogt, J. et al. 2024. The day after mowing: Time and type of mowing
influence grassland arthropods. Ecological Applications 34: e3022. https://doi.org/10.1002/eap.3022
Braschi, J., Hélard, O., Mazzia, C., Oger, P., Ponel, P., Buisson, E. 2021.
Impacts of the removal of invasive Carpobrotus on spider assemblage
dynamics. Biodiversity and Conservation 30: 497-518. https://doi.org/10.1007/s10531-020-02102-6
Brauns, M., Allen, D.C., Boëchat, I.G., Cross, W.F., Ferreira, V.,
Graeber, D., Patrick, C.J. et al. 2022. A global synthesis of human
impacts on the multifunctionality of streams and rivers. Global Change
Biology 28: 4783-4793. https://doi.org/10.1111/gcb.16210
Brundu, G. 2015. Plant invaders in European and Mediterranean inland
waters: profiles, distribution, and threats. Hydrobiologia 746:
61-79. https://doi.org/10.1007/s10750-014-1910-9
Calvo de Anta, R., Macías,
F. 1992. Suelos de la provincia de La Coruña. Colección de Mapas
1:50.000. ISBN: 978-84-86040-70-3.
Chao, A., Chiu, C.-H., Jost, L. 2014.
Unifying Species Diversity, Phylogenetic Diversity, Functional
Diversity, and Related Similarity and Differentiation Measures Through Hill
Numbers. Annual Review of Ecology, Evolution, and Systematics 45:
297-324. https://doi.org/10.1146/annurev-ecolsys-120213-091540
Chinery, M. 2006. Guía de los
insectos de Europa. 4aed. Ediciones Omega, Barcelona, España.
Christie, A.P., Amano, T., Martin, P.A., Shackelford, G.E., Simmons, B.I.,
Sutherland, W.J. 2019. Simple study designs in ecology produce inaccurate
estimates of biodiversity responses Louzada, J. (ed.),. Journal of Applied
Ecology 56: 2742-2754. https://doi.org/10.1111/1365-2664.13499
Clarkson, B.R., Cave, V.M., Bartlam, S., Watts, C.H., Thornburrow, D.,
Paynter, Q. 2023. Status of forest remnants invaded by tradescantia ( Tradescantia
fluminensis Vell.) following introduction of biocontrol beetles and manual
clearance after three years. New Zealand Journal of Botany1-25. https://doi.org/10.1080/0028825X.2023.2279297
Dosskey, M.G., Vidon, P., Gurwick, N.P., Allan, C.J., Duval, T.P.,
Lowrance, R. 2010. The Role of Riparian Vegetation in Protecting and Improving
Chemical Water Quality in Streams 1. JAWRA Journal of the
American Water Resources Association 46: 261-277. https://doi.org/10.1111/j.1752-1688.2010.00419.x .
Dugdale, T.M., McLaren, D.A.,
Conran, J.G. 2015. The Biology of Australian Weeds 65. Tradescantia
fluminensis Vell. Plant Protection Quarterly 30(4):116.
Fagúndez,
J., Sánchez, A. 2024. High variability and multiple
trade‐offs in reproduction and growth of the invasive grass. Weed
Research 64: 251-260. https://doi.org/10.1111/wre.12631
Fowler, S.V., Barreto, R., Dodd, S., Macedo, D.M., Paynter, Q.,
Pedrosa-Macedo, J.H., Pereira, O.L., et al. 2013. Tradescantia
fluminensis, an exotic weed affecting native forest regeneration in New
Zealand: Ecological surveys, safety tests and releases of four biocontrol
agents from Brazil. Biological Control 64: 323-329. https://doi.org/10.1016/j.biocontrol.2012.11.013
Green, R.H. 1979. Sampling design and statistical methods for
environmental biologists. John Wiley & Sons.
Heleno, R., Lacerda, I., Ramos, J.A., Memmott, J. 2010. Evaluation of
restoration effectiveness: community response to the removal of alien plants. Ecological
Applications 20: 1191-1203. https://doi.org/10.1890/09-1384.1
Hess, M.C., Samways, M.J., Buisson, E. 2024. Reconciling invasive alien
species management and insect conservation in terrestrial ecosystems. In: Rodriguez,
J., Pyšek, P., Novoa, A. (eds.). Biological Invasions and Global Insect
Decline, pp. 259-289. Academic Press, Elsevier.
Hood, W.G.,
Naiman, R.J. 2000. Vulnerability of riparian zones
to invasion by exotic vascular plants. Plant Ecology 148: 105-114.
Hsieh, T., Chao, A. 2024. iNEXT: Interpolation and Extrapolation for Species
Diversity. https://doi.org/10.32614/CRAN.package.iNEXT
Hurrell, G.A., Belton, T., Lusk, C.S., Lamoureaux, S.L. 2012. Tradescantia
management in a New Zealand National Park. Ecological Management &
Restoration 13: 311-314. https://doi.org/10.1111/j.1442-8903.2012.00664.x
Jäger, H., San-José, M., Peabody, C., Chango, R., Sevilla, C. 2024.
Restoring the threatened Scalesia forest: insights from a decade of invasive
plant management in Galapagos. Frontiers in Forests and Global Change 7:
1350498. https://doi.org/10.3389/ffgc.2024.1350498
Kelly, D.,
Skipworth, J.P. 1984. Tradescantia fluminensis
in a Manawatu (New Zealand) forest: I. Growth and effects on regeneration. New
Zealand Journal of Botany 22: 393-397. https://doi.org/10.1080/0028825X.1984.10425270
Kyaw, E.H.,
Kato-Noguchi, H. 2021. Assessment of allelopathic
activity of Tradescantia spathacea Sw. for weed control. Biologia
Futura 72: 489-495. https://doi.org/10.1007/s42977-021-00098-w
Lazzaro, L., Mugnai, M., Ferretti, G., Giannini, F., Giunti, M., Benesperi,
R. 2023. (Not) sweeping invasive alien plants under the carpet: results from
the use of mulching sheets for the control of invasive Carpobrotus spp. Biological
Invasions 25: 2583-2597. https://doi.org/10.1007/s10530-023-03059-7
Lenth, R.V. 2024. emmeans: Estimated Marginal Means, aka Least-Squares
Means. https://doi.org/10.32614/CRAN.package.emmeans
Lusk, C.S., Hurrell, G.A., Lamoureaux, S.L. 2012. Native plant and weed
diversity in forest remnants affected by Tradescantia fluminensis
management. New Zealand Plant Protection 65: 74-80. https://doi.org/10.30843/nzpp.2012.65.5428
Maoela, M.A., Roets, F., Jacobs, S.M., Esler, K.J. 2016. Restoration of
invaded Cape Floristic Region riparian systems leads to a recovery in
foliage-active arthropod alpha- and beta-diversity. Journal of Insect
Conservation 20: 85-97. https://doi.org/10.1007/s10841-015-9842-x
Martínez-Arbizu, P. 2020. pairwiseAdonis: Pairwise multilevel comparison using
adonis. https://github.com/pmartinezarbizu/pairwiseAdonis
McAlpine, K.G., Lamoureaux, S.L., Westbrooke, I. 2015. Ecological impacts of
ground cover weeds in New Zealand lowland forests. New Zealand Journal of
Ecology 39(1):50-60 39: 50-60.
McGavin, G. 2000. Manuales de identificación. Insectos,
arañas y otros artrópodos terrestres. Ediciones Omega. Barcelona, España.
Núñez-González, N., Novoa,
A., Pyšek, P., Rodríguez, J. 2024. Biological invasions: a
global threat to insect diversity. In: Rodriguez, J., Pyšek, P., Novoa, A.
(eds.). Biological Invasions and Global Insect Decline, pp. 1-15. Academic
Press. Elsevier.
Oksanen, J., Simpson, G.L., Blanchet, G., Kindt, R., Legendre, P., Michin,
R., O’Hara, R.B., et al. 2022. vegan: Community Ecology Package. https://doi.org/10.32614/CRAN.package.vegan
O’Loughlin, L.S., Panetta, F.D., Gooden, B. 2021. Identifying thresholds in
the impacts of an invasive groundcover on native vegetation. Scientific
Reports 11: 20512. https://doi.org/10.1038/s41598-021-98667-5
Pardini, E.A., Parsons, L.S., Ştefan, V., Knight, T.M. 2018. GLMM BACI
environmental impact analysis shows coastal dune restoration reduces seed
predation on an endangered plant. Restoration Ecology 26: 1190-1194. https://doi.org/10.1111/rec.12678
Pyšek, P., Hulme, P.E., Simberloff, D., Bacher, S., Blackburn, T.M.,
Carlton, J.T., Dawson, W. et al. 2020. Scientists’ warning on invasive
alien species. Biological Reviews 95: 1511-1534. https://doi.org/10.1111/brv.12627
Qian, H., Guo, Q. 2010. Linking biotic homogenization to habitat type,
invasiveness and growth form of naturalized alien plants in North America. Diversity
and Distributions 16: 119-125. https://doi.org/10.1111/j.1472-4642.2009.00627.x
R Core Team. 2025. R: A Language and Environment for Statistical Computing. https://www.r-project.org/
Richardson, D.M., Holmes, P.M., Esler, K.J., Galatowitsch, S.M., Stromberg,
J.C., Kirkman, S.P., Pyšek, P., Hobbs, R.J. 2007. Riparian
vegetation: degradation, alien plant invasions, and restoration prospects. Diversity
and Distributions 13: 126-139. https://doi.org/10.1111/j.1366-9516.2006.00314.x
Riis, T., Kelly-Quinn, M., Aguiar, F.C., Manolaki, P., Bruno, D.,
Bejarano, M.D., Clerici, N. et al. 2020. Global Overview of Ecosystem
Services Provided by Riparian Vegetation. BioScience 70: 501-514. https://doi.org/10.1093/biosci/biaa041
Rivas-Torres, A., Graça,
M.A.S., Landeira-Dabarca, A., Álvarez, M., Juen, L., Cordero-Rivera, A. 2025. Eucalyptus globulus Afforestation
Reduces Invertebrate Richness and Diversity in Streams. Hydrobiology 4:
16. https://doi.org/10.3390/hydrobiology4020016
Rockström, J., Steffen, W., Noone, K., Persson, Å., Chapin, F.S.I., Lambin,
E., Lenton, T.M. et al. 2009. Planetary Boundaries: Exploring the Safe
Operating Space for Humanity. Ecology and Society 14: 1-33. https://doi.org/10.5751/ES-03180-140232
Rodríguez, J., Thompson, V.,
Rubido-Bará, M., Cordero-Rivera, A., González, L. 2019. Herbivore
accumulation on invasive alien plants increases the distribution range of
generalist herbivorous insects and supports proliferation of non-native insect
pests. Biological Invasions 21: 1511-1527. https://doi.org/10.1007/s10530-019-01913-1
Rodríguez, J., Cordero-Rivera,
A., González, L. 2020a. Characterizing arthropod communities
and trophic diversity in areas invaded by Australian acacias. Arthropod-Plant
Interactions 14: 531-545. https://doi.org/10.1007/s11829-020-09758-5
Rodríguez, J., Novoa, A., Cordero-Rivera, A., Richardson, D.M., González, L. 2020b.
Biogeographical comparison of terrestrial invertebrates and trophic feeding
guilds in the native and invasive ranges of Carpobrotus edulis. NeoBiota
56: 49-72. https://doi.org/10.3897/neobiota.56.49087
Rodríguez, J., Cordero-Rivera,
A., González, L. 2021. Impacts of the invasive plant Carpobrotus
edulis on herbivore communities on the Iberian Peninsula. Biological
Invasions 23: 1425-1441. https://doi.org/10.1007/s10530-020-02449-5
Rodríguez, J., Pyšek, P., Novoa, A. 2024. Biological Invasions and Global
Insect Decline. Academic Press. Elsevier.
Rodríguez-Guitián,
M.A., Ramil-Rego, P. 2007. Clasificaciones climáticas aplicadas a Galicia:
revisión desde una perspectiva biogeográfica. Recursos
Rurais 31-53. https://doi.org/10.15304/rr.id5318
Seabloom, E.W., Kinkel, L., Borer, E.T., Hautier, Y., Montgomery, R.A.,
Tilman, D. 2017. Food webs obscure the strength of plant diversity effects on
primary productivity Casper, B. (ed.),. Ecology Letters 20: 505-512. https://doi.org/10.1111/ele.12754
Seitz, J.C.,
Clark, M.W. 2016. Identification, Biology, and
Control of Small-Leaf Spiderwort (Tradescantia fluminensis): A Widely
Introduced Invasive Plant: SL428/SS652, 1/2016. EDIS 2016: 7. https://doi.org/10.32473/edis-ss652-2016
Standish, R.J. 2002. Experimenting with methods to control Tradescantia
fluminensis, an invasive weed of native forest remnants in New Zealand. New
Zealand Journal of Ecology 26: 2.
Standish, R.J. 2004. Impact of an invasive clonal herb on epigaeic
invertebrates in forest remnants in New Zealand. Biological Conservation
116: 49-58. https://doi.org/10.1016/S0006-3207(03)00172-1
Standish, R.J., Robertson, A.W., Williams, P.A. 2001. The impact of an
invasive weed Tradescantia fluminensis on native forest regeneration. Journal
of Applied Ecology 38: 1253-1263. https://doi.org/10.1046/j.0021-8901.2001.00673.x
Standish, R.J., Williams, P.A., Robertson, A.W., Scott, N.A., Hedderley,
D.I. 2004. Invasion by a Perennial Herb Increases Decomposition Rate and Alters
Nutrient Availability in Warm Temperate Lowland Forest Remnants. Biological
Invasions 6: 71-81. https://doi.org/10.1023/B:BINV.0000010127.06695.f4
Steidle, J.L.M., Kimmich, T., Csader, M., Betz, O. 2022. Negative impact of
roadside mowing on arthropod fauna and its reduction with ‘arthropod‐friendly’
mowing technique. Journal of Applied Entomology 146: 465-472. https://doi.org/10.1111/jen.12976
Tabacchi, E., Lambs, L., Guilloy, H., Planty-Tabacchi, A.-M., Muller, E.,
Décamps, H. 2000. Impacts of riparian vegetation on hydrological processes. Hydrological
Processes 14: 2959-2976. https://doi.org/10.1002/1099-1085(200011/12)14:16/17<2959::AID-HYP129>3.0.CO;2-B
Toft, R.J., Harris, R.J., Williams, P.A. 2001. Impacts of the weed Tradescantia
fluminensis on insect communities in fragmented forests in New Zealand. Biological
Conservation 102: 31-46. https://doi.org/10.1016/S0006-3207(01)00091-X
Underwood, A.J. 1993. The mechanics of spatially replicated sampling
programmes to detect environmental impacts in a variable world. Australian
Journal of Ecology 18: 99-116. https://doi.org/10.1111/j.1442-9993.1993.tb00437.x
Valliere, J.M., Balch, S., Bell, C., Contreras, C., Hilbig, B.E. 2019.
Repeated mowing to restore remnant native grasslands invaded by nonnative
annual grasses: upsides and downsides above and below ground. Restoration
Ecology 27: 261-268. https://doi.org/10.1111/rec.12873
Van Hengstum, T., Hooftman, D.A.P., Oostermeijer, G.B., van Tienderen, P. 2013.
Impact of plant invasions on local arthropod communities: a meta-analysis. Journal
of Ecology 102: 4-11. https://doi.org/10.1111/1365-2745.12176
Varela, Z., Rodríguez, J., Boquete,
T. 2024. Desafíos de la mediterraneización para la preservación de la
diversidad de briófitos en ríos ibéricos. Ecosistemas 33: 26-32. https://doi.org/10.7818/ECOS.2632
Vilà, M., Espinar, J.L., Hejda, M.,
Hulme, P.E., Jarošík, V., Maron, J.L., Pergl, J. et al. 2011. Ecological impacts of invasive alien plants: a meta-analysis of
their effects on species, communities and ecosystems: Ecological impacts of
invasive alien plants. Ecology Letters 14: 702-708. https://doi.org/10.1111/j.1461-0248.2011.01628.x
Weidenhamer,
J.D., Callaway, R.M. 2010. Direct and Indirect
Effects of Invasive Plants on Soil Chemistry and Ecosystem Function. Journal
of Chemical Ecology 36: 59-69. https://doi.org/10.1007/s10886-009-9735-0
Zeil-Rolfe, I., O’Loughlin, L., Gooden, B. 2024. Habitat context and
functional growth traits explain alien plant invader impacts on native
vegetation communities. Biological Invasions 26: 2663-2679. https://doi.org/10.1007/s10530-024-03338-x
Anexos / Annex
Anexo 1: Distribución de las áreas de
muestreo
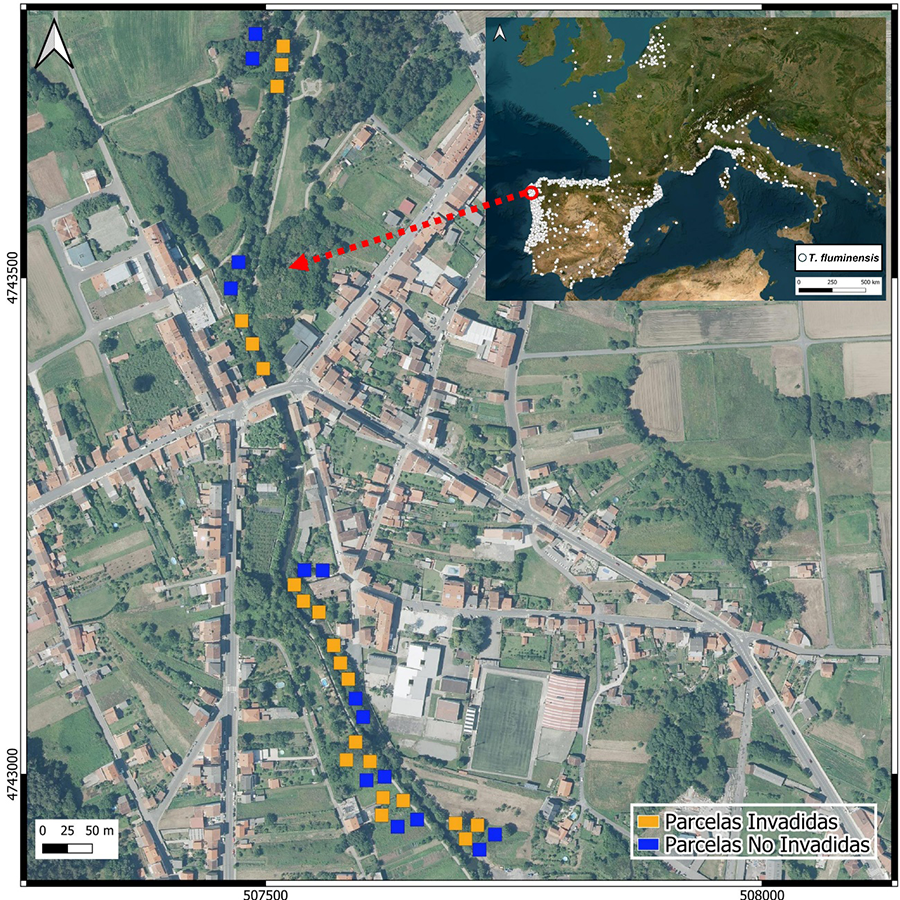
Figura A1. Áreas de muestreo a lo
largo del río Tins (Outes), en naranja (Parcelas Invadidas por T.
fluminensis) y en azul (Parcelas No Invadidas). En la parte superior
derecha aparece representada con puntos blancos el área de distribución actual
de T. fluminensis en el suroeste de Europa (GBIF, 2025). El círculo rojo
representa la ubicación del área de trabajo.
Figure A1.
Sampling areas along the Tins River (Outes), in orange (Plots invaded by T. fluminensis) and in blue (Non-Invaded
Plots). In the upper right corner, the current distribution area of T. fluminensis in southwestern Europe is
shown with white dots (GBIF, 2025). The red circle represents the location of
the study area.
Anexo 2:
Tabla de caracterización de las áreas de muestreo
Tabla A2. Tabla de caracterización de las áreas
de muestreo. Incluye información geográfica (UTM, centroide del área), información
sobre la vegetación (familia arbórea predominante y procedencia de la misma) y
diversos parámetros edáficos (Temperatura, humedad, pH y conductividad
eléctrica). Medidas tomadas el mismo día y bajo condiciones similares. Se
muestran representadas las diferentes áreas (formadas cada una por tres
parcelas en el caso de las invadidas y dos en el caso de las no invadidas).
Table A2. Characterization of the sampling areas. Includes geographical
information (UTM, area centroid), vegetation data (predominant tree family and
its origin), and various edaphic parameters (temperature, moisture, pH, and
electrical conductivity). Measurements were taken on the same day under similar
conditions. Each area consisting of three plots in the case of invaded sites
and two in the case of non-invaded ones.
Anexo 3: Esquema del diseño experimental
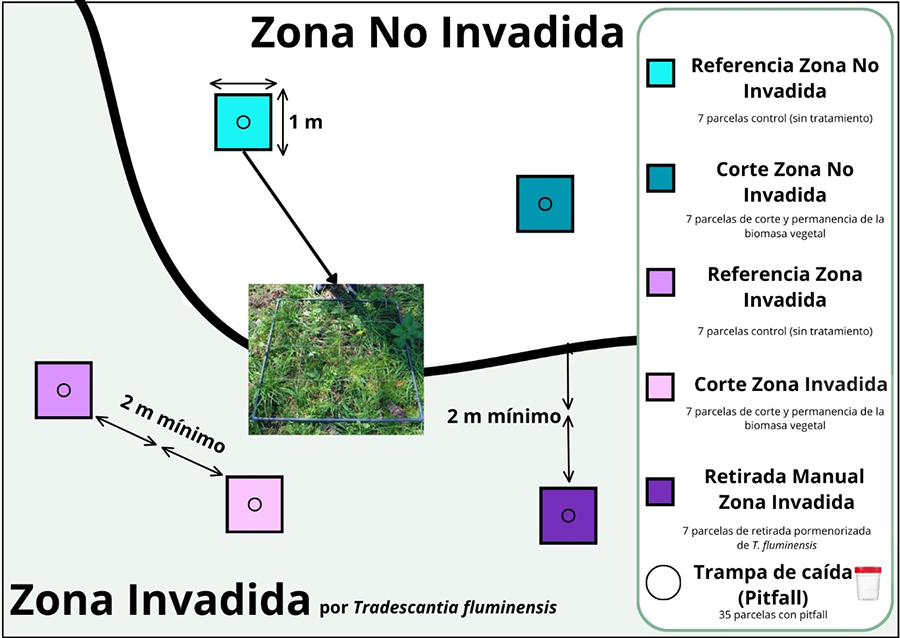
Figura A3. Esquema de
diseño experimental. Representación aproximada de las parcelas y tratamientos en
cada área de muestreo.
Figure A3. Experimental
design diagram. Approximate representation of the plots and treatments in each
sampling area.
Anexo 4:
Inventario de especies de plantas
Tabla A4. Inventario de especies vegetales
encontradas en las 21 parcelas invadidas y las 14 no invadidas tanto antes como
después de los tratamientos.
Table A4. Inventory of plant species recorded in 21 invaded and 14
non-invaded areas, before and after treatments.
Anexo 5:
Resultados del post hoc
Tabla A5. Resultado de la prueba post hoc
comparando por niveles las diferencias en la diversidad beta de los diferentes
tratamientos antes y después de su aplicación. “Inv” representa parcelas
invadidas y “NoInv” parcelas no invadidas. Los asteriscos indican diferencias
estadísticas *, p < 0.05; **, p
< 0.01; ***, p < 0.001. Valores
en negrita indican significancia a p ≤ 0.05.
Table A5. Results
of the post hoc test comparing beta diversity differences across treatment
levels before (Antes) and after (Después) its application. “Inv” stands for
invaded plots and “NoInv” for non-invaded plots. Asterisks indicate statistical
differences *, p <
0.05; **, p < 0.01; ***, p < 0.001. Bold values indicate
significance at p ≤
0.05.
Anexo 6: Resultados del análisis
PERMDISP
Tabla A6. Resultados del análisis multivariante
de homogeneidad de dispersión (PERMDISP, 999 permutaciones) de las diferencias
en áreas invadidas por T. fluminensis en la comunidad vegetal y de
artrópodos en función del estado de invasión y los tratamientos aplicados
(Antes y Después). En el caso de la vegetación se hizo a partir de una matriz
de disimilitud de Jaccard y en el caso de los artrópodos a partir de una matriz
de disimilitud de Bray-Curtis. Aparecen indicados los grados de libertad (g.
l.), el valor de F del análisis de la varianza, la probabilidad asociada
(Pr(>F)) y la varianza explicada (calculada como la proporción de la
suma de cuadrados del factor respecto a la suma total de cuadrados). Los
asteriscos indican diferencias estadísticas *, p
< 0.05; **, p < 0.01; ***, p
< 0.001. Valores en negrita indican significancia a p ≤ 0.05.
Table A6. Results of the multivariate analysis of homogeneity of dispersion
(PERMDISP, 999 permutations) assessing differences in areas invaded by T. fluminensis in plant and arthropod
communities as a function of invasion status and applied treatments (Before and
After). For vegetation, the analysis was performed using a Jaccard
dissimilarity matrix, and for arthropods, using a Bray–Curtis dissimilarity
matrix. The table shows the degrees of freedom (g. l.), the F value from the analysis of variance
(valor de F), the
associated probability (Pr(>F)), and the explained variance (Varianza explicada, calculated as
the proportion of the sum of squares of the factor relative to the total sum of
squares). Asterisks indicate statistical significance *, p < 0.05; **, p
< 0.01; ***, p <
0.001. Bold values indicate significance at p ≤ 0.05.
Anexo 7:
Resultado de las comparaciones BACI
Tabla A7. Efecto BACI sobre las diferentes
variables. Los tratamientos son el impacto y se estudian antes y después de
aplicarlos, comparándose con las respectivas zonas control. Los asteriscos
indican diferencias estadísticas *, p < 0.05; **, p < 0.01; ***, p <
0.001. Valores en negrita indican significancia a p ≤ 0.05.
Table A7.
BACI effect over different parameters. Treatments act as the impact and we
studied their effects comparing before and after (“Antes-Después”) with the
control plots. Asterisks indicate statistical differences *, p < 0.05; **, p
< 0.01; ***, p <
0.001. Bold values indicate significance at p ≤ 0.05.
![]() , Aarón
García-Loira1
, Aarón
García-Loira1 ![]() , Rubén Retuerto1
, Rubén Retuerto1 ![]() , Jonatan
Rodríguez2,*
, Jonatan
Rodríguez2,* ![]()