"Ahora que hemos comprobado con tristeza la impermanencia
del conocimiento ecológico y que tenemos que reconstruirlo porque el mundo ha
pasado a ser otro, hagámoslo bien, empecemos otra vez por el principio"
–Carlos M. Herrera (18 de marzo de 2025). Última frase del
discurso de investidura como Doctor Honoris Causa. Universidad de Jaén, Jaén,
España.
Introducción
Los ectosimbiontes permanentes de las aves ofrecen un
experimento natural idóneo para abordar numerosas cuestiones en ecología y
evolución, de forma análoga al de los clásicos sistemas insulares (Darwin 1859; MacArthur y
Wilson 1967; Koop et al. 2014; Lapoint y Whiteman 2021). Esto se debe,
fundamentalmente, a sus singulares modos de vida: completan su ciclo de vida
íntegramente sobre el hospedador y presentan mecanismos de transmisión
relativamente simples: transmisión vertical (anual, de adultos a pollos) y
horizontal (mediante contactos intra e interespecíficos). En este contexto, los
piojos de las aves se han consolidado como un sistema modelo en estudios de
coevolución, particularmente a escala macroevolutiva (Clayton
et al. 2015). Gracias a su estudio, se han caracterizado patrones generales
de codiversificación así como los factores clave que modulan estas
interacciones (Johnson y Clayton 2004; Sweet y Johnson 2018). De manera similar, otro
grupo de interés son los ácaros de las plumas, que ofrecen un sistema
comparable al de los piojos (Jovani 2003) y que se han
establecido como un modelo en el estudio de la naturaleza de las relaciones
hospedador-simbionte (Jovani et al. 2017; Doña et al. 2019a; Labrador et
al. 2024).
La diversidad de ectosimbiontes de las aves es notable. En
el caso de los ácaros, pueden distinguirse varios grupos en función de su
localización en el ave y adaptación al microhábitat: desde los que ocupan el
cuerpo (Astigmata: Analgidae), las cavidades nasales (Mesostigmata:
Rhynonyssideae) o el raquis de las plumas (Trombidiformes: Syringophilidae),
hasta los denominados ácaros de las plumas (Astigmata: Analgoidea y
Pterolichoidea), grupo en el que se centra este trabajo (Fig.
1; Dabert y Mironov 1999; Proctor 2003). Por otro lado, los piojos de las aves (Fig. 2) se dividen en dos clados principales: los
Ischnocera (Phthiraptera: Ischnocera, principalmente plumícolas) y los
Amblycera (Phthiraptera: Amblycera, mayoritariamente hematófagos; de Moya et al. 2019; Johnson et
al. 2022). Dentro de los Ischnocera, además, se reconocen distintos
morfotipos (piojos del ala, de la cabeza, del cuerpo y generalistas) que
reflejan la especialización en nichos ecológicos específicos del hospedador (Kolenčík et al. 2024).
En las últimas décadas, los
avances en metodologías experimentales, ecología molecular y genómica han
supuesto un gran avance para el estudio de estas interacciones. Técnicas como
el DNA Barcoding y el DNA metabarcoding han contribuido a
catalogar la diversidad (Doña et al. 2015a), así como
a entender dinámicas de dispersión complejas en los ácaros de las plumas (Doña et al. 2019b). Asimismo, los análisis genómicos y
filogenómicos han esclarecido el origen de los linajes actuales (Johnson et al. 2022) y han revelado los factores
principales que controlan aspectos poblacionales centrales de los piojos de las
aves (Doña y Johnson 2023). No obstante,
persisten carencias notables en la estandarización de protocolos de muestreo y
metodologías moleculares, lo que limita el poder comparativo entre estudios y
dificulta el avance experimental. Esta revisión se propone, en parte,
sistematizar los avances recientes en estas áreas (muestreo, metodologías
moleculares y experimentación), con el fin de avanzar hacia un marco
metodológico más unificado que estimule y ayude a futuras investigaciones sobre
la biología, ecología y evolución de estos ectosimbiontes.

Figura 1. Ácaros de las plumas en la parte
ventral de las plumas del ala (A). Toma de muestras con una aguja bajo
la lupa binocular (B). Uso de guantes, hisopos desechables y mascarilla
para estudios que requieran minimizar al máximo la contaminación de las
muestras (C). Tubo de rosca para garantizar que no se evapore el alcohol
(D).
Figure 1. Feather mites on the ventral side of wing feathers (A). Sample collection using a needle
under a stereomicroscope (B). Use of disposable gloves, swabs, and a face mask for studies that require minimizing sample contamination (C. Screw-cap tube to prevent alcohol evaporation (D).

Figura 2. Vista dorsal de piojos hematófagos
(Amblycera: Menoponidae; Izquierda: ninfa, Derecha: Adulto) colectados en un
pollo de urraca (Pica pica). Crédito: Pedro J. Sandoval Cortés,
Departamento de Zoología, Universidad de Granada.
Figure 2. Dorsal
view of blood-feeding lice (Amblycera: Menoponidae; left: nymph, right: adult)
collected from a magpie chick (Pica pica). Credit: Pedro J. Sandoval
Cortés, Department of Zoology, University of Granada.
Metodologías de muestreo
La Figura 3 presenta de
forma muy esquemática los pasos más recomendados para el conteo y la colecta de
ácaros y piojos. A continuación, se describen con más detalle cada una de estas
metodologías y otras consideraciones adicionales.
Muestreo de ácaros de las plumas
Conteos
Los ácaros que habitan en las plumas de vuelo de las aves se
pueden contar poniendo las alas o la cola a contraluz (Fig.
1). En general, la luz
natural indirecta ofrece mejores resultados que la luz artificial que suele dar
peor resultado. En caso de utilizar luz artificial, puede mejorarse la
visibilidad colocando un papel o plástico translúcido entre el foco de luz y el
ala o la cola del ave. Observando la pluma a contraluz desde la parte dorsal
(lo que permite visualizar los ácaros tanto en la cara dorsal como la ventral
de las plumas), los ácaros se ven como pequeñas “motas de polvo” de alrededor
de medio milímetro de longitud. Es frecuente que se dispongan en forma de
cadenas a lo largo de las barbas de la parte ventral de la pluma (Fig. 1). Algunos géneros como Trouessartia se
han adaptado a vivir en la parte dorsal de las plumas (Dabert y Mironov 1999; Mestre
et al. 2011; Fernández-González et al.
2015); estos ácaros son algo más grandes y pueden contarse a contraluz como
el resto de ácaros o directamente observando la pluma dorsalmente, con la luz
incidiendo desde arriba sobre el ala.
Los ácaros pueden llegarse a contar a simple vista, aunque
es recomendable usar lupas de 5 a 10 aumentos, que permanezcan sujetas con la
mano o montadas en gafas o viseras. Otra opción es disponer el ala del ave bajo
una lupa binocular (óptica o digital; Fig. 1).
Este enfoque resulta especialmente útil en estudios que requieran alta
precisión en los conteos, ya que permite hacer fotografías o vídeos para
realizar los conteos posteriormente.
Se debe prestar especial atención a dos posiciones de los
ácaros que los hacen especialmente difíciles de localizar. Por un lado, muchos
ácaros se disponen adheridos al raquis de la pluma. Por otro, las plumas
cobertoras del ala también pueden albergar ácaros (tanto ventral como
dorsalmente) pertenecientes a las mismas especies que se encuentran en las
plumas de vuelo. Se ha sugerido que no merece la pena el esfuerzo de contar
ácaros en las cobertoras de aves paseriformes, alegando que es necesario arrancar
las plumas y que estas casi nunca tienen ácaros (Behnke
et al. 1999). Nuestra experiencia indica que, si bien estas plumas
frecuentemente están libres de ácaros, a veces pueden estar completamente
infestadas, incluso en individuos con pocos ácaros en las plumas de vuelo (ver
más abajo). Además, aunque el conteo en cobertoras es más complejo por la
interferencia con otras plumas (primarias, secundarias o infracobertoras), es
posible contar los ácaros en las cobertoras alares sin necesidad de extraer
ninguna pluma; basta con extender adecuadamente el ala y realizar el conteo.
La decisión sobre dónde (por
ejemplo, sólo en las plumas de vuelo del ala) y cómo (conteo total por pluma, o
por secciones de pluma) hacer los conteos depende de los objetivos específicos
del estudio. De todas formas, se deben tener en cuenta algunas consideraciones
generales importantes. La distribución de los ácaros en las alas y cola de las
aves no es aleatoria. Un estudio realizado en 49 currucas capirotadas (Sylvia
atricapilla) muestreadas en dos días en una misma localidad (Jovani y Serrano 2004) mostró que, aunque la
distribución de los ácaros a lo largo del ala variaba notablemente entre
individuos, esta era extremadamente simétrica entre ambas alas de una misma
ave. En cada ave, se contaron los ácaros de cada pluma primaria, secundaria y
terciaria de las dos alas. Se vio que la distribución a lo largo del ala
difería mucho entre aves, pero que era extremadamente simétrica entre las dos
alas de una misma ave. Además, aunque el número total de ácaros variaba mucho
entre individuos, era muy similar entre las dos alas de un mismo individuo. De
esto podemos extraer varias enseñanzas. Si el objetivo es cuantificar el número
total de ácaros que tiene un ave en sus alas, podría ser suficiente contar solo
una de ellas. En cambio, si solo se cuentan los ácaros de solo unas pocas
plumas, estos datos pueden no ser comparables ni siquiera entre individuos de
la misma especie de ave, debido a la alta variabilidad en su distribución.
Aunque en algunas especies de aves la distribución de ácaros puede ser más consistente
entre individuos, esto deber ser demostrado antes de hacer un estudio. En
cualquier caso, para las comparaciones entre especies, no es recomendable
contar ácaros solo en unas pocas plumas. Además, múltiples factores pueden
influir y modificar la distribución de los ácaros a lo largo del tiempo. Por
ejemplo, se ha observado que la temperatura exterior afecta a la distribución a
lo largo del ala (Dubinin 1951; Wiles
et al. 2000), y se sospecha que la humedad también tiene un efecto (Dubinin 1951; McClure 1989).
Por lo tanto, es fundamental realizar un muestreo lo más completo posible para
evitar atribuir diferencias estacionales en la abundancia de ácaros a cambios
reales en el tamaño poblacional, cuando podrían deberse a una redistribución de
los ácaros hacia zonas más visibles del ala en determinadas épocas del año.
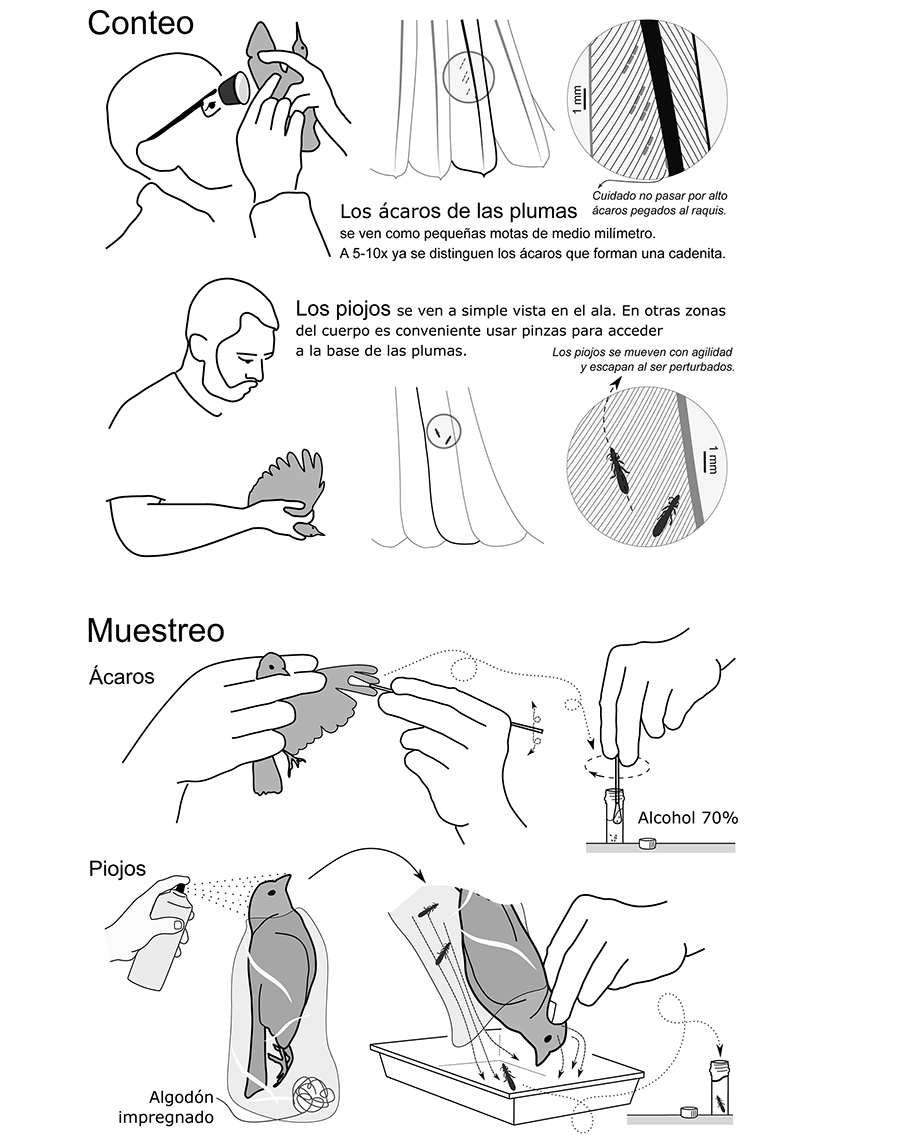
Figura 3. Diagrama simplificado de conteo
(arriba) y colecta (abajo) de ácaros y piojos de las plumas.
Figura 3. Simplified
diagram of counting (top) and sampling (bottom) of feather mites and lice.
Otra consideración a tener en cuenta es que las especies de
ave difieren considerablemente en la abundancia de ácaros que albergan.
Algunas, como el mosquitero común (Phylloscopus collybita) rara vez
tienen más de diez ácaros, mientras que otras como la alondra ricotí (Chersophilus
duponti) pueden tener cientos o incluso más de mil ácaros en un solo ala (Díaz-Real et al. 2014). Esto implica que el conteo
individual de todos los ácaros de un ave no siempre es la opción más práctica.
Dependiendo de las preguntas del estudio, la abundancia esperada de ácaros en
la especie, las consideraciones logísticas del estudio y del tipo de análisis
estadístico que se pretenda aplicar, se pueden utilizar métodos alternativos de
conteo. Una opción es utilizar métodos semicuantitativos, como el desarrollado
por Behnke et al. (1999), especialmente útil en
estudios intraespecíficos, aunque es necesario validarlo previamente
comparándolo con conteos más precisos. Otra aproximación es realizar los
conteos a partir de fotografías. Aunque el pequeño tamaño de los ácaros, la
curvatura de las alas y el solapamiento de las plumas, incluso en un ala
extendida, dificultan capturar toda su distribución en una sola imagen, se
pueden realizar múltiples fotografías de una misma ala o cola para conseguir un
registro más completo. Con fotografías de buena calidad, no solo es posible
contar los ácaros, sino también digitalizar su posición e incluso identificar
su edad y sexo. Por ejemplo, Labrador et al. (2022),
mediante fotografías tomadas en diferentes momentos de la noche de las mismas
aves, pudieron registrar los movimientos de los ácaros según edades calculando
la posición de cada ácaro a la punta de la pluma. Otra manera sería realizar
fotos o video a través de una lupa binocular o un microscopio digital.
Colecta
Una manera muy sencilla, rápida y recomendable de muestrear
los ácaros de las plumas consiste en usar un hisopo humedecido con etanol
absoluto, cogido directamente del mismo microtubo en el que se conservarán los
ácaros (Fig. 1). Es recomendable usar microtubos
con cierre hermético como los microtubos con tapón de rosca y junta tórica (Fig. 1) para evitar la evaporación del etanol. Es
importante usar un hisopo nuevo para cada ave con el fin de prevenir
contaminaciones cruzadas. El procedimiento puede verse en el video titulado
“Como muestrear ácaros de las plumas” (https://youtu.be/UioLTVsYmtw?
feature=shared; https://doi.org/10.6084/m9.figshare.29245592).
No se ha observado que los ácaros se desprendan del ave al ser guardada en las
bolsas de ropa (talegas) comúnmente usadas durante el anillamiento científico
de aves (Fernández-González et al. 2013).
Sin embargo, si el estudio lo requiere, se pueden usar bolsas de papel
desechables (o sobres de tamaño apropiado) así como guantes de látex, para
reducir al máximo posibles transferencias de ácaros entre aves (Doña et al. 2019b).
El uso de una lupa binocular es también una opción muy útil
para aplicaciones especiales. Esta técnica puede ser recomendable para estudios
donde se pretende estudiar las características de los ácaros dependiendo de su
posición en la pluma, o si se requiere de un muestreo concreto de ciertos
grupos de edad o sexo. Por ejemplo, para identificar especies, los ácaros
machos (adultos) son más fáciles de identificar y suelen ser la clase de
edad/sexo más escasa. Bajo la lupa, localizar los machos es relativamente
sencillo, así como muestrearlos con la ayuda de una aguja de acero, donde los
ácaros se adhieren fácilmente solo con tocarlos ligeramente (Fig.
1). Es importante desechar la aguja después de muestrear cada ave o, si
no se puede, revisarla minuciosamente bajo la lupa antes de reutilizarla. Dubinin (1951; p.327) recomienda humedecer la aguja con
agua para facilitar la adherencia de los ácaros.
Muestreo de piojos
Muestrear piojos de aves es una tarea laboriosa, que incluye
técnicas específicas para su captura, identificación y cuantificación. El
método a emplear varía dependiendo de si el ave está viva o muerta, del tipo de
piojo (por ejemplo, si habita en las alas o el cuerpo) y de los objetivos y
necesidades del estudio (ya sea realizar conteos, análisis moleculares o cría
en cautividad). Se han desarrollado y evaluado diferentes métodos, entre los
que destacan:
Conteos
Este procedimiento requiere del uso de ambas manos: una para
sujetar al ave (de espaldas) y otra para manipular las plumas, las cuales
pueden moverse con pinzas o soplando. Es importante considerar que los piojos
son bastante móviles y que el ave puede moverlos al utilizar las patas (por
esto, algunos autores recomiendan inmovilizar las patas del ave con una cinta
de velcro). A diferencia de los ácaros, algunos piojos pueden quedarse en la
bolsa donde se guardó el ave, o incluso transferirse a las manos del
investigador, por lo que se recomienda usar guantes de látex blancos y bolsas
de papel de un solo uso para evitar contaminaciones cruzadas y facilitar su
localización.
El método más utilizado y recomendado es el conteo
estructurado siguiendo una secuencia y tiempos definidos para garantizar
consistencia y comparabilidad (Clayton 1991; Clayton y Drown 2001). El examen, que duraría un
total de 3 minutos, se realiza en cinco pasos: (1) zonas ventrales de las
plumas primarias y secundarias de las alas (1 minuto), (2) zona ventral de las
plumas de la cola (30 segundos), (3) región abdominal cercana a la quilla (30
segundos), (4) parte dorsal (30 segundos) y (5) rabadilla (30 segundos).
Existen también métodos más simples, como el propuesto por Hunter y Colwell (1994), que consiste en contar
los piojos de una única zona del cuerpo, como la cabeza. Aunque práctico, puede
pasar por alto especies que no habitan esa región del ave. Sin embargo, podría
ser útil cuando la especie de piojo objetivo se encuentra exclusivamente en un
área específica del ave, como en el caso de Columbicola passerinae, que
se ubica casi exclusivamente en la cabeza de sus hospedadores. En algunos
estudios, se han usado aproximaciones categóricas, donde se asignan
puntuaciones visuales a distintas regiones del ave (por ejemplo: 1 = bajo; 2 =
moderado; 3 = alto; 4 = muy alto). Luego se suman los valores para obtener una
estimación semicuantitativa de la abundancia (Booth et
al. 1993).
Una consideración generalizada es que los conteos visuales
de piojos son más fiables (i.e. ofrecen una medida más cercana a la abundancia
total de piojos del ave) en los piojos del cuerpo que en los de las alas (Clayton y Drown 2001). Otro aspecto para tener en
cuenta es la muda: en aves que están mudando las estimaciones de abundancias
tienden a subestimarse (Moyer et al. 2002a). El tipo
y densidad del plumaje también influye en la precisión de los conteos. Por
ejemplo, en palomas bravías (Columba livia), un examen de 3 minutos
permitió contabilizar el 12% del total de piojos recuperados posteriormente. En
cambio, en vencejos comunes (Apus apus), con un plumaje menos denso y
piojos relativamente más grandes, se contabilizó una media del 82% (Walther y Clayton 1997). En el caso del
estornino pinto (Sturnus vulgaris), la única especie de paseriforme
donde se ha evaluado la eficacia de los conteos, estos capturaron el 14% del
total de piojos, pero representaron el 68% de la variación entre individuos.
Por tanto, puede considerarse un buen método para estimar abundancias (Koop y Clayton 2013). La estacionalidad también
influye en la abundancia de piojos: las poblaciones suelen ser más grandes
justo antes de la reproducción de las aves (Galloway
y Lamb 2021). Sin embargo, factores abióticos como la humedad pueden tener
un efecto aún mayor. En zonas áridas, por ejemplo, las poblaciones de piojos
tienden a ser más pequeñas y la prevalencia más baja (Moyer
et al. 2002b).
También puede considerarse la presencia de los huevos de los
piojos como un indicador indirecto de abundancia. Estos suelen encontrarse en
zonas del cuerpo que el ave no alcanza con el pico, como en las infracobertoras
(Nelson y Murray 1971). No obstante, su uso
como proxy de la abundancia tiene limitaciones (Lee y Clayton 1995). En algunos casos, se
encuentran numerosos huevos eclosionados (aplanados y sin opérculo) sin
presencia de piojos vivos, que podrían haber muerto o emigrado hace tiempo (Clayton y Walther 1997).
Una estrategia recomendable que seguir, por tanto, sería
realizar pruebas piloto en la especie de ave y piojo de interés, a lo largo de
diferentes estaciones. Esto permite familiarizarse con el sistema específico y
evaluar la relación entre los conteos visuales y el total de piojos, que puede
determinarse utilizando métodos más completos como las cámaras de acetato de
etilo (ver abajo).
Colecta
La opción más precisa para colectar piojos consiste en
examinar manualmente todas las plumas y extraer cada individuo uno a uno. Sin
embargo, este método rara vez se usa debido a que resulta extremadamente
laborioso. Por ejemplo, en palomas domésticas (Columba livia), este
proceso puede llevar entre 7 y 10 horas por ave (Clayton
y Drown 2001). Por ello, se han desarrollado técnicas más eficientes como
las cámaras de fumigación (Fig. 4) y el dust-ruffling
(espolvoreado con insecticida), que permiten una recolección más rápida y
efectiva. Estas son actualmente las metodologías más usadas:
Cámaras de fumigación o anestesia: Consiste en
exponer el cuerpo del ave a vapores que maten o anestesien a los piojos (y
otros ectosimbiontes del plumaje, como los ácaros) del plumaje (Walther y Clayton 1997; Visnak y Dumbacher 1999). Generalmente, se
utilizan recipientes de vidrio o plástico con una tapa modificada en la que la
parte central presenta una hendidura (diafragma de goma) que permite sacar la
cabeza del ave (Fowler y Cohen 1983). En la
base del recipiente se suele colocar papel de filtro en la base para facilitar
la recolección de los piojos al finalizar el proceso. Las cámaras de fumigación
son pesadas y menos portátiles, pero estables e ideales para aves grandes. Otra
opción consiste en usar bolsas de plástico con cierre hermético en lugar de
cámaras. Estas son más ligeras, fáciles de transportar y reducen el riesgo de
contaminación cruzada entre individuos. Sin embargo, generan más residuos y
requieren que el ave sea sostenida manualmente durante todo el proceso
(abrazando la bolsa para asegurar que un cierre lo más hermético posible). El
uso de bolsas opacas blancas facilita la localización de los piojos.
Un aspecto importante a considerar en la recolección
mediante fumigación es el agente químico utilizado. Los compuestos más usados
son el acetato de etilo, cloroformo, dióxido de carbono y, en mucha menor
medida, el éter (Visnak y Dumbacher 1999).
El dióxido de carbono es el más rápido en actuar (2 min aprox.) y no mata a los
piojos, pero necesita de cámaras de fumigación bien selladas (no se pueden usar
bolsas) y botellas de CO₂
(Clayton y Walther 1997; Visnak y Dumbacher 1999). El cloroformo es el
segundo más rápido, pero la inhalación de los vapores es tóxica tanto para el
investigador como para el ave, por lo que no es recomendable (Fowler 1984; Visnak y
Dumbacher 1999). Por último, el acetato de etilo, aunque su acción es algo
más lenta (5 min aprox.) y menos efectiva (33% del total de piojos colectados
vs. 76% usando cloroformo; Visnak y Dumbacher
1999), es seguro para el investigador y ave y es, por tanto, la opción más
usada, aunque es más inflamable que el cloroformo (Visnak y Dumbacher 1999). La forma más común
de usarlos, excepto para el CO₂,
consiste en impregnar una pequeña bola de algodón con el agente químico líquido
que se deposita inmediatamente en la cámara o bolsa (Fig.
4).
Un problema frecuente con las cámaras de fumigación es que
la cabeza del ave no queda expuesta a los vapores del agente químico, por lo
que los piojos de esta región suelen no recolectarse. Para solucionarlo, se
recomienda aplicar primero un agente químico en aerosol (como
Tetrametrina-butóxido de piperonilo) sobre la cabeza del ave. Después, al
terminar la exposición en la cámara, se debe realizar un ruffle
(sacudida o peinado controlado del plumaje) sobre la cámara o bolsa para
recoger también los piojos de la cabeza (se recomienda extender este suave
peinado de las plumas a toda el ave para recoger así también piojos que
pudieran haber quedado atrapados en otras zonas).
Dust-ruffling: En esta técnica se aplica polvo
insecticida (generalmente una piretrina junto con butóxido de piperonilo) sobre
el plumaje del ave durante unos 3-5 min. Después, se puede dejar al ave
descansar en una bolsa durante un periodo (p.ej., 10 min; Poiani
et al. 2000), o pasar directamente (porque el insecticida suele actuar
rápido) a sacudir suavemente las plumas y desalojar los piojos (durante una o
varias rondas) sobre una superficie colectora (generalmente una bandeja grande
con un fondo de papel o una bolsa) (Walther y
Clayton 1997). También puede usarse un aerosol insecticida en lugar del
polvo, lo cual puede llegar a ser incluso más efectivo, aunque se debe tener
precaución para no mojar el plumaje del ave (Clayton
y Walther 1997).
El dust-ruffling es una
técnica sencilla y efectiva, con un 25% más de piojos recolectados comparado
con las cámaras de fumigación, pero también presenta algunas limitaciones. Una
de ellas es que la mezcla de polvo insecticida y piojos puede dificultar la
colección de los especímenes. Otra es que esta técnica requiere de al menos dos
personas: una que sujete el ave y otra que aplique el polvo y recolecte los
piojos. Por último, factores ambientales como el viento pueden dificultar la
aplicación del polvo y la recolección. Por ejemplo, el viento suele desplazar a
los piojos fácilmente de las bandejas, aunque esto se puede minimizar usando
bolsas en lugar de bandejas. Independientemente del método elegido, al igual
que con los conteos, siempre es recomendable realizar pruebas piloto para
ajustar la técnica a la especie de ave y piojo de interés.

Figura 4. Cámara de fumigación (bolsa)
utilizada para colecta de piojos. Obsérvese la bola de algodón impregnada de
acetato de etilo. El ave se mantiene así durante aproximadamente 5 minutos.
Crédito: Stephany Virrueta Herrera, School of Environmental Sustainability,
Loyola University Chicago.
Figure 4. Fumigation
chamber (bag) used for louse collection. Note the cotton ball soaked in ethyl
acetate. The bird remains in this position for approximately 5 minutes. Credit:
Stephany Virrueta Herrera, School of Environmental Sustainability, Loyola
University Chicago.
Aproximaciones moleculares
Ácaros
Preservación y extracción de ADN
Los ácaros de las plumas generalmente se preservan en etanol
absoluto, aunque el etanol al 96% también ha demostrado ser efectivo para
muestras recientes (Doña et al. 2019b). La
conservación a temperaturas de -80°C no se ha probado con relación a la
cantidad y calidad del ADN. Las extracciones de ADN se han realizado a menudo
agrupando varios individuos (pooling) para maximizar la cantidad de ADN
extraído (Vízcaino et al. 2018; Matthews et al. 2023a), aunque algunos trabajos de DNA
barcoding y genética de poblaciones que utilizaron secuenciación Sanger han
usado como material de partida ácaros individuales (Dabert
et al. 2008; Fernández-González 2013; Doña et al. 2015b; Fernández-González
et al. 2018). A pesar de esto, es frecuente que las muestras no lleguen al
nivel mínimo recomendable para secuenciación masiva con Illumina (Doña et al. 2019b). Es posible secuenciar por debajo de
este umbral recomendado, pero los efectos del misstagging (secuencias de
unas muestras, generalmente muy abundantes, que aparecen en otras con un menor
número de secuencias) se maximizan en estos casos (Vízcaino
et al. 2018). Hasta la fecha, solo se conoce un caso de extracción de ADN
de un solo ácaro en un trabajo con el objetivo de generar un borrador de genoma
nuclear, que tuvo que complementarse con datos genómicos de muestras de varios
individuos (Matthews et al. 2023b). Hasta el
momento, ningún proyecto ha usado secuenciación de lecturas largas.
DNA barcoding
El DNA barcoding se ha consolidado como una
herramienta indispensable para documentar la biodiversidad de ácaros en las
plumas de las aves. Doña et al. (2015a) evaluaron la
efectividad de la identificación basada en el standard barcode (un
fragmento de unos 650 pb del gen mitocondrial COI), encontrando que, en la
mayoría de los casos, rondaba el 100%. En ese mismo trabajo, se encontró que el
umbral de diferenciación de 3.4% era el valor óptimo y que, el cálculo de este,
aunque sensible al número de especies del estudio, era estable a partir de un
número bajo de especies (i.e., no se encontraron cambios significativos en el
valor del umbral a partir de un número mayor de 10 especies).
Las publicaciones taxonómicas de descripción de nuevas
especies continúan siendo el área con mayor actividad dentro del campo y la
adición de la secuencia barcode en las descripciones es una práctica
común desde hace tiempo (Dabert et al. 2008; Mironov et al. 2015; Constantinescu
et al. 2018; Hernandes et al. 2018; Mironov et al. 2019; Han et al.
2021). Además, los datos de DNA barcoding se han usado en estudios
de genética de la especiación y de poblaciones (Dabert et
al. 2015; Doña et al. 2015b; Fernández-González et al. 2018). La mayoría
de los trabajos de DNA barcoding en ácaros de las plumas han usado
secuenciación Sanger, con primers específicos desarrollados por Jacek Dabert y
colaboradores (Dabert et al. 2008), diseñados para
amplificar regiones del gen COI de estos ácaros (con eficacia variable; Vízcaino et al. 2018). Estos primers siguen siendo los
más usados en la actualidad debido a su buen rendimiento. La secuenciación
Sanger es más económica y probablemente sigue siendo la mejor opción para
estudios con un número bajo de individuos, en los que no se pueda aprovechar al
máximo el multiplexado (i.e., < 300 muestras) que permite secuenciar
múltiples muestras simultáneamente en un carril (lane) de secuenciadores
de Illumina.
DNA metabarcoding
El DNA metabarcoding
usa secuenciación masiva para amplificar simultáneamente todas las secuencias
del gen COI presente en una muestra de ácaros de las plumas (Doña et al. 2019b). Generalmente esta técnica se ha usado a nivel de
individuo de ave, es decir, se realiza una extracción de ADN a partir de todos
los ácaros recolectados de un solo individuo de ave. En estos casos, el DNA
metabarcoding permite obtener todas las secuencias de COI (haplotipos) de
los ácaros presentes en la muestra.
Uno de los principales usos
de esta técnica ha sido el estudio de los ácaros “divagantes” o stragglers,
es decir, individuos de especies de ácaros que aparecen en hospedadores
inusuales. Estos registros proporcionan información muy útil sobre las
dinámicas de dispersión y evolución de estos ectosimbiontes (Doña et al. 2019b). Asimismo, el DNA metabarcoding se ha usado
para estudiar los patrones de diferenciación y estructura genética de especies
que habitan múltiples hospedadores (p.ej., ácaros de las lavanderas del género Motacilla;
Doña et al. 2019c). También se ha utilizado para investigar la dieta de
los ácaros de las plumas, permitiendo la amplificación de marcadores
bacterianos, de hongos y de algas, además del COI. Esto ha facilitado la
identificación simultánea del ácaro y de los microorganismos presentes,
descartando, por el momento, la presencia de material genético del ave
hospedadora en los ácaros (Doña et al. 2019a; Matthews et al. 2024).
Para abordar el problema del mistagging
(ver sección “Preservación y extracción de ADN”), se desarrolló un filtro
bioinformático que elimina los eventos de mistagging (Vízcaino et al. 2018).
Este filtro identifica los haplotipos “donadores” y elimina las secuencias
correspondientes a estos haplotipos en muestras erróneas. Estudios
experimentales con muestras compuestas por individuos de diferentes especies (mock
communities) han demostrado que el DNA metabarcoding tiene un poder
semi-cuantitativo, permitiendo obtener información sobre la abundancia relativa
de las especies en una muestra. Cuando se conoce el número total de ácaros por
muestra analizada, también se puede estimar el número de individuos por especie
de acaro (Díaz-Real
et al. 2015; Vízcaino et al. 2018).
Filogenética y Filogenómica
Los estudios filogenéticos
tradicionales de ácaros de las plumas han utilizado marcadores individuales o
la concatenación de unos pocos marcadores para resolver relaciones evolutivas
de las principales familias y super familias y algunos géneros con interés
taxonómico (Klimov
y O'Connor 2008; Dabert et al. 2010; Knowles y Klimov 2011). Sin embargo, aún queda mucho por hacer y hay una
notable ausencia de estudios filogenómicos (usando paneles de miles de
marcadores o genomas completos) y las pocas excepciones provienen de trabajos
que han utilizado genomas mitocondriales completos (Doña et al. 2017; Matthews
et al. 2023c). A pesar de los
estudios recientes sobre patrones de codivergencia (Dabert 2005;
Doña et al. 2017; Klimov et al. 2017; Matthews et al. 2018, 2023c),
este sigue siendo un campo con amplio potencial para investigaciones tanto
micro como macroevolutiva, particularmente a través de la integración de datos
genómicos.
Genómica
Los estudios genómicos (o que
usen datos genómicos) en ácaros de plumas son aún escasos (Doña et al. 2017; Matthews et al. 2023c, d). A nivel
de genomas nucleares, actualmente, solo existe un borrador de genoma completo (Matthews et al. 2023b) y ninguno a nivel cromosómico. Además, la
secuenciación de lecturas largas no se ha aplicado en este grupo. A nivel
mitocondrial, se han publicado únicamente dos genomas mitocondriales completos
(Han y Min 2017; Esteban et al. 2018). En general, los estudios genómicos en estos organismos presentan
amplias oportunidades de desarrollo y los datos que se generen podrían ser
fundamentales no solo para entender su biología, sino también para estudiar sus
microbiomas y endosimbiontes, campos que actualmente están poco explorados.
Piojos
Los métodos moleculares han
sido herramientas clave en estudios recientes sobre los piojos de las aves. Se
han empleado ampliamente para tareas como la identificación de especies,
análisis filogenéticos, cofilogenéticos, genética de poblaciones, conservación
y estudio de endosimbiontes. Un paso fundamental y muy importante en todas las
aproximaciones basadas en ADN es la preservación y extracción del material
genético, puesto que su calidad es crucial para cualquier análisis posterior,
especialmente desde la llegada de las tecnologías de secuenciación masiva.
Preservación y extracción de ADN
Los piojos recolectados
suelen preservarse en etanol absoluto para evitar la degradación del ADN. Sin
embargo, estudios recientes (Sweet et al. 2023) han evaluado diferentes condiciones de almacenamiento y determinado que
la mejor estrategia para preservar ADN de alta calidad consiste en almacenar
los especímenes en etanol absoluto a -80°C. Esta condición es especialmente
importante cuando el objetivo es la extracción de ADN de alta masa molecular
(HMW), necesario para secuenciación de regiones genómicas amplias, como en el
caso de secuenciación de lecturas largas.
La extracción de ADN puede
realizarse a partir de individuos aislados o pools de ejemplares (p.ej.,
Baldwin-Brown
et al. 2021), dependiendo del
objetivo del estudio. Sin embargo, actualmente lo más común y recomendable es
trabajar con piojos individuales. El primer paso consiste en la evaporación del
etanol, idealmente bajo una campana extractora para minimizar la exposición a
vapores, evitar su acumulación en el laboratorio y reducir el riesgo de
contaminación cruzada, incluyendo la de microorganismos. Antes de continuar con
el siguiente procedimiento (que generalmente comprende la destrucción de los
especímenes), se suele tomar una o varias fotografías del mismo bajo una lupa
binocular para documentar los caracteres morfológicos del espécimen (algo
particularmente útil en casos donde podría tratarse de una especie no
descrita). Una vez evaporado el alcohol y fotografiada la muestra, el piojo se
tritura con un pistilo de plástico desechable. Por último, la extracción de ADN
se realiza utilizando kits de extracción de ADN de alta calidad, como el
MagAttract HMW (Qiagen). La extracción de ARN para estudios de RNA-Seq y
ensamblaje de transcriptomas solo se ha utilizado en una ocasión en piojos de
aves (Johnson et
al. 2018). En ese estudio, los
especímenes fueron preservados en RNAlater y almacenados a +4°C o -80°C antes
de la extracción.
A continuación, se destacan
las aproximaciones más utlizadas en ecología molecular para el estudio de estos
organismos:
DNA barcoding y metabarcoding
A diferencia de otros grupos
de simbiontes, el DNA barcoding ha sido poco empleado en piojos de aves
(Whiteman et al.
2004; Lee et al. 2022). Sin embargo, existen numerosos datos de marcadores moleculares como
COI y EF-1α en GenBank, generados en el contexto de estudios filogenéticos que
usaban secuenciación Sanger (p.ej., Escalante et al. 2016; Catanach et al. 2019). Estos datos han sido (y siguen siendo) fundamentales para la
identificación y clasificación de especies, aunque hasta el momento no han sido
aplicados sistemáticamente en estudios de DNA barcoding a gran escala.
El DNA metabarcoding
no se ha usado en estudios de piojos de aves hasta la fecha, pero tiene un gran
potencial para estudios de diversidad y composición de comunidades, así como
para la detección de stragglers (piojos que se encuentran en un
hospedador no habitual; Whiteman et al. 2004; Rivera-Parra et al. 2017). Su uso permitiría la detección simultánea de
múltiples especies a partir de muestras mixtas, aunque presenta desafíos
metodológicos, como los sesgos de amplificación y la necesidad de contar con
bases de datos de referencia bien curadas, lo cual puede ser un problema en
regiones con comunidades de piojos poco estudiadas.
Filogenética y análisis de delimitación de
especies
Los enfoques filogenéticos
han destacado especialmente entre las herramientas usadas en el estudio
evolutivo de los piojos de aves. Numerosas filogenias basadas en marcadores
individuales obtenidos mediante secuenciación Sanger han permitido resolver aspectos
evolutivos centrales en este grupo, e incluso extensibles a otros organismos
(p.ej., regla de Harrison; Johnson et al. 2007). Los análisis cofilogenéticos, que comparan de las filogenias de
hospedadores y parásitos, han sido usados ampliamente, consolidando a los
piojos como un sistema de referencia para este tipo de estudios (Johnson y Clayton 2004). Desde la llegada de tecnologías de secuenciación
masiva, la estrategia más común en los estudios filogenómicos consiste en la
generación de paneles (matrices) de genes ortólogos de copia simple mediante el
software aTRAM, desarrollado por investigadores expertos en filogenética de
piojos (Johnson et
al. 2013; Allen et al. 2015, 2017, 2018). Estos paneles suelen
incluir entre 1000 y 2400 loci, aunque mejoras recientes en la eficiencia de
aTRAM han permitido el uso de todos los loci de un genoma (~500 000 loci; Grant et al. 2024). Este enfoque requiere datos de secuenciación de Illumina
de librerías shotgun de todo el genoma, idealmente con una cobertura de
30X. Gracias a esta estrategia de análisis, en la actualidad se dispone de
filogenias muy robustas y la mayoría de los aspectos sistemáticos de alto nivel
están bien resueltos. Sin embargo, persisten desafíos a a nivel de género (que
se crearon, generalmente, uniendo a grupos morfológicamente similares) y donde
la diversidad críptica es aún alta (Johnson 2022).
Los paneles de genes ortólogos ensamblados con aTRAM también son muy útiles
para realizar análisis de delimitación de especies (Sweet et al. 2018; Sweet
y Johnson 2018). Asimismo, aTRAM se
usa con frecuencia para ensamblar genes mitocondriales (COI, generalmente) que
posteriormente se usan para análisis de delimitación de especies (p. ej., Johnson et al. 2021; Doña y Johnson 2023; Sweet et al.
2025). Una ventaja de usar el gen
mitocondrial COI es que también permite validar la identidad de la muestra
mediante comparación con secuencias de GenBank. Asimismo, permite aplicar
umbrales de diferenciación (distancias genéticas) que están mejor estudiados en
estos marcadores (p. ej., 5% COI para diferenciar especies de un mismo género; Johnson et al. 2021).
Genomas completos (y usos derivados)
El principal problema para la
generación de genomas completos de piojos de aves ha sido la baja cantidad y
calidad del ADN disponible a partir de extracciones individuales (Johnson 2022). Un piojo suele proporcionar entre 10 y 100 ng de
ADN, lo que dificulta la construcción de librerías/genotecas para
secuenciación, especialmente para tecnologías de fragmentos largos (p.ej., Oxford
Nanopore o PacBio).
El primer genoma completo
ensamblado fue, por tanto, de una especie de piojo que podía criarse fácilmente
en cautividad. En particular, se trató del piojo humano (Pediculus humanus),
cuyo genoma fue secuenciado mediante tecnología Sanger (Kirkness et al. 2010). Además de la facilidad de la cría en cautividad
para obtener un pool de 100 individuos relativamente homocigotos para
realizar la extracción de ADN, su pequeño tamaño genómico (~110 Mbp) hizo que
su secuenciación fuera viable con una estrategia de librerías shotgun y
secuenciación Sanger.
El primer genoma completo de
una especie de piojo de las aves, Columbicola columbae (piojo de Columba
livia), se publicó en 2021. Este se ensambló usando una combinación de
secuenciación Oxford Nanopore, Illumina y Hi-C, a partir de un pool de individuos
(100 para Illumina, 1000 para Oxford Nanopore, Baldwin-Brown et al.
2021). Con esta estrategia se logró
una mejor resolución del ensamblaje a pesar del mayor tamaño del genoma (~208
Mbp).
El segundo genoma completo de
piojo aviar secuenciado es el de Brueelia nebulosa (parásito de Sturnus
vulgaris). Es el último hasta la fecha y tercer genoma de piojos en
general. Notablemente, se consiguió a partir de la extracción de ADN de un solo
individuo, eliminando la necesidad de grandes cantidades de especímenes
relativamente homocigotos (Sweet et al. 2023). Las mejoras
en la preservación (individuos almacenados en etanol absoluto a -80°C) y en los
protocolos de extracción de ADN (mediante kits para la obtención de ADN de alto
peso molecular), ahora el standard en el área, posibilitaron la generación de ensamblajes
de alta calidad combinando secuenciación PacBio y Illumina (TELL-Seq).
La generación de librerías
para la secuenciación de genomas completos posibilita la reutilización de las
lecturas obtenidas para otros usos. En particular, las lecturas de ADN de una
misma muestra (pero que no eran del genoma nuclear de los piojos) se han
reutilizado principalmente para estudios genómicos de endosimbiontes de piojos
(principalmente, para estudiar las dinámicas de coespeciación y reemplazo a
escala evolutiva), así como para investigar los patrones de evolución del
número de cromosomas mitocondriales de los piojos. En el caso de los
endosimbiontes, el uso de protocolos de análisis de genome-resolved
metagenomics permite ensamblar el genoma de todos los microorganismos
presentes en una muestra (Doña et al. 2021). Esta
aproximación tiene la ventaja de no requerir un genoma de referencia. Sin
embargo, para estudios más dirigidos, centrados en obtener el genoma completo
de un endosimbionte de una especie o género en particular, existen otras
técnicas basadas en ensamblajes de referencia, como minYS (Guyomar et al. 2020). La combinación de estas metodologías ha hecho
viable, en la actualidad, la obtención de genomas completos de numerosos
linajes de endosimbiontes piojos (Soto-Patiño et al. 2025). Debido a la mayor abundancia de lecturas
mitocondriales vs. nucleares en las muestras de ADN, el ensamblaje de los
distintos cromosomas mitocondriales de piojos suele realizarse con librerías
bioinformáticamente reducidas (en las que se seleccionan al azar un número
reducido de lecturas). Para el ensamblaje, se utilizan herramientas que
incluyan un ensamblador metagenómico (como MetaSPAdes), lo que permite
recuperar los distintos cromosomas (en los casos donde haya más de un cromosoma
mitocondrial). Los cromosomas ensamblados se someten posteriormente a un
proceso de verificación en el que se descartan aquellos con picos anómalos de
cobertura y que no se puedan circularizar (Sweet et al. 2020; Najer et al.
2024).
Experimentación
Ácaros
Según la naturaleza de la
aproximación experimental, los estudios sobre los ácaros de las plumas y su
interacción con las aves pueden clasificarse en cuatro grandes categorías:
Manipulación de las condiciones ambientales
Las condiciones ambientales
son fundamentales para los ácaros de las plumas puesto que no solo son
ectosimbiontes, sino que además muchos viven en las plumas de vuelo y, por lo
tanto, su contacto con condiciones ambientales como la luz, la temperatura o la
humedad del aire les afectan directamente. Varios estudios experimentales han
tratado de entender cómo los ácaros responden a estas condiciones ambientales.
Dubinin
(1951; p.171) hizo un experimento con
ocho estorninos pintos en jaulas pequeñas. Los mantuvo a 22ºC y después entre
15 y 155 min en una cámara frigorífica a 6-10ºC. Cada individuo solo estuvo en
una condición experimental (sin grupos controles). Se observó que los ácaros (Trouessartia
rosterii y Pteronyssus truncatus) pasaron de estar mayoritariamente
en la zona central de las plumas de vuelo y las plumas cobertoras del ala a
estar en la zona basal de las plumas. También hizo el experimento con unas
pocas aves más con el procedimiento inverso (pasando de frío a calor) y observó
que el proceso de retorno a las zonas más expuestas de las plumas era más lento
que el de huida del frío.
Wiles et
al. (2000) hicieron un experimento
parecido con herrerillos comunes (Cyanistes caeruleus) donde estudiaron
la distribución de los ácaros en las plumas de vuelo del ala en 14 aves recién
capturadas a una temperatura exterior de 9–11°C. Después, las aves fueron
mantenidas a 20ºC durante 20 min en el interior de la casa. En ese corto
periodo, los ácaros pasaron de estar en las plumas terciarias y secundarias
internas a estar distribuidos uniformemente por todas las plumas del ala.
Pap et al.
(2010) evaluaron los efectos del
fotoperiodo en gorriones comunes (Passer domesticus) en cautividad.
Compararon un grupo control bajo el fotoperiodo natural (12 horas luz:12 horas
oscuridad, 12L:12O) con un grupo experimental expuesto a 18L:6O. Observaron que
los conteos de ácaros del grupo experimental disminuían más que los del grupo control,
apoyando la hipótesis de que los ácaros son fotofóbicos y que esto puede
afectar los conteos realizados en las alas.
Manipulación de la morfología de las aves
Otros estudios experimentales
manipulan directamente algún aspecto de la morfología de las aves para entender
distintos aspectos de la ecología de la interacción entre las aves y los ácaros
de las plumas, tales como la muda de las aves o el acicalamiento por parte del
ave.
Los ácaros de las plumas
evitan estar en las plumas que van a ser mudadas (Dubinin 1951;
Jovani y
Serrano 2001; Jovani et al. 2006). Dubinin (1951; p.236) describe un experimento con un solo individuo de
corneja cenicienta (Corvus corone cornix) al que hizo una incisión en la
base de una pluma de vuelo que tenía muchos ácaros (Gabucinia delibata),
le ató una cuerda a la pata y le hizo volar durante 24 horas. Al cabo de ese
tiempo los ácaros habían desaparecido de esa pluma.
Pap et al.
(2006) hicieron un experimento más
riguroso para intentar entender cómo percibían los ácaros que una pluma iba a
ser mudada. El experimento consistía en un grupo control y dos experimentales.
En el primer grupo experimental practicaron una incisión en la base de una
pluma. Esto se hizo para testar la hipótesis de Dubinin (1951) que sostenía que los ácaros percibían la vibración de la pluma antes de
la muda; con la incisión en la pluma se pretendía simular la vibración que
experimenta una pluma cuando empieza el proceso que termina con su caída. El
segundo tratamiento consistía en arrancar una pluma para testar la hipótesis de
Jovani y
Serrano (2001) que mantenía que los
ácaros perciben el incremento de turbulencias creado por la caída de la pluma
de al lado de la que están los ácaros. Al cabo de unos días recuperaron las
aves para ver cómo había cambiado la distribución de los ácaros. Encontraron que
los dos tratamientos hacían escapar a los ácaros. Un revisor de este artículo
nos sugiere que sigue quedando la duda de la relevancia relativa entre los dos
mecanismos, o de si distintos mecanismos actúan en distintos escenarios. Por
ejemplo, se podría estudiar si en el caso de una muda parcial sin un orden de
muda fijo se usan distintos mecanismos que los usados en una muda completa, o
ver si en el caso de una caída accidental de una pluma también pueden escapar
los ácaros, o estudiar el caso del papamoscas gris (Muscicapa striata)
que presenta una secuencia de muda completa inversa a la del resto de
paseriformes.
Waller
et al. (2024) hicieron un experimento
con garcillas bueyeras (Bubulcus ibis) en cautividad en el que
eliminaron las uñas pectinadas que tiene esta especie (y otras ardeidas) en el
dedo central de la pata, que se creen son usadas para acicalarse la cabeza y la
nuca. Encontraron que las aves eliminaron igualmente los piojos de las plumas,
sugiriendo que estas estructuras no son esenciales para el control de los
piojos al menos en condiciones de cautividad con tiempo suficiente para el
autoacicalamiento. Además, el tratamiento no afectó a la abundancia de ácaros
de las plumas.
Manipulación del número de ácaros en las aves
Los experimentos que
manipulan el número de ácaros en aves silvestres tienen un gran potencial para
entender aspectos que afectan tanto a las aves (como su coloración), como los
ácaros (su transmisión entre aves), como a la naturaleza de la interacción entre
aves y ácaros de las plumas.
Figuerola
et al. (2003) aplicaron el
insecticida Drione de Bayer (piretrinas incluyendo las cinerinas 1% del peso,
butóxido de piperonilo 10%) a serines verdecillos (Serinus serinus)
durante la muda, dejando un grupo control sin insecticida. Posteriormente,
midieron la coloración del plumaje al recapturarlos cuando ya habían completado
la muda. Encontraron que las aves fumigadas desarrollaban un plumaje más
brillante.
Doña et
al. (2017) estudiaron la transmisión
de ácaros entre progenitores y pollos en nidos de papamoscas cerrojillo (Ficedula
hypoleuca) aplicando un acaricida comercial. Vieron que solo los pollos de
los padres control (es decir, a los que no se había fumigado) tenían ácaros,
confirmando así la transmisión vertical entre progenitores y descendencia.
Pap et al.
(2005) hicieron un experimento con
golondrinas comunes (Hirundo rustica) donde la mitad de los individuos
eran tratados con insecticida (permetrina 0.17% y bioresmetrina 0.07%;
Insecticide 2000, Waldner GmbH, Vienna, Austria) y la otra mitad con agua. Al
año siguiente recapturaron los mismos individuos para estudiar su morfología,
éxito reproductor y supervivencia. Observaron que el tratamiento (que
previamente se había demostrado que disminuía las poblaciones de ácaros de las
plumas) no tuvo efecto sobre estas variables estudiadas, sugiriendo una posible
relación de comensalismo entre aves y ácaros.
Matthews et al. (comunicación
personal; artículo en evaluación) realizaron un experimento para estudiar la
naturaleza de la relación entre los ácaros y dos especies de reinitas: la
reinita cerúlea (Setophaga cerulea; hospedadora del ácaro Amerodectes
ischyros) y la reinita cabecidorada (Protonotaria citrea;
hospedadora de A. protonotaria). Usando una torunda de algodón y las
uñas eliminaron todos los ácaros y huevos encontrados en todas las plumas de
vuelo. Un aspecto interesante de este trabajo es que justifican esta
aproximación "sin el uso de alcohol ni otros químicos" con el fin de
no afectar a otros simbiontes de la pterosfera, o ecosistema de las plumas de
las aves (piojos, bacterias, hongos) (Labrador et al. 2021), logrando así obtener un grupo experimental donde únicamente se
eliminaron los ácaros.
Experimentación con ácaros fuera de las aves
Otra manera para experimentar
con ácaros plumícolas es hacerlo inmediatamente después de extraerlos de las
aves para soslayar el reto de mantenerlos vivos durante largos periodos de
tiempo fuera del ave. Con esta metodología se han podido estudiar aspectos
fundamentales para la biología de los ácaros, tales como la captación de agua a
través de la humedad ambiental o la fotofobia. Gaede y Knülle (1987) estudiaron el mecanismo de captación de agua de la
humedad del aire en Proctophyllodes troncatus de gorriones comunes. Para
ello, usaron ácaros recién extraídos de aves y crearon condiciones de baja
humedad ambiental (con gel de sílice y cloruro de magnesio anhidro) y midieron
su masa con una precisión de 0.1 microgramos. Encontraron que a humedades del
55% o menores, los ácaros perdían peso rápidamente, es decir, se deshidrataban.
Además, cuando un ácaro deshidratado se exponía a alta humedad relativa, ganaba
peso en cuestión de una hora y su cuerpo pasaba de verse comprimido
dorsoventralmente a pasar a tener un aspecto más voluminoso (“normal”).
Una estrategia similar fue
utilizada por Mestre
et al. (2011): arrancaron la misma
pluma de ambas alas de 29 carricerines reales (Acrocephalus melanopogon)
con Trouessartia bifurcata. Una pluma se expuso a la luz solar y la otra
permaneció a la sombra. Observaron que los ácaros huían de la exposición solar,
confirmando su fotofobia.
En esta misma línea, Dubinin (1951; p.192) filtró la luz con diferentes cristales para conseguir
“luz fría”, concluyendo que la luz (y no el calor), provocaba la huida de los
ácaros, lo que sugiere que estos utilizan la luz como señal para evitar
ambientes potencialmente perjudiciales como zonas de la pluma más expuestas.
Mantener ácaros vivos y en
buen estado fuera de sus aves hospedadores por más de unas pocas horas o
minutos sigue siendo un desafío. Dubinin (1951; p.224) intentó mantener ácaros de las plumas en cautividad,
logrando una supervivencia máxima de 25-40 días, incluso con plumas renovadas
cada 3-5 días tomadas de sus especies hospedadoras de aves recién sacrificadas,
manteniendo temperaturas entre 25-30ºC y renovando el aire de los viales donde
tenía los ácaros tres veces al día. A temperaturas de 12-18ºC, los ácaros no
sobrevivían más de 3-10 días.
Gaede
y Knülle (1987) también encontraron
que incluso los ácaros mantenidos en condiciones de alta humedad relativa (pero
sin comida), empezaban a perder peso de manera significativa (ca. 5%) a partir
de las cuatro horas de haber sido extraídos del ave. Por otro lado, Labrador et al. (2022) mostraron otro aspecto que puede estar relacionado
con la dificultad de mantener ácaros vivos durante días. Se capturaron dos
individuos de mirlo común (Turdus merula) y uno de curruca capirotada (Sylvia
atricapilla) y se les tomaron muestras de ácaros tanto al anochecer como al
amanecer siguiente. Observaron que la gran mayoría de los ácaros tenían el
ventrículo vacío de comida al anochecer, pero que la gran mayoría lo tenían
lleno al amanecer, indicando que la alimentación ocurre predominantemente de
noche. Además, tanto al anochecer como al amanecer, los ácaros tenían un bolo
alimenticio y un pellet fecal (el alimento del ventrículo se encapsula, pasando
a bolo alimenticio y luego a pellet fecal antes de ser excretado). Esto
refuerza la idea de que los ácaros necesitan comer cada noche, lo que podría
explicar al menos parte de la dificultad en mantener a los ácaros con vida
durante largo tiempo. Esto también sugiere la importancia de mantener a los
ácaros en condiciones naturales de luz/oscuridad.
Posiblemente el experimento
más exhaustivo hecho hasta la fecha sobre la vida de los ácaros fuera del ave
es el estudio de Matthews
et al. (2022). Estudiaron en
cautividad (placas Petri) 1085 ácaros de la especie Amerodectes ischyros
y 1138 de A. protonotaria. La temperatura y humedad se mantuvieron
relativamente constantes alrededor de 21ºC y 51%, respectivamente. Las paredes
de la placa fueron forradas con Fluon® diluido en agua, una sustancia
(fluoropolímero) que una vez seca hace que los insectos resbalen y no puedan
escapar. Los ácaros se colectaron junto con la pluma en la que vivían en el
ave. Se retiraron todos los ácaros muertos y los huevos, de tal manera que no
pudieran nacer nuevos ácaros. Cada día anotaban cuántos ácaros mostraban signos
de estar vivos y cuántos se encontraban fuera de la pluma. Aunque hubo
diferencias estadísticamente significativas en estos dos parámetros que los autores
relacionan con el carácter más o menos especialista de las dos especies, los
resultados fueron muy parecidos en las dos especies: los ácaros vivieron de
media unos 11 días con un máximo de 17 días, y solo un 2% de los ácaros
abandonó la pluma.
Piojos
La mayoría de los estudios
experimentales sobre la ecología, comportamiento y evolución de los piojos de
las plumas de las aves se han realizado en poblaciones mantenidas en palomas
domésticas en condiciones de cautividad. Casi todos estos trabajos han sido
llevados a cabo por el grupo de investigación Clayton-Bush de la Universidad de
Utah (Estados Unidos). El procedimiento experimental más común consiste primero
en exponer de manera prolongada a las aves a condiciones de baja humedad
ambiental para deshidratar y así eliminar todos los piojos existentes en el
hospedador. Posteriormente, a las aves sin piojos se le añaden, de manera
controlada, nuevos piojos de la especie objetivo obtenidos de otros
hospedadores usando anestesia (CO2). La efectividad de esta
aproximación experimental se ha consolidado hasta tal punto que de ella han
surgido aplicaciones prácticas relevantes. Por ejemplo, Bush et al. (2011) desarrollaron el dispositivo médico LouseBuster,
basado en el uso de aire caliente controlado para deshidratar y eliminar
eficazmente los piojos y sus huevos en humanos sin necesidad de usar
insecticidas químicos. La mayoría de los trabajos experimentales sobre piojos
de las aves se enmarcan en las siguientes cuatro categorías:
Defensas del hospedador contra los piojos
La capacidad de las aves para
controlar las poblaciones de piojos mediante comportamientos específicos como
el acicalamiento con el pico (preening) y el rascado con las patas (scratching)
ha sido un tema central y pionero en los estudios experimentales de piojos de
aves.
Los primeros estudios (Clayton 1989, 1990, 1991) estaban inspirados en observaciones de campo que
mostraban que aves con picos y/o patas con alguna deformidad presentaban
poblaciones de piojos mucho más abundantes de lo normal. Inspirado por estos
hallazgos, Clayton diseñó experimentos que modificaban de forma controlada la
capacidad de acicalamiento de las aves con el pico. En particular, Clayton (1989, 1990) usó
unos separadores (“bits”) que impedían el cierre completo del pico de
las palomas. Estos bits son pequeños anillos en forma de “C” (similares
a los empleados en avicultura para evitar que las aves se piquen entre sí), que
se insertan entre las mandíbulas del ave y se fijan ligeramente en las narinas
para evitar que se caigan. Las aves que portaban los bits y no podían
acicalarse presentaron un incremento significativo en la abundancia de piojos.
Este método permitió descubrir el proceso de selección recíproca (coevolución
en sentido estricto) entre piojos y hospedadores: los piojos ejercen una
presión selectiva sobre las aves, favoreciendo a aquellas con mejores
capacidades de acicalamiento y picos sin deformidades, mientras que las aves
seleccionan piojos más pequeños, que pueden escapar con mayor facilidad al
acicalamiento (Clayton
et al. 1999).
Posteriormente, Clayton et al. (2005) ampliaron estos hallazgos al demostrar que el
saliente de la parte superior del pico desempeña un papel esencial en la
eficacia del acicalamiento. Al alterar experimentalmente esta estructura,
observaron incrementos significativos en la abundancia de piojos. Con el
objetivo de explorar más a fondo esta defensa, Villa et al. (2016) evaluaron la hipótesis de que el acicalamiento podría funcionar de
manera similar a una memoria inmunológica. Usaron un diseño experimental en el
que colonizaban aves (sin exposición previa) con piojos durante tres meses y
después dejaban un periodo prolongado sin piojos. Finalmente, realizaban una
segunda exposición. Compararon así la eficacia del acicalamiento entre aves con
experiencia previa y aves que nunca habían tenido exposición. Los resultados
mostraron que, aunque el comportamiento de acicalarse se induce con la
presencia de piojos, la experiencia previa con piojos no mejoraba la eficacia.
Recientemente Bush
y Clayton (2023) investigaron si las
aves podían llegar eliminar por completo sus piojos mediante el acicalamiento,
es decir, si este comportamiento también influía en la prevalencia (y no solo
en la abundancia, como se había visto hasta el momento). Compararon aves a las
que se les impidió el acicalamiento (“bits”) con aves que podían
acicalarse con normalidad, durante aproximadamente 42 semanas. Observaron que
las aves con el acicalamiento bloqueado mantuvieron prevalencias altas durante
todo el experimento, mientras que algunas con acicalamiento normal lograron
eliminar por completo sus piojos. Esto demostró que el acicalamiento puede
influir en la prevalencia y no solo controlar la abundancia de piojos. Sin
embargo, los autores advierten que en condiciones naturales esta eficacia
podría ser menor, debido a la posibilidad de recibir piojos por transmisión
horizontal.
Además del acicalamiento con
el pico, diversos estudios experimentales han abordado cómo el rascado con las
patas (scratching) contribuye al control de los piojos. En una serie de
experimentos, Goodman
et al. (2020) limitaron físicamente
los movimientos de las patas de las palomas mediante unas cintas de plástico
flexibles que impedían el rascado. Observaron abundancias mayores de piojos,
particularmente en zonas del cuerpo inaccesibles al pico (p. ej., en la cabeza).
En otro experimento, donde además de anular el rascado anularon la capacidad de
acicalarse con el pico, observaron que no había incrementos en la abundancia de
piojos, demostrando el papel complementario que tiene el rascado moviendo
piojos a zonas accesibles al pico para así mejorar la eficacia del
acicalamiento (preening). Otra estructura que se había hipotetizado que
podría tener un papel relevante para controlar las poblaciones de ectoparásitos
eran las uñas pectinadas de algunas aves. Waller et al. (2024) eliminaron experimentalmente (limando) estas estructuras dentadas y
observaron que su ausencia no tenía impacto en la abundancia ni distribución de
piojos ni otros ectosimbiontes.
Mecanismos de transmisión y dispersión de los
piojos
Aunque los estudios
cofilogenéticos indicaban que, a escala evolutiva, los piojos de las aves
cambiaban frecuentemente de hospedador, los mecanismos concretos de transmisión
y dispersión eran desconocidos. Esto ha motivado una destacada línea
experimental centrada en investigar cómo se dispersan estos parásitos.
Harbison
et al. (2008) realizaron experimentos
en cautividad para evaluar la transmisión directa e indirecta (foresis mediante
moscas hipobóscidas) de los piojos. Para probar la transmisión directa,
colocaron en contacto cercano palomas con piojos con otras sin piojos. Para la
indirecta, permitieron que moscas hipobóscidas (Pseudolynchia canariensis)
accedieran a jaulas individuales con palomas con piojos y sin piojos.
Encontraron que tanto los piojos del ala como los del cuerpo podían dispersarse
verticalmente (de padres a hijos, aunque con mayor eficacia los del ala), así
como horizontalmente (entre aves adultas en contacto directo, con tasas
similares). Además, observaron que solo los piojos del ala, y no los del
cuerpo, lograban colonizar nuevos hospedadores a través de foresis en moscas
hipobóscidas. En un estudio posterior, Harbison et al. (2009) profundizaron en los mecanismos específicos implicados
en la transmisión indirecta mediante experimentos con estructuras en forma de
puente, diseñadas para evaluar si los piojos podían orientarse y desplazarse
activamente hacia las moscas vectores. Observaron que solo los piojos del ala
se orientaban activamente hacia moscas hipobóscidas activas (no anestesiadas),
y que ciertas adaptaciones morfológicas especializadas para vivir en las plumas
del ala facilitaban su adhesión eficaz a las moscas durante vuelos cortos. Para
explicar estas diferencias en la capacidad de transmisión indirecta (i.e., por
foresis) entre los distintos tipos de piojos, Bartlow et al. (2016) evaluaron si las especies con mayor capacidad de
desplazamiento independiente (que les permitiría colonizar nuevos hospedadores
durante contactos directos entre aves) tenían una menor capacidad para
adherirse eficazmente a las moscas hipobóscidas (y, por tanto, menor potencial
de transmisión indirecta). Para ello, midieron la capacidad de desplazamiento
independiente como la distancia recorrida por los piojos en respuesta a
estímulos luminosos negativos (los piojos tienden a alejarse de la luz). Además,
analizaron la capacidad de los piojos para adherirse a las moscas hipobóscidas
durante actividades como vuelos cortos y acicalamientos. Encontraron que los
piojos del cuerpo tenían mayor capacidad para desplazarse de manera
independiente, pero menor capacidad para utilizar la foresis mediante moscas,
mientras que los piojos del ala mostraron menor movilidad independiente, pero
una notable capacidad para adherirse eficazmente a las moscas vectores durante
vuelos cortos y otras actividades. Además de los mecanismos físicos de
dispersión, otros estudios investigaron cómo influye el comportamiento en la
localización de zonas adecuadas dentro del hospedador. Harbison y
Boughton (2014) exploraron
experimentalmente cómo influye el estado nutricional de los piojos en sus
preferencias térmicas. Utilizaron gradientes térmicos artificiales que
simulaban distintas regiones corporales del hospedador: zonas más cálidas
(~37°C) y zonas más frías (~32°C). Compararon las preferencias térmicas de
piojos recién alimentados frente a aquellos que no se habían alimentado durante
periodos cortos (18-20 horas). Observaron que los piojos recién alimentados
preferían zonas más frías, mientras que los que llevaban tiempo sin alimentarse
se desplazaban hacia regiones más cálidas, probablemente en búsqueda de
alimento. Siguiendo esta línea sobre orientación térmica, Harbison et al. (2020) profundizaron en los mecanismos que utilizan los
piojos del ala para orientarse térmicamente en el cuerpo del hospedador,
investigando específicamente cómo integran señales espaciales (control
alotético) y temporales (control idiotético) para localizar regiones corporales
cálidas (~37°C). A través de experimentos que combinaban gradientes térmicos
controlados con antenectomías unilaterales (extirpación de una sola antena),
demostraron que los piojos pueden orientarse hacia zonas cálidas utilizando
exclusivamente cambios temporales en la temperatura (control idiotético). No
obstante, cuando conservaban ambas antenas intactas y disponían de señales
espaciales claras, su precisión en la orientación mejoraba considerablemente,
indicando que los piojos combinan eficazmente ambos tipos de información.
Finalmente, Harbison
et al. (2023) extendieron estos
estudios sobre señales sensoriales investigando experimentalmente la
comunicación química (feromonas) en piojos del ala. Mediante experimentos con
un olfatómetro en “Y”, observaron que los piojos se desplazaban activamente
hacia grupos de congéneres, pero solo si estos habían estado previamente
ubicados sobre plumas del ala, lo que sugiere que la producción de feromona de
agregación está ligada a esta localización específica. Además, determinaron que
tanto los machos como las hembras prefieren congregarse con individuos de su
mismo sexo, sugiriendo la existencia de feromonas específicas según el sexo.
Competencia interespecífica e interacciones
ecológicas entre especies de piojos
Otro aspecto que ha suscitado
interés es el estudio de las interacciones entre especies de piojos que
coexisten en un mismo hospedador. Estas interacciones están estrechamente
vinculadas con las diferencias en las capacidades de dispersión y transmisión,
factores que influyen directamente en los patrones de especiación. Bush y Malenke (2008) demostraron la existencia de competencia
interespecífica mediante experimentos en los que colonizaron palomas con una o
dos especies de piojos bloqueando el acicalamiento en algunos tratamientos.
Observaron que la competencia era particularmente intensa cuando las aves no
podían acicalarse y que esta era asimétrica: los piojos del cuerpo, con menor
capacidad de dispersión (Harbison et al. 2008),
resultaron ser competitivamente superiores a los piojos de las alas. Johnson et al. (2009) confirmaron y ampliaron estas observaciones al
colonizar zenaidas huilotas (Zenaida macroura) con dos especies
congenéricas de piojos del ala (Columbicola baculoides y C. macrourae).
Encontraron que ambas especies también competían entre sí, observando
disminuciones significativas en la abundancia final de cada especie cuando
coexistían en un mismo hospedador, en comparación con los tratamientos donde
cada especie se encontraba sola.
Adaptación fenotípica y especialización en
términos de hospedador
A partir de los patrones
macroevolutivos de salto de hospedador se ha buscado entender cómo pueden los
piojos adaptarse a nuevos hospedadores. Bush et al. (2006) evaluaron la capacidad de adhesión física de piojos del ala (Columbicola
columbae) sobre plumas individuales de distintas especies de palomas de
tamaños muy distintos. En experimentos donde los piojos eran colocados en
plumas individuales (que luego sometían a perturbaciones similares al vuelo en
un ventilador) o directamente sobre hospedadores (que volaban 50–100m).
Encontraron que los piojos se adherían eficazmente a plumas y hospedadores de
distintos tamaños. Esto sugiere que la capacidad de adhesión no es un factor
limitante para la colonización. Posteriormente, Bush y Clayton (2006) extendieron estos experimentos mediante
transferencias experimentales tanto de piojos del ala como del cuerpo desde
hospedadores grandes hacia hospedadores más pequeños y viceversa. Encontraron
que, aunque los piojos podían adherirse temporalmente en todos los casos (Bush et al. 2006), solo lograban establecerse con éxito en hospedadores
más pequeños cuando el acicalamiento estaba bloqueado experimentalmente y en
ningún caso en hospedadores más grandes probablemente debido a problemas en la
comunicación por feromonas necesaria para la reproducción de los piojos. Estos
resultados destacan que las transferencias exitosas son más probables entre
aves con tamaños corporales similares, enfatizando la interacción crítica entre
tamaño del hospedador, comportamiento defensivo y éxito reproductivo de los
piojos. En línea con estos resultados, Bush (2009)
realizó experimentos adicionales donde transfirió piojos del ala (Columbicola
columbae y C. passerinae) y del cuerpo (Campanulotes compar y
Physconelloides eurysema) a aves de diferentes tamaños. Encontró que los
piojos del ala mostraban una notable flexibilidad comportamental, modificando
su distribución en el plumaje según el tamaño del nuevo hospedador, con un
mayor cambio de microhábitat cuanto mayor era el cambio en tamaño del
hospedador. En cambio, los piojos del cuerpo apenas modificaron sus microhábitats.
Finalmente, Malenke
et al. (2009) abordaron la adaptación
específica al hospedador utilizando un enfoque combinado de análisis
filogenéticos y experimentos de transferencia recíproca. Inicialmente
demostraron mediante análisis filogenéticos que poblaciones de Columbicola
macrourae que vivían en distintas especies de palomas eran probablemente
especies crípticas, con diferencias morfológicas sutiles. Luego, al transferir
piojos entre Zenaida asiatica y Z. macroura, demostraron que cada
linaje de piojos alcanzaba un mayor éxito reproductivo en su hospedador
original.
En otro estudio relacionado Villa et al. (2018) investigaron la correlación entre el tamaño corporal
de los piojos y su fecundidad en C. columbae. Bloquearon el
acicalamiento en palomas domésticas para permitir varios ciclos reproductivos y
así generar variabilidad en el tamaño corporal de los piojos. Posteriormente,
midieron la fecundidad hembras individuales (cantidad de huevos producidos en
condiciones controladas), encontrando una correlación positiva entre mayor
tamaño y un número mayor de huevos. Este proceso de selección hacia tamaños
corporales más grandes, equilibrado por la selección en contra generada por el
acicalamiento, proporciona una explicación mecanística para la regla de
Harrison (correlación positiva entre tamaños del hospedador y sus piojos; Johnson et al. 2005; Harnos et al. 2017).
Más recientemente Villa et al. (2019) llevaron a cabo uno de los experimentos más
influyentes del área, consiguiendo replicar una radiación adaptativa
experimental. Mantuvieron poblaciones de piojos en hospedadores de diferentes
tamaños corporales durante aproximadamente 60 generaciones (~4 años),
observando divergencias morfológicas heredables que generaron aislamiento
reproductivo entre las poblaciones adaptadas a distintos hospedadores. Esta
misma metodología fue usada posteriormente por Bush et al. (2019) para investigar adaptaciones rápidas en la coloración de los piojos en
respuesta al color del plumaje del hospedador al que eran transferidos,
encontrando cambios heredables en la coloración corporal de los piojos durante
el experimento. Finalmente, Baldwin-Brown et al. (2024) analizaron en estos cambios fenotípicos mediante
genómicas comparada, demostrando que diferentes poblaciones podían alcanzar
adaptaciones fenotípicas similares (color) mediante vías genéticas distintas,
es decir, por convergencia evolutiva.
Oportunidades y retos para el futuro
A pesar de todo lo revisado
en este trabajo, el conocimiento actual que tenemos sobre aspectos esenciales
de la biología y ecología de estos organismos podría considerarse que sigue
siendo muy limitado. Por otro lado, tanto los ácaros de las plumas como los
piojos han demostrado ser magníficos modelos de estudio, lo que anima a seguir
aprendiendo sobre estos organismos y sobre su interacción con las aves y el
resto de los organismos de la pterosfera.
Para aquellos que se adentren
por primera vez en el estudio de estos sistemas, es recomendable empezar
revisando los clásicos. En el caso de los ácaros de las plumas, los estudios de
Dubinin (1951) son difíciles de aceptar hoy en día como
investigaciones rigurosas, bien documentadas o éticamente aceptables en
términos de bienestar animal. Aun así, Vsevolod Borisovich Dubinin sigue siendo
el investigador que más profundamente ha indagado en su estudio y su monografía
debería considerarse lectura obligada para cualquier persona interesada en
estos simbiontes. En sus páginas abundan pequeños —y no tan pequeños—
experimentos y observaciones valiosas sobre la biología de los ácaros. Es una
obra densa, repleta de perlas escondidas y de ensayos que merecería la pena
replicar con metodologías actuales. Aunque fue escrita en ruso, existe una
traducción mecanografiada al inglés y el libro en ruso todavía puede
encontrarse en librerías especializadas. En el caso de los piojos, hay dos
obras que podrían calificarse como imprescindibles para aquellos que se inician
en el estudio de estos organismos: “The chewing lice: world checklist and
biological overview” de Price, Hellenthal, Palma, Johnson y Clayton (2003), que recoge la diversidad global conocida de especies
y sus hospedadores así como una primera introducción a su biología, y el más
reciente “Coevolution of life on hosts” de Clayton, Bush y Johnson (2015), que incluye un capítulo completo dedicado a la
biología de los piojos, así como todos los descubrimientos en biología
coevolutiva de estos sistemas y es la obra de referencia en la actualidad.
Sin lugar a duda, uno de los
retos principales para ambos grupos sigue siendo poder mantener colonias
viables en cautividad. En ácaros, las vías más prometedoras podrían ser
aquellas encaminadas a controlar la dieta basada en microorganismos, así como
otras que exploren métodos que permitan mantenerlos en cautividad junto a sus
hospedadores. Sobre este aspecto, estudios previos (Pap et al. 2010; Waller et
al. 2024) han mostrado que la
abundancia de ácaros disminuye drásticamente debido al estrés de las aves y a
la vibración de sus plumas en cautividad, pero en estos casos no se bloqueó la
capacidad de acicalamiento de las aves, aunque el efecto del acicalamiento
sobre las poblaciones de ácaros de las plumas sigue poco entendido. En el caso
de los piojos, se han conseguido criar con éxito en hospedadores (palomas,
principalmente; Clayton y Walther 1997) y, en
especies hematófagas, una aproximación prometedora podría ser la adaptación de
métodos de alimentación artificial para parásitos hematófagos que ya han sido
usados con éxito en piojos humanos. Para los piojos comedores de plumas, una
aproximación interesante podría venir por la evaluación y manipulación de las
comunidades de microorganismos ambientales y de endosimbiontes para criarlos
sin necesidad de hospedadores.
Contar con poblaciones
estables en laboratorio facilitaría responder de forma más concluyente a las
preguntas centrales, entre las cuales estarían: la dieta, interacciones
interespecíficas (por ejemplo, lo relacionado con la tanatocresis observada en
ácaros sobre huevos eclosionados de piojos), patrones de actividad diaria y
nocturna o el estudio de su tolerancia frente a las condiciones climáticas
adversas. Este último punto es un aspecto central dado el contexto de cambio
climático en el que nos encontramos y sobre el que todavía apenas sabemos nada.
Existen indicios de que las condiciones de humedad ambiental baja les
perjudican, pero también hay evidencias de que algunos ácaros podrían entrar en
un estado similar a la criptobiosis cuando las condiciones son adversas y de
que los piojos hematófagos no serían, en teoría, tan sensibles por estar más
hidratados por la dieta. Por otro lado, estudios recientes de macroecología
sugieren que estos organismos podrían estar entre los más afectados en
escenarios futuros de cambio climático (Carlson et al. 2017) y no tenemos estudios sobre adaptación local a condiciones ambientales
en ácaros ni en piojos de aves.
El ámbito molecular, que
también se beneficiarían de la posibilidad de trabajar con poblaciones en
cautividad, tiene un gran potencial para ayudar con muchas de las cuestiones
aún sin respuesta. Entre otras, permanecen prácticamente inexplorados aspectos
como el uso de datos genómicos para estudiar patrones de adaptación local (con
la excepción de Baldwin-Brown et al. 2024), los
patrones de variación epigenética o las interacciones y dependencia de
endosimbiontes bacterianos. Además, la aplicación de técnicas de edición
genómica permitiría validar experimentalmente muchos de estos resultados y
abrir nuevas líneas de investigación.
Queda mucho por hacer en
estudios de campo, desde experimentación hasta muestreos sistemáticos, que
podrían aclarar muchos aspectos aún desconocidos. Persisten numerosas preguntas
relacionadas con las dinámicas de dispersión. Por ejemplo, se desconoce en gran
medida la relevancia de los denominados stragglers (ácaros o piojos
hallados en hospedadores distintos a los habituales; Whiteman et al. 2004; Rivera-Parra et al. 2017; Doña et al. 2019b), tanto los
posibles agentes de dispersión (parásitos de cría, contactos interespecíficos,
o la reutilización de nidos) como su posible influencia en los procesos de
diversificación a escala macroevolutiva. Los patrones genéticos de las
poblaciones, así como los procesos de especiación con flujo génico, siguen
estando casi sin investigar en ácaros y solo se han abordado puntualmente en
algunos grupos específicos de piojos. También, el posible papel de factores
epigenéticos en contextos ecológicos relevantes no se ha estudiado aún en
ninguno de estos sistemas.
Merece la pena terminar
destacando el hecho de que existe una gran diferencia en el grado de
conocimiento que existe sobre estos simbiontes en comparación con el que existe
sobre sus hospedadores, las aves, que estarían entre los grupos animales mejor
estudiados. Este hecho implica que cualquier descubrimiento sobre ácaros y
piojos puede aportar información muy relevante en aspectos considerados “bien
conocidos” en aves, con todo lo que eso conlleva. Un ejemplo muy ilustrativo es
el hallazgo de que los ácaros de las plumas se alimentan, principalmente, de
hongos y bacterias de las plumas de las aves (Doña et al. 2019a; Matthews
et al. 2024). Este descubrimiento
sugiere que estos simbiontes ejercen un papel de “limpiadores” de las plumas.
Ejemplos como este ponen de manifiesto el potencial de estos sistemas para
aportar al conocimiento más allá del propio sistema y refuerzan la idea de que
constituyen una oportunidad excepcional para investigar en un campo aún lleno
de incógnitas.
Disponibilidad de los datos
Este
artículo no utiliza conjuntos de datos.
Contribución de los autores
JD y RJ concibieron la idea, escribieron y revisaron el
manuscrito de manera conjunta. En concreto, JD ha liderado la introducción,
todas las secciones referentes a los piojos de las aves y la sección de
aproximaciones moleculares al estudio de los ácaros de las plumas. RJ ha
liderado las secciones de muestreo y experimentación de los ácaros de las
plumas.
Financiación, permisos requeridos, potenciales
conflictos de interés y agradecimientos
Los autores/as declaran no tener ningún conflicto de
intereses.
Agradecemos a Stephany Virrueta Herrera (Loyola University
Chicago) el habernos facilitado imágenes de muestreo de piojos. A los editores
del volumen especial por la invitación. A los revisores por el trabajo tan
exhaustivo y constructivo.
Referencias
Allen, J.M., Huang, D.I., Cronk, Q.C., Johnson, K.P. 2015.
aTRAM-automated target restricted assembly method: a fast method for assembling
loci across divergent taxa from next-generation sequencing data. BMC
Bioinformatics 16, 1-7. https://doi.org/10.1186/s12859-015-0515-2
Allen, J.M., Boyd, B., Nguyen, N.P., Vachaspati, P., Warnow, T., Huang,
D.I., Grady, P.G.S., et al. 2017. Phylogenomics from whole genome sequences
using aTRAM. Systematic Biology 66(5), 786-798. https://doi.org/10.1093/sysbio/syw105
Allen, J.M., LaFrance, R., Folk, R.A., Johnson, K.P., Guralnick, R.P.
2018. aTRAM 2.0: an improved, flexible locus assembler for NGS data. Evolutionary
Bioinformatics 14, 1176934318774546. https://doi.org/10.1177/1176934318774546
Baldwin-Brown, J.G., Villa, S.M., Vickrey, A.I., Johnson, K.P., Bush, S.E.,
Clayton, D.H., Shapiro, M.D. 2021. The assembled and annotated genome of the
pigeon louse Columbicola columbae, a model ectoparasite. G3 11(2),
jkab009. https://doi.org/10.1093/g3journal/jkab009
Baldwin-Brown, J., Villa, S.M., Waight, E., Johnson, K.P., Bush, S.E., Clayton,
D.H., Shapiro, M.D. 2024. Genomics of experimental adaptive radiation in the
cryptic coloration of feather lice. bioRxiv 2024-12. https://doi.org/10.1101/2024.12.20.629508
Bartlow, A.W., Villa, S.M., Thompson, M.W., Bush, S.E. 2016. Walk or ride?
Phoretic behaviour of amblyceran and ischnoceran lice. International
Journal for Parasitology 46(4), 221-227. https://doi.org/10.1016/j.ijpara.2016.01.003
Behnke, J., McGregor, P., Cameron, J., Hartley, I., Shepherd, M., Gilbert,
F., Barnard, C., et al. 1999. Semi-quantitative assessment of wing feather mite
(Acarina) infestations on passerine birds from Portugal. Journal of
Zoology 248, 337-347. https://doi.org/10.1017/S0952836999007062
Booth, D.T., Clayton, D.H., Block, B.A. 1993. Experimental demonstration
of the energetic cost of parasitism in free-ranging hosts. Proceedings
of the Royal Society of London B: Biological Sciences 253(1337),
125-129. https://doi.org/10.1098/rspb.1993.0091
Bush, S.E. 2009. Does behavioural flexibility facilitate host switching
by parasites? Functional Ecology 23(3), 578-586. https://doi.org/10.1111/j.1365-2435.2008.01535.x
Bush, S.E.,
Clayton, D.H. 2006. The role of body size in host
specificity: reciprocal transfer experiments with feather lice. Evolution 60(10),
2158-2167. https://doi.org/10.1111/j.0014-3820.2006.tb01853.x
Bush, S.E., Clayton, D.H. 2023. Does preening behavior reduce the
prevalence of avian feather lice (Phthiraptera: Ischnocera)? Journal of
Parasitology 109(3), 145-147. https://doi.org/10.1645/23-2
Bush, S.E.,
Malenke, J.R. 2008. Host defence mediates
interspecific competition in ectoparasites. Journal of Animal Ecology 77(3),
558-564. https://doi.org/10.1111/j.1365-2656.2007.01353.x
Bush, S.E., Sohn, E., Clayton, D.H. 2006. Ecomorphology of parasite
attachment: experiments with feather lice. Journal of Parasitology 92(1),
25-31. https://doi.org/10.1645/GE-612R.1
Bush, S.E., Rock, A.N., Jones, S.L., Malenke, J.R., Clayton, D.H. 2011.
Efficacy of the Louse Buster, a new medical device for treating head lice
(Anoplura: Pediculidae). Journal of Medical Entomology 48(1),
67-72. https://doi.org/10.1603/ME10122
Bush, S.E., Villa, S.M., Altuna, J.C., Johnson, K.P., Shapiro, M.D.,
Clayton, D.H. 2019. Host defense triggers rapid adaptive radiation in
experimentally evolving parasites. Evolution Letters 3(2),
120-128. https://doi.org/10.1002/evl3.104
Carlson, C.J., Burgio, K.R., Dougherty, E.R., Phillips, A.J., Bueno, V.M.,
Clements, C.F., Castaldo, G., et al. 2017. Parasite biodiversity faces
extinction and redistribution in a changing climate. Science Advances 3(9),
e1602422. https://doi.org/10.1126/sciadv.1602422
Catanach, T.A., Johnson, K.P., Marks, B.D., Moyle, R.G., Valim, M.P.,
Weckstein, J.D. 2019. Two lineages of kingfisher feather lice exhibit differing
degrees of cospeciation with their hosts. Parasitology 146(8),
1083-1095. https://doi.org/10.1017/S0031182019000453
Clayton, D.H. 1989. The coevolutionary ecology of the rock dove, Columba
livia, and its chewing lice (Mallophaga ischnocera). Doctoral
Thesis, The University of Chicago, EEUU.
Clayton, D.H. 1990. Mate choice in experimentally parasitized rock doves:
lousy males lose. American Zoologist 30(2), 251-262. https://doi.org/10.1093/icb/30.2.251
Clayton, D.H. 1991. Coevolution of avian grooming and ectoparasite
avoidance. En: Zuk, M., Loye, J.E. (Eds.), Bird-parasite interactions,
pp. 258-289, Oxford University Press, New York. https://doi.org/10.1093/oso/9780198577386.003.0014
Clayton, D.H.,
Drown, D.M. 2001. Critical evaluation of five
methods for quantifying chewing lice (Insecta: Phthiraptera). Journal
of Parasitology 87(6), 1291-1300. https://doi.org/10.1645/0022-3395(2001)087[1291:CEOFMF]2.0.CO;2
Clayton,
D.H., Walther, B.A. 1997. Collection and
quantification of arthropod parasites of birds. In: Clayton, D.H., Moore, J.
(Eds.), Host-parasite evolution: general principles and avian models,
pp. 419-440. Oxford University Press, Oxford. UK. https://doi.org/10.1093/oso/9780198548935.005.0003
Clayton, D.H., Lee, P.L., Tompkins, D.M., Brodie III, E.D. 1999. Reciprocal
natural selection on host-parasite phenotypes. American Naturalist 154(3),
261-270. https://doi.org/10.1086/303237
Clayton, D.H., Moyer, B.R., Bush, S.E., Jones, T.G., Gardiner, D.W.,
Rhodes, B.B., Goller, F. 2005. Adaptive significance of avian beak morphology
for ectoparasite control. Proceedings of the Royal Society B:
Biological Sciences 272(1565), 811-817. https://doi.org/10.1098/rspb.2004.3036
Clayton, D.H., Bush, S.E., Johnson, K.P. 2015. Coevolution of life
on hosts: integrating ecology and history. University of Chicago
Press. https://doi.org/10.7208/chicago/9780226302300
Constantinescu, I.C., Popa, O.P., Popa, L.O., Cobzaru, I., Adam, C. 2018. A new
feather mite species of the genus Trouessartia Canestrini,
1899 (Acarina, Trouessartiidae) – an integrative description (morphology and
DNA barcoding data). ZooKeys (789), 19. https://doi.org/10.3897/zookeys.789.27829
Dabert, J. 2005. Feather mites (Astigmata; Pterolichoidea, Analgoidea) and
birds as models for cophylogenetic studies. Phytophaga 14,
409-424.
Dabert, J.,
Mironov, S.V. 1999. Origin and evolution of feather
mites (Astigmata). En: Ecology and Evolution of the Acari: Proceedings
of the 3rd Symposium of the European Association of Acarologists, pp.
89-103. Springer Netherlands. https://doi.org/10.1007/978-94-017-1343-6_5
Dabert, J., Ehrnsberger, R., Dabert, M. 2008. Glaucalges tytonis sp.
n. (Analgoidea, Xolalgidae) from the barn owl Tyto alba (Strigiformes,
Tytonidae): compiling morphology with DNA barcode data for taxon descriptions
in mites (Acari). Zootaxa 1719(1), 41-52. https://doi.org/10.11646/zootaxa.1719.1.2
Dabert, M., Witalinski, W., Kazmierski, A., Olszanowski, Z., Dabert, J.
2010. Molecular phylogeny of acariform mites (Acari, Arachnida): strong
conflict between phylogenetic signal and long-branch attraction
artifacts. Molecular Phylogenetics and Evolution 56(1),
222-241. https://doi.org/10.1016/j.ympev.2009.12.020
Dabert, M., Coulson, S.J., Gwiazdowicz, D.J., Moe, B., Hanssen, S.A.,
Biersma, E.M., Pilskog, H.E., et al. 2015. Differences in speciation progress
in feather mites (Analgoidea) inhabiting the same host: the case of Zachvatkinia and Alloptes living
on arctic and long-tailed skuas. Experimental and Applied Acarology 65,
163-179. https://doi.org/10.1007/s10493-014-9856-1
Darwin, C. 1859. On the origin of species by means of natural
selection. John Murray. https://doi.org/10.5962/bhl.title.82303
de Moya, R.S., Allen, J.M., Sweet, A.D., Walden, K.K., Palma, R.L., Smith,
V.S., Cameron, S.L., et al. 2019. Extensive host-switching of avian feather
lice following the Cretaceous-Paleogene mass extinction event. Communications
Biology 2(1), 445. https://doi.org/10.1038/s42003-019-0689-7
Diaz-Real, J., Serrano, D.,
Pérez-Tris, J., Fernández-González, S., Bermejo, A., Calleja, J., Martínez-de
la Puente, J., et al. 2014. Repeatability of feather mite
prevalence and intensity in Passerine birds. PLoS ONE 9,
e107341. https://doi.org/10.1371/journal.pone.0107341
Diaz-Real, J., Serrano, D.,
Píriz, A., Jovani, R. 2015. NGS metabarcoding proves
successful for quantitative assessment of symbiont abundance: the case of
feather mites on birds. Experimental and Applied Acarology 67,
209-218. https://doi.org/10.1007/s10493-015-9944-x
Doña, J.,
Johnson, K.P. 2023. Host body size, not host
population size, predicts genome-wide effective population size of
parasites. Evolution Letters 7(4), 285-292. https://doi.org/10.1093/evlett/qrad026
Doña, J., Diaz‐Real, J., Mironov, S., Bazaga, P., Serrano, D., Jovani, R. 2015a. DNA
barcoding and minibarcoding as a powerful tool for feather mite studies. Molecular
Ecology Resources 15(5), 1216-1225. https://doi.org/10.1111/1755-0998.12384
Doña, J., Moreno‐García, M., Criscione, C.D.,
Serrano, D., Jovani, R. 2015b. Species mtDNA genetic diversity
explained by infrapopulation size in a host‐symbiont
system. Ecology and Evolution 5(24), 5801-5809. https://doi.org/10.1002/ece3.1842
Doña, J., Sweet, A.D., Johnson, K.P., Serrano, D., Mironov, S., Jovani,
R. 2017. Cophylogenetic analyses reveal extensive host-shift speciation in a
highly specialized and host-specific symbiont system. Molecular
Phylogenetics and Evolution 115, 190-196. https://doi.org/10.1016/j.ympev.2017.08.005
Doña, J., Proctor, H., Serrano, D., Johnson, K.P., Oploo, A.O.V., Huguet‐Tapia,
J.C., Ascunce, M.S., et al. 2019a. Feather mites play a role in cleaning host
feathers: new insights from DNA metabarcoding and microscopy. Molecular
Ecology 28(2), 203-218. https://doi.org/10.1111/mec.14581
Doña, J., Serrano, D., Mironov, S.,
Montesinos‐Navarro, A.,
Jovani, R. 2019b. Unexpected bird-feather mite associations
revealed by DNA metabarcoding uncovers a dynamic ecoevolutionary
scenario. Molecular Ecology 28(2), 379-390. https://doi.org/10.1111/mec.14968
Doña, J., Osuna-Mascaró, C.,
Johnson, K.P., Serrano, D., Aymí, R., Jovani, R. 2019c. Persistence
of single species of symbionts across multiple closely-related host
species. Scientific Reports 9(1), 17442. https://doi.org/10.1038/s41598-019-54015-2
Doña, J., Virrueta Herrera, S., Nyman, T., Kunnasranta, M., Johnson,
K.P. 2021. Patterns of microbiome variation among infrapopulations of permanent
bloodsucking parasites. Frontiers in Microbiology 12, 642543. https://doi.org/10.3389/fmicb.2021.642543
Dubinin, V.B., 1951. Feather mites (Analgesoidea). Part I. Introduction to
their study. Fauna SSSR Paukoobraznye 6, 1-363.
Escalante, G.C., Sweet, A.D., McCracken, K.G., Gustafsson, D.R., Wilson,
R.E., Johnson, K.P. 2016. Patterns of cryptic host specificity in duck lice
based on molecular data. Medical and Veterinary Entomology 30(2),
200-208. https://doi.org/10.1111/mve.12157
Esteban, R., Doña, J., Vierna,
J., Vizcaíno, A., Serrano, D., Jovani, R. 2018. The complete
mitochondrial genome of the feather mite Trouessartia rubecula Jablonska,
1968 (Astigmata: Analgoidea: Trouessartiidae). Mitochondrial DNA
Part B 3(2), 652-654. https://doi.org/10.1080/23802359.2018.1476072
Fernandez-Gonzalez, S.
2013. Ecology and evolutionary perspectives of feather mite
coexistence on the blackcap Sylvia atricapilla. Doctoral
Thesis, Universidad Complutense de Madrid, España.
Fernández-González, S.,
Pérez-Rodríguez, A., de la Hera, I., Proctor, H.C., Pérez-Tris, J. 2015. Different space preferences and within-host competition promote
niche partitioning between symbiotic feather mite species. International
Journal for Parasitology 45(9-10), 655-662. https://doi.org/10.1016/j.ijpara.2015.04.003
Fernández-González, S.,
Pérez-Rodríguez, A., Proctor, H.C., de la Hera, I., Pérez-Tris, J. 2018. High diversity and low genetic structure of feather mites associated
with a phenotypically variable bird host. Parasitology 145(9),
1243-1250. https://doi.org/10.1017/S0031182017002360
Figuerola, J. 2003. Plumage colour is related to ectosymbiont load during
moult in the serin, Serinus serinus: an experimental study. Animal
Behaviour 65, 551-557. https://doi.org/10.1006/anbe.2003.2072
Fowler, J.A. 1984. A safer anaesthetic for delousing live birds. Ringer's
Bulletin 6, 69.
Fowler, J.A.,
Cohen, S. 1983. A method for the quantitative
collection of ectoparasites from birds. Ringing and Migration 4(3),
185-189. https://doi.org/10.1080/03078698.1983.9673804
Gaede, K.,
Knülle, W. 1987. Water vapour uptake from the
atmosphere and critical equilibrium humidity of a feather mite. Experimental
and Applied Acarology 3, 45-52. https://doi.org/10.1007/BF01200412
Galloway, T.D.,
Lamb, R.J. 2021. Population dynamics of chewing
lice (Phthiraptera) infesting birds (Aves). Annual Review of Entomology 66(1),
209-224. https://doi.org/10.1146/annurev-ento-041420-075608
Goodman, G.B., Klingensmith, M.C., Bush, S.E., Clayton, D.H. 2020. The role
of scratching in the control of ectoparasites on birds. Auk 137(2),
ukaa010. https://doi.org/10.1093/auk/ukaa010
Grant, A.R., Johnson, K.P., Stanley, E.L., Baldwin-Brown, J., Kolenčík,
S., Allen, J.M. 2024. Rapid targeted assembly of the proteome reveals
evolutionary variation of GC content in avian lice. Bioinformatics and
Biology Insights 18, 11779322241257991. https://doi.org/10.1177/11779322241257991
Guyomar, C., Delage, W., Legeai, F., Mougel, C., Simon, J.C., Lemaitre, C.
2020. MinYS: mine your symbiont by targeted genome assembly in symbiotic
communities. NAR Genomics and Bioinformatics 2(3), lqaa047.
Han, Y.D., Min, G.S. 2017. Complete mitochondrial genome of the feather mite Ardeacarus
ardeae (Acari, Sarcoptiformes, Pterolichidae). Mitochondrial
DNA Part B 2(1), 41-42. https://doi.org/10.1080/23802359.2017.1289345
Han, Y.D., Mironov, S.V., Kim, J.H., Min, G.S. 2021. Feather mites
(Acariformes, Astigmata) from marine birds of the Barton Peninsula (King George
Island, Antarctica), with descriptions of two new species. ZooKeys 1061,
109. https://doi.org/10.3897/zookeys.1061.71212
Hernandes, F.A., Matthews, A.E., Boves, T.J. 2018. Four new feather mite
species of the genus Amerodectes Valim & Hernandes
(Acariformes: Proctophyllodidae) from New World warblers (Passeriformes:
Parulidae) in the USA. Systematic and Applied Acarology 23(5),
946-968. https://doi.org/10.11158/saa.23.5.12
Harbison,
C.W., Boughton, R.M. 2014. Thermo-orientation and
the movement of feather-feeding lice on hosts. Journal of Parasitology 100(4),
433-441. https://doi.org/10.1645/13-374.1
Harbison, C.W., Bush, S.E., Malenke, J.R., Clayton, D.H. 2008. Comparative
transmission dynamics of competing parasite species. Ecology 89(11),
3186-3194. https://doi.org/10.1890/07-1745.1
Harbison, C.W., Jacobsen, M.V., Clayton, D.H. 2009. A hitchhiker's guide to
parasite transmission: the phoretic behaviour of feather lice. International
Journal for Parasitology 39(5), 569-575. https://doi.org/10.1016/j.ijpara.2008.09.014
Harbison, C.W., Boughton, R.M., Shine, P.J. 2020. Evidence for idiothetic
and allothetic control of thermo-orientation in feather-feeding lice. Journal
of Insect Physiology 120, 103985. https://doi.org/10.1016/j.jinsphys.2019.103985
Harbison, C.W., Breen, M.K., Hutchins, C.E., Roberto, D.P. 2023. Pheromone
communication in feather-feeding wing lice (Insecta: Phthiraptera). Journal
of Parasitology 109(4), 333-339. https://doi.org/10.1645/23-29
Harnos, A., Lang, Z., Petras, D.,
Bush, S.E., Szabo, K., Rozsa, L. 2017. Size matters for lice
on birds: coevolutionary allometry of host and parasite body size. Evolution 71,
421-431. https://doi.org/10.1111/evo.13147
Hunter,
J.E., Colwell, M.A. 1994. Phthiraptera infestation
of five shorebird species. The Wilson Bulletin 106(2),
400-403.
Johnson, K.P. 2022. Genomic approaches to uncovering the coevolutionary
history of parasitic lice. Life 12(9), 1442. https://doi.org/10.3390/life12091442
Johnson,
K.P., Clayton, D.H. 2004. Untangling coevolutionary
history. Systematic Biology 53(1), 92-94. https://doi.org/10.1080/10635150490264824
Johnson, K.P., Bush, S.E., Clayton, D.H. 2005. Correlated evolution of host
and parasite body size: tests of Harrison's rule using birds and lice. Evolution 59(8),
1744-1753. https://doi.org/10.1554/05-035.1
Johnson, K.P., Reed, D.L., Parker, S.L.H., Kim, D., Clayton, D.H. 2007.
Phylogenetic analysis of nuclear and mitochondrial genes supports species
groups for Columbicola (Insecta: Phthiraptera). Molecular
Phylogenetics and Evolution 45(2), 506-518. https://doi.org/10.1016/j.ympev.2007.07.005
Johnson, K.P., Malenke, J.R., Clayton, D.H. 2009. Competition promotes the
evolution of host generalists in obligate parasites. Proceedings of the
Royal Society B: Biological Sciences 276(1675), 3921-3926. https://doi.org/10.1098/rspb.2009.1174
Johnson, K.P., Walden, K.K., Robertson, H.M. 2013. Next-generation
phylogenomics using a target restricted assembly method. Molecular
Phylogenetics and Evolution 66(1), 417-422. https://doi.org/10.1016/j.ympev.2012.09.007
Johnson, K.P., Dietrich, C.H., Friedrich, F., Beutel, R.G., Wipfler, B.,
Peters, R.S., Allen, J.M., et al. 2018. Phylogenomics and the evolution of
hemipteroid insects. Proceedings of the National Academy of Sciences of
the United States of America 115(50), 12775-12780. https://doi.org/10.1073/pnas.1815820115
Johnson, K.P., Weckstein, J.D., Herrera, S.V., Doña, J. 2021. The interplay
between host biogeography and phylogeny in structuring diversification of the
feather louse genus Penenirmus. Molecular Phylogenetics and
Evolution 165, 107297. https://doi.org/10.1016/j.ympev.2021.107297
Johnson, K.P., Matthee, C., Doña, J. 2022. Phylogenomics reveals the origin
of mammal lice out of Afrotheria. Nature Ecology and Evolution 6(8),
1205-1210. https://doi.org/10.1038/s41559-022-01803-1
Jovani, R. 2003. Understanding parasite strategies. Trends in Parasitology 19(1),
15-17. https://doi.org/10.1016/S1471-4922(02)00007-7
Jovani, R.,
Serrano, D. 2001. Feather mites (Astigmata) avoid
moulting wing feathers of passerine birds. Animal Behaviour 62,
723-727. https://doi.org/10.1006/anbe.2001.1814
Jovani, R.,
Serrano, D. 2004. Fine-tuned distribution of
feather mites (Astigmata) on the wing of birds: the case of blackcaps Sylvia
atricapilla. Journal of Avian Biology 35, 16-20. https://doi.org/10.1111/j.0908-8857.2004.03213.x
Jovani, R., Serrano, D., Frías, Ó., Blanco, G. 2006. Shift in feather mite
distribution during the molt of passerines: the case of barn swallows (Hirundo
rustica). Canadian Journal of Zoology 84(5), 729-735. https://doi.org/10.1139/z06-042
Jovani, R., Doña, J., Labrador, M., Serrano, D. 2017. Opening the doors of
parasitology journals to other symbionts. Trends in Parasitology 33,
578-579. https://doi.org/10.1016/j.pt.2017.05.003
Kirkness, E.F., Haas, B.J., Sun, W., Braig, H.R., Perotti, M.A., Clark,
J.M., Lee, S.H., et al. 2010. Genome sequences of the human body louse and its
primary endosymbiont provide insights into the permanent parasitic
lifestyle. Proceedings of the National Academy of Sciences of the
United States of America 107(27), 12168-12173.
Klimov, P.B.,
OConnor, B.M. 2008. Origin and higher-level
relationships of psoroptidian mites (Acari: Astigmata: Psoroptidia): evidence
from three nuclear genes. Molecular Phylogenetics and Evolution 47(3),
1135-1156. https://doi.org/10.1016/j.ympev.2007.12.025
Klimov, P.B., Mironov, S.V., OConnor, B.M. 2017. Detecting ancient
codispersals and host shifts by double dating of host and parasite phylogenies:
Application in proctophyllodid feather mites associated with passerine
birds. Evolution 71(10), 2381-2397. https://doi.org/10.1111/evo.13309
Knowles, L.L.,
Klimov, P.B. 2011. Estimating phylogenetic
relationships despite discordant gene trees across loci: the species tree of a
diverse species group of feather mites (Acari: Proctophyllodidae). Parasitology 138(13),
1750-1759. https://doi.org/10.1017/S003118201100031X
Kolenčík, S., Stanley, E.L., Punnath, A., Grant, A.R., Doña, J., Johnson,
K.P., Allen, J.M. 2024. Parasite escape mechanisms drive morphological
diversification in avian lice. Proceedings of the Royal Society B:
Biological Sciences 291(2019), 20232665. https://doi.org/10.1098/rspb.2023.2665
Koop, J.A.,
Clayton, D.H. 2013. Evaluation of two methods for
quantifying passeriform lice. Journal of Field Ornithology 84(2),
210-215. https://doi.org/10.1111/jofo.12020
Koop, J.A., DeMatteo, K.E., Parker, P.G., Whiteman, N.K. 2014. Birds are
islands for parasites. Biology Letters 10(8), 20140255.
https://doi.org/10.1098/rsbl.2014.0255
Labrador, M. del M., Doña, J.,
Serrano, D., Jovani, R. 2021. Quantitative interspecific
approach to the stylosphere: patterns of bacteria and fungi abundance on
Passerine bird feathers. Microbial Ecology 81,
1088-1097. https://doi.org/10.1007/s00248-020-01634-2
Labrador, M. del M., Doña, J.,
Serrano, D., Jovani, R. 2022. Feather mites at night: an
exploration of their feeding, reproduction, and spatial ecology. Ecology 103,
e03550. https://doi.org/10.1002/ecy.3550
Labrador, M. del M., Serrano, D.,
Doña, J., Aguilera, E., Arroyo, J.L., Atiénzar, F., Barba, E., et al. 2024. Host space, not energy or symbiont size, constrains feather mite
abundance across passerine bird species. Journal of Animal Ecology 93(4),
393-405. https://doi.org/10.1111/1365-2656.14032
Lapoint, R.,
Whiteman, N. 2012. How a bird is an island. BMC
Biology 10, 1-4. https://doi.org/10.1186/1741-7007-10-53
Lee, P.L.,
Clayton, D.H. 1995. Population biology of swift (Apus
apus) ectoparasites in relation to host reproductive success. Ecological
Entomology 20(1), 43-50. https://doi.org/10.1111/j.1365-2311.1995.tb00427.x
Lee, L., Tan, D.J., Oboňa, J., Gustafsson, D.R., Ang, Y., Meier, R.
2022. Hitchhiking into the future on a fly: Toward a better understanding of
phoresy and avian louse evolution (Phthiraptera) by screening bird carcasses
for phoretic lice on hippoboscid flies (Diptera). Systematic Entomology 47(3),
420-429. https://doi.org/10.1111/syen.12539
MacArthur,
R.H., Wilson, E.O. 1967. The theory of
island biogeography. Princeton University Press, Princeton, NJ,
USA.
Malenke, J.R., Johnson, K.P., Clayton, D.H. 2009. Host specialization
differentiates cryptic species of feather-feeding lice. Evolution 63(6),
1427-1438. https://doi.org/10.1111/j.1558-5646.2009.00642.x
Matthews, A.E., Klimov, P.B., Proctor, H.C., Dowling, A.P., Diener, L.,
Hager, S.B., Boves, T.J. 2018. Cophylogenetic assessment of New World warblers
(Parulidae) and their symbiotic feather mites (Proctophyllodidae). Journal
of Avian Biology 49(3), jav-01580. https://doi.org/10.1111/jav.01580
Matthews, A.E., Barnett, C.J., Boves, T.J. 2022. Differential survival and
dispersal of avian feather mites with contrasting host specificities. Ecological
Entomology 47, 864-871. https://doi.org/10.1111/een.13176
Matthews, A.E., Boves, T.J., Percy, K.L., Schelsky, W.M., Wijeratne, A.J.
2023a. Population genomics of pooled samples: Unveiling symbiont
infrapopulation diversity and host-symbiont coevolution. Life 13(10),
2054. https://doi.org/10.3390/life13102054
Matthews, A.E., Boves, T.J., Percy, K.L., Wijeratne, A.J. 2023b. Draft
genome sequencing data of a feather mite, Amerodectes protonotaria Hernandes
2018 (Acariformes: Proctophyllodidae). Data in Brief 46,
108835. https://doi.org/10.1016/j.dib.2022.108835
Matthews, A.E., Wijeratne, A.J., Sweet, A.D., Hernandes, F.A., Toews, D.P.,
Boves, T.J. 2023c. Dispersal-limited symbionts exhibit unexpectedly wide
variation in host specificity. Systematic Biology 72(4),
802-819. https://doi.org/10.1093/sysbio/syad014
Matthews, A.E., Boves, T.J., Sweet, A.D., Ames, E.M., Bulluck, L.P.,
Johnson, E.I., Johnson, M., et al. 2023d. Novel insights into symbiont
population structure: Globe‐trotting avian feather mites contradict the specialist-generalist
variation hypothesis. Molecular Ecology 32(19),
5260-5275. https://doi.org/10.1111/mec.17115
Matthews, A.E., Trevelline, B.K., Wijeratne, A.J., Boves, T.J. 2024. Picky
eaters: Selective microbial diet of avian ectosymbionts. Journal of
Animal Ecology 94(4), 466-481. https://doi.org/10.1111/1365-2656.14215
McClure, H.E. 1989. Occurrence of feather mites (Proctophyllodidae) among
birds of Ventura County Lowlands, California. Journal of Field
Ornithology 60, 431-450.
Mestre, A., Mesquita-Joanes, F., Proctor, H., Monrós, J.S. 2011. Different
scales of spatial segregation of two species of feather mites on the wings of a
Passerine Bird. Journal of Parasitology 97, 237-244. https://doi.org/10.1645/GE-2585.1
Mironov, S.V., Doña, J., Jovani, R. 2015. A new feather mite of the
genus Dolichodectes (Astigmata: Proctophyllodidae) from Hippolais
polyglotta (Passeriformes: Acrocephalidae) in Spain. Folia
Parasitologica 62, 032. https://doi.org/10.14411/fp.2015.032
Mironov, S.V., Klimov, P.B.,
Pérez, T.M., OConnor, B.M. 2019. Feather mites of the
family Ptyssalgidae (Acari: Analgoidea) associated with
hummingbirds and suboscine passerines – A morphological review supplemented by
CO1 barcode sequences. Systematic and Applied Acarology 24(8),
1406-1448. https://doi.org/10.11158/saa.24.8.6
Moyer, B.R., Gardiner, D.W., Clayton, D.H. 2002a. Impact of feather molt
on ectoparasites: looks can be deceiving. Oecologia 131,
203-210. https://doi.org/10.1007/s00442-002-0877-9
Moyer, B.R., Drown, D.M., Clayton, D.H. 2002b. Low humidity reduces
ectoparasite pressure: implications for host life history evolution. Oikos 97(2),
223-228. https://doi.org/10.1034/j.1600-0706.2002.970208.x
Najer, T., Doña, J., Buček, A., Sweet, A.D., Sychra, O., Johnson, K.P.
2024. Mitochondrial genome fragmentation is correlated with increased rates of
molecular evolution. PLoS Genetics 20(5), e1011266. https://doi.org/10.1371/journal.pgen.1011266
Nelson, B.C.,
Murray, M.D. 1971. The distribution of Mallophaga
on the domestic pigeon (Columba livia). International Journal
for Parasitology 1(1), 21-29. https://doi.org/10.1016/0020-7519(71)90042-7
Pap, P.L., Tökölyi, J., Szép, T. 2005. Host-symbiont relationship and
abundance of feather mites in relation to age and body condition of the barn
swallow (Hirundo rustica): an experimental study. Canadian
Journal of Zoology 83, 1059-1066. https://doi.org/10.1139/z05-100
Pap, P.L., Szép, T., Tökölyi, J., Piper, S. 2006. Habitat preference,
escape behavior, and cues used by feather mites to avoid molting wing
feathers. Behavioral Ecology 17, 277-284. https://doi.org/10.1093/beheco/arj026
Pap, P.L., Vágási, C.I., Osváth, G., Mureşan, C., Barta, Z. 2010.
Seasonality in the uropygial gland size and feather mite abundance in house
sparrows Passer domesticus: natural covariation and an
experiment. Journal of Avian Biology 41, 653-661. https://doi.org/10.1111/j.1600-048X.2010.05146.x
Poiani, A., Goldsmith, A.R., Evans, M.R. 2000. Ectoparasites of house
sparrows (Passer domesticus): an experimental test of the
immunocompetence handicap hypothesis and a new model. Behavioral
Ecology and Sociobiology 47, 230-242. https://doi.org/10.1007/s002650050660
Price, R.D., Hellenthal, R.A., Palma, R.L., Johnson, K.P., Clayton, D.H.
2003. The chewing lice: world checklist and biological overview (Special
Publication No. 24). Illinois Natural History Survey, Champaign,
IL, USA.
Proctor, H.C. 2003. Feather mites (Acari: Astigmata): ecology, behavior,
and evolution. Annual Review of Entomology 48(1), 185-209. https://doi.org/10.1146/annurev.ento.48.091801.112725
Rivera‐Parra, J.L., Levin, I.I., Johnson, K.P., Parker, P.G. 2017. Host sympatry
and body size influence parasite straggling rate in a highly connected
multihost, multiparasite system. Ecology and Evolution 7(11),
3724-3731. https://doi.org/10.1002/ece3.2971
Soto-Patiño, J., Walden, K.K., Doña, J., D'Alessio, L.M., Bush, S.E., Clayton,
D.H., Dale, C., et al. 2025. Independent and repeated acquisition of
endosymbiotic bacteria across the diversification of feather lice. bioRxiv,
2025-01. https://doi.org/10.1101/2025.01.17.633592
Sweet, A.D.,
Johnson, K.P. 2018. The role of parasite dispersal
in shaping a host-parasite system at multiple evolutionary scales. Molecular
Ecology 27(24), 5104-5119. https://doi.org/10.1111/mec.14937
Sweet, A.D., Boyd, B.M., Allen, J.M., Villa, S.M., Valim, M.P.,
Rivera-Parra, J.L., Wilson, R.E., et al. 2018. Integrating phylogenomic and
population genomic patterns in avian lice provides a more complete picture of
parasite evolution. Evolution 72(1), 95-112. https://doi.org/10.1111/evo.13386
Sweet, A.D., Johnson, K.P., Cameron, S.L. 2020. Mitochondrial genomes
of Columbicola feather lice are highly fragmented, indicating
repeated evolution of minicircle-type genomes in parasitic lice. PeerJ 8,
e8759. https://doi.org/10.7717/peerj.8759
Sweet, A.D., Browne, D.R., Hernandez, A.G., Johnson, K.P., Cameron, S.L.
2023. Draft genome assemblies of the avian louse Brueelia nebulosa and
its associates using long-read sequencing from an individual specimen. G3:
Genes, Genomes, Genetics 13(4), jkad030. https://doi.org/10.1093/g3journal/jkad030
Sweet, A.D., Doña, J., Johnson, K.P. 2025. Biogeographic history of
pigeons and doves drives the origin and diversification of their parasitic body
lice. Systematic Biology 74(2), 198-214. https://doi.org/10.1093/sysbio/syae038
Villa, S.M., Campbell, H.E., Bush, S.E., Clayton, D.H. 2016. Does
antiparasite behavior improve with experience? An experimental test of the
priming hypothesis. Behavioral Ecology 27(4), 1167-1171. https://doi.org/10.1093/beheco/arw032
Villa, S.M., Evans, M.D., Subhani, Y.K., Altuna, J.C., Bush, S.E.,
Clayton, D.H. 2018. Body size and fecundity correlated in feather lice
(Phthiraptera: Ischnocera): implications for Harrison's rule. Ecological
Entomology 43, 394-396. https://doi.org/10.1111/een.12511
Villa, S.M., Altuna, J.C., Ruff, J.S., Beach, A.B., Mulvey, L.I., Poole,
E.J., Campbell, H.E., et al. 2019. Rapid experimental evolution of reproductive
isolation from a single natural population. Proceedings of the National
Academy of Sciences of the United States of America 116(27),
13440-13445. https://doi.org/10.1073/pnas.1901247116
Visnak,
R.M., Dumbacher, J.P. 1999. Comparison of four
fumigants for removing avian lice. Journal of Field Ornithology 70(1),
42-48.
Vizcaíno, A., Doña, J., Vierna, J., Mari-Mena, N., Esteban, R., Mironov, S.,
Urien, C., et al. 2018. Enabling large-scale feather
mite studies: an Illumina DNA metabarcoding pipeline. Experimental and
Applied Acarology 76, 81-97. https://doi.org/10.1007/s10493-018-0288-1
Waller, M.M., Warr, H.M., Goodman, G.B., Bush, S.E., Clayton, D.H. 2024.
Influence of grooming on permanent arthropod associates of birds: cattle
egrets, lice, and mites. Journal of Parasitology 110(2),
143-149. https://doi.org/10.1645/23-85
Walther,
B.A., Clayton, D.H. 1997. Dust-ruffling: A simple
method for quantifying ectoparasite loads of live birds. Journal of
Field Ornithology 68(4), 509-518.
Wiles, P.R., Cameron, J., Behnke, J.M., Hartley, I.R., Gilbert, F.S.,
McGregor, P.K. 2000. Season and ambient air temperature influence the
distribution of mites (Proctophyllodes stylifer) across the wings of
blue tits (Parus caeruleus). Canadian Journal of Zoology 78,
1397-1407. https://doi.org/10.1139/z00-068
Whiteman, N.K., Santiago-Alarcon, D., Johnson, K.P., Parker, P.G. 2004.
Differences in straggling rates between two genera of dove lice (Insecta:
Phthiraptera) reinforce population genetic and cophylogenetic patterns. International Journal for Parasitology 34(10),
1113-1119. https://doi.org/10.1016/j.ijpara.2004.06.003
![]() , Roger Jovani2,*
, Roger Jovani2,* ![]()



