ecosistemas
ISSN 1697-2473
Open access / CC BY-NC 4.0
© 2025 Los autores [ECOSISTEMAS no se hace responsable del uso indebido de material sujeto a derecho de autor] / © 2025 The authors [ECOSISTEMAS is not responsible for the misuse of copyrighted material]
Ecosistemas 34(3): 3013 [septiembre-diciembre / September-December, 2025]: https://doi.org/10.7818/ECOS.3013
MONOGRÁFICO: Ecología de las invasiones / MONOGRAPHIC: Invasion Ecology
Editores invitados / Guest editors: Jonatan Rodríguez y Luis González
ARTÍCULO DE INVESTIGACIÓN / RESEARCH ARTICLE
Respuesta de la planta invasora Carpobrotus sp. a la heterogeneidad espacio-temporal en la distribución de recursos
Victoria Ruiz-Veloz1 ![]() , Sergio R. Roiloa1,2,*
, Sergio R. Roiloa1,2,* ![]()
(1) Universidade da Coruña, Área de Ecoloxía, Departamento de Bioloxía, Facultade de Ciencias, Campus A Zapateira, 15071, A Coruña, España.
(2) Universidade da Coruña, Grupo BioCost, CICA - Centro Interdisciplinar de Química e Bioloxía, Campus de Elviña, Rúa As Carballeiras, 15071, A Coruña, España.
* Autor para correspondencia / Corresponding author: Sergio R. Roiloa [sergio.roiloa@udc.es]
|
> Recibido / Received: 07/04/2025 – Aceptado / Accepted: 16/11/2025 |
Cómo citar / How to cite: Ruiz-Veloz, V., Roiloa, S. 2025. Respuesta de la planta invasora Carpobrotus sp. a la heterogeneidad espacio-temporal en la distribución de recursos. Ecosistemas 34(3): 3013. https://doi.org/10.7818/ECOS.3013
|
Respuesta de la planta invasora Carpobrotus sp. a la heterogeneidad espacio-temporal en la distribución de recursos Resumen: Las invasiones biológicas están consideradas como una de las mayores amenazas para la biodiversidad a nivel global al alterar los ecosistemas y afectar a diferentes servicios ecosistémicos. El éxito invasor de las plantas se ha relacionado con estrategias que incrementan la eficiencia en el uso de los recursos y respuestas plásticas ante diferentes ambientes. Este trabajo tiene como objetivo comparar dos poblaciones de Carpobrotus sp. que crecen en el mismo sistema dunar costero, pero que se localizan en dos ambientes contrastados (dimensión espacial: duna embrionaria y duna gris). Además, pretende determinar el efecto que los cambios temporales en la disponibilidad de recursos provocan en sus patrones de crecimiento (dimensión temporal). Los resultados muestran que independientemente del hábitat de origen, Carpobrotus sp. presenta un mayor crecimiento en las condiciones simuladas de duna embrionaria, donde dispone de un alto nivel de luz y tiene una baja disponibilidad hídrica. Este resultado sugiere que la radiación podría ser un recurso más limitante que la escasez hídrica para Carpobrotus sp. Por otra parte, se observa que esta especie presenta una rápida respuesta plástica, tanto a nivel morfológico como fisiológico, a la distinta disponibilidad de recursos. Así, Carpobrotus sp. incrementa la biomasa proporcional destinada a producir raíces en respuesta a la escasez de agua, y mantiene una alta eficiencia fotoquímica en condiciones de baja luminosidad. Esta respuesta es interpretada como una estrategia para aumentar la eficiencia en la adquisición de los recursos más limitantes, lo que le permitiría adaptarse eficientemente al hábitat que coloniza y contribuir a su éxito invasor. En el caso de Carpobrotus sp., más que la adaptación local, la elevada plasticidad espacio-temporal resulta clave para la colonización de hábitats con diferentes condiciones. Resulta crucial conocer esta estrategia para la protección de espacios especialmente biodiversos como los sistemas dunares costeros. Palabras clave: Carpobrotus sp.; dunas costeras; eficiencia fotoquímica; invasiones biológicas; patrón de repartición de recursos; plasticidad Response of the invasive Carpobrotus sp. to spatial and temporal heterogeneity in resource distribution Abstract: Biological invasions are considered one of the main threats to biodiversity worldwide, altering ecosystems and affecting several ecosystem services. The invasive success of plants has been linked to strategies that increase resource use efficiency and plasticity to different environments. This work aims to compare two populations of Carpobrotus sp. growing in the same coastal dune system but located in two contrasting environments (spatial dimension: embryo dune and grey dune). It also aims to determine the effect of temporal changes in resource availability on their growth patterns (temporal dimension). The results show that regardless of the habitat of origin, Carpobrotus sp. exhibit higher growth under embryo dune conditions, which have high light and low water availability. This result suggests that radiation may be a more limiting resource for Carpobrotus sp. than water scarcity. On the other hand, it is observed that this species shows a rapid plastic response, both morphologically and physiologically, to different resource availability. Thus, Carpobrotus sp. increases the proportion biomass allocated to roots in response to water scarcity and maintains high photochemical efficiency under low light conditions. This response is interpreted as a strategy to increase efficiency in the acquisition of the most limiting resources, which would allow it to adapt efficiently to the habitat it colonizes and contribute to its invasive success. In the case of Carpobrotus sp., rather than local adaptation, high spatio-temporal plasticity is key to habitat colonization. It is crucial to understand this strategy for the protection of particularly biodiverse areas such as coastal dune systems. Keywords: biological invasions; biomass partitioning pattern; Carpobrotus sp.; coastal sand dunes; photochemical efficiency; plasticity |
Introducción
Las invasiones biológicas representan una de las principales amenazas para la conservación de la biodiversidad y sus servicios ecosistémicos a escala global (Vilà et al. 2006; Ehrenfeld 2010; McGeoch et al. 2010; Simberloff et al. 2013; Mollot et al. 2017). Entender los mecanismos que subyacen en los procesos de invasión es clave para una gestión eficiente de este problema ambiental, incluyendo la identificación de futuros escenarios de invasión (Levine et al. 2003; Blackburn et al. 2011). Por ello, una de las cuestiones fundamentales en el campo de las invasiones biológicas continúa siendo la identificación de aquellos atributos que puedan ser determinantes para entender el éxito de una especie invasora. En este sentido, la respuesta plástica de los individuos a las condiciones locales que experimentan es considerado como un mecanismo de adaptación (Sultan 2001; Grime y Mackey 2002; van Kleunen y Fischer 2005; Valladares et al. 2006), y en particular ha sido señalo como una característica que podría favorecer el potencial invasor en plantas (Richards et al. 2006; Davidson et al. 2011; Pichancourt y Van Klinken 2012; Keser et al. 2014). La disponibilidad de recursos esenciales determina las respuestas plásticas de las plantas, que pueden ajustar sus patrones de crecimiento con el objetivo de incrementar la eficiencia en la adquisición de aquellos recursos más limitantes, tal y como establece la teoría clásica de distribución de recursos (Bloom et al. 1985; Hilbert 1990; Gleeson y Tilman 1992). Por otra parte, diferentes estudios han sugerido que una rápida adaptación a las condiciones del área introducida podría contribuir al éxito de las plantas invasoras (Maron et al. 2004; Sax et al. 2007; Colautti y Barrett 2013), y cabría esperar una selección positiva de aquellas características de las plantas que les confirieran una ventaja en el hábitat que están colonizando, como podría ser la plasticidad fenotípica (Lande 2015).
Estudios previos han comparado el crecimiento de diferentes especies de Carpobrotus que coexisten en el área introducida. Así, Campoy et al. (2019) demuestran una diferenciación ecofisiológica entre Carpobrotus edulis (L.) N.E.Br. y su congénere Carpobrotus aff. acinaciformis, que muestran estrategias diferentes en características como uso del agua, la eficiencia fotoquímica, o las respuestas a nutrientes. También se han comparado genotipos de C. edulis procedentes de diferentes hábitats, comprobándose que las estrategias de propagación clonal diferían entre poblaciones de dunas costeras y poblaciones de costa rocosa (Campoy et al. 2017). Similarmente, se han conducido experimentos estudiando el crecimiento de C. aff. acinaciformis en dunas costeras y costa rocosa bajo diferentes niveles de luz, reportando una alta plasticidad fenotípica en respuesta a los diferentes niveles de insolación (Traveset et al. 2008). Otros experimentos han examinado procesos de rápida adaptación de C. edulis durante el proceso de invasión en respuesta a los niveles de recursos. Así, Portela et al. (2019) encontraron una mayor plasticidad en repuesta a la disponibilidad de nutrientes en las poblaciones del área invadida que en las poblaciones del área nativa, indicando que esta característica podría haber sido seleccionada positivamente. Sin embargo, no se han realizado estudios que comparen poblaciones de Carpobrotus que colonizan un sistema dunar costero en relación con los diferentes factores que determina el marcado gradiente ambiental de estos hábitats, como son duna embrionaria y duna gris.
En este estudio examinamos la respuesta de la planta invasora Carpobrotus sp. a diferentes niveles de recursos, y si existe una adaptación a las condiciones locales donde se desarrolla. En particular, se testa el efecto de la disponibilidad de agua y luz en individuos de Carpobrotus sp. procedentes de condiciones contrastadas dentro de un sistema dunar costero. Se comparan individuos procedentes de duna embrionaria frente a individuos procedentes de duna gris, creciendo con niveles de agua y luz que simulan las disponibilidades de estos recursos en condiciones naturales. El objetivo es determinar si las poblaciones de Carpobrotus sp. que crecen dentro de un sistema dunar costero, pero localizadas en dos ambientes contrastados (duna embrionaria y duna gris) constituyen dos ecotipos, es decir, variantes genéticas dentro de la especie que reflejan la adaptación local de los organismos a su entorno. Además, se pretende determinar el efecto que los cambios temporales en estas condiciones ambientales provocan en el desarrollo de Carpobrotus sp. Concretamente, se plantean las siguientes preguntas: (1) ¿Ha experimentado Carpobrotus sp. procesos de adaptación a las condiciones locales dentro de un sistema dunar costero? Se hipotetiza que Carpobrotus sp. se desarrollará mejor cuando esté sometido a los mismos niveles de recursos que experimenta en su hábitat de origen, sugiriendo la presencia de una selección adaptativa. Así, si los individuos procedentes del hábitat donde una característica se prevé que sea ventajosa, la muestran de una manera más acentuada, sugeriría que esa característica ha sido seleccionada en ese hábitat por ser más favorable. (2) ¿Tiene Carpobrotus sp. capacidad de respuesta plástica ante un cambio temporal en los niveles de recursos? Hipotetizamos que Carpobrotus sp. podrá revertir sus patrones de asignación de recursos a las diferentes estructuras de la planta con el objetivo de adaptarse a los nuevos niveles de recursos y así optimizar su adquisición. Esta respuesta plástica de Carpobrotus sp. le reportaría una ventaja de adaptación ante ambientes cambiantes.
Material y métodos
Especie de estudio
Actualmente, se asume que las plantas del género Carpobrotus introducidas en la península ibérica son originarias de la región del Cabo (Sudáfrica) (Novoa et al. 2023). Ocupa hábitats costeros, incluyendo dunas, costa rocosa y acantilados, y está catalogada como invasora en diferentes regiones del mundo, incluyendo Australia, Nueva Zelanda, el sur de Europa y EE.UU. (Campoy et al. 2018). Carpobrotus sp. muestra propagación clonal mediante la producción de una estructura de tallos rastreros con capacidad de enraizamiento en cada nudo (Wisura y Glen 1993). Esta capacidad de reproducción asexual le permite expandirse horizontalmente, con la formación de grandes estructuras de individuos, denominados rametos, que pueden permanecer interconectados y fisiológicamente integrados (Roiloa 2019). Durante los últimos años se han estudiado diferentes aspectos de la ecología de Carpobrotus spp. en la Península, incluyendo trabajos sobre interacciones planta-suelo (de la Peña et al. 2010), planta-polinizador (Bartomeus et al. 2008), planta-herbívoro (Rodríguez et al. 2020, 2021, 2023), o aspectos relacionados con su clonalidad (para una revisión ver Roiloa 2019). Sin embargo, las repuestas plásticas de las plantas de Carpobrotus a los niveles de recursos ha sido menos estudiada (Portela et al. 2019).
Material vegetal
En enero de 2024 se recolectaron un total de 60 individuos de Carpobrotus sp., 30 en una duna embrionaria y 30 en una duna gris en el sistema dunar costero de Nerga (42º15'50'' N, 8º51'10'' W; Pontevedra, España) donde existe un marcado gradiente ambiental, con una duna embrionaria ocupada por especies como Silene littorea Brot., Pancratium maritimum L., Calamagrostis arenaria (L.) Roth o Eryngyum maritimun L., entre otras; y una duna gris con pinares bien desarrollados. Los individuos recolectados se correspondían con el rameto más apical del sistema clonal, y en momento de su recolección no había desarrollado raíces. Los individuos fueron recolectados en diferentes rodales de Carpobrotus sp. a lo largo del sistema dunar. La separación entre rodales de la duna embrionaria y la duna gris fue superior a 50 m. La separación entre los rodales dentro de cada tipo de duna fue variable, pudiendo ser recolectados varios fragmentos en el mismo rodal, o en rodales separados del más inmediato por distancias superiores a 2 m. El material vegetal recolectado se trasladó a la Facultad de Ciencias de la Universidade da Coruña donde cada individuo se pesó para obtener su peso fresco inicial. Un análisis previo mostró que no existían diferencias estadísticamente significativas entre los individuos procedentes de la duna embrionaria y los procedentes de la duna gris (ANOVA para el efecto del hábitat de origen para la variable peso fresco: F1,57 = 0.120, p = 0.730).
Diseño experimental
Los individuos se trasplantaron individualmente a macetas de plástico de 0.5 L llenadas previamente con arena de sistemas dunares típicamente habitados por Carpobrotus sp. Una vez trasplantados se regaron hasta capacidad de campo, y permanecieron en las mismas condiciones durante 30 días en una cámara de crecimiento. Estas condiciones consistieron en un ciclo de 12/12 h de luz con 80 µmol m-2 s-2 de PAR (radiación fotosintéticamente activa), con una humedad del 65 % y una temperatura de 18 °C durante el día y de 11 °C durante la noche. Durante este periodo las plantas fueron regadas para mantener el sustrato húmedo en todo momento, y periódicamente se examinaron 8 individuos escogidos al azar para detectar la producción de las primeras raíces. Una vez detectadas raíces incipientes, se procedió a aplicar los tratamientos experimentales.
El diseño experimental comprende tres factores cruzados: “hábitat”, “recursos” y “tiempo” (Fig. 1). El factor “hábitat” incluía dos niveles correspondientes a los dos ambientes donde Carpobrotus sp. fue recolectada: duna embrionaria y duna gris. El factor “recursos” incluía dos niveles: alta disponibilidad lumínica - baja disponibilidad hídrica (simulación duna embrionaria) y baja disponibilidad lumínica - alta disponibilidad hídrica (simulación duna gris). Estos tratamientos emulan las condiciones naturales experimentadas por Carpobrotus sp. en los hábitats estudiados. Así, cabría esperar que en la duna embrionaria se den condiciones de una mayor disponibilidad de luz (ausencia de vegetación arbórea y arbustiva) y una menor disponibilidad de agua (asociada a la menor presencia de vegetación y mayor insolación). Por el contrario, en la duna gris es previsible encontrar condiciones de baja disponibilidad de luz (debida a la sombra proyectada por una vegetación de mayor porte), y una mayor disponibilidad hídrica (derivada de la menor insolación y de un suelo con mayor capacidad de retención de agua). El factor “tiempo” comprendía tres niveles: t1: las plantas crecen durante 30 días desde el inicio de los tratamientos; t2: las plantas crecen durante 60 días desde el inicio de los tratamientos; t3: las plantas crecen durante 30 días bajo unas condiciones de recursos, y los siguientes 30 días se invierten esas condiciones de recursos (30 + 30 días). Los tratamientos del factor “tiempo” permitirán determinar la velocidad de respuesta de las plantas a los niveles de recursos aplicados (t1 vs t2) y la capacidad de revertir estas respuestas si las condiciones cambian (t3). En este sentido, t3 permitirá conocer la capacidad de adaptación de Carpobrotus sp. ante un cambio en las condiciones que ha experimentado durante su desarrollo, y que en condiciones naturales podrían deberse a procesos de sucesión o perturbación, o a la capacidad de dispersión de la propia especie que la sitúe en otras localizaciones. Las plantas procedentes de cada uno de los dos hábitats estudiados fueron aleatoriamente asignadas a cada tratamiento de recursos y tiempo. Cada combinación de tratamientos fue replicada cinco veces (n = 5).
El experimento se desarrolló en condiciones controladas de laboratorio, empleando para ello una cámara de crecimiento isotérmica (Equitec EGCHS 1505 HR 3L LED). El tratamiento de alta disponibilidad lumínica y baja disponibilidad hídrica consistió en regar una única vez las plantas al inicio del experimento y dejarlas crecer bajo una radiación fotosintéticamente activa (PAR) de 800 µmol m-2 s-1, valor que se corresponde con el PAR promedio en un día despejado en un sistema dunar (Baldwin y Maun 1983). El tratamiento baja disponibilidad lumínica y alta disponibilidad hídrica consistió en regar las plantas periódicamente para mantener el sustrato húmedo en todo momento y dejarlas crecer bajo un PAR de 160 µmol m-2 s-1, lo que corresponde con una reducción del 80 % con respecto a la luz recibida por las plantas en el tratamiento de alta disponibilidad de luz. Reducciones similares en radiación fueron descritas previamente en condiciones de sombra para C. edulis (Traveset et al. 2008). Todas las plantas crecieron en condiciones de temperatura de 26 °C y 60 % de humedad durante el día, y una temperatura de 11 °C, y humedad del 75 % durante la noche, siendo las 8:00 la hora a la que amanece y las 20:00 la hora a la que anochece (periodo día/noche de 12/12h). Estas condiciones de fotoperiodo, humedad y temperatura utilizados son similares a las obtenidas en la estación meteorológica de Cangas-Porto (Pontevedra) recogida en el mes de mayo de 2023 (MeteoGalicia, s.f.). Esta estación meteorológica se localiza próxima al sistema dunar de Nerga, donde fue recolectado el material vegetal. Estudios previos en sistemas dunares han mostrado que el máximo crecimiento de Carpobrotus se produce durante el mes de mayo (Roiloa et al. 2010).
Los tratamientos comenzaron el día 4 de marzo de 2024. A los 30 días se procedió a la cosecha de 1/3 de los individuos (t1), otro 1/3 permaneció en el experimento bajo las mismas condiciones (t2), y al tercer 1/3 de plantas se le invirtieron los tratamientos de recursos a los que estaban sometidos (t3). A los 60 días desde el inicio del experimento, el 2 de mayo de 2024, se cosechó todo el material vegetal restante (t2 y t3) (Fig. 1).
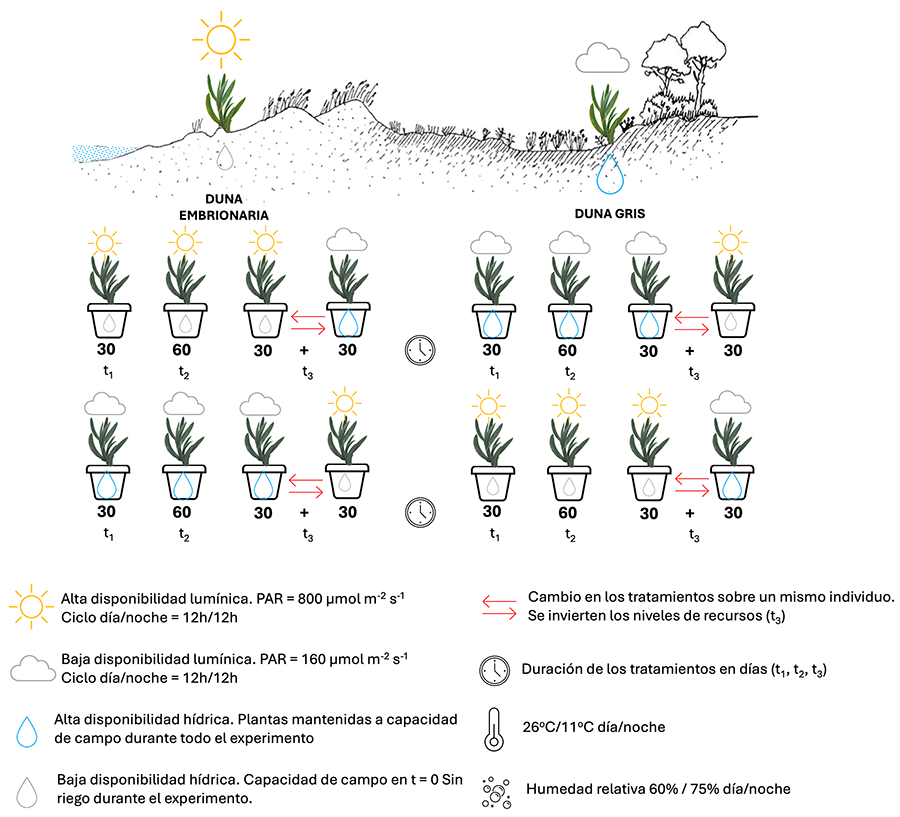
Figura 1. Representación gráfica del diseño experimental, mostrando los niveles “hábitat de origen” (duna embrionaria, y duna gris), “recursos” (alta disponibilidad lumínica-baja disponibilidad hídrica, y baja disponibilidad lumínica-alta disponibilidad hídrica) y “tiempo” (30, 60 y 30 +30 días).
Figure 1. Graphical representation of the experimental design, showing the levels "habitat" (embryo dune, and grey dune), "resources" (high light-low water, and low light-high water) and "time" (30, 60 and 30 +30 days).
Medidas
Biomasa
A los 30 días (t1), se cosecharon un total de 20 plantas, 5 individuos de cada una de las cuatro combinaciones de tratamientos: 2 “hábitat” x 2 “recursos”. Se lavaron cuidadosamente las raíces para eliminar la arena, se secaron, se guardaron de forma individual en sobres de papel y se dejaron secar en estufa a 70 °C durante 48 h. Una vez secas, se separó la parte aérea (hojas y estolón) de las raíces y se pesaron por separado en una balanza de precisión. De esta forma se obtuvo para cada individuo su biomasa aérea y su biomasa radicular. A los 60 días desde el inicio del experimento se realizó la cosecha de las 40 plantas restantes: 20 que habían permanecido todo el experimento en las mismas condiciones de disponibilidad de recursos (t2), y 20 cuyas condiciones habían sido invertidas tras los 30 primeros días (t3). La cosecha de este material al finalizar el experimento siguió el mismo protocolo que el de la cosecha intermedia. Posteriormente, se calculó para cada una de las plantas: la biomasa total en peso seco, sumando el peso de la parte aérea y de las raíces (biomasa total = biomasa aérea + biomasa de raíz), y la proporción de biomasa destinada a las raíces, que resulta de la división de la biomasa de las raíces entre la biomasa seca total (relación de masa radicular, RMR = biomasa raíz / biomasa total).
Fluorescencia de la clorofila
La máxima eficiencia cuántica de PSII (Fv/Fm) se obtuvo utilizando un fluorímetro de clorofila portátil (OS30p+, Opti-Sciences, Inc. Hudson, NH, USA). La Fv/Fm se determinó como la relación (Fm - F0)/Fm, donde F0 y Fm son, respectivamente, el rendimiento mínimo y máximo de fluorescencia de una muestra adaptada a la oscuridad, donde todos los receptores primarios de PSII están oxidados (Maxwell y Johnson 2000). La Fv/Fm se determinó después de un período de adaptación a oscuridad de 30 minutos, permitiendo así que los centros de reacción de PSII de la hoja estuviesen completamente abiertos. Las medidas se realizaron sobre una hoja sana y que estuviese desarrollada por completo en cada una de las plantas del experimento. La Fv/Fm se midió a lo largo del experimento a los 0, 16, 30, 44 y 60 días después del comienzo de los tratamientos. La La Fv/Fm estima la eficiencia en el transporte de electrones en el PSII, indicador de limitaciones en la actividad fotosintética asociadas a estrés fisiológico, como exceso de luz, sequía, temperaturas extremas o deficiencias nutricionales (Maxwell y Johnson 2000; Adams y Demmig-Adams 2204; Murchie y Lawson 2013; Bussotti et al. 2020).
Análisis estadístico
En el transcurso del experimento se registró la muerte de un individuo a los 42 días desde el trasplante inicial de las plantas, y por lo tanto no fue incluido en los análisis estadísticos. Las diferencias en el peso fresco inicial se analizaron mediante un análisis de varianza (ANOVA) de una vía con “hábitat” como factor principal. Las diferencias en la biomasa de raíces, parte aérea, biomasa total y RMR se analizaron utilizando un ANOVA de dos vías con “hábitat” y “recursos” como factores fijos, incluyendo su interacción, y para cada uno de los tiempos ensayados: cosecha intermedia (t1), cosecha final (t2), y cosecha final con cambio intermedio de tratamientos (t3). Las diferencias en la máxima eficiencia cuántica de PSII (Fv/Fm) se determinaron mediante un análisis de varianza de medidas repetidas (ANOVAR) de dos vías con “hábitat” y “recursos” como factores fijos, incluyendo su interacción, y considerando tiempo como factor aleatorio.
Los requisitos de normalidad y homogeneidad de varianza de la estadística paramétrica se testaron mediante los test de Kolmogorov-Smirnov y de Levene, respectivamente. Todas las variables cumplían con estas condiciones, por lo que no fue necesario realizar ninguna transformación de los datos. Los niveles de significación se establecieron en p = 0.05. Los análisis se llevaron a cabo con IBM SPSS Statistics, versión 27 (IBM Corp., Armonk, Nueva York, NY, EE.UU.).
Resultados
Los resultados de la cosecha inicial (t1) mostraron un efecto de los niveles de recursos marginalmente significativo para la biomasa total (p = 0.052), y estadísticamente significativo para la biomasa de raíz y el índice RMR (p < 0.05) (Tabla 1). Se observó un incremento de las tres variables cuando las plantas fueron sometidas a unas condiciones de alta disponibilidad lumínica y baja disponibilidad hídrica (Fig. 2). Este patrón se obtuvo tanto en las plantas procedentes de la duna embrionaria como en las procedentes de la duna gris. Esta misma tendencia observada a los 30 días (t1), se mantuvo significativa en la cosecha final (60 días, t2). Además, al finalizar el experimento la biomasa de la parte área fue significativamente mayor en las plantas que crecieron en condiciones de alta disponibilidad lumínica y sequía (Tabla 1; Fig. 2). Por otra parte, en función del hábitat de origen los resultados mostraron diferencias marginalmente significativas en la biomasa total (p = 0.054) y estadísticamente significativas en la biomasa aérea (p = 0.031) (Tabla 2). Para ambas variables se observó una mayor biomasa en las plantas procedentes de la duna gris (Fig. 2). Cuando se cambiaron los tratamientos aplicados a las plantas en la mitad del experimento (t3), los resultados obtenidos solo muestran diferencias marginalmente significativas en la biomasa de raíz en función de los recursos (p = 0.053). Así, se pudo observar que la producción de biomasa radicular se mantuvo significativamente mayor en aquellas plantas que crecieron en condiciones de alta disponibilidad lumínica y baja disponibilidad de agua, incluso cuando las condiciones se invirtieron en la mitad del experimento (Fig. 2).
Los resultados del ANOVAR que testó las diferencias en la máxima eficiencia cuántica de PSII (Fv/Fm) a lo largo del tiempo mostró un efecto significativo de la disponibilidad de recursos en los tres escenarios del experimento: t1, t2, y t3 (Tabla 2). En todos los casos se observa que la eficiencia fotoquímica está afectada por la disponibilidad de recursos y es independiente del hábitat de origen. Así, se puede observar que las plantas que se desarrollan bajo unas condiciones de baja disponibilidad lumínica y alta disponibilidad hídrica presentan valores significativamente mayores de Fv/Fm, y que este patrón se mantiene en las tres situaciones ensayadas: a los 30 días (t1), a los 60 días (t2), y cuando los niveles de recursos se invirtieron a mitad del experimento (t3) (Fig. 3).
Tabla 1. Resultados del análisis de varianza (ANOVA) para el efecto del hábitat de origen y nivel de recursos sobre a la biomasa aérea, la biomasa de raíz, la biomasa total, la biomasa proporcional destinada a las raíces (RMR). Los valores con p < 0.05 se muestran en negrita. Consultar la Figura 2 para los datos.
Table 1. Results of the analysis of variance (ANOVA) for the effects of the habitat and level of resources on the aboveground biomass, root biomass, total biomass, proportional biomass allocated to roots (RMR). Values of p < 0.05 are shown in bold. See Figure 2 for data.
|
|
|
Biomasa aérea |
Biomasa raíz |
Biomasa total |
RMR |
||||
|
Efectos |
g.l. |
F |
p |
F |
p |
F |
p |
F |
p |
|
t1 |
|||||||||
|
Hábitat (H) |
1 |
0.948 |
0.345 |
2.316 |
0.148 |
0.181 |
0.676 |
2.339 |
0.146 |
|
Recursos (R) |
1 |
0.906 |
0.355 |
12.165 |
0.003 |
4.388 |
0.052 |
12.901 |
0.002 |
|
H x R |
1 |
0.129 |
0.724 |
1.402 |
0.254 |
0.556 |
0.467 |
0.253 |
0.622 |
|
Error |
16 |
|
|
|
|
|
|
|
|
|
t2 |
|||||||||
|
Hábitat (H) |
1 |
5.649 |
0.031 |
0.008 |
0.932 |
4.376 |
0.054 |
1.98 |
0.180 |
|
Recursos (R) |
1 |
14.369 |
0.002 |
11.964 |
0.004 |
21.147 |
<0.001 |
5.799 |
0.029 |
|
H x R |
1 |
2.378 |
0.144 |
0.283 |
0.602 |
2.446 |
0.139 |
0.005 |
0.946 |
|
Error |
15 |
|
|
|
|
|
|
|
|
|
t3 |
|||||||||
|
Hábitat (H) |
1 |
2.968 |
0.104 |
3.598 |
0.076 |
3.561 |
0.077 |
0.001 |
0.970 |
|
Recursos (R) |
1 |
2.634 |
0.124 |
4.352 |
0.053 |
3.347 |
0.086 |
0.434 |
0.519 |
|
H x R |
1 |
0.026 |
0.875 |
0.103 |
0.752 |
0.008 |
0.930 |
0.305 |
0.589 |
|
Error |
16 |
|
|
|
|
|
|
|
|
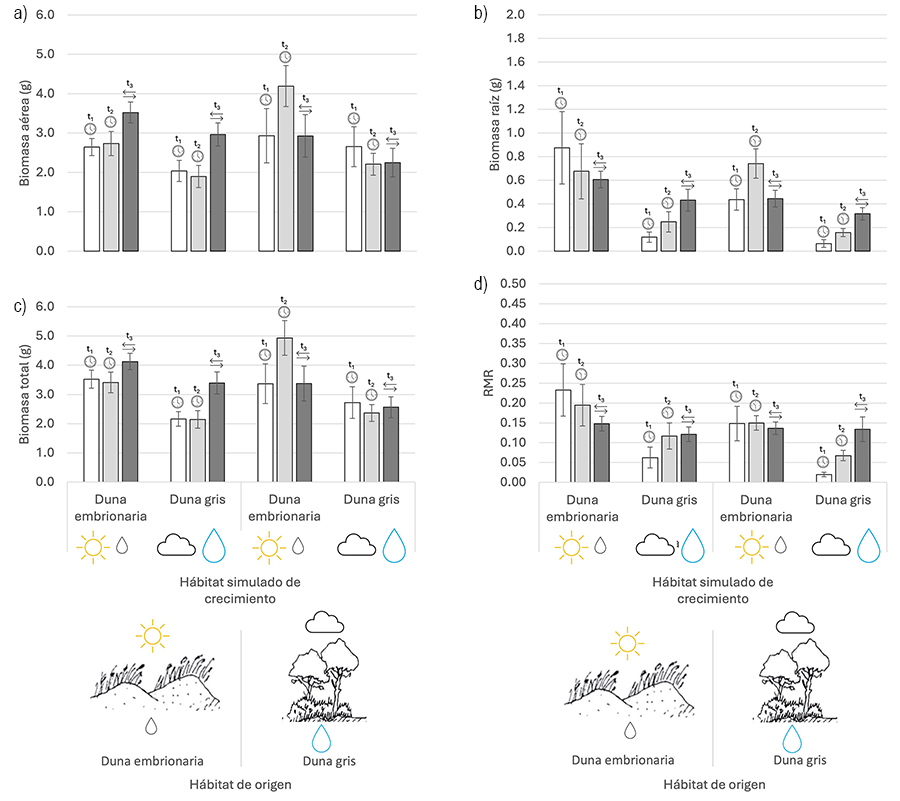
Figura 2. Biomasa aérea (a), biomasa de raíz (b), biomasa total (c) y biomasa proporcional destinada a raíces (RMR = biomasa de raíz / biomasa total) (d) (media ± Error Estándar) de C. edulis en los diferentes tratamientos (Hábitat de origen: duna embrionaria; duna gris. Recursos: alta disponibilidad lumínica y baja disponibilidad hídrica » duna embrionaria; baja disponibilidad lumínica y alta disponibilidad hídrica » duna gris. Tiempo: 30 días desde el inicio de los tratamientos t1; 60 días desde el inicio de los tratamientos t2; cambio de los niveles de recursos en la mitad del experimento t3). Consulte la Tabla 1 para los resultados del ANOVA.
Figure 2. Aboveground biomass (a), root biomass (b), total biomass (c) and proportional biomass allocated to roots (RMR = root biomass / total biomass) (d) (mean ± SE) of C. edulis in the different treatments (Habitat: embryo dune; grey dune. Resources: high light - low water » embryo dune; low light - high water » grey dune. Time: 30 days from the begin of treatments t1; 60 days from the begin of treatments t2; change of resource levels at the middle of the experiment t3). See Table 1 for ANOVA results.
Tabla 2. Resultados del análisis de varianza (ANOVAR) para el efecto del hábitat de origen y nivel de recursos sobre la máxima eficiencia cuántica de PSII (Fv/Fm) a lo largo del tiempo según la variabilidad espacial (t1 y t2) y la variabilidad temporal. Los valores con p < 0.05 se muestran en negrita. Consultar la Figura 3 para los datos.
Table 2. Results of the analysis of variance (ANOVAR) for the effect2 of habitat and level of resources on the maximum quantum efficiency of PSII (Fv/Fm) over time according to spatial variability (t1 and t2) and temporal variability. Values of p < 0.05 are shown in bold. See Figure 3 for data.
|
Efectos |
g.l. |
|
F |
p |
|
t1 |
||||
|
Hábitat (H) |
1 |
Entre sujetos |
0.100 |
0.756 |
|
Recursos (R) |
1 |
22.205 |
<0.001 |
|
|
H x R |
1 |
0.130 |
0.723 |
|
|
Error |
16 |
|||
|
Tiempo (t) |
2 |
Dentro de sujeto |
14.402 |
<0.001 |
|
H x t |
2 |
0.572 |
0.570 |
|
|
R x t |
2 |
18.488 |
<0.001 |
|
|
H x R x t |
2 |
0.403 |
0.672 |
|
|
Error |
32 |
|||
|
t2 |
|
|
|
|
|
Hábitat (H) |
1 |
Entre sujetos |
0.392 |
0.541 |
|
Recursos (R) |
1 |
99.919 |
<0.001 |
|
|
H x T |
1 |
0.091 |
0.768 |
|
|
Error |
15 |
|||
|
Tiempo (t) |
4 |
Dentro de sujeto
|
22.559 |
<0.001 |
|
H x t |
4 |
0.396 |
0.811 |
|
|
R x t |
4 |
20.687 |
<0.001 |
|
|
H x R x t |
4 |
0.530 |
0.714 |
|
|
Error |
60 |
|
|
|
|
t3 |
||||
|
Hábitat (H) |
1 |
Entre sujetos |
0.820 |
0.379 |
|
Recursos (R) |
1 |
4.717 |
0.045 |
|
|
H x R |
1 |
1.983 |
0.178 |
|
|
Error |
16 |
|||
|
Tiempo (t) |
4 |
Dentro de sujeto
|
13.568 |
<0.001 |
|
H x t |
4 |
1.198 |
0.320 |
|
|
R x t |
4 |
55.430 |
<0.001 |
|
|
H x R x t |
4 |
0.844 |
0.502 |
|
|
Error |
64 |
|
|
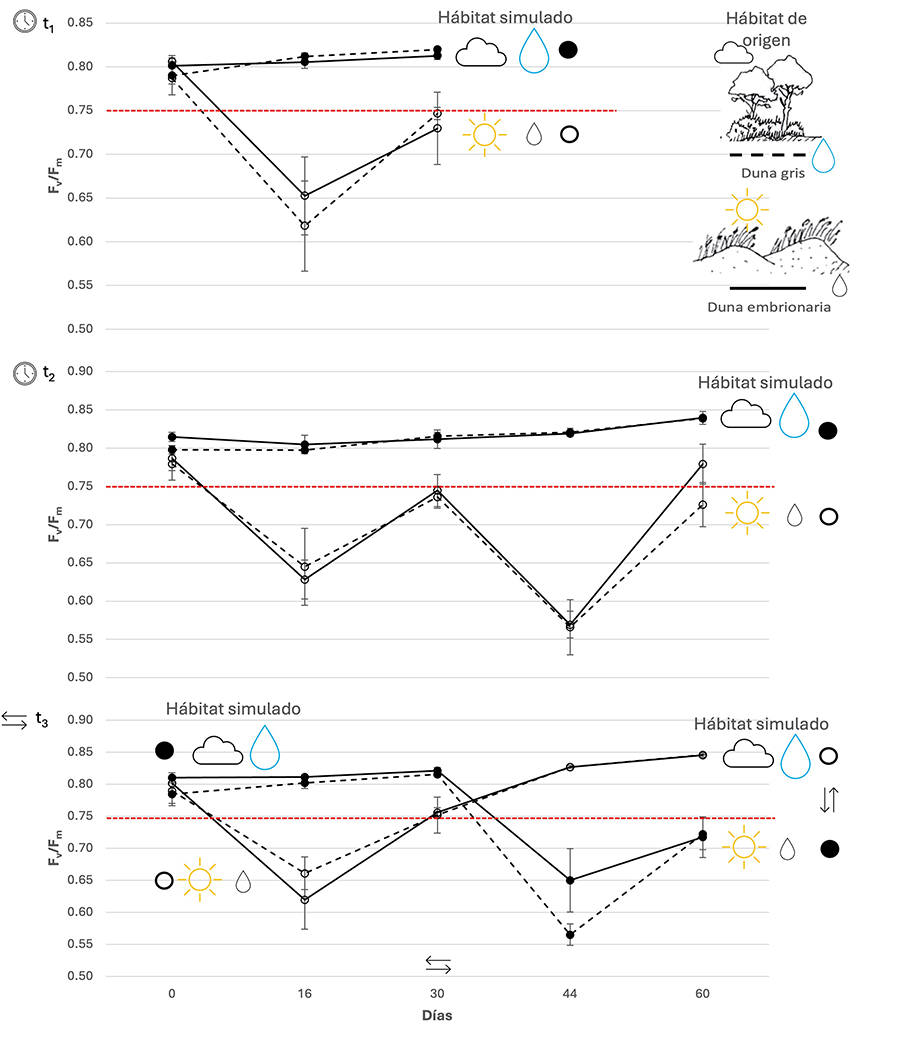
Figura 3. Cambios de Fv/Fm (media ± Error Estándar) a lo largo del tiempo en los individuos de duna embrionaria (línea continua) y de duna gris (línea discontinua) que crecían al inicio del experimento en condiciones de alta disponibilidad lumínica y baja disponibilidad hídrica » duna embrionaria (círculos abiertos) y baja disponibilidad lumínica y alta disponibilidad hídrica » duna gris (círculos cerrados), en los diferentes “tiempos”: t1, t2 , y t3. Se destaca en rojo valores de Fv/Fm de 0.75 como indicativo del límite inferior de ausencia de fotoinhibición. Consulte la Tabla 2. para los resultados del ANOVA.
Figure 3. Changes of Fv/Fm (mean ± SE) over time in embryo dune (solid line) and grey dune (dashed line) individuals growing at the beginning of the experiment under high light - low water » embryo dune (open circles) and low light - high water » grey dune (closed circles) conditions, in the different "times": t1, t2, and t3. Fv/Fm values of 0.75 are highlighted in red as indicative of the lower limit of the absence of photoinhibition. See Table 2. for ANOVA results.
Discusión
La primera hipótesis planteaba la presencia de una adaptación de las condiciones locales. Así, se proponía que los individuos procedentes de duna embrionaria se desarrollarían mejor bajo los niveles de recursos que simulaban ese hábitat —alta disponibilidad lumínica y escasez hídrica—, mientras que para los individuos recolectados en la duna gris se preveía un mayor crecimiento en condiciones de sombra y mayor disponibilidad hídrica, como cabría encontrar en su hábitat de origen. Esta hipótesis se basa en la racionalización de que parece lógico presuponer procesos de selección de aquellas características que representen una ventaja en los ambientes locales, y que por lo tanto los individuos se desarrollaran mejor en esas condiciones donde han evolucionado adaptativamente. Trabajos previos ya habían apuntado a procesos de adaptación a las condiciones locales en C. edulis. Así, Campoy et al. (2017) reportan diferencias en sus estrategias de integración clonal entre genotipos de C. edulis en función de su hábitat de origen, con aquellos procedentes de una duna costera mostrando un ecotipo con una mayor plasticidad en sus patrones de crecimiento modular, a diferencia de los genotipos que colonizan las costas rocosas. Esta mayor plasticidad modular, expresada como capacidad de división de tareas en el sistema clonal, es seleccionada positivamente en aquellos ambientes más heterogéneos, representados por las dunas costeras, y que por lo tanto donde esta plasticidad modular puede ser más beneficiosa. Sin embargo, en nuestro estudio, los resultados no apuntan a la existencia de procesos de adaptación local. Así, se observó un mayor crecimiento en condiciones de alta disponibilidad de luz y baja disponibilidad hídrica, tanto en los individuos procedentes de la duna embrionaria, como en aquellos procedentes de la duna gris. Este resultado descarta, al menos para las características estudiadas, la presencia de dos ecotipos diferentes de Carpobrotus sp. en función de su localización en un gradiente dunar. La mayor producción de biomasa total observada en las plantas que crecieron con una alta disponibilidad lumínica y una baja disponibilidad hídrica se detectó a los 30 días (t1) y se mantuvo o incluso se acentuó al finalizar el experimento (60 días, t2). Estos resultados apuntan a que las mejores condiciones para el crecimiento de Carpobrotus sp. se corresponden con las de una duna embrionaria, donde podemos encontrar situaciones de alta insolación y baja disponibilidad hídrica en sus suelos arenosos (McLachlan y Brown 2006; Maun 2009).
Carpobrotus sp. es una planta suculenta que bajo condiciones no estresantes presenta un metabolismo C3 pero capaz activar facultativamente un metabolismo CAM en condiciones de baja disponibilidad hídrica y salinidad (CAM facultativa) confiriéndole una gran tolerancia a la sequía (Earnshaw et al. 1987; Rabas y Martin 2003). Por lo tanto, bajo los tratamientos ensayados, el agua no representaría una limitación para el crecimiento de Carpobrotus sp. y sería la disponibilidad de luz el factor que limita el crecimiento. Así, las adaptaciones de Carpobrotus sp. le permiten desarrollarse especialmente bien en una duna embrionaria, donde la alta disponibilidad lumínica es aprovechada en el proceso fotosintético sin que la limitación hídrica produzca un estrés significativo. En este sentido, cabría esperar que Carpobrotus sp. muestre puntos de compensación de la luz elevados, que le permitieran aprovechar las condiciones de duna embrionaria, pero que limitaran su crecimiento en condiciones umbrías. Además, trabajos previos han demostrado la capacidad de C. edulis de activar diferentes respuestas fotoprotectoras que le permiten mitigar los posibles efectos negativos de un exceso de radiación (Fenollosa et al. 2017). Sin embargo, en las condiciones de duna gris, la menor disponibilidad de luz provocada por el sombreado de otras especies de mayor porte podría disminuir su capacidad de crecimiento. No obstante, otros estudios han apuntado que la plasticidad de Carpobrotus en respuesta a diferentes intensidades de luz le permite mantener su crecimiento incluso en condiciones de sombra moderada, lo que podría facilitar su crecimiento en hábitats de sotobosque (Traveset et al. 2008). Es importante señalar que nuestro estudio ha utilizado únicamente la combinación simultanee de dos niveles de recursos (luz y agua) que, si bien muestran diferentes patrones en los hábitats de duna embrionaria y duna gris, no son los únicos factores que caracterizan estos sistemas. Así, otros factores abióticos como niveles de nutrientes del suelo, movilidad del sustrato, salinidad, temperatura, o pH, también juegan un papel importante a la hora de definir los cambios en un gradiente ambiental costa-interior (McLachlan y Brown 2006; Maun 2009). Sin embargo, estos factores abióticos no han sido considerados en nuestro estudio. En este sentido, experimentos con un diseño de trasplantes recíprocos en condiciones de campo podría contribuir a dilucidar la presencia de ecotipo de Carpobrotus sp. en duna embrionarias y duna gris. En un reciente estudio Pérez-Diz et al. (2023) señalan la capacidad de Carpobrotus sp. para tolerar condiciones de estrés abiótico en hábitats costeros mediante plasticidad fenotípica. De manera similar Campoy et al. (2022) apuntan a la plasticidad fenotípica como un atributo que podría estar explicando la capacidad de C. edulis para colonizar nuevos hábitats. Estudios previos han reportado diferentes estrategias de las plantas para adatarse a las condiciones prevalentes en las dunas costeras, discutiendo su importancia para explicar la co-existencia de especies y el ensamblaje de las comunidades (Rubio-Casal et al. 2010; Bermúdez y Retuerto 2014). Por otra parte, también debe considerarse que nuestro estudio solo recoge la variabilidad de condiciones de un único sistema dunar, y que por lo tanto para poder realizar una generalización más sólida de nuestros resultados más sistemas dunares deberían ser examinados.
En cuanto a los patrones de distribución de recursos a las distintas estructuras de la planta, se observa un incremento significativo de la proporción de biomasa destinada a las raíces (RMR) cuando Carpobrotus sp. crece en condiciones de duna embrionaria, es decir con una baja disponibilidad hídrica y alta luminosidad. Este resultado se ajusta con la teoría clásica de distribución de recursos (Bloom et al. 1985; Hilbert 1990; Gleeson y Tilman 1992), que propone una respuesta plástica de las plantas que incrementan la biomasa destinada a la producción del órgano responsable de la adquisición del recurso más limitante. En este caso, la planta tiende a responder a la baja disponibilidad hídrica incrementando la proporción de sus raíces con el objetivo de mejorar su capacidad de captación de agua, compensando de esta manera su escasez. Este patrón se observa ya a los 30 días (t1) desde el inicio de los tratamientos y se mantiene hasta el final del experimento. Esta respuesta plástica a la disponibilidad de recursos se encontró tanto en las plantas procedentes de duna embrionaria como en aquellas procedentes de duna gris, ahondando en la evidencia de que, al menos en este caso, no existen ecotipos diferenciados de Carpobrotus sp.. Esta habilidad de Carpobrotus sp. a compensar la escasez hídrica mediante cambios en sus patrones de crecimiento, junto con su fisiología CAM facultativa (Earnshaw et al. 1987), podría explicar el buen desarrollo de la especie en condiciones de duna embrionaria, donde la baja disponibilidad de agua en el suelo es una característica habitual (McLachlan y Brown 2006; Maun 2009).
La segunda hipótesis planteada en nuestro estudio perseguía determinar la capacidad de respuesta de Carpobrotus sp. ante un cambio brusco en la disponibilidad de recursos. Cuando los niveles de recursos se invierten en la mitad del experimento los resultados muestran un cambio en los patrones de producción de estructuras en Carpobrotus sp., y las diferencias observadas en RMR durante los primeros 30 días desaparecen. Es decir, con el incremento de la disponibilidad hídrica Carpobrotus sp. comienzan a revertir su respuesta, reduciendo la proporción de biomasa destinada a producir raíces. Análogamente, el cese de suministro de agua provoca un incremento en la producción de raíces como mecanismo compensatorio, y siguiendo la teoría clásica de reparto de biomasa (Bloom et al. 1985; Hilbert 1990; Gleeson y Tilman 1992). Aunque este cambio plástico en los patrones de crecimiento se detectó tanto en los genotipos recolectados en la duna embrionaria como en aquellos procedentes de una duna gris, fue especialmente marcado en dos casos: (i) individuos que procedían de una duna embrionaria, que crecieron la mitad del experimento en condiciones de baja disponibilidad híbrida (común en su hábitat de origen), al recibir un mayor aporte de agua en la segunda mitad del experimento disminuyen abruptamente la producción proporcional de raíces. (ii) Por otra parte, individuos recolectados en la duna gris, que fueron sometidos durante la primera fase del experimento a condiciones típicas de su hábitat de origen (alta disponibilidad hídrica), incrementaron claramente su biomasa proporcional destinada a producir raíces al detectar la ausencia de agua. El cambio en los niveles de recursos provocó, por lo tanto, que las diferencias en RMR detectadas en la primera fase del experimento desaparezcan, sin embargo, nuestros resultados no mostraron que el cambio de patrón fuera lo suficientemente intenso para provocar nuevas diferencias estadísticamente significativas. En cualquier caso, nuestros resultados avalan la segunda hipótesis propuesta, probando la capacidad de Carpobrotus sp. para responder rápidamente ante un cambio en los niveles de recursos, modificando sus patrones de crecimiento. Esta respuesta plástica podría favorecer la capacidad de adaptación de Carpobrotus sp. a ambientes cambiantes. Diferentes fenómenos pueden provocar que las condiciones en las que se desarrolla Carpobrotus sp. cambien a lo largo del tiempo (Maun 2009). Así, procesos de sucesión ecológica podrían modificar las condiciones de una duna embrionaria y hacerla evolucionar hacía una duna gris. Por otra parte, eventos de perturbación podrían revertir una duna gris hacía una duna embrionaria. Además, la capacidad de dispersión de Carpobrotus sp. a partir de fragmentos del sistema clonal, puede provocar que individuos que inicialmente se hayan desarrollado en unas condiciones terminen por colonizar ambientes con otras condiciones diferentes (Roiloa y Retuerto 2016; Roiloa 2019). Los resultados obtenidos en nuestro estudio denotan la alta capacidad de respuesta plástica de Carpobrotus sp., con individuos adaptándose a las condiciones en un periodo de apenas un mes, y con capacidad para revertir, o al menos para iniciar este proceso, cuando las condiciones cambian.
Diferentes estudios han sugerido que la plasticidad en respuesta a las factores ambientales es un atributo importante que podría explicar el éxito invasor de las especies introducidas (Richards et al. 2006; Davidson et al. 2011; Pichancourt y Van Klinken 2012; Keser et al. 2014). En este sentido, Portela et al. (2019) han encontrado que poblaciones de C. edulis en el rango invadido presentan una mayor plasticidad en respuesta a la disponibilidad de recursos que poblaciones en el rango nativo. Traveset et al. (2008) también han señalado una elevada plasticidad de Carpobrotus en respuesta a niveles de luz, manteniendo un rendimiento fotosintético relativamente alto, lo que permite así poder invadir no solo sistemas dunares abiertos si no también hábitats de sotobosque. Por otra parte, Fenollosa et al. (2017) apuntan a una mayor plasticidad fenotípica, en términos de estrategias de fotoprotección, de C. edulis en comparación con especies nativas con las que coexiste. Estos estudios previos y nuestros resultados parecen apoyar la idea de que éxito invasor de Carpobrotus sp. podría estar explicada, al menos en parte, por su capacidad plástica de adaptación a las condiciones ambientales.
En cuanto a la eficiencia fotoquímica (estimada como el rendimiento cuántico máximo de PSII, Fv/Fm) se observa que independientemente del hábitat de origen, los individuos que crecen con baja radiación presentan valores de Fv/Fm significativamente mayores a lo largo del experimento que aquellos individuos que crecían en condiciones de alta radiación. Se podría sugerir que, pese a la escasez de intensidad lumínica, la planta es capaz de mantener eficiencia fotoquímica y su crecimiento, denotando su plasticidad para adaptarse a estos ambientes más umbríos. Esta interpretación estaría acorde con la teoría clásica de distribución de recursos por la cual las plantas se especializan en la adquisición del recurso más limitante (Bloom et al. 1985; Hilbert 1990; Gleeson y Tilman 1992). Estos niveles de eficiencia fotoquímica a pesar de las condiciones de baja radiación podrían explicar la presencia de Carpobrotus sp. en hábitats sombreados, como es el caso de sotobosque de pinares en hábitats costeros (Pérez-Diz et al. 2023). De manera similar a nuestros resultados, Traveset et al. (2008) reportaron también valores significativamente mayores de Fv/Fm en condiciones de sombra que en condiciones de luz para C. aff. acinaciformis, señalando la importancia de la plasticidad en repuesta a diferentes condiciones de radiación para la colonización de diferentes hábitats por parte de esta especie invasora. Interesantemente, cuando se cambiaron las condiciones a mitad del experimento este patrón se mantuvo. Así, las plantas que antes disponían de una alta disponibilidad de luz y que en la segunda mitad del experimento fueron sombreadas incrementor su eficiencia fotoquímica, pudiendo compensar la baja cantidad de radiación. Este resultado sugiere que la respuesta plástica de Carpobrotus sp. a los niveles de recursos se produjo también a nivel fisiológico, pudiendo contribuir a la rápida adaptación de la especie a las condiciones de los hábitats que invade. Estudios previos también han señalado la capacidad de C. edulis de mostrar cambios plásticos en su eficiencia fotoquímica en función de los niveles de recursos y su grado de integración fisiológica (Roiloa et al. 2014; Roiloa et al. 2016). Por otra parte, los valores de Fv/Fm para condiciones de sombra y riego fueron 0.82 ± 0.003 (media ± error estándar), con valores relativamente estables en el tiempo. Algunos autores señalan que valores de Fv/Fm de 0.75 o superiores son indicativos de plantas saludables (Demmig‐Adams et al. 1996), pudiendo ser indicativos de fotoinhibición valores por debajo de este umbral. Los valores más bajos obtenidos en las condiciones que emulan duna embrionaria podrían ser achacados a un efecto de estrés hídrico y fotoinhibición como consecuencia de la alta radiación. Sin embargo, el mayor crecimiento detectado en las plantas sometidas a este tratamiento sugiere la capacidad de Carpobrotus de compensar este tipo de estrés. En este sentido, diferentes estudios han sugerido la capacidad de C. edulis para desarrollar diferentes estrategias fisiológicas que le permitan mitigar tanto la escasez de agua como el exceso de radiación (Fenollosa et al. 2017; Campoy et al. 2018). Sería interesante monitorizar en futuros estudios los valores Fv/Fm de Carpobrotus sp. en condiciones de campo, tanto en duna embrionario como en duna gris para confirmar si se mantienen estos patrones.
Conclusiones
Los resultados muestran la capacidad de Carpobrotus sp. a responder de manera plástica a la disponibilidad de recursos. Esta respuesta además se produce tanto a nivel morfológico como fisiológico. Así, Carpobrotus sp. incrementa la biomasa proporcional destinada a producir raíces en respuesta a la escasez de agua, e incrementa su eficiencia fotoquímica en respuesta a las condiciones sombra. Esta respuesta es interpretada como una estrategia para aumentar la eficiencia en la adquisición de los recursos más limitantes, lo que estaría acorde con la teoría clásica de distribución de recursos en plantas. Interesantemente, Carpobrotus sp. mostró capacidad para alterar este patrón de respuesta cuando la disponibilidad de recursos varia temporalmente. Esta plasticidad podría facilitar su capacidad de adaptación a las condiciones locales, incluso cuando estas son cambiantes, y así contribuir al éxito invasor de Carpobrotus sp.. Los resultados encontrados fueron consistentes en los individuos de las dos poblaciones estudiadas, los procedentes de duna embrionaria y los procedentes de duna gris. Por lo tanto, al menos para las características estudiadas, se descarta la presencia de procesos de adaptación a las condiciones locales a lo largo del gradiente ambiental del sistema dunar, y por lo tanto no se podría hablar de existencia de ecotipos en cada uno de estos hábitats. Además, los resultados podrían indicar que los hábitats de duna embrionaria son especialmente sensibles a una invasión por Carpobrotus sp., ya que es donde mejor parece desarrollarse.
Contribución de los autores
Victoria Ruiz-Veloz: Investigación, Análisis formal, Redacción – borrador original. Sergio R. Roiloa: Conceptualización, Supervisión, Redacción - revisión y edición.
Disponibilidad de datos y código
Los datos estarán disponibles bajo demanda contactando con el autor de correspondencia.
Financiación, permisos requeridos, potenciales conflictos de interés y agradecimientos
Los autores declaran no tener ningún conflicto de interés.
Referencias
Adams, W.W., Demmig-Adams, B. 2004. Chlorophyll Fluorescence as a Tool to Monitor Plant Response to the Environment. In: Papageorgiou, G.C., Govindjee (eds.). Chlorophyll a Fluorescence. Advances in Photosynthesis and Respiration, vol 19., pp 583–604. Springer, Dordrecht. https://doi.org/10.1007/978-1-4020-3218-9_22
Baldwin, K. A., Maun, M. A. 1983. Microenvironment of Lake Huron sand dunes. Canadian Journal of Botany 61(1), 241-255. https://doi.org/10.1139/b83-028
Bartomeus, I., Bosch, J., Vilà, M. 2008. High invasive pollen transfer, yet low deposition on native stigmas in a Carpobrotus-invaded community. Annals of Botany 102 (3): 417–424. https://doi.org/10.1093/aob/mcn109
Bermúdez, R., Retuerto, R. 2014. Together but different: co-occurring dune plant species differ in their water-and nitrogen-use strategies. Oecologia 174:651–663. https://doi.org/10.1007/s00442-013-2820-7
Blackburn, T.M., Pyšek, P., Bacher, S., Carlton, J.T., Duncan, R.P., Jarošík, V., Wilson, J.R.U., et al. 2011. A proposed unified framework for biological invasions. Trends in Ecology & Evolution 26(7):333–9. https://doi.org/10.1016/j.tree.2011.03.023
Bloom, A.J., Chapin, F.S., Mooney, H.A. 1985. Resource limitation in plants - An economic analogy. Annual Review of Ecology and Systematics 16:363-392. https://www.jstor.org/stable/2097053
Bussotti, F., Gerosa, G., Digrado, A., Pollastrini, M. 2020. Selection of chlorophyll f luorescence parameters as indicators of photosynthetic efficiency in large scale plant ecological studies. Ecological Indicators 108, 105686. https://doi.org/10.1016/j.ecolind.2019.105686
Campoy, J.G., Retuerto, R., Roiloa, S.R. 2017. Resource-sharing strategies in ecotypes of the invasive clonal plant Carpobrotus edulis: Specialization for abundance or scarcity of resources. Journal of Plant Ecology 10(4):681-691. https://doi.org/10.1093/jpe/rtw073
Campoy, J.G., Acosta, A.T.R., Affre, L., Barreiro, R., Brundu, G., Buisson, E., González, L., et al. 2018. Monographs of invasive plants in Europe: Carpobrotus. Botany Letters 165(3-4):440-475. https://doi.org/10.1080/23818107.2018.1487884
Campoy, J.G., Roiloa, S.R., Santiso, X., Retuerto, R. 2019. Ecophysiological differentiation between two invasive species of Carpobrotus competing under different nutrient conditions. American Journal of Botany 106(11):1454-1465. https://doi.org/10.1002/ajb2.1382
Campoy J.G., Sobral, M., Carro, B., Lema, M., Barreiro, R., Retuerto, R. 2022. Epigenetic and phenotypic responses to experimental climate change of native and invasive Carpobrotus edulis. Frontiers in Plant Science. 13:888391. https://doi.org/10.3389/fpls.2022.888391
Colautti, R.I., Barrett, S.C.H. 2013. Rapid adaptation to climate facilitates range expansion of an invasive plant. Science 342: 364–366. https://doi.org/10.1126/science.1242121
Davidson, A.M., Jennions, M., Nicotra, A.B. 2011. Do invasive species show higher phenotypic plasticity than native species and, if so, is it adaptive? A meta-analysis. Ecology Letters 14(4):419-431. https://doi.org/10.1111/j.1461-0248.2011.01596.x
de la Peña, E., de Clercq, N., Bonte, D., Roiloa, S.R., Rodriguez-Echeverria, S., Freitas, H. 2010. Plant–soil feedback as a mechanism of invasión by Carpobrotus edulis. Biological Invasions 12:3637–3648. https://doi.org/10.1007/s10530-010-9756-1
Demmig‐Adams, B., Adams, W.W., Barker, D.H., Logan, B.A., Bowling, D.R., Verhoeven, A.S. 1996. Using chlorophyll fluorescence to assess the fraction of absorbed light allocated to thermal dissipation of excess excitation. Physiologia Plantarum 98(2):253-264. https://doi.org/10.1034/j.1399-3054.1996.980206.x
Earnshaw, M.J., Carver, K.A., Charlton W.A. 1987. Leaf anatomy, water relations and crassulacean acid metabolism in the chlorenchyma and colourless internal water storage tissue of Carpobrotus edulis and Senecio mandraliscae. Planta 170: 421–432. https://doi.org/10.1007/BF00395036
Ehrenfeld, J.G. 2010. Ecosystem consequences of biological invasions. Annual Review of Ecology, Evolution, and Systematics 41:59-80. http://www.jstor.org/stable/27896214
Fenollosa, E., Munné-Bosch, S., Pintó-Marijuan, M. 2017. Contrasting phenotypic plasticity in the photoprotective strategies of the invasive species Carpobrotus edulis and the coexisting native species Crithmum maritimum. Physiologia Plantarum 160(2):185–200. https://doi.org/10.1111/ppl.12542
Gleeson, S.K., Tilman, D. 1992. Plant allocation and the multiple limitation hypothesis. American Naturalist 139:1322–1343. https://www.jstor.org/stable/2462344
Grime, J.P., Mackey, J.M.L. 2002. The role of plasticity in resource capture by plants. Evolutionary Ecology 16: 299–307. https://doi.org/10.1023/A:1019640813676
Hilbert, D.W. 1990. Optimization of plant:root ratios and internal nitrogen concentration. Annals of Botany 66:91–99. https://doi.org/10.1093/oxfordjournals.aob.a088005
Keser, L.H., Dawson, W., Song, Y.B., Yu, F.H., Fischer, M., Dong, M., van Kleunen, M. 2014. Invasive clonal plant species have a greater rootforaging plasticity than non-invasive ones. Oecologia 174:1055–1064. https://doi.org/10.1007/s00442-013-2829-y
Lande, R. 2015. Evolution of phenotypic plasticity in colonizing species. Molecular Ecology 24: 2038–2045. https://doi.org/10.1111/mec.13037
Levine, J.M., Vilà, M., D’Antonio, C.M., Dukes, J.S., Grigulis, K., Lavorel, S. 2003. Mechanisms underlying the impacts of exotic plant invasions. Proceedings of the Royal Society B Biological Sciences 270:775–81. https://doi.org/10.1098/rspb.2003.2327
Maron, J.L., Vila, M., Bommarco, R., Elmendorf, S., Beardsley, P. 2004. Rapid evolution of an invasive plant. Ecological Monographs, 74:261–280. https://doi.org/10.1890/03-402
Maun, M.A. 2009. The Biology of Coastal Sand Dunes. Oxford University Press, Oxford, United Kingdom.
Maxwell, K., Johnson. G.N. 2000. Chlorophyll fluorescence—a practical guide. Journal of Experimental Botany 51: 659–668. https://doi.org/10.1093/jexbot/51.345.659
McGeoch, M.A., Butchart, S.H.M., Spear, D., Marais, E., Kleynhans, E.J., Symes, A., Chanson, J., et al. 2010. Global indicators of biological invasion: species numbers, biodiversity impact and policy responses. Diversity and Distributions 16(1):95-108. https://doi.org/10.1111/j.1472-4642.2009.00633.x
McLachlan, A., Brown, A. C. 2006. The ecology of sandy shores (2nd ed.). Academic Press.
Mollot, G., Pantel, J., Romanuk, T. 2017. The effects of invasive species on the decline in species richness: a global meta-analysis. Advances in Ecological Research 56:61-83. https://doi.org/10.1016/bs.aecr.2016.10.002
MeteoGalicia (s.f.). Histórico de la red meteorológica [Base de datos]. https://www.meteogalicia.gal/observacion/estacionshistorico/consultar.action
Murchie, E.H., Lawson, T. 2013. Chlorophyll fluorescence analysis: a guide to good practice and understanding some new applications. Journal of Experimental Botany 64(13): 3983–3998. https://doi.org/10.1093/jxb/ert208
Novoa, A., Hirsch, H., Castillo, M.L., Canavan, S., González, L., Richardson, D.M., Pyšek, P., et al. 2023. Genetic and morphological insights into the Carpobrotus hybrid complex around the world. NeoBiota 89:135-160. https://doi.org/10.3897/neobiota.89.109164
Pérez-Diz, M., Rodríguez-Addesso, B., Hussain, M.I., Rodríguez, J., Novoa, A., González, L. 2023. Carbon and nitrogen stable isotope compositions provide new Insights into the phenotypic plasticity of the invasive species Carpobrotus sp. pl. in different coastal habitats. Science of the Total Environment 873:162470. https://doi.org/10.1016/j.scitotenv.2023.162470
Pichancourt, J.B., Van Klinken, R.D. 2012. Phenotypic plasticity influences the size, shape and dynamics of the geographic distribution of an invasive plant. PLoS One 7(2):e32323. https://doi.org/10.1371/journal.pone.0032323
Portela, R., Barreiro, R., Roiloa, S.R. 2019. Biomass partitioning in response to resources availability: A comparison between native and invaded ranges in the clonal invader Carpobrotus edulis. Plant Species Biology 34(1):11-18. https://doi.org/10.1111/1442-1984.12228
Rabas, A.R., Martin, C.E. 2003. Movement of water from old to young leaves in three species of succulents. Annals of Botany 92(4): 529-536. https://doi.org/10.1093/aob/mcg171
Richards, C.L., Bossdorf, O., Muth, N.Z., Gurevitch, J., Pigliucci, M. 2006. Jack of all trades, master of some? On the role of phenotypic plasticity in plant invasions. Ecology Letters 9:981–993. https://doi.org/10.1111/j.1461-0248.2006.00950.x
Rodríguez, J., Novoa, A., Cordero-Rivera, A., Richardson, D.M., González, L. 2020. Biogeographical comparison of terrestrial invertebrates and trophic feeding guilds in the native and invasive ranges of Carpobrotus edulis. NeoBiota 56: 49-72. https://doi.org/10.3897/neobiota.56.49087
Rodríguez, J., Cordero-Rivera, A., González, L. 2021. Impacts of the invasive plant Carpobrotus edulis on herbivore communities on the Iberian Peninsula. Biological Invasions 23(5): 1425-1441. https://doi.org/10.1007/s10530-020-02449-5
Rodríguez, J., Cordero-Rivera, A., González, L. 2023. Variation in defensive traits against herbivores of native and invasive populations of Carpobrotus edulis. Biological Invasions 25(4):1149-1164. https://doi.org/10.1007/s10530-022-02970-9
Roiloa, S.R. 2019. Clonal traits and plant invasiveness: The case of Carpobrotus N.E.Br. (Aizoaceae). Perspectives in Plant Ecology, Evolution and Systematics 40:125479. https://doi.org/10.1016/j.ppees.2019.125479
Roiloa, S.R., Retuerto, R. 2016. Effects of fragmentation and seawater submergence on photochemical efficiency and growth in the clonal invader Carpobrotus edulis. Flora 225: 45-51. https://doi.org/10.1016/j.flora.2016.10.002
Roiloa, S.R., Rodríguez-Echeverría, S., de la Peña, E., Freitas, H. 2010. Physiological integration increases the survival and growth of the clonal invader Carpobrotus edulis. Biological Invasions 12:1815–1823. https://doi.org/10.1007/s10530-009-9592-3
Roiloa, S.R., Rodríguez-Echeverría, S., López-Otero, A., Retuerto, R., Freitas, H. 2014. Adaptive plasticity to heterogeneous environments increases capacity for division of labor in the clonal invader Carpobrotus edulis (Aizoaceae). American Journal of Botany 101(8):1301–1308. https://doi.org/10.3732/ajb.1400173
Roiloa, S.R., Retuerto, R., Campoy, J.G., Novoa, A., Barreiro, R. 2016. Division of labor brings greater benefits to clones of Carpobrotus edulis in the non-native range: Evidence for rapid adaptive evolution. Frontiers in Plant Science 7:349. https://doi.org/10.3389/fpls.2016.00349
Rubio-Casal, A.E., Leira-Doce, P., Figueroa, M.E., Castillo, J.M. 2010. Contrasted tolerance to low and high temperatures of three tree taxa co-occurring on coastal dune forests under Mediterranean climate. Journal of Arid Environment 74: 429–439. https://doi.org/10.1016/j.jaridenv.2009.10.004
Sax, D.F., Stachowicz, J.J., Brown, J.H., Bruno, J.F., Dawson, M.N., Gaines, S.D., Grosbeerg, R.K., et al. 2007. Ecological and evolutionary insights from species invasions. Trends in Ecology and Evolution 22:465–471. https://doi.org/10.1016/j.tree.2007.06.009
Simberloff, D., Martin, J.L., Genovesi, P., Maris, V., Wardle, D.A., Aronson, J., Courchamp, F., et al. 2013. Impacts of biological invasions: what's what and the way forward. Trends in Ecology and Evolution 28(1):58-66. https://doi.org/10.1016/j.tree.2012.07.013
Sultan, S.E. 2001. Phenotypic plasticity for fitness components in Polygonum species of contrasting ecological breadth. Ecology 82:328–343. https://doi.org/10.1890/0012-9658(2001)082[0328:PPFFCI]2.0.CO;2
Traveset, A., Moragues, E., Valladares, F. 2008. Spreading of the invasive Carpobrotus aff. acinaciformis in Mediterranean ecosystems: The advantage of performing in different light environments. Applied Vegetation Science 11(1):45-54. https://doi.org/10.1111/j.1654-109X.2008.tb00203.x
Valladares, F., Sanchez, D., Zavala, M. A. 2006. Quantitative estimation of phenotypic plasticity: Bridging the gap between the evolutionary concept and its ecological applications. Journal of Ecology 94:1103–1116. https://doi.org/10.1111/j.1365-2745.2006.01176.x
van Kleunen, M., Fischer, M. 2005. Constraints on the evolution of adaptive phenotypic plasticity in plants. New Phytologist 166:49–60. https://doi.org/10.1111/j.1469-8137.2004.01296.x
Vilà, M., Tessier, M., Suehs, C.M., Brundu, G., Carta, L., Galanidis, A., Lambdon, P., et al. 2006. Local and regional assessments of the impacts of plant invaders on vegetation structure and soil properties of Mediterranean islands. Journal of Biogeography 33(5):853-861. https://doi.org/10.1111/j.1365-2699.2005.01430.x
Wisura, W., Glen, H.F., 1993. The south african species of Carpobrotus (Mesembryanthema-Aizoaceae). Contributions from the Bolus Herbarium 15:76–107.