Introducción
Las especies invasoras, definidas como aquellas especies
alóctonas cuya introducción o propagación supone una amenaza para la diversidad
biológica (según la Convención sobre Diversidad Biológica, Decisión VI/23,
2002), son una de las principales causas de pérdida de biodiversidad y
extinción de especies en todo el mundo (Brook et al. 2008;
Bellard et al. 2016, 2017;
Dueñas et al. 2021). La investigación sobre sus
impactos ecológicos y sociales ha crecido sustancialmente en las últimas
décadas, demostrando que pueden transformar los ecosistemas profundamente (Simberloff et al. 2013; Vilà
y Hulme 2017). Por un lado, los factores abióticos del medio pueden verse
alterados, como es el caso de la composición del suelo y los ciclos
biogeoquímicos de nutrientes por parte de plantas invasoras, lo que a su vez
puede favorecer la invasión de otras especies, entrando en un bucle de
retroalimentación positiva (Weidenhamer y
Callaway 2010). Las especies invasoras también pueden transformar los
factores bióticos, causando incluso la disrupción de interacciones ecológicas
clave para el funcionamiento de los ecosistemas (Traveset y Richardson 2014).
Los impactos ecológicos de las especies invasoras no se
limitan a los ecosistemas terrestres, sino que también afectan a los
ecosistemas acuáticos y costeros. Por ejemplo, el jacinto de agua Pontederia crassipes (Mart.) Solms
altera la purificación de ríos y lagos (Villamanga
y Murphy 2010), mientras que el mejillón cebra Dreissena polymorpha Pallas modifica las redes tróficas de estos
ecosistemas acuáticos (Karatayev et al. 2014). En
los arrecifes de coral y manglares, las invasiones contribuyen a la degradación
y vulnerabilidad frente a tormentas y erosión (Biswas et
al. 2007; Hume et al. 2014). Incluso, en algunos
casos, las especies invasoras pueden intensificar los efectos del cambio
climático. Por ejemplo, plantas invasoras como las pertenecientes a los géneros
Prosopis sp. Willd. y Schinus sp. L. aumentan la
frecuencia de incendios forestales, liberando más CO2 a la atmósfera
e incrementando la vulnerabilidad de los ecosistemas (Landis
2010; Ayanu et al. 2015). Estas alteraciones no
solo afectan al funcionamiento de los ecosistemas, sino también a sectores
económicos clave como la agricultura, la pesca y el turismo, con pérdidas
estimadas en cientos de miles de millones de dólares anuales a nivel global (Pimentel et al. 2001; Henry et
al. 2023). Por último, las invasiones biológicas también tienen
repercusiones directas en la salud humana (Chinchio et
al. 2020; Najberek et al. 2022). Ejemplos como
el del mosquito Aedes aegypti L., vector de enfermedades como dengue y
zika (Iwamura et al. 2020), ilustran los riesgos asociados.
Aunque en la mayoría de los casos las especies alóctonas
suponen una amenaza, en algunas situaciones también pueden aportar beneficios
al ser humano o a los ecosistemas (Sax et al. 2022). Se
han documentado casos en los que estas especies llegan a desempeñar funciones
ecológicas similares a las de especies nativas extintas, actuando como
“sustitutas funcionales”. Por ejemplo, la marta (Martes martes L.), un
carnívoro introducido en las Islas Baleares en época romana, dispersa las
semillas del arbusto mediterráneo Cneorum tricoccon L. en la isla de
Mallorca, sustituyendo en parte a las lagartijas endémicas del género Podarcis
Wagler, localmente extintas probablemente por la introducción de
este y otros depredadores (Celedón-Neghme et al.
2013). En las últimas décadas, se han invertido grandes esfuerzos en
métodos de control y erradicación de especies invasoras (Spatz
et al. 2022). Sin embargo, estos suelen ser costosos, de larga duración y
con resultados variables, lo que supone una dificultad añadida a la gestión de
esta amenaza planetaria.
En este contexto, las islas son particularmente vulnerables
a las invasiones biológicas debido a que sus ecosistemas son aislados,
altamente especializados, a menudo, con ausencia de depredadores naturales y
sin (o baja) competencia que pueda contrarrestar los efectos de las especies
introducidas. Cabe aclarar que nos referimos con “islas” a porciones de tierra
completamente rodeadas por agua, definidas como “islas verdaderas” según Whittaker y Fernández-Palacios (2007). Estas se
clasifican en tres tipos dependiendo de su origen geológico: (i) islas
oceánicas, formadas por actividad volcánica y que nunca han estado conectadas
al continente, por ejemplo, Hawái y Canarias; (ii) islas continentales, penínsulas
que quedaron aisladas del continente por la subida del nivel del mar,
típicamente durante periodos interglaciares, por ejemplo, Sri Lanka, Bahamas y
Borneo; (iii) fragmentos continentales, porciones de corteza separadas del
continente original mediante procesos tectónicos, a menudo de gran tamaño y
antigüedad, como Nueva Zelanda, Seychelles y muchas de las islas mediterráneas,
incluidas las Baleares. Precisamente, dicho aislamiento ha promovido que
lleguen a estos ecosistemas tan sólo una proporción de la biota que habita el
continente cercano y que ha logrado superar todas las barreras para
establecerse. Como resultado, la biota insular es disarmónica, es decir, los
grupos taxonómicos presentes en las islas difieren notablemente en proporción y
diversidad de los encontrados en los continentes cercanos. Además, las especies
establecidas han evolucionado durante largos períodos en condiciones
ambientales específicas, lo que a menudo conlleva la pérdida de defensas frente
a depredadores, herbívoros, patógenos o competidores (Whittaker
y Fernández-Palacios 2007). Aunque todos los ecosistemas insulares son
frágiles, las islas oceánicas lo son especialmente debido a las altas tasas de
endemicidad, lo que incrementa el riesgo de extinción de sus especies nativas (Kier et al. 2009; Spatz et al. 2017).
De hecho, se estima que las especies invasoras han contribuido al 86 % de las
extinciones de especies endémicas documentadas en islas, tanto continentales
como oceánicas (Bellard et al. 2016, 2017). Además, dado el tamaño relativamente pequeño de
las islas, cada invasión biológica tiene un impacto relativamente grande en el
ecosistema. Una sola especie invasora puede desencadenar efectos en cascada,
alterando varias especies y funciones ecológicas. Así, por ejemplo, en las
islas Pitiusas, la culebra invasora Hemorrhois hippocrepis L. está
desplazando a la lagartija endémica Podarcis pityusensis Wagler (Hinckley et al. 2017), con potenciales efectos
negativos sobre la reproducción de C. tricoccon, planta que depende en
gran medida de esta lagartija para la dispersión de sus semillas en esas islas
(Celedón-Neghme et al. 2013). Por lo tanto,
comprender, prevenir y mitigar los impactos de las invasiones biológicas en
estos ecosistemas frágiles y únicos es una tarea de vital importancia.
En este trabajo, hacemos una revisión de los impactos
ecológicos, directos e indirectos, que tiene la introducción de especies
alóctonas – muchas de las cuales se vuelven invasoras – en islas, tanto en los
rasgos funcionales de las especies nativas como en las distintas funciones e
interacciones ecológicas (polinización, dispersión de semillas, herbivoría,
microorganismos). Presentamos ejemplos de diferentes ecosistemas insulares en
los que hemos trabajado (casos de estudio) e identificamos lagunas de
conocimiento que deberían abordarse en futuras investigaciones.
Impactos en rasgos y diversidad funcional
Los rasgos funcionales son características medibles de los
organismos que influyen directamente en sus interacciones abióticas y bióticas
(Nock et al. 2016). Estos rasgos caracterizan las
respuestas de las comunidades a los cambios ambientales (rasgos respuesta)
y determinan su impacto en procesos ecosistémicos (rasgos de efecto) (Violle et al. 2007; Díaz et al. 2013).
Incluyen aspectos morfológicos, fisiológicos, estructurales, fenológicos,
bioquímicos y de comportamiento que afectan al rendimiento de los organismos y,
por tanto, influyen en su capacidad para contribuir a funciones ecológicas como
la polinización o la dispersión de semillas (Fig. 1a; Schleuning et al.
2020; Bello et al. 2023). El tamaño del pico en
aves, de una semilla o de un huevo, la masa corporal, el periodo de actividad,
la masa foliar por área, o la tasa fotosintética potencial, son algunos
ejemplos de rasgos funcionales.
La diversidad funcional
(entendida como la variación en los rasgos de las especies que determinan su
papel dentro de la comunidad), más que la identidad taxonómica, es clave para
entender la relación entre diversidad, estructura de las comunidades y funcionamiento
de los ecosistemas (Córdova-Tapia y Zambrano
2015; Donoso et al. 2020). Esto ha impulsado
estudios basados en rasgos funcionales (Schleuning et
al. 2015; Westoby 2025), que abordan diferentes
niveles organizativos: desde el análisis de rasgos de especies individuales o
niveles tróficos, pasando por la evaluación del ajuste de rasgos entre especies
en comunidades locales (Nowak et al. 2025),
hasta marcos conceptuales que integran ecología funcional (rasgos funcionales)
con ecología de redes (complejidad trófica) (Bello et al.
2023). También se refleja en el esfuerzo por compilar nuevas bases de datos
globales de rasgos de especies publicadas en los últimos años (Fig. 1b).
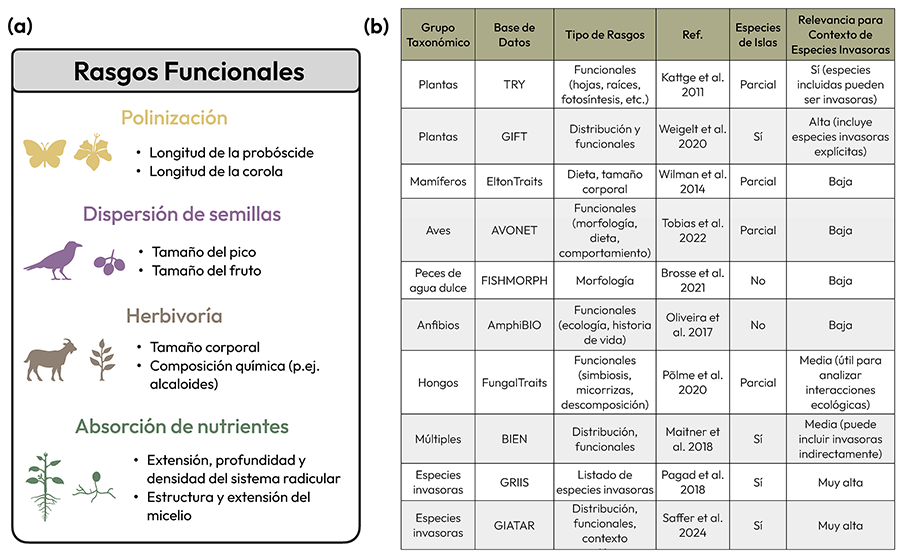
Figura 1. (a)
Ejemplos de rasgos funcionales asociados a diferentes interacciones entre
especies y funciones específicas. (b) Tabla resumen con ejemplos
de bases de datos de rasgos funcionales de especies (tanto introducidas como
nativas), organizadas por grupo taxonómico o por bases que abarcan múltiples
taxones con un enfoque exclusivo en invasoras. Se incluye breve descripción de
tipos de rasgos que abarcan cada una de ellas, referencia principal, si
contienen información específica sobre especies de islas (Sí: datos
explícitos; No: no incluidas o no es posible analizarlas con esa base; Parcial:
presentes, pero no categorizadas o diferenciadas explícitamente) y relevancia
de cada base de datos para estudios en contextos de invasiones biológicas (Muy
alta: diseñada para especies invasoras; Media; o Baja:
invasoras no especificadas).
Figure 1. (a) Examples
of functional traits associated with different species interactions and
specific ecological functions. (b) A summary table with examples of databases focused on
functional traits of species (both introduced and native), organized either by
taxonomic groups or as multi-taxa databases with an exclusive focus on invasive
species. The table includes a brief description of the types of traits covered
by each database, the main reference, whether they contain specific information
on island species (Yes: explicit data; No: not included or not
possible to analyze them with that database; Partial: present but not
explicitly categorized or differentiated) and the relevance of each database
for studies on biological invasions (Very high: specifically developed
for invasive species; Medium; or Low: invasive species not
specified).
Estas bases de datos permiten calcular la diversidad
funcional de comunidades, una medida de diversidad definida por la variación y
el promedio en los valores de rasgos entre organismos (Sobral
2023). También permiten definir el espacio funcional, un espacio
multivariado determinado por combinaciones de rasgos que describe la
variabilidad de rasgos entre comunidades ecológicas (López-Bustamante et al. 2024). Esto posibilita
calcular distintos índices para identificar nichos ecológicos y redundancias
funcionales (ver índices en Kaushik et al. 2022),
por ejemplo, al comparar comunidades con y sin especies introducidas.
La introducción de
especies modifica la composición de las comunidades locales, contribuye a la
homogeneización biótica y aumenta el riesgo de extinción de especies nativas (Bellard et al. 2016, 2017; Díaz et al. 2022). Estos efectos son especialmente alarmantes en sistemas insulares.
Revisiones globales que incluyen islas oceánicas, como Hawái, Galápagos o
Canarias, así como fragmentos continentales del Mediterráneo o Nueva Zelanda,
muestran que las especies invasoras tienen mayor probabilidad de causar
impactos negativos en la riqueza de plantas y animales nativos en islas que en
continentes, afectando la diversidad funcional (Pyšek et al. 2012). Estos impactos pueden ser más evidentes en
islas de menor tamaño, las cuales suelen albergar poblaciones de especies más
reducidas (Fernández-Palacios et al. 2021; Schrader
et al. 2024). Además, las
especies insulares presentan rasgos funcionales característicos como el
gigantismo, el enanismo, la dispersión reducida, la pérdida de defensas, la
falta de vuelo en aves e insectos, y el desarrollo de lignificación en plantas
herbáceas, entre otras (Russel y Keuffer 2019).
Aunque no hay un patrón único en los efectos de la
introducción de especies sobre la diversidad funcional de comunidades insulares
nativas, los impactos se manifiestan principalmente de dos formas: (i)
Introduciendo nuevos rasgos al ecosistema, diferentes a los de las especies
nativas, aumentando la diversidad funcional y alterando (o no) las
interacciones entre especies. Por ejemplo, las plantas invasoras en islas
suelen presentar rasgos funcionales que difieren de las especies nativas,
permitiéndoles ocupar nichos vacíos y competir eficazmente con la flora local (Mathakutha et al. 2019; Barton
y Fortunel 2023). Así, diferentes estudios han observado que la
introducción de especies ha aumentado la diversidad funcional de plantas en las
islas Canarias (Hanz et al. 2022), de peces de agua
dulce en Japón (Matsuzaki et al. 2013), la riqueza
funcional de reptiles en pequeñas islas del Caribe (Kemp 2023),
y en Azores, el aumento de riqueza de artrópodos derivado de la introducción de
nuevas especies ha contribuido a un incremento del espacio funcional ocupado
por estas comunidades (Whittaker et al. 2014). (ii)
Reduciendo la diversidad funcional al añadir rasgos similares a los promedios
de las especies nativas, o desplazando a especies nativas con rasgos únicos.
Uno de los casos más estudiados es la extinción de aves en islas debido a
especies introducidas a lo largo de la historia (Case
y Tarwater 2020; Sayol et al. 2021; Ali et al. 2023). Por ejemplo, Soares
et al. (2022) encontraron que la extinción de especies únicas en 74 islas
oceánicas del Pacífico, Índico y Atlántico ha reducido la riqueza y uniformidad
funcional de las comunidades de aves, ahora dominadas por especies más
redundantes. De manera consistente, Sayol et al. (2021)
mostraron que la introducción de especies alóctonas en nueve archipiélagos no
ha compensado las pérdidas funcionales por extinciones debidas a distintas
presiones humanas, contribuyendo a la homogeneización funcional de las
comunidades de aves en archipiélagos oceánicos. Esta disminución de la
diversidad funcional puede alterar interacciones clave como la polinización y
dispersión de semillas. En Hawái, Case y Tarwater
(2020) compararon comunidades históricas (antes de la llegada humana) y
modernas (mayoritariamente introducidas) de aves frugívoras, y observaron que
las actuales tienen menores tamaños corporales y picos más estrechos. Estos
cambios las hacen menos efectivas para dispersar semillas grandes, reduciendo
el tamaño de las semillas consumidas, las tasas de frugivoría y las distancias
de dispersión.
Todos estos hallazgos sugieren que los impactos de las
especies introducidas son contexto-dependientes y están influenciados por la
diversidad de rasgos de las especies nativas e introducidas (Kaushik et al. 2022). De hecho, un estudio global
reciente destaca que estos impactos dependen principalmente de la composición
de rasgos funcionales de las comunidades nativas (Nowak et
al. 2025). Esto subraya la importancia de considerar dicha variabilidad
para entender y predecir los impactos de las especies invasoras, así como el
potencial de los enfoques basados en rasgos para analizar sus efectos en
funciones ecosistémicas derivadas de interacciones ecológicas como las que se
exponen a continuación.
Impactos en interacciones y funciones ecológicas
Polinización
La polinización
mediada por animales es una función ecosistémica esencial para el mantenimiento
de la biodiversidad. Alrededor del 90 % de las plantas con flores dependen de
los animales para completar el primer paso de su reproducción (Ollerton et al. 2011; Díaz et al.
2013). De esta relación entre plantas con flores y polinizadores emergen
redes complejas de interacciones mutualistas que sustentan la estructura,
estabilidad y funcionamiento de las comunidades ecológicas (Bascompte 2009). En islas, las redes de polinización se
caracterizan por una baja diversidad de especies (Traveset
et al. 2016). Además, la limitada capacidad de dispersión hacia islas
oceánicas de los insectos, en especial de los no voladores, en comparación con
las plantas (Bernardello et al. 2001; Gillespie y Roderick 2002; Whittaker y Fernández-Palacios 2007), moldea
fuertemente la estructura de las redes de polinización, promoviendo asimetrías
en el número de especies interactuantes, reduciendo la competencia
interespecífica y resultando en redes altamente generalistas (Olesen y Jordano 2002; Kaiser-Bunbury
et al. 2009; Padrón et al. 2009; Traveset et al. 2013). Por otro lado, el aislamiento
geográfico de las islas durante largos períodos de tiempo ha promovido la
coevolución de las especies (Kress 1993; Guimaraes et al. 2011), contribuyendo al
fortalecimiento de interacciones específicas entre plantas y polinizadores
endémicos (Traveset y Richardson 2014).
En las últimas décadas,
las invasiones biológicas han contribuido significativamente a la alarmante
disminución de insectos polinizadores observada a nivel global (Potts et al 2010). Las islas oceánicas, en concreto, han sido
identificadas como una de las regiones geográficas con mayor riesgo de
disrupción de sus interacciones mutualistas (Bellard
et al. 2016, 2017). Las estimaciones predicen que el éxito reproductivo de las plantas
insulares que han perdido a sus socios mutualistas disminuye entre un 40 % y un
58 % (Aslan et
al. 2013). Además, la
introducción de nuevas especies de plantas y animales en los ecosistemas
insulares puede desencadenar una variedad de respuestas ecológicas en la flora
y fauna nativas y, en consecuencia, en sus relaciones (Traveset y
Richardson 2014). Las plantas
introducidas pueden competir con las plantas nativas por los polinizadores,
resultando en una reducción en las tasas de visitas y en el éxito reproductivo
de las especies de plantas nativas, con impactos negativos más fuertes a
mayores densidades de especies introducidas y características florales
similares a las nativas (Morales y Traveset 2009). Por otra parte, la introducción de especies
animales puede añadir nuevos competidores o depredadores a la comunidad, con
efectos negativos en las interacciones planta-polinizador (Aizen y Torres 2024). Aunque los polinizadores nativos suelen tener
la capacidad de cambiar a recursos alternativos, la baja diversidad vegetal de
las islas comparada con la de los continentes reduce las opciones de cambio y
hace más probable que las especies introducidas usurpen los recursos de las
nativas (Valido
et al. 2019). Por ejemplo, un
estudio reciente revela que la presencia de hormigas invasoras (Anoplolepis
gracillipes Smith y Technomyrmex albipes Smith) reduce el número de
flores visitadas por polinizadores voladores y la producción de frutos de
plantas nativas en Seychelles (Costa et al. 2023a). Las abejas (superfamilia Apoidea) se encuentran
entre los polinizadores invasores más ampliamente reconocidos, aunque sus
impactos son mayormente especulativos debido al escaso número de estudios
publicados hasta el momento, excepto para los géneros Apis y Bombus
(Ackerman 2021). Así, existen numerosos estudios sobre el efecto
de la abeja de la miel, Apis mellifera L., para la cual se han reportado
desplazamientos de polinizadores nativos por competencia en archipiélagos de
todo el mundo: Baleares (Montero-Castaño y Vilà 2017), Canarias (Valido et al. 2019) Hawái (Ing y Mogren 2020), Ogasawara (Kato et al. 1999), Nueva Caledonia (Kato y Kawakita 2004) y Mauricio (Hansen et al. 2002). Además, su introducción puede conllevar
impactos indirectos, como la cointroducción de parásitos y patógenos (p. ej., Varroa
destructor Anderson & Trueman, Nosema spp. Nägeli) y la
transmisión de enfermedades a abejas silvestres, un fenómeno conocido como
Invasiones mediadas por enfermedades (“Disease-mediated invasions”; p.
ej., Fürst et
al. 2014; Graystock et al. 2016). Los ecosistemas insulares también son
particularmente vulnerables a la introducción de depredadores, ya que las
especies nativas han evolucionado en ausencia de esta presión y no han
desarrollado mecanismos de defensa efectivos (Aizen y Torres 2024). Este es el caso de islas como Guam (Fritts y Rodda 1998), Taiwán (Huang et al. 2008) o Bahamas (Schoener y Spiller 1999), donde la introducción de reptiles insectívoros
ha causado declives en la diversidad de insectos, con efectos directos o
indirectos sobre la polinización.
No obstante, la introducción de especies también puede tener
efectos positivos en la polinización del ecosistema anfitrión (Aizen y Torres 2024). Por ejemplo, plantas invasoras
pueden facilitar la polinización de plantas nativas cuando el aumento de
visitas florales se debe a una mayor exhibición y diversidad floral colectiva,
actuando como especies “imán” (Schemske 1981; Johnson et al. 2003; Ghazoul 2006).
La fauna introducida también puede coexistir con la nativa, como es el caso de
la abeja de la miel con las abejas endémicas de las islas de Fiji y Hawái (Groutsch et al. 2019; Cortina
et al. 2019). Además, también se han observado interacciones beneficiosas
cuando las especies introducidas reemplazan funciones perdidas debido a la
extinción de las especies mutualistas nativas (Traveset
y Richardson 2014). Es el caso del pájaro ojiblanco japonés (Zosterops
japonicus Temminck & Schlegel), introducido en Hawái en 1929, que
desempeña de manera efectiva el rol de polinizador de numerosas plantas
endémicas, anteriormente desempeñado por aves nativas ahora extintas (Aslan et al. 2014).
En definitiva, los efectos de la introducción de especies en
las redes de polinización son diversos y dependen de las densidades en las que
se encuentren las especies invasoras y el estado de conservación de las
comunidades nativas. Sin embargo, la baja diversidad de especies y, por tanto,
de parejas efectivas en las islas comparado con la de los continentes, reduce
las opciones de cambio dentro de la red, y hace más probable que las especies
introducidas desplacen a las especies nativas de sus recursos.
Caso de estudio: Polinización en las Galápagos
El archipiélago de las
Galápagos se encuentra en el océano Pacífico, a aproximadamente 960 km al oeste
de la costa continental de Ecuador. Se compone de 13 islas de más de 10 km²,
además de 9 islas de 1-10 km² y más de 100 islotes, formadas por actividad
volcánica durante los últimos 4 millones de años (Fig. 2a; Poulakakis
et al. 2012); algunas de las
cuales estuvieron unidas en el pasado debido a fluctuaciones en el nivel del
mar (Ali y
Aitchison 2014). El aislamiento y
la ubicación del archipiélago con respecto a las corrientes oceánicas y los
vientos alisios han favorecido la presencia de un alto grado de endemismos. El
59 % de todos los vertebrados son endémicos (Tye et al. 2002), siendo especialmente alta esta tasa para las aves terrestres (84 %).
La flora de las Galápagos consta de unas 557 especies de plantas nativas
(180–190 endémicas) y aproximadamente 825 especies de plantas introducidas (Van Leeuwen et al. 2008; Jaramillo
et al. 2011). Sin embargo, tal diversidad endémica, rica y única, está
viéndose cada vez más amenazada por la introducción de especies. Traveset et al. (2013) evaluaron el impacto de las
especies invasoras sobre las redes de polinización de cinco islas de las
Galápagos. Sorprendentemente, el 20 % de todas las especies en la red son
invasoras (60 plantas y 220 polinizadores), participando en el 38 % de las
interacciones. La mayoría de las especies invasoras son insectos, especialmente
dípteros (36 %), himenópteros (30 %) y lepidópteros (14 %). Estos insectos
invasores tienen más interacciones que los polinizadores endémicos o los
nativos, actuando incluso como nodos centrales. Las especies invasoras se
vinculan principalmente a especies generalistas, aumentando el anidamiento y,
por lo tanto, la estabilidad de la red. Además, se han podido observar
adhesiones de las especies invasoras a los ocho módulos conectados
(determinados por restricciones geográficas y filogenéticas) de la red general,
representando alrededor del 30 % de las especies en dos de ellos (Fig. 2b). Una proporción sorprendentemente alta (38
%) de conectores (especies que mejoran la cohesión de la red) son especies
invasoras. Por otro lado, los polinizadores endémicos y nativos claves de estas
redes no demuestran una preferencia por las plantas nativas, incluyendo también
en su dieta especies de plantas introducidas (Fig. 2c;
Chamorro et al. 2012; Traveset
et al. 2015). Esto facilita la integración de plantas invasoras en la red,
incrementando el grado de generalismo de las interacciones. Estos resultados
indican que la estructura de estas comunidades emergentes podría volverse más
resistente a ciertos tipos de perturbaciones (por ejemplo, la pérdida de
especies), pero más vulnerable a otras (por ejemplo, la propagación de
enfermedades). Por tanto, se espera que estos cambios, tan notables en la
estructura de la red, tengan importantes consecuencias para el mantenimiento de
la biodiversidad nativa a medida que aumenten las invasiones.

Figura 2. (a)
Mapa de las Islas Galápagos mostrando los sitios de estudio. (b) Se
identificaron ocho módulos (en diferentes colores) en la red de interacción
entre 60 plantas y 220 polinizadores. El tamaño de los nodos (especies)
representa los diferentes roles, de periféricos (pequeños) a centrales
(grandes, círculos grises). Las plantas han sido representadas con círculos y
los animales con cuadrados. Las interacciones con al menos una especie invasora
(planta y/o polinizador) se indican en rojo, el resto de las interacciones, en
negro (nativas, endémicas o desconocidas). (c) Visitas florales por
parte de diferentes animales en Galápagos. (A) Xylocopa darwini Cockerell
polinizando Centratherum punctatum Cass.; (B) Agraulis
vanillae L. polinizando Bidens pilosa L.; (C) Geospiza
fuliginosa Gould. polinizando Opuntia galapageia Hemsley; (D)
Microlophus pacificus Steindachner en Opuntia galapageia Hemsley;
(E) Eumorpha labruscae yupanquii Kernbach polinizando Hibiscus
rosa-sinensis L.; (F) Mimus parvulus Gould en Opuntia
galapageia Hemsley; (G) Blaesoxipha sp. polinizando Croton
scouleri. Figura modificada a partir de Chamorro et
al. (2012) y Traveset et al. (2013).
Figure 2. (a) Map of the Galapagos Islands showing the study sites. (b)
Modules (in different colors) in the interaction network between 60 plants and
220 pollinators. The size of the nodes (species) represents the different
roles, from peripheral (small) to central (large, grey circles). Plants have
been represented with circles and animals with squares. Interactions with at least one invasive species (plant and/or
pollinator) are indicated in red, the rest of the interactions in black
(native, endemic or unknown). (c) Flower visits by different animals in
Galapagos. (A) Xylocopa darwini Cockerell pollinating Centratherum
punctatum Cass.; (B) Agraulis vanilla L. pollinating Bidens
pilosa L.; (C) Geospiza fuliginosa Gould. pollinating Opuntia
galapageia Hemsley; (D) Microlophus pacificus Steindachner
on Opuntia galapageia Hemsley; (E) Eumorpha labruscae
yupanquii Kernbach pollinating Hibiscus rosa-sinensis L.; (F)
Mimus parvulus Gould on Opuntia galapageia Hemsley;
(G) Blaesoxipha sp. pollinating Croton scouleri. Figure modified from Chamorro et al. (2012) and Traveset et al. (2013).
Dispersión de semillas
La dispersión de semillas es el proceso por el cual las
semillas, embriones que contienen el material genético para la próxima
generación, se transportan lejos de la planta madre. A través de este proceso,
las plantas aumentan las probabilidades de encontrar sitios adecuados para la
germinación, a la vez que reducen la competencia por recursos, tanto con la
planta madre como con plántulas conespecíficas, lo que hace más probable su
éxito de establecimiento. Por lo tanto, la dispersión de semillas es un proceso
ecológico fundamental que contribuye al flujo genético de las plantas y a la
dinámica de las poblaciones (Jordano 2000). Las
plantas han desarrollado diferentes mecanismos y estrategias para dispersar sus
semillas como, por ejemplo, estructuras morfológicas como las sámaras (alas)
que permiten la dispersión por el viento (anemocoria), o espinas y ganchos que
se adhieren a las plumas y al pelaje de los animales (ectozoocoria). En
particular, las angiospermas han desarrollado frutos carnosos que atraen a
animales frugívoros, los cuales dispersan sus semillas (endozoocoria). Este
proceso ha contribuido a la tasa de diversificación de las plantas leñosas con
flores tras su aparición (Tiffney y Mazer 1995).
Así, en algunos ecosistemas tropicales, hasta un 90 % de las angiospermas
pueden depender de frugívoros para dispersar sus semillas (Howe y Smallwood 1982). Además de proporcionar
una dispersión directa a sitios favorables para la planta, los frugívoros
pueden aumentar el éxito de germinación a través del paso de las semillas por
el sistema digestivo (Traveset et al. 2001). Las
aves, los mamíferos y los reptiles conforman los grupos de frugívoros más
comunes, siendo las aves y los reptiles particularmente importantes en los
ecosistemas de islas tropicales (Kaiser-Bunbury et
al. 2010).
La introducción de especies puede modificar la estructura y
dinámica de las interacciones entre plantas y frugívoros nativos, lo que puede
causar la disrupción de la función de dispersión de semillas (Traveset y Richardson 2014; Vizentin-Bugoni et al. 2021). Los ecosistemas
insulares son particularmente vulnerables a tales alteraciones, ya que los
organismos mutualistas de las islas han evolucionado en aislamiento y
frecuentemente han desarrollado rasgos específicos, como una dispersión
modificada o la pérdida de defensas en el caso de las plantas (Burns 2019). Algunos estudios han demostrado que los
frugívoros introducidos pueden alterar los patrones de reclutamiento de las
especies de plantas nativas, tanto de manera directa, por ejemplo, al reducir
la viabilidad o el éxito de germinación de plantas nativas tras su dispersión (Duron et al. 2017) o al dispersar exitosamente plantas
alóctonas (Mandon-Dalger et al. 2004), como de
manera indirecta, al reducir los servicios proporcionados por los dispersores
de semillas nativos (Traveset y Richardson
2014). En Hawái, por ejemplo, la mayoría de las aves frugívoras nativas han
sido reemplazadas por especies introducidas como el Ruiseñor del Japón (Leiothrix
lutea Scopoli). Estos frugívoros introducidos, además, dispersan las
semillas de plantas alóctonas en proporciones mucho mayores que las de plantas
nativas, promoviendo la expansión de las alóctonas y no logrando sustituir el papel de las aves extintas (Vinzentin-Bugoni et al. 2019, 2021). En la isla de Guam, Rogers
et al. (2017) demostraron que un depredador introducido, la culebra arbórea
marrón (Boiga irregularis Merrem), responsable de la extinción de
todas las especies nativas de aves forestales, redujo indirectamente la
dispersión, provocando un descenso del 61–92 % en el reclutamiento.
Sin embargo, la introducción de especies frugívoras podría
tener efectos positivos en la dispersión de plantas nativas a través del
reemplazo funcional de frugívoros extintos o la mejora del reclutamiento y la
supervivencia de especies vegetales. Por ejemplo, en Île aux Aigrettes
(Mauricio), la introducción de la tortuga gigante de Aldabra (Aldabrachelys
gigantea Schweigger) mejoró la regeneración del ébano endémico Diospyros
egrettarum I.Richardson, en peligro de extinción, al sustituir la función
de dispersión que llevaban a cabo las extintas tortugas gigantes del género Cylindraspis
(Griffiths et al. 2011). En cualquier caso, los
efectos negativos de las especies introducidas sobre la dispersión de semillas
nativas en las islas son más frecuentes que los efectos positivos (Cordero et al. 2023). Además, la interacción entre
especies introducidas puede tener efectos fatales a largo plazo, contribuyendo
a la emergencia de "complejos de invasión" (Invasional Meltdown),
en los que grupos de especies introducidas tienen efectos sinérgicos cada vez
más negativos en las comunidades nativas (Simberloff
y von Holle 1999).
Caso de estudio: Dispersión de semillas en
Seychelles
El archipiélago de Seychelles, en el Océano Índico, está
formado por 115 islas, 42 graníticas y 73 coralinas. Las islas graníticas se
aislaron hace aproximadamente 65 millones de años, cuando India y Seychelles se
separaron (Briggs 2003), estando consideradas entre los
fragmentos continentales más antiguos del mundo (Baker
y Miller 1963). Mahé es la isla más grande del archipiélago, representando
el 67 % (155 km²) de la superficie total de las islas graníticas y cuya flora,
al tratarse de un fragmento continental, proviene de remanentes de floras
continentales antiguas, en lugar de eventos de dispersión a larga distancia (Kueffer et al. 2010). A pesar de la larga historia de
invasiones de plantas y siglos de deforestación, aún quedan parches importantes
de vegetación nativa en Mahé, especialmente en afloramientos rocosos graníticos
que se elevan abruptamente desde las tierras bajas, denominados “inselbergs” (Fleischmann 1997; Schumacher
et al. 2009, Fig. 3a). Estos inselbergs
representan el último refugio para muchas especies de plantas endémicas
(proporción de endemismos ~ 63 %; Biedinger
y Fleischmann 2000) y sus comunidades están gravemente amenazadas por la
invasión de plantas, especialmente por la canela Cinnamomum verum J.
Presl (Kueffer et al. 2007). Costa
et al. (2022a, 2022b) estudiaron los efectos espacio-temporales de especies
alóctonas en la dispersión de semillas mediante un experimento natural a gran
escala, que consistió en ocho comunidades de plantas en inselbergs - cuatro
exclusivamente con plantas nativas (se eliminaron las alóctonas) y cuatro con
plantas nativas y alóctonas - en la isla de Mahé (Kaiser-Bunbury
et al. 2017). En Costa et al. (2022a), se
monitorizó la dirección del transporte de semillas dispersadas por aves
(llegando y saliendo de los parches de bosque nativo en inselbergs hacia la
matriz invadida circundante). Encontraron que los restos de bosque en
inselbergs son áreas importantes de alimentación para frugívoros, actuando como
fuente de propágulos nativos para los bosques invadidos circundantes y
potencialmente limitando la progresión de la invasión de plantas alóctonas. Dos
de estas especies dominantes (C. verum J. Presl y Clidemia hirta (L.)
D. Don) están muy integradas en las dietas de los frugívoros, compitiendo con
plantas nativas por los servicios de dispersión. Usando el mismo experimento, Costa et al. (2022b) estudiaron el impacto de las
invasiones de plantas en la dinámica estacional de la frugivoría (dentro y
fuera del pico de fructificación) y las redes de dispersión de semillas (Fig. 3b). Los frugívoros nativos dispersaron
semillas durante períodos más prolongados y una mayor diversidad de especies en
comparación con los alóctonos. Por lo tanto, es poco probable que los
frugívoros alóctonos reemplacen el papel de dispersión de semillas llevado a
cabo por frugívoros nativos. Además, al fructificar de forma sincronizada con
las plantas nativas, las plantas alóctonas compiten por los servicios de
dispersión, llevados a cabo predominantemente por frugívoros nativos (Fig. 3c). Durante el pico principal de
fructificación, cuando los frutos nativos son abundantes, no hay suficientes
animales para dispersar los frutos (el servicio de dispersión está saturado),
lo que probablemente intensifica la competencia entre frutos nativos y
alóctonos. Cuando los recursos son escasos, los frugívoros se vuelven más
selectivos hacia frutos alóctonos con alto valor nutricional en sitios
invadidos. Por tanto, las especies nativas que fructifican fuera de temporada
en zonas invadidas tienen menos probabilidades de dispersarse.
Caso de estudio: Dispersión de semillas en el
Caribe
Las islas oceánicas del Caribe
incluyen el archipiélago de Lucayas, las Antillas Mayores y las Antillas
Menores. La interacción entre diferentes tamaños, historias geológicas y grados
de aislamiento de las islas ha contribuido a crear una de las regiones más
biodiversas del planeta (Maunder et al. 2008; Nieto-Blázquez et al. 2017), albergando, por
ejemplo, cerca del 2.3 % de la flora global (Torres-Santana
et al. 2010). Debido a la alta proporción de endemismos y la elevada
pérdida de hábitats, la región se considera uno de los puntos calientes de
biodiversidad y una región con alta prioridad de conservación (Shi et al. 2005). Desde que llegaron los humanos hace
alrededor de 7000 años (Fitzpatrick y Keegan
2007), las islas han sufrido impactos antropogénicos, como la introducción
de nuevas especies. Esto ha llevado a la pérdida de muchas especies nativas,
como diversos papagayos endémicos (Gala y Lenoble
2015), y se estima que un 37.5 % de las extinciones de mamíferos
registradas globalmente en los últimos 500 años han tenido lugar en las islas
del Caribe (MacPhee y Fleming 1999). Aunque
existen estudios sobre la dispersión de semillas en la región (p. ej. Carlo y Morales 2016), los efectos de las especies
introducidas en estos sistemas y cómo estas especies se integran en las redes
de dispersión de semillas nativas siguen siendo campos poco estudiados. Vollstädt et al. (2022) llevaron a cabo una revisión
de la literatura disponible sobre interacciones planta-frugívoro en el Caribe
revelando que la red estaba compuesta por, al menos, 486 especies de plantas y
178 de frugívoros, de las cuales el 16 % de las plantas y el 8 % de los
frugívoros son introducidos. Al analizar en más detalle las interacciones de
las especies introducidas, se descubrió que los frugívoros introducidos
interactuaron significativamente más con plantas introducidas de lo esperado al
azar, indicando una preferencia de las especies introducidas para interactuar entre sí. Además,
en un experimento con frutos artificiales llevado a cabo en la región, se
observó que los frugívoros nativos redujeron significativamente su actividad
cuando los frugívoros introducidos interactuaron con los frutos artificiales (Kim et al., datos
sin publicar). Por último, de manera más general, se demostró que, para muchas
de las islas del Caribe, particularmente las Antillas menores, hay muy pocos
datos empíricos que permitan estimar el impacto de la flora y la fauna
introducidas sobre la función de dispersión de semillas de plantas nativas (Vollstädt et al. 2022).
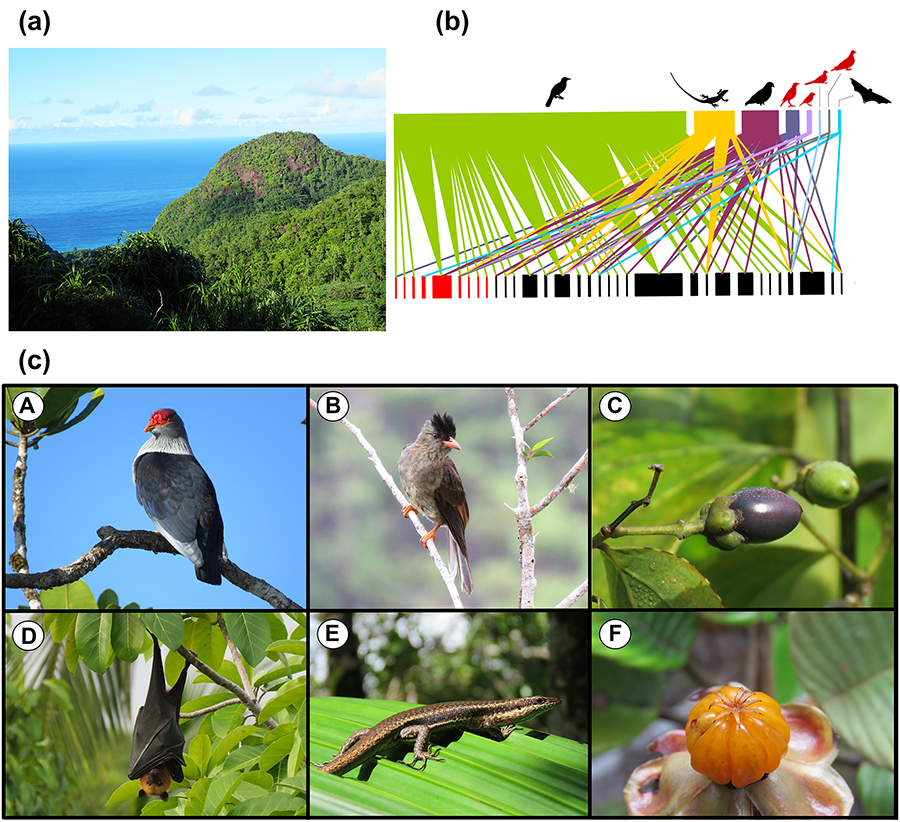
Figura 3. (a)
Inselberg en la isla de Mahé, Seychelles. (b) Red de interacciones entre
especies de frugívoros (barra superior, en diferentes colores, siluetas de
animales introducidos en rojo) y plantas (barra inferior, introducidas en rojo)
durante todo el periodo de fructificación en Mahé. Obtenido de Costa et al.
2022b. (c) Ejemplos de animales dispersores y frutos en inselbergs de
Mahé: (A) Alectroenas pulcherrimus Scopoli; (B) Hypsipetes
crassirostris Newton; (C) Cinnamomum verum J. Presl; (D)
Pteropus seychellensis Kerr; (E) Trachylepis seychellensis Duméril
& Bibron; (F) Dillenia ferruginea (Baill.) Gilg. Todas las
especies son endémicas excepto C. verum, que es invasora. Fotos: Alba Costa.
Figure 3. (a)
Inselberg on Mahé Island, Seychelles. (b) Interaction network between frugivore species (top bar, in
different colours, symbols of non-native in red) and plants (bottom bar,
non-natives in red) throughout the fruiting period on Mahé. Extracted from
Costa et al. 2022b. (c)
Examples of seed dispersers and fruits on inselbergs of Mahé: (A) Alectroenas pulcherrimus Scopoli;
(B) Hypsipetes
crassirostris Newton; (C) Cinnamomum verum J. Presl; (D) Pteropus seychellensis Kerr; (E) Trachylepis seychellensis Duméril & Bibron; (F) Dillenia ferruginea (Baill.)
Gilg. All species are endemic except C. verum, which is invasive. Photos:
Alba Costa.
Herbivoría
La herbivoría, definida como el consumo de partes
vegetativas o reproductivas de una planta por un animal (Crawley
1983), es una interacción ecológica tradicionalmente clasificada como
antagónica por los numerosos efectos negativos que han sido descritos sobre las
comunidades vegetales. En particular, se han documentado impactos severos sobre
el crecimiento, la supervivencia, la reproducción, el reclutamiento y la
dinámica poblacional de las plantas (Haas y Lortie
2020; Leal et al. 2022). Además, los herbívoros
pueden causar la disrupción de interacciones ecológicas (Barber
et al. 2012), siendo la polinización una de las más estudiadas en las
últimas décadas (Moreira et al. 2019; Haas y Lortie 2020 y referencias ahí citadas; Muñoz-Gallego et al. 2022). Por el contrario, hay
muy pocos estudios que exploren los impactos de la herbivoría sobre otras
interacciones como la dispersión de semillas (Whitehead
y Poveda 2011; Muñoz-Gallego et al. 2025).
Estas disrupciones ecológicas pueden dar lugar a efectos en cascada sobre el
funcionamiento de los ecosistemas. Por ejemplo, Vitali et
al. (2023) reportaron que el consumo de hojas de Aristotelia chilensis (Molina)
Stuntz, el principal hospedador del muérdago Tristerix corymbosus
(L.) Kuijt en la Patagonia, por ungulados introducidos afectó
negativamente a las poblaciones de dos especies clave, el colibrí Sephanoides
sephaniodes Lesson y el marsupial Dromiciops gliroides Thomas,
polinizador y dispersor de semillas del muérdago, respectivamente, pero también
de muchas otras plantas de la comunidad. La disrupción de estas interacciones
clave generó efectos en cascada en toda la comunidad, afectando a la
conectividad y estabilidad de las redes de interacción mutualistas. Sin
embargo, las plantas también pueden responder a la herbivoría con mecanismos
positivos para la reproducción (es decir, sobrecompensación; Paige y Whitham 1987), aumentando la producción
de semillas/frutos o la atracción de polinizadores (Aguirrebengoa
et al. 2021; Cozzolino et al. 2015; Muñoz-Gallego et al. 2022). Por último, los
grandes herbívoros son cruciales como dispersores de semillas en muchos
ecosistemas (Jaroszewicz et al. 2013; Sridhara et al. 2016).
En los ecosistemas insulares, los herbívoros introducidos
son una de las principales causas de extinciones de especies, ya que muchas
plantas han evolucionado en ausencia de dicha presión (Cubas
et al. 2019). Entre todos los herbívoros alóctonos, los mamíferos destacan
por sus impactos devastadores, extensamente documentados (Courchamp et al. 2003; Clout
y Russell 2007). Especies como la cabra (Capra hircus L.), el conejo
(Oryctolagus cuniculus L.) y roedores (Rattus spp. L. y Mus
musculus L.) están clasificadas entre las 100 especies invasoras más
destructivas a nivel mundial (Lowe et al. 2000). En
particular, la introducción histórica de cabras domésticas en islas para
abastecer nuevos asentamientos humanos ha afectado drásticamente la flora
nativa y la estructura de los ecosistemas, llegando a extinguir muchas especies
de plantas endémicas (Gizicki et al. 2018; Abe 2021; Menezes de
Sequeira et al. 2021). En consecuencia, iniciativas de erradicación han
demostrado que es posible recuperar parte de la biodiversidad perdida, como se
ha observado en algunas islas mediterráneas (p.ej. Capó et
al. 2022). Por otra parte, más del 80 % de las islas de todo el mundo
presenta roedores introducidos (Harris 2009). Sus
efectos incluyen la depredación de aves, insectos y semillas, y el consumo de
plantas, limitando la regeneración de las comunidades vegetales y alterando
interacciones clave como la polinización y la dispersión de semillas (Traveset et al. 2009). Para los conejos se han
descrito impactos similares (Cubas et al. 2019; Kossoff et al. 2024). No obstante, en ciertos casos,
los herbívoros introducidos pueden desempeñar un rol positivo en el ecosistema;
por ejemplo, en Chile, las cabras introducidas actúan como el único dispersor
legítimo del cactus endémico Eulychnia acida Phil., cuyos frutos están
adaptados a grandes herbívoros ahora extintos (Cares et
al. 2018). Si bien los ecosistemas insulares también pueden verse afectados
por la introducción de insectos herbívoros (Russell et
al. 2017), sus impactos ecológicos siguen siendo desconocidos en la mayoría
de los casos. En las Islas Galápagos, por ejemplo, se han introducido más de
460 especies de insectos, de los cuales aproximadamente el 40 % son herbívoros,
representando una amenaza potencial para la flora nativa de la isla (Causton et al. 2006).
Más allá del papel de los
herbívoros como especies invasoras, hay muy pocos estudios que describan los
impactos de las invasiones biológicas sobre las interacciones planta-herbívoro
(Harvey y
Fortuna 2012; McCary et al. 2016), y la mayoría de ellos están asociados al
proceso de invasibilidad de plantas alóctonas (p. ej., Rodríguez et al. 2019, 2021;
Santos
de Araújo et al. 2024). En este
sentido, la herbivoría puede actuar como un filtro ecológico en el proceso de
invasión (Sullivan
y Shaw 2023). Un trabajo de
revisión del impacto de los herbívoros nativos sobre plantas alóctonas mostró
una reducción de hasta un tercio en la producción y viabilidad de semillas,
reclutamiento, supervivencia y crecimiento de plántulas, y de casi la mitad en
el tamaño y el crecimiento de las plantas adultas (Maron y Vilà 2001). Esto puede deberse a que las plantas alóctonas
carezcan de defensas efectivas frente a los herbívoros nativos, viéndose más
afectadas que las plantas nativas (Hipótesis de la Nueva Asociación,”New
Association Hypothesis”; Parker y Hay 2005). Sin embargo, los herbívoros también pueden
promover y facilitar las invasiones. Así, pueden establecer relaciones
mutualistas con plantas alóctonas, por ejemplo, dispersando sus semillas a
largas distancias (Maron y Vilà 2001).
Además, herbívoros alóctonos pueden asociarse con plantas alóctonas,
promoviendo una retroalimentación positiva (Complejos de Invasión, “Invasional
Meltdown”), como es el caso de las suculentas invasoras Carpobrotus
edulis (L.) N.E.Br. y C. aff. acinaciformis (L.) L.Bolus,
dispersadas por ratas y conejos introducidos en islas del sureste de Francia (Bourgeois et al. 2005). Por otro lado, los herbívoros también pueden
facilitar la invasión de plantas alóctonas si muestran preferencia por las
nativas (Hipótesis de la Liberación del Enemigo, “Enemy Release Hypothesis”; Keane y Crawley 2002). Por ejemplo, las plantas endémicas de la isla
de Tenerife son mucho más consumidas por conejo (introducido) que las plantas
alóctonas (Cubas
et al. 2019). Finalmente, los
herbívoros también pueden facilitar indirectamente el establecimiento de
plantas introducidas mediante la alteración de las interacciones de competencia
de la comunidad y las condiciones abióticas del medio (Maron y Vilà 2001).
Caso de estudio: Herbivoría en las Baleares
El archipiélago de las Islas Baleares, situado en el mar
Mediterráneo, a 88 km de la península ibérica, comprende dos grupos de islas
continentales: las Pitiusas, formadas por Ibiza, Formentera y unos 60 islotes,
y las Gimnésicas, formadas por Mallorca, Menorca, Cabrera y alrededor de 30
islotes. Mallorca es la isla más grande del archipiélago, con una superficie
aproximada de 3640 km2 y una flora típicamente mediterránea, con
unas 2000 especies, de las cuales más de 100 son introducidas (Govern de les Illes Balears 2025). La mayoría de los
herbívoros vertebrados presentes actualmente en la isla fueron introducidos
históricamente, hace milenios (Bover y Alcover 2008).
Es el caso de animales domésticos como las cabras y las ovejas, el conejo, así
como de diferentes especies de roedores. Sin embargo, se han descrito
introducciones más recientes como la del coatí Nasua nasua L. (Mayol et al. 2009), el gamo Dama dama L. (Pinya y Lassnig 2018) o el mapache Procyon lotor
L. (Lassnig et al. 2020). Entre los herbívoros
invertebrados, destacan la procesionaria del pino Thaumetopoea pityocampa Denis
& Schiffermüller, el picudo rojo Rhyncophorus ferrugineus Olivier,
la polilla barrenadora del palmito Paysandisia archon Burmeister y
la polilla peluda de la encina Lymantria dispar L., entre otros (Govern de les Illes Balears 2025). Sin embargo,
son muy pocos los estudios que hayan evaluado el impacto de estas especies
introducidas sobre la flora nativa de la isla (p. ej., Cursach
et al. 2013; Capó et al. 2021). Muñoz-Gallego (2023) evaluó
recientemente, mediante estudios observacionales y aproximaciones espacialmente
explícitas, el impacto combinado de la polilla invasora P. archon y la
cabra asilvestrada C. hircus sobre la reproducción y las interacciones
planta-animal del palmito mediterráneo Chamaerops humilis L. (Fig. 4a).
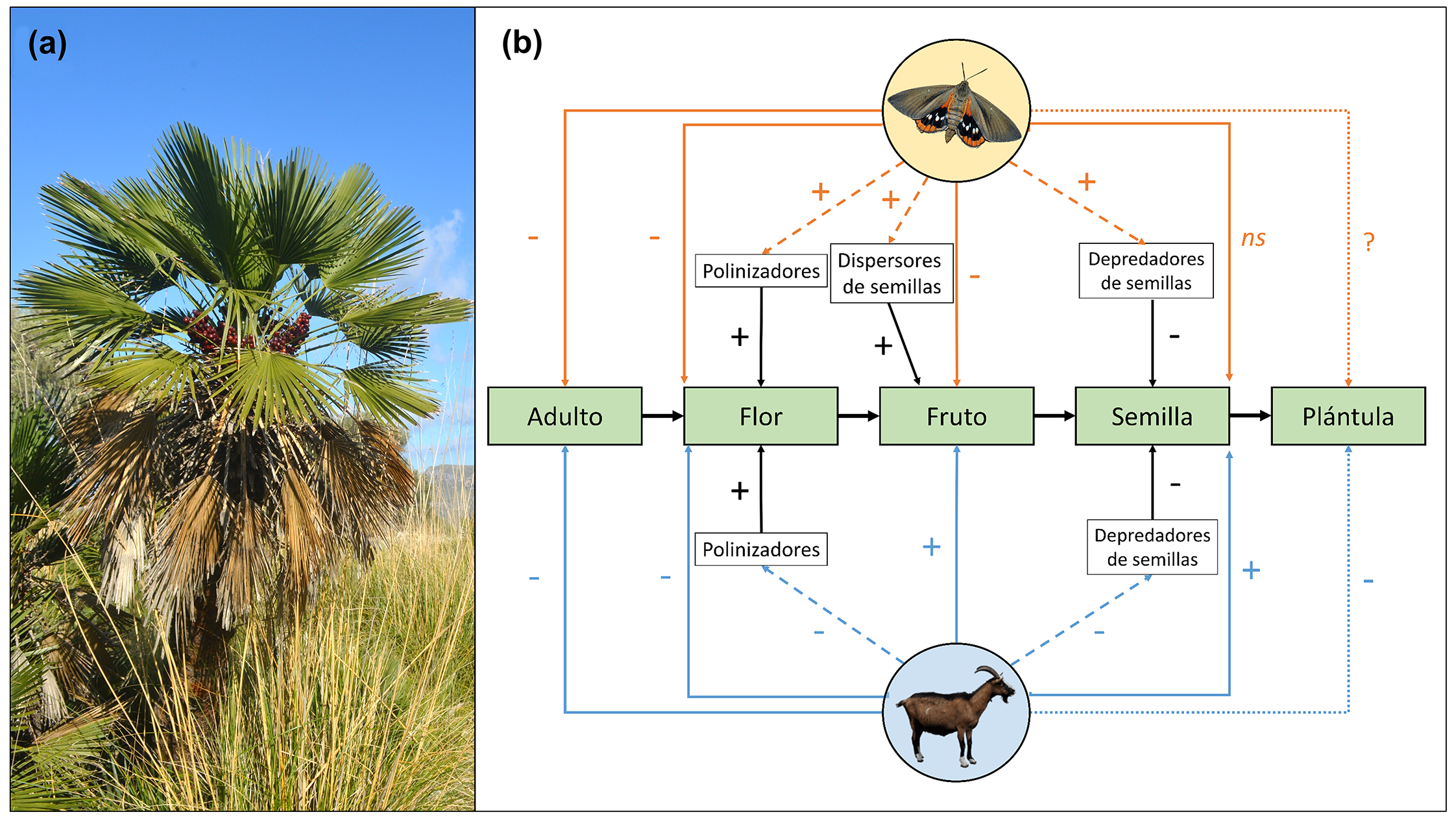
Figura 4. (a)
Individuo de palmito mediterráneo Chamaerops humilis L. (b)
Representación esquemática de los efectos directos e indirectos observados y
esperados de los dos herbívoros invasores alóctonos, Paysandisia archon Burmeister
(naranja) y Capra hircus L. (azul), en las etapas del ciclo de vida
(adulto, flor, fruto, semilla, plántula) del palmito C. humilis L.
(verde). Las líneas negras representan los efectos directos de otros animales
interactuantes (mutualistas y antagonistas) en la reproducción de la palmera.
Las líneas continuas indican efectos directos, las líneas discontinuas
representan efectos en otros animales interactuantes que conducen a efectos
indirectos en la reproducción de la palmera, y las
líneas punteadas indican efectos no evaluados en este proyecto, pero
probablemente presentes. Nótese que los efectos indirectos solo se muestran
cuando fueron estadísticamente significativos. El signo del efecto se indica
junto a las flechas (+, positivo; -, negativo; ns, no significativo; ?,
desconocido). Obtenido de R. Muñoz-Gallego (2023).
Figure 4. (a) An
individual of the Mediterranean dwarf palm Chamaerops humilis L. (b) Schematic representation of observed
and expected direct and indirect effects of the two invasive non-native
herbivores, Paysandisia archon (orange) and Capra hircus L.
(blue), on the life cycle stages (adult, flower, fruit, seed, seedling) of the
dwarf palm C. humilis (green). Black lines represent direct effects of
other interacting animals (both mutualists and antagonists) on the dwarf palm
reproduction. Solid lines indicate direct effects, dashed lines represent
effects on other interacting animals which lead to indirect effects on palm
reproduction, and dotted lines indicate effects not evaluated in this thesis
but probably present. Note that indirect effects are only shown when they were
statistically significant. The sign of the effect is indicated next to the
arrows (+, positive; -, negative; ns, non-significant; ?, unknown). Extracted
from R. Muñoz-Gallego (2023).
La polilla, originaria de Sudamérica, fue detectada en la
isla en 2003 (Sarto i Monteys y Aguilar 2005),
mientras que las poblaciones de cabra asilvestrada comenzaron a expandirse en
los años 60 tras el abandono de la agricultura, alcanzando en la actualidad más
de 20 000 individuos (Vives y Baraza 2010).
En un primer estudio, Muñoz-Gallego et al. (2019)
demostraron que las cabras dispersan eficientemente las semillas de palmito,
posiblemente reemplazando el papel de dispersores extintos. Sin embargo,
esta interacción mutualista puede tornarse antagonista dependiendo de la
densidad de cabras (Muñoz-Gallego et al. 2023a).
En poblaciones sin cabras, la agregación espacial de las semillas dispersadas y
la tasa de depredación de semillas por insectos fueron altas, mientras que la
tasa de germinación fue muy baja, debido a una limitación en el servicio de
dispersión. Por el contrario, una densidad de cabras muy elevada anuló por
completo el reclutamiento del palmito, debido a la intensa florivoría (es
decir, consumo de flores/inflorescencias) ejercida en la época de floración (Muñoz-Gallego et al. 2023b). Además, se
reportaron efectos directos e indirectos de ambos herbívoros sobre las
interacciones de polinización y frugivoría. Las palmeras atacadas por la
polilla mostraron mayores tasas de polinización, mientras que las atacadas por
cabra mostraron el patrón contrario. Además, ambos herbívoros tuvieron efectos
no-aditivos negativos sobre el desarrollo de los frutos (Muñoz-Gallego et al. 2022). Finalmente, las tasas
de depredación de semillas por insectos, pero también las de visitas por
frugívoros, fueron mayores en las palmeras atacadas por la polilla, sugiriendo
efectos indirectos de la herbivoría mediados por rasgos del fruto (Muñoz-Gallego et al. 2025). Por lo tanto,
ambos herbívoros invasores ejercieron múltiples y variados efectos, directos e
indirectos, positivos y negativos, dependiendo de la etapa del ciclo vital de
la planta y de la densidad de las especies interactuantes (Fig.
4b). Estos hallazgos destacan la importancia de evaluar el impacto
combinado de diferentes especies invasoras sobre las comunidades vegetales y
los ecosistemas en toda su complejidad.
Interacciones con microorganismos
Entre los numerosos organismos invasores, los
microorganismos como bacterias, hongos, virus y protistas desempeñan un papel
significativo en la transformación de los ecosistemas (Thakur
et al. 2019). Además de actuar como patógenos, estos microorganismos son
mediadores clave en las interacciones ecológicas, influyendo significativamente
en las comunidades vegetales, los procesos del suelo y la dinámica de los
ecosistemas, creando condiciones que favorecen a las especies invasoras (Van Der Putten et al. 2007). Caracterizados por su
rápido crecimiento, adaptabilidad y competitividad, estos microorganismos se
convierten en importantes agentes de cambio en los ecosistemas (Litchman 2010). A pesar de su importancia, los
microorganismos invasores han recibido menos atención que las plantas o los
animales debido a su naturaleza microscópica y los desafíos que plantea su
detección.
La introducción de microorganismos en las islas se ha visto
facilitada en las últimas décadas por la globalización y el creciente comercio
intercontinental, incluyendo el transporte de suelo, material vegetal y
materiales de construcción (Jairus et al. 2011; Hulme 2021). Además, el movimiento deliberado de insectos
con fines agrícolas o alimentarios puede actuar como vector adicional de
organismos asociados (patógenos, parásitos o microorganismos simbióticos),
contribuyendo también a la invasión biológica en estos ecosistemas (Rodríguez et al. 2024). Los patógenos invasores que
afectan a las especies vegetales, tanto agrícolas como silvestres, han sido
objeto de un estudio más profundo debido a su significativo impacto ecológico y
económico (Thakur et al. 2019). Entre estos, el
oomiceto Phytophthora cinnamomi Rands ha causado daños severos en
huertos de aguacate en las islas Canarias (Rodríguez-Padrón
et al. 2018) y ha amenazado especies nativas como Banksia spp. en
Australia, afectando indirectamente a las poblaciones de aves que dependen de
estos hábitats (Hart et al. 2024). Otro caso relevante
es la bacteria Xylella fastidiosa Wells et al., una amenaza global para
cultivos como viñedos, almendros y olivos. Detectada en las islas Baleares,
esta región alberga una notable diversidad genética del patógeno, lo que ha
llevado a medidas preventivas y a un monitoreo continuo para mitigar su
propagación (Quetglas et al. 2022). Aparte de su
impacto en la flora, algunos patógenos han afectado gravemente a la fauna
insular, como el hongo quítrido Batrachochytrium dendrobatidis Longcore,
Pessier & D.K. Nichols, responsable de drásticas disminuciones en las
poblaciones de anfibios en regiones como Hawái y Madagascar. Este patógeno ha
estado estrechamente asociado con especies invasoras como las ranas Eleutherodactylus
coqui Thomas, que actúan como reservorios y facilitan su propagación (Beard y O’Neill 2005; Bletz et
al. 2015).
Más allá de los impactos directos de los patógenos, otros
microorganismos desempeñan un papel crucial en los procesos de invasión al
interactuar de diversas formas con las plantas alóctonas (Callaway y Lucero 2020). Por ejemplo, la gramínea
invasora Bromus tectorum L., presente en islas como Islandia y Japón,
incrementa su competitividad al aumentar la abundancia de patógenos de semillas
perjudiciales para las especies nativas (Beckstead et
al. 2010; GISD 2016). A su vez, algunas especies
logran escapar de las interacciones antagónicas en su área de origen y
aprovechar las condiciones del suelo invadido (Keane
y Crawley 2002). Muchas plantas invasoras también llegan acompañadas de
mutualistas obligados, como hongos micorrícicos o bacterias fijadoras de
nitrógeno, lo que facilita su establecimiento en nuevos entornos, ayudándolas a
superar la resistencia biótica de las comunidades nativas y alterando las
dinámicas de los ecosistemas, especialmente en ambientes insulares (Rodríguez-Echeverría 2009; Dickie et al. 2010; Delavaux et
al. 2021). En las Islas Galápagos, por ejemplo, Psidium guajava L.,
una planta invasora, se beneficia tanto de hongos micorrícicos locales como
introducidos para colonizar suelos pobres, desplazando así a las especies
nativas (Duchicela et al. 2020). Las invasiones de
pinos, facilitadas por hongos ectomicorrícicos como Suillus spp. y Rhizopogon
spp. introducidos en plántulas y suelos comerciales, representan un caso
destacado de coinvasión (Policelli et al. 2019).
En regiones como Nueva Zelanda y Hawái, estas coinvasiones han eliminado
barreras clave para su establecimiento, provocando cambios significativos en la
biodiversidad y los ciclos de nutrientes (Hayward et al.
2015; Sapsford et al. 2022). Animales introducidos, como jabalíes y ciervos
en Isla Victoria, Argentina, pueden dispersar hongos micorrícicos y facilitar
el establecimiento de pinos introducidos (Nuñez et al. 2013). Algunas aves también dispersan esporas
micorrícicas (Correia et al. 2019; Caiafa et al. 2021), lo que
podría constituir un mecanismo adicional en la expansión de especies alóctonas. Estos hongos
ectomicorrícicos invasores pueden tener impactos inesperados. Por ejemplo, Amanita
phalloides (M. Bieb.) Cavara & Grande, un hongo tóxico para los
humanos, se ha establecido en asociación con árboles introducidos en Nueva
Zelanda y Australia, planteando serios desafíos para la salud pública y la
gestión ambiental (Pringle y Vellinga 2006; Dickie et al. 2016). Por otra parte, las bacterias fijadoras de nitrógeno,
como Rhizobium spp. y Frankia spp., establecen simbiosis con
leguminosas y plantas actinorrícicas, algunas de ellas invasoras como especies
de los géneros Acacia y Cytisus, enriqueciendo el suelo y
aumentando su productividad (Rodríguez-Echeverría
2010; Traveset y Richardson 2014). En
Hawái, Myrica faya (Aiton) Wilbur incrementa el nitrógeno en suelos
pobres a través de Frankia spp., beneficiando a otras invasoras frente a
las nativas (Vitousek y Walker 1989; Huguet et al. 2005).
Por otro lado, las interacciones planta-microorganismo
propias de un ecosistema también pueden verse alteradas por especies
introducidas mediante tres mecanismos principales: la competencia entre plantas
nativas e invasoras, los cambios en las propiedades del suelo y la alelopatía (Lorenzo y González 2010; Grove
et al. 2017). Muchas plantas invasoras producen compuestos alelopáticos,
como Alliaria petiolata (M. Bieb.) Cavara & Grande, introducida en
varias islas, los cuales interfieren con las asociaciones micorrícicas de
plantas nativas, mientras que las especies invasoras no micorrícicas permanecen
inalteradas (GISD 2016; Kalisz et
al. 2021; Roche et al. 2023).
Las invasiones biológicas pueden trascender la disrupción de
las interacciones planta-microorganismo, alterando procesos ecológicos
fundamentales (Traveset 2015). En Nueva Zelanda, los
ungulados invasores modifican las comunidades de hongos micorrízicos
arbusculares, afectando negativamente a la vegetación nativa (Kardol et al. 2014). Las plantas invasoras que
establecen mutualismos con microorganismos nativos del suelo, como micorrizas y
simbiosis rizobianas, mejoran su éxito invasor al optimizar la adquisición de
recursos y las interacciones con polinizadores y dispersores (Rodríguez-Echeverría y Traveset 2015).
Las micorrizas arbusculares juegan un papel clave en las defensas contra
herbívoros, con efectos variables según las especies y condiciones ambientales
(Pineda et al. 2010; Bennett
2013). Sin embargo, estas interacciones entre plantas, microorganismos e
insectos requieren mayor investigación (Bennett 2013).
Comprender estas relaciones es crucial para mitigar los impactos de las
invasiones y fortalecer la resiliencia de los ecosistemas insulares (Traveset 2015; Russell et al.
2017).
Impactos indirectos
Los impactos de las invasiones biológicas pueden ocurrir a
través de mecanismos directos (por ejemplo, depredación; Doherty
et al. 2016) o indirectos (por ejemplo, cascadas tróficas; Benkwitt et al. 2021). Los efectos indirectos ocurren
cuando una especie alóctona altera las interacciones entre una especie nativa y
otra especie, independientemente de su origen (Strauss
1991). Estos efectos son difíciles de predecir, detectar y cuantificar
debido a su elevada complejidad, lo que ha llevado a que se reconozcan menos
que los efectos directos (Strauss 1991; Wootton 1994; Simberloff
y Von Holle 1999). A pesar de esto, se cree que son más comunes de lo que
se piensa (White et al. 2006; Kuebbing
2020). Además, estos efectos se vuelven más relevantes en un contexto en el
que quedan cada vez menos islas sin haber sido invadidas por múltiples especies
alóctonas. En el pasado, los impactos de las especies invasoras en los
ecosistemas receptores se analizaban de manera individual (p. ej. Fritts y Rodda 1998). Sin embargo, se ha
demostrado que las especies introducidas interactúan entre sí de manera cada
vez más compleja (Levine et al. 2017), lo que genera
efectos a menudo imprevistos y sorprendentes (Caut et al.
2009). En última instancia, los resultados ecológicos de estas
interacciones dependen de la posición trófica de las especies y de la
naturaleza de la limitación trófica en el sistema, lo que influye profundamente
en la dinámica del ecosistema invadido (Russell
y Kaiser-Bunbury 2019). Así, las especies introducidas pueden generar cinco
tipos de efectos indirectos en una tercera especie: dos tipos de competencia
que puede ser explotativa interespecífica o aparente, la cascada trófica, y la
depredación intragremio que puede ser simétrica o asimétrica (Polis et al. 1989; Wootton 1994;
Russell y Kaiser-Bunbury 2019).
La competencia explotativa interespecífica ocurre cuando
varias especies compiten por un recurso común, reduciendo su disponibilidad,
como ocurre con los depredadores introducidos que afectan a las aves marinas en
islas (Russell 2011). A menudo, las interacciones
competitivas no se reconocen como efectos indirectos (Strauss
1991; Wootton 2002), siendo pocos los estudios que
cuantifican el impacto de especies alóctonas sobre las nativas. Si una especie
alóctona es más eficiente que una nativa en utilizar un recurso biótico, la
especie nativa puede sufrir un impacto negativo indirecto por la reducción de
dicho recurso. Además, este tipo de efecto ha sido menos estudiado en otros
grupos funcionales, como los herbívoros o los polinizadores.
La competencia aparente ocurre cuando un consumidor (como un
depredador o herbívoro) aumenta en número o eficiencia al consumir un recurso
debido a la presencia de otra especie (Holt y Bonsall
2017). Este cambio en la abundancia de un recurso puede alterar el
comportamiento del consumidor, generando la impresión de que los recursos
compiten entre sí. Este efecto ha sido destacado en redes de polinización, como
en las islas Cícladas (Grecia), donde la competencia entre abejas silvestres y
melíferas aumentó con la abundancia de estas últimas, afectando la estructura
de la red y la abundancia de las abejas nativas (Lázaro
et al. 2021). Sin embargo, la competencia aparente es más difícil de
predecir en redes complejas. En la isla Reunión, por ejemplo, un parasitoide
fue introducido en 2003 para controlar a la mosca de la fruta Bactrocera
zonata Saunders y, desde la invasión de Bactrocera dorsalis Hendel
en 2017, ambas moscas comparten tanto el mismo nicho como el mismo enemigo
natural. Tras la invasión, la tasa de parasitismo aumentó significativamente y
la población de B. zonata disminuyó, sugiriendo un caso de competencia
aparente (Moquet et al. 2023). No obstante, se
necesitan más estudios para confirmar estos efectos indirectos en la red
trófica.
Las cascadas tróficas describen cómo la introducción de un
nuevo consumidor puede afectar indirectamente a otras especies, a menudo a
través de una cadena de interacciones ecológicas (Strong
1992). En algunos casos, estas cascadas pueden originarse a partir de
mecanismos como la competencia aparente. No obstante, aunque ambos procesos
pueden solaparse o estar interconectados, es útil analizarlos por separado para
comprender mejor los distintos caminos por los que una especie introducida
puede modificar una red ecológica (Holt et al. 1994; Wootton 2002). En las cascadas "de arriba hacia
abajo" (top-down), la eliminación o reducción de los depredadores
principales permite el aumento de las poblaciones de los niveles inferiores,
como los herbívoros. En las cascadas "de abajo hacia arriba" (bottom-up),
los cambios en los recursos disponibles afectan a los niveles superiores, como
los depredadores. Estas cascadas han sido bien documentadas en sistemas
acuáticos (White et al. 2006) y en ecosistemas
terrestres desde la década de 1990 (Ripple et al. 2016).
Un ejemplo clásico, ya descrito con anterioridad, es la introducción de la
serpiente arbórea parda (B. irregularis) en Guam, que causó una cascada
de extinciones (Fritts y Rodda 1998). Otro caso
interesante es el de las aves marinas: aunque no generan cascadas tróficas
directas, su presencia en ecosistemas terrestres influye en la productividad
primaria y secundaria al enriquecer el suelo con nutrientes procedentes de sus
excrementos. Sin embargo, cuando estas aves son depredadas por fauna terrestre
introducida, la alteración del flujo de nutrientes puede desencadenar cascadas
tróficas. Esto ha sido documentado en las Islas Aleutianas, donde la
depredación de aves marinas por ratas introducidas redujo los aportes de guano,
afectando los flujos de nutrientes hacia los ecosistemas costeros y
disminuyendo indirectamente la cobertura de algas al incrementar la abundancia
de herbívoros marinos invertebrados (Kurle et al. 2008).
La depredación intragremio ocurre cuando dos depredadores no
solo compiten por una presa común, sino que, además, uno de ellos puede
alimentarse del otro, combinando elementos de competencia y depredación (Polis et al. 1989). Esta doble dimensión hace que sus
consecuencias ecológicas puedan ser más intensas o impredecibles que en la
competencia convencional. Si ambos se alimentan mutuamente, se habla de
depredación intragremio simétrica; si solo uno se alimenta del otro, se trata
de depredación asimétrica. En islas, la depredación intragremio simétrica es
rara, especialmente entre especies nativas e introducidas, y suele tener
efectos negativos sobre las poblaciones nativas (Gerber
y Echternacht 2000; Huang et al. 2023). En cambio,
la depredación intragremio asimétrica es más común, sobre todo en ecosistemas
insulares con depredadores introducidos, donde uno es el depredador principal y
el otro, un mesodepredador. Este fenómeno se observa en especies con alta
plasticidad dietética, como roedores y aves rapaces (Russell
2011). Sin embargo, la depredación intragremio en otros grupos como las
arañas, a pesar de su alta diversidad en islas, sigue siendo poco estudiada (Costa et al. 2023b).
Caso de estudio: Impactos indirectos en las Azores
La isla de Corvo (Océano
Atlántico), la más pequeña y aislada del archipiélago de las Azores, tiene 17
km² y una elevación máxima de 718 m. Corvo alberga una de las mayores colonias
de pardela cenicienta (Calonectris borealis Cory), con una estimación de
6326 nidos en la isla (con un intervalo de confianza del 95 % que oscila entre
3735 a 10 524 nidos; Oppel et al. 2014).
La población de pardela cenicienta en las Azores representa aproximadamente el
70 % de la población mundial de esta especie (Monteiro
et al. 1996). Esta isla volcánica es un refugio crucial para las aves
marinas del Atlántico (Furness et al. 2000). Sin
embargo, las poblaciones de aves marinas en las Azores han disminuido debido a
la explotación humana, la pérdida de hábitat y la depredación por mamíferos
invasores. En Corvo, los roedores (Rattus rattus L. y Mus domesticus L.)
fueron introducidos durante la colonización (Fructuoso
1561), y los gatos (Felis catus L.) llegaron en 1717 (Chagas 1989). Los roedores se concentran principalmente
por debajo de los 250 m de altitud, siendo los ratones más comunes que las
ratas (Hervías-Parejo et al. 2012). Por otro
lado, los gatos cimarrones se distribuyen por encima de esa altitud, mientras
que los gatos domésticos ocupan áreas cercanas al núcleo urbano (Oppel et al. 2012). El impacto de los mamíferos invasores
sobre la supervivencia de los nidos de pardela es complejo, con efectos tanto
directos como indirectos (Fig. 5).
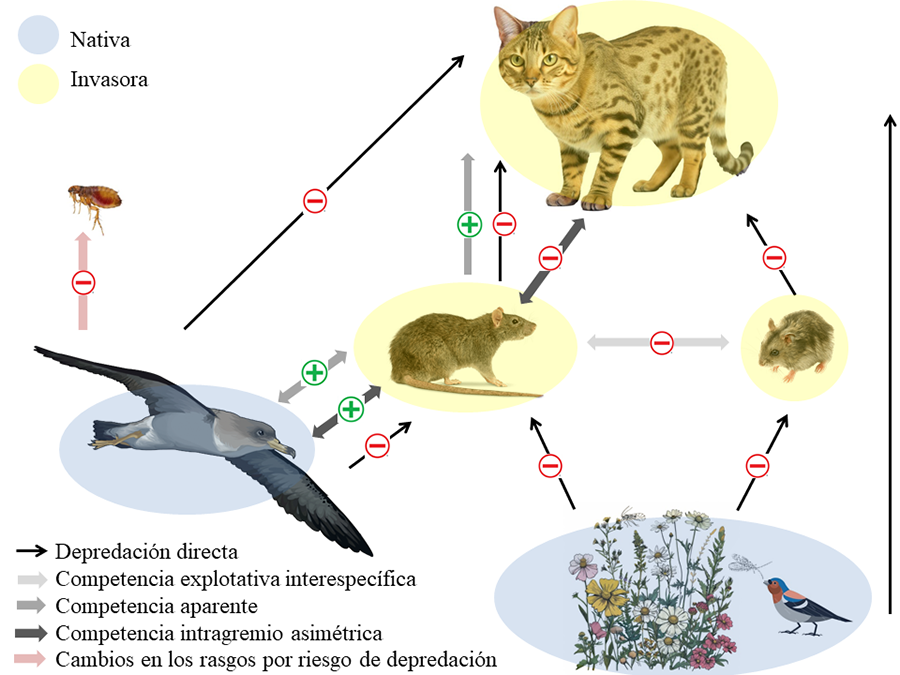
Figura 5. Efectos
directos (representados por flechas negras finas) e indirectos (flechas
ligeramente más gruesas y de distintos colores según el tipo de interacción),
con el signo que indica el tipo de efecto (negativo o positivo) entre gatos,
ratas, ratones invasores (en amarillo), aves y plantas nativas (en azul) en la
isla de Corvo, Azores. Las líneas con una sola punta de flecha indican el flujo
de energía (interacciones tróficas) y apuntan hacia el organismo que la recibe,
mientras que las líneas con dos puntas de flecha representan interacciones de
competencia.
Figure 5. Direct effects (represented by thin black arrows) and indirect
effects (slightly thicker arrows in different colors depending on the type of
interaction), with symbols indicating the type of effect (positive or
negative), among invasive cats, rats, and mice (in yellow), and native birds
and plants (in blue) on Corvo island, Azores. Arrows represent the direction of
energy flow and point toward the receiving organism. Lines with a single
arrowhead indicate energy flow (trophic interactions) and point toward the
receiving organism, while lines with two arrowheads represent competitive
interactions.
Los gatos son los principales depredadores de las pardelas,
causando depredación directa sobre los nidos. Las ratas y ratones afectan
indirectamente a las pardelas al servir de alimento para los gatos fuera de la
época reproductiva (competencia aparente entre roedores y aves), lo que
favorece la expansión de la población de gatos y amplifica su impacto (Hervías-Parejo et al. 2013a; 2014a). Sin embargo, las ratas tienen un efecto
indirecto positivo, ya que los gatos moderan su depredación cuando las ratas
están presentes, reduciendo su impacto sobre las pardelas (competencia
intragremio asimétrica) (Hervías-Parejo et al.
2013b). Los ratones, por su parte, pueden beneficiarse de la liberación de
recursos, como plantas e invertebrados, cuando las ratas se alimentan de las
aves (Hervías-Parejo et al. 2014b). Fuera de
la temporada de nidificación, ratones y ratas compiten por los mismos recursos
(competencia explotativa), y los ratones, con su comportamiento oportunista,
pueden consumir pardelas en ausencia de gatos o ratas. Además, el estrés por el
riesgo de depredación aumenta la probabilidad de que las pardelas alojen
ectoparásitos, lo que afecta su condición corporal y éxito reproductivo (Hervías-Parejo et al. 2013a). Aunque el miedo a
la depredación ha sido bien estudiado en interacciones depredador-presa, se
sabe poco sobre su impacto en las relaciones parásito-hospedador y la dinámica
de enfermedades en fauna silvestre. Futuros estudios podrían arrojar más información
sobre estos efectos indirectos y su relevancia comparativa frente a los efectos
directos de los depredadores.
Conclusiones y perspectivas futuras de investigación
Las islas representan algunos de los ecosistemas más
vulnerables a las invasiones biológicas, debido a su aislamiento geográfico, la
alta proporción de especies endémicas, su notable grado de especialización y la
ausencia de presiones ecológicas como la depredación y la competencia (Whittaker y Fernández-Palacios 2007). Estas
características los convierten en sistemas únicos pero vulnerables, cuya
biodiversidad demanda un esfuerzo continuo de investigación, prevención y
mitigación para enfrentar los diversos impactos de las invasiones biológicas. A
lo largo de esta revisión, hemos ahondado en cómo las especies alóctonas (e
invasoras en muchos casos) afectan al funcionamiento de los ecosistemas
mediante la alteración de diferentes interacciones ecológicas clave como la
polinización, la dispersión de semillas, la herbivoría y las interacciones con
microorganismos, así como otros aspectos más complejos como la diversidad
funcional y los impactos indirectos. A continuación, para cada uno de ellos,
identificamos las principales lagunas de conocimiento que persisten a día de
hoy y que creemos deberían ser abordadas en futuras investigaciones:
·
La introducción de especies no sólo puede afectar a la
composición de las comunidades nativas sino también a los rasgos funcionales de
las especies. En islas, las evidencias señalan interacciones complejas entre
especies introducidas y nativas, influyendo en la configuración de los rasgos
en comunidades, con una marcada contexto-dependencia. Hasta ahora, estos
impactos han sido estudiados principalmente en comunidades vegetales (Kueffer et al. 2010; Pyšek et al.
2012; Barton y Fortunel 2023), mientras
que las comunidades animales han recibido menor atención. Futuros trabajos
deben abordar el impacto en diversos grupos taxonómicos para ofrecer una
perspectiva más integral. El creciente desarrollo de bases de datos globales de
rasgos funcionales, que incluyen tanto especies insulares como invasoras,
representa una oportunidad única para realizar estudios macroecológicos y
comprender los factores determinantes de los impactos en islas. Además,
incorporar la variación intraespecífica en estas bases de datos proporcionará
una visión más detallada y precisa de las respuestas y adaptaciones de las
especies frente a las invasiones, facilitando la planificación de estrategias
de conservación eficaces. Finalmente, son necesarios más estudios que evalúen
los efectos sinérgicos de las especies invasoras con otros motores del cambio
global; por ejemplo, se sabe que algunas invasiones biológicas están muy
relacionadas con los cambios en el clima (Mainka y
Howard 2010), o con la pérdida o fragmentación de los hábitats (Hoffmeister et al. 2005).
·
Los estudios sobre el impacto de las invasiones biológicas en las
interacciones ecológicas en islas han aumentado considerablemente en las
últimas décadas (Traveset y Richardson 2014;
2020). Sin embargo, por lo general, las
interacciones mutualistas de polinización y dispersión de semillas han recibido
mayor atención que otras interacciones también importantes para el correcto
funcionamiento de los ecosistemas, como la herbivoría o las interacciones
planta-microorganismo. En cuanto al impacto de insectos introducidos sobre la polinización
en islas, los estudios se han centrado principalmente en dos géneros de abejas,
Apis y Bombus, dejando importantes lagunas de conocimiento sobre
el impacto de otras especies (Ackerman 2021; Leza et al. 2021; Rabitsch et al.
2024). En el caso de la dispersión de semillas, la recopilación de listas
completas de especies de plantas de fruto carnoso y animales frugívoros
(nativas y alóctonas), junto con datos de rasgos funcionales de cada isla,
permitirá desarrollar estudios macroecológicos, comparar ecosistemas insulares
y continentales, y evaluar si los patrones observados de forma individual en
cada isla o archipiélago son consistentes a mayor escala. Además, existe una
falta de información acerca de la alteración de las interacciones de dispersión
de semillas causada por extinciones y/o por nuevas interacciones con animales
introducidos, en particular aquellos con distribuciones amplias, como roedores
(ratas y ratones), ungulados (especialmente cabras), lagomorfos (principalmente
conejos) y carnívoros (gatos asilvestrados, hurones o mangostas) (Nogales et al. 2024).
·
En el ámbito de las interacciones de herbivoría, la interacción
entre múltiples herbívoros invasores y sus efectos sinérgicos sobre las
comunidades vegetales representan un desafío importante (Glen
et al. 2013). La coexistencia de herbívoros vertebrados e invertebrados
puede producir impactos inesperados en el éxito reproductivo de las plantas,
destacando la necesidad de estudios que analicen estos efectos conjuntos y su
dependencia del contexto (Stephens et al. 2013; Muñoz-Gallego et al. 2022). Por otro lado, en
islas, los impactos ecológicos derivados de herbívoros invertebrados invasores
permanecen en gran medida inexplorados (Russell et al.
2017; Rego et al. 2019). Además, los efectos
indirectos de la herbivoría, como los mediados por densidad (p. ej. Muñoz-Gallego et al. 2023a) o por rasgos de las
especies interactuantes (p. ej. Muñoz-Gallego
et al. 2025), son áreas de investigación poco estudiadas que podrían
aportar una comprensión más completa de las dinámicas ecológicas afectadas por
las invasiones (Strauss 1991; Haas y Lortie 2020 y referencias ahí citadas). Por
último, la mayoría de los estudios que relacionan invasiones biológicas y
herbivoría se centran en los herbívoros como agentes invasores, pero muy pocos
abordan cómo las invasiones alteran las interacciones de herbivoría dentro de
los ecosistemas insulares (Ruiz-Guerra et al. 2019).
·
Las invasiones microbianas constituyen un desafío significativo
para los ecosistemas insulares, ya que pueden alterar ciclos de nutrientes e
interacciones ecológicas, afectando la estabilidad y funcionalidad de estos
ecosistemas. Herramientas moleculares avanzadas, como la secuenciación de nueva generación (NGS) y el "DNA
barcoding", han facilitado la caracterización de comunidades microbianas y
el análisis de redes ecológicas. Sin embargo, persisten limitaciones
importantes para detectar especies raras y validar interacciones funcionales in
situ (Le Roux 2021). En este sentido, las redes
planta-hongo que involucran especies invasoras siguen siendo un área
particularmente poco explorada (Dickie et al. 2017a,
b). Investigaciones futuras deberían enfocarse en
cómo las plantas invasoras establecen asociaciones microbianas, el papel de los
rasgos funcionales microbianos en su éxito invasor, y los impactos a largo
plazo de estas interacciones en las comunidades nativas (Litchman 2010; Hui et al.
2016). Los análisis filogenéticos y de redes temporales podrían revelar
patrones evolutivos y ecosistémicos esenciales para la gestión de estas
invasiones (Grove et al. 2017; Le
Roux 2021). Además, la introducción indirecta de microorganismos a través
de vectores animales utilizados con fines agrícolas o comerciales representa
una vía adicional de invasión biológica, con potenciales impactos sobre las
especies insulares nativas y sus funciones ecológicas (ver Rodríguez et al. 2024). En islas con recursos
limitados, la implementación de protocolos rigurosos de bioseguridad y la
restauración de hábitats se perfilan como estrategias esenciales para prevenir
y mitigar los impactos de estas invasiones (Boser et al.
2014; Koskella et al. 2017).
·
La evidencia empírica ya ha comenzado a sugerir que los efectos
indirectos pueden jugar un papel crucial en los impactos de las especies
invasoras sobre los ecosistemas. Aunque en los últimos años ha aumentado el
esfuerzo por documentar estos impactos (Wootton 2002),
a menudo se han identificado de manera anecdótica y rara vez se prueban de
manera directa. Comprender las interacciones entre múltiples invasores en
comunidades nativas se vuelve aún más desafiante cuando las especies alóctonas
coexisten simultáneamente con otros tipos de cambios ambientales, que pueden
facilitar la invasión o alterar directamente la estructura de la comunidad (MacDougall y Turkington 2005). Dado que
estas interacciones indirectas pueden ser difíciles de prever y cuantificar, es
fundamental abordarlas dentro de un marco dinámico que capture la complejidad
de las interacciones ecológicas. Un enfoque particularmente adecuado es el de
comunidades multifunción (p.ej. Hervías-Parejo et
al. 2024), que permite estudiar simultáneamente los múltiples procesos
directos e indirectos que operan en estos sistemas, los cuales pueden
reforzarse, neutralizarse o incluso generar efectos opuestos. En este contexto,
resulta especialmente necesario desarrollar y evaluar metodologías empíricas
que faciliten la identificación sistemática de los efectos indirectos. Este
enfoque no sólo mejorará nuestra comprensión de las interacciones ecológicas
complejas, sino que también aumentará nuestra capacidad predictiva sobre los
impactos potenciales de las especies invasoras. A su vez, nos permitirá diseñar
estrategias de manejo más efectivas, tanto para las especies invasoras como
para las nativas, en un contexto de cambio global, y especialmente en
ecosistemas vulnerables como los insulares.
Dada la significativa pérdida de biodiversidad nativa en las
islas, especialmente en los últimos 500 años, y teniendo en cuenta que las
especies invasoras son un factor crucial en este declive, es de suma
importancia que se invierta más esfuerzo en estudiar los impactos que estas
especies tienen sobre los ecosistemas y se aborde las lagunas de conocimiento
descritas. Aunque en este trabajo se presentan algunos ejemplos de efectos
positivos de especies invasoras sobre funciones ecológicas concretas, queremos
dejar claro que es fundamental evaluar siempre su impacto neto sobre el
ecosistema en su conjunto. Una investigación interdisciplinar y colaborativa,
que integre la variación contextual y los múltiples niveles de organización
ecológica, será clave para desarrollar estrategias de conservación exitosas.
Puesto que las especies invasoras dominan muchos ecosistemas de todo el mundo,
aplicar métodos de control en comunidades nativas vulnerables puede ser crucial
para mantener la biodiversidad y funcionalidad de los ecosistemas nativos.
Contribución de los autores
Raquel Muñoz-Gallego: Conceptualización,
Investigación, Redacción - borrador original, Redacción – revisión y edición,
Supervisión. Marta Correia: Investigación, Redacción - borrador
original, Redacción – revisión y edición. Alba Costa: Investigación,
Redacción - borrador original, Redacción – revisión y edición. Isabel Donoso:
Investigación, Redacción - borrador original, Redacción – revisión y edición. Sandra
Hervías-Parejo: Investigación, Redacción - borrador original, Redacción –
revisión y edición. Alejandro Mieles: Investigación, Redacción -
borrador original, Redacción – revisión y edición. Marta Quitián:
Investigación, Redacción - borrador original, Redacción – revisión y edición. Maximilian
Vollstädt: Investigación, Redacción - borrador original, Redacción –
revisión y edición. Anna Traveset: Conceptualización, Investigación,
Redacción - borrador original, Redacción – revisión y edición.
Disponibilidad de datos y código
Este artículo no utiliza conjuntos
de datos.
Financiación, permisos requeridos, potenciales
conflictos de interés y agradecimientos
Este estudio se ha llevado a
cabo en el marco de las actividades del Gobierno de España a través de la
Unidad de Excelencia María de Maeztu 2023-2027 (MCIN/AEI/10.13039/501100011033) concedido al
IMEDEA (CSIC-UIB) (ref. CEX2021-001198) y al BC3 (ref. CEX2021-001201-M).
El trabajo se enmarca también dentro del proyecto IslandLife (Ref.
101054177) financiado por el Consejo Europeo de Investigación (ERC, Advanced
Grant). I. Donoso fue financiada por una beca postdoctoral Ikerbasque. M. Vollstädt fue financiado por una beca postdoctoral Marie Curie
(Horizon-TMA-MSCA-101149502). Los autores declaran no tener ningún conflicto de
interés.
Referencias
Abe, T. 2021. Impacts
by feral goats on critically endangered Crepidiastrum grandicollum (Compositae)
endemic to the Ogasawara Islands. Plant Species Biology 36: 361-367. https://doi.org/10.1111/1442-1984.12314
Ackerman, J.D. 2021. Island Invasions by Introduced Honey Bees: What Can Be
Expected for Puerto Rico and the Caribbean? Frontiers in Ecology and
Evolution 8: 1-7. https://doi.org/10.3389/fevo.2020.556744
Aguirrebengoa, M., Müller, C., González-Megías, A. 2021. Pre ‑
dispersal seed predators boost seed production in a short‑lived
plant. Oecologia 195: 971-982. https://doi.org/10.1007/s00442-021-04885-z
Aizen, M.A., Torres, A. 2024.
The Invasion Ecology of Mutualism. Annual
Review of Ecology, Evolution, and Systematics 55:
41-63. https://doi.org/10.1146/annurev-ecolsys-102622-031210
Ali, J.R.,
Aitchison, J.C. 2014. Exploring the combined role
of eustasy and oceanic island thermal subsidence in shaping biodiversity on the
Galápagos. Journal of Biogeography 41: 1227-1241.
Ali, J.R., Blonder, B.W., Pigot, A.L., Tobias, J.A. 2023. Bird extinctions threaten to cause disproportionate reductions of
functional diversity and uniqueness. Functional Ecology, 37(1), 162-175.
https://doi.org/10.1111/1365-2435.14201
Aslan, C.E., Zavaleta, E.S., Tershy, B., Croll, D. 2013. Mutualism
disruption threatens global plant biodiversity: a systematic review. PLoS
ONE 8(6): e66993. https://doi.org/10.1371/journal.pone.0066993
Aslan, C.E., Zavaleta, E.S., Tershy, B., Croll, D., Robichaux, R.H. 2014.
Imperfect replacement of native species by non-native species as pollinators of
endemic Hawaiian plants. Conservation Biology 28: 478-488. https://doi.org/10.1111/cobi.12193
Ayanu, Y., Jentsch, A., Müller-Mahn, D., Rettberg, S., Romankiewicz, C.,
Koellner, T. 2015. Ecosystem engineer unleashed: Prosopis juliflora
threatening ecosystem services?. Regional Environmental Change 15,
155-167. https://doi.org/10.1007/s10113-014-0616-x
Baker, B.H.,
Miller, J.A. 1963. Geology and geochronology of the
Seychelles Islands and structure of the floor of the Arabian Sea. Nature
199(4891): 346-348. https://doi.org/10.1038/199346a0
Barber, N.A., Adler, L.S., Theis, N., Hazzard, R. V., Kiers, E.T. 2012.
Herbivory reduces plant interactions with above- and belowground antagonists
and mutualists. Ecology 93: 1560-1570. https://doi.org/10.1890/11-1691.1
Barton, K.E.,
Fortunel, C. 2023. Island plant functional
syndromes and competition with invasive species. Journal of Biogeography
50(4): 641-653. https://doi.org/10.1111/jbi.14568
Bascompte, J. 2009. Disentangling the web of life. Science 325:
416-419. https://doi.org/10.1126/science.1170749
Beard, K.H.,
O'Neill, E.M. 2005. Infection of an invasive frog Eleutherodactylus
coqui by the chytrid fungus Batrachochytrium dendrobatidis in Hawaii.
Biological Conservation 126: 591-595. https://doi.org/10.1016/j.biocon.2005.07.004
Beckstead, J., Meyer, S.E., Connolly, B.M., Huck, M.B., Street, L.E. 2010.
Cheatgrass facilitates spillover of a seed bank pathogen onto native grass
species. Journal of Ecology 98: 168-177. https://doi.org/10.1111/j.1365-2745.2009.01599.x
Bellard, C., Cassey, P., Blackburn, T.M. 2016. Alien species as a driver of
recent extinctions. Biology letters 12(2): 20150623. https://doi.org/10.1098/rsbl.2015.0623
Bellard, C., Rysman, J.F., Leroy, B., Claud, C., Mace, G.M. 2017. A global
picture of biological invasion threat on islands. Nature Ecology and
Evolution 1: 1862-1869. https://doi.org/10.1038/s41559-017-0365-6
Bello, C., Schleuning, M., Graham, C.H. 2023. Analyzing trophic ecosystem
functions with the interaction functional space. Trends in Ecology &
Evolution 38(5): 424-434. https://doi.org/10.1016/j.tree.2022.12.001
Benkwitt, C.E., Gunn, R.L., Le Corre, M., Carr, P., Graham, N.A. 2021. Rat
eradication restores nutrient subsidies from seabirds across terrestrial and
marine ecosystems. Current Biology 31: 2704-2711. https://doi.org/10.1016/j.cub.2021.03.104
Bennett, A.E. 2013. Can plant-microbe-insect interactions enhance or
inhibit the spread of invasive species? Functional Ecology 27: 661-671. https://doi.org/10.1111/1365-2435.12099
Bernardello, G., Anderson, G.J., Stuessy, T.F., Crawford, D.J. 2001. A
Survey of floral traits, breeding systems, floral visitors, and pollination
systems of the angiosperms of the Juan Fernández Islands (Chile). The
Botanical Review 67: 255-308. https://doi.org/10.1007/BF02858097
Biedinger,
N., Fleischmann, K. 2000. Seychelles. In: Porembski,
S., Barthlott, W. (eds.), Inselbergs, pp. 277-290. Ecological Studies,
vol 146. Springer, Berlin, Heidelberg. Germany. https://doi.org/10.1007/978-3-642-59773-2_14
Biswas, S.R., Choudhury, J.K., Nishat, A., Rahman, M.M. 2007. Do
invasive plants threaten the Sundarbans mangrove forest of Bangladesh? Forest
Ecology and Management 245: 1-9. https://doi.org/10.1016/j.foreco.2007.02.011
Bletz, M.C., Rosa, G.M., Andreone, F., Courtois, E.A., Schmeller, D.S.,
Rabibisoa, N.H.C., Rabemananjara, F.C.E., et al. 2015. Widespread presence of
the pathogenic fungus Batrachochytrium dendrobatidis in wild amphibian
communities in Madagascar. Scientific Reports 5: 8633. https://doi.org/10.1038/srep08633
Boser, C.L., Cory, C., Faulkner, K.R., Randall, J.M., Knapp, J.J.,
Morrison, S.A. 2014. Strategies for Biosecurity on a Nearshore Island in
California. Monographs of the Western North American Naturalist 7:
412-420. https://doi.org/10.3398/042.007.0131
Bourgeois, K., Suehs, C.M., Vidal, E., Médail, F. 2005. Invasional meltdown
potential: Facilitation between introduced plants and mammals on French
Mediterranean islands. Ecoscience 12: 248-256. https://doi.org/10.2980/i1195-6860-12-2-248.1
Bover, P.,
Alcover, J.A. 2008. Extinction of the
autochthonous small mammals of Mallorca (Gymnesic Islands, Western
Mediterranean) and its ecological consequences. Journal of Biogeography
35: 1112-1122. https://doi.org/10.1111/j.1365-2699.2007.01839.x
Briggs, J.C. 2003. The biogeographic and tectonic history of India.
Journal of Biogeography 30(3): 381-388. https://doi.org/10.1046/j.1365-2699.2003.00809.x
Brook, B.W., Sodhi, N.S., Bradshaw, C.J.A. 2008. Synergies among
extinction drivers under global change. Trends in Ecology and Evolution
23: 453-460. https://doi.org/10.1016/j.tree.2008.03.011
Brosse, S., Charpin, N., Su, G., Toussaint, A., Herrera‐r,
G.A., Tedesco, P.A., Villéger, S. 2021. FISHMORPH: A global database on
morphological traits of freshwater fishes. Global Ecology and Biogeography
30(12): 2330-2336. https://doi.org/10.1111/geb.13395
Burns, K.C. 2019. Evolution in isolation: The search for an Island
syndrome in plants. Cambridge University Press. https://doi.org/10.1017/9781108379953
Caiafa, M. V., Jusino, M.A., Wilkie, A.C., Díaz, I.A., Sieving, K.E.,
Smith, M.E. 2021. Discovering the role of Patagonian birds in the dispersal of
truffles and other mycorrhizal fungi. Current Biology 31: 5558-5570. https://doi.org/10.1016/j.cub.2021.10.024
Callaway,
R.M., Lucero, J.E. 2020. Soil biota and non-native
plant invasions. In: Traveset, A., Richardson,
D.M. (eds.), Plant invasions: the role of biotic interactions, pp.
45-66. CABI. https://doi.org/10.1079/9781789242171.0045
Capó, M., Engelbrecht, C., Cardona,
C., Castells, E., Bartolomé, J., Ramoneda, M., Baraza, E. 2021. Mildly toxic shrubs as indicators of goats herbivory gives
information for the management of natural landscapes on Mediterranean islands.
Science of The Total Environment 786: 1-8. https://doi.org/10.1016/j.scitotenv.2021.147391
Capó, M., Cursach, J., Picorelli, V.,
Baraza, E., Rita, J. 2022. Eradication of feral goats, not
population control, as a strategy to conserve plant communities on
Mediterranean islets. Journal for Nature Conservation 65: 1-9. https://doi.org/10.1016/j.jnc.2021.126108
Cares, R.A., Sáez-Cordovez, C., Valiente-Banuet, A., Medel, R.,
Botto-Mahan, C. 2018. Frugivory and seed dispersal in
the endemic cactus Eulychnia acida: extending the anachronism hypothesis
to the Chilean Mediterranean ecosystem. Revista Chilena de
Historia Natural 91: 1-7. https://doi.org/10.1186/s40693-018-0079-4
Carlo, T.A., Morales, J.M.
2016. Generalist birds promote tropical forest regeneration
and increase plant diversity via rare-biased seed dispersal. Ecology 7:
1819-1831. https://doi.org/10.1890/15-2147.1
Case, S.B.,
Tarwater, C.E. 2020. Functional traits of avian
frugivores have shifted following species extinction and introduction in the
Hawaiian Islands. Functional Ecology 34(12): 2467-2476. https://doi.org/10.1111/1365-2435.13670
Causton, C.E., Peck, S.B., Sinclair, B.J., Roque-Albelo, L., Hodgson, C.J.,
Landry, B. 2006. Alien insects: threats and implications for conservation of
Galápagos Islands. Annals of the Entomological Society of America 99:
121-143. https://doi.org/10.1603/0013-8746(2006)099[0121:AITAIF]2.0.CO;2
Caut, S., Angulo, E., Courchamp, F. 2009. Avoiding surprise effects on
Surprise Island: alien species control in a multitrophic level perspective.
Biological Invasions 11: 1689-1703. https://doi.org/10.1007/s10530-008-9397-9
Celedón-Neghme, C., Traveset, A., Calviño-Cancela, M. 2013. Contrasting patterns
of seed dispersal between alien mammals and native lizards in a declining plant
species. Plant Ecology 214: 657-667. https://doi.org/10.1007/s11258-013-0197-7
Chagas, D. 1989. Espelho
crystalino em jardim de varias flores, A.T. Matos (Ed.), Secretaria
Regional da Educação e Cultura, Angra do Heroismo (1645-1650). Azores,
Portugal.
Chamorro, S., Heleno, R., Olesen,
J.M., McMullen, C.K., Traveset, A. 2012. Pollination patterns
and plant breeding systems in the Galápagos: A review. Annals of Botany
110: 1489-1501. https://doi.org/10.1093/aob/mcs132
Chinchio, E., Crotta, M., Romeo, C., Drewe, J.A., Guitian, J., Ferrari, N.
2020. Invasive alien species and disease risk: An open challenge in public and
animal health. PLoS Pathogens 16: 1-7. https://doi.org/10.1371/journal.ppat.1008922
Clout, M.N.,
Russell, J.C. 2007. The invasion ecology of
mammals: a global perspective. Wildlife Research 35: 180-184. https://doi.org/10.1071/WR07091
Cordero, S., Gálvez, F., Fontúrbel, F.E. 2023. Ecological impacts of exotic
species on native seed dispersal systems: A systematic review. Plants
12(2): 261. https://doi.org/10.3390/plants12020261
Córdova-Tapia, F.,
Zambrano, L. 2015. La diversidad funcional en la ecología de comunidades.
Ecosistemas 24(3): 78-87. https://doi.org/10.7818/ECOS.2015.24-3.10
Correia, M., Heleno, R., da Silva,
L.P., Costa, J.M., Rodríguez-Echeverría, S. 2019. First
evidence for the joint dispersal of mycorrhizal fungi and plant diaspores by
birds. New Phytologist 222: 1054-1060. https://doi.org/10.1111/nph.15571
Cortina, C.A., Aslan, C.E., Litson, S.J. 2019. Importance of Non-Native Honeybees (Apis
mellifera) as Flower Visitors to the Hawaiian Tree 'Ōhi'a Lehua (Metrosideros
polymorpha) Across an Elevation Gradient. Pacific Science 73:
345-355. https://doi.org/10.2984/73.3.3
Costa, A., Heleno, R., Dufrene, Y., Huckle, E., Gabriel, R., Doudee, D.,
Kaiser-Bunbury, C.N. 2022a. Seed dispersal by frugivores from forest remnants
promotes the regeneration of adjacent invaded forests in an oceanic island. Restoration
Ecology 30: e13654. https://doi.org/10.1111/rec.13654
Costa, A., Heleno, R., Dufrene, Y.,
Huckle, E., Gabriel, R., Harrison, X., Schabo, D.G., et al. 2022b. Seasonal variation in impact of non-native species on tropical seed
dispersal networks. Functional Ecology 36: 2713-2726. https://doi.org/10.1111/1365-2435.14171
Costa, A., Heleno, R., Freide, E.F., Dufrene, Y., Huckle, E.,
Kaiser-Bunbury, C.N. 2023a. Impacts of invasive ants on pollination of native
plants are similar in invaded and restored plant communities. Global Ecology
and Conservation 42: e02413. https://doi.org/10.1016/j.gecco.2023.e02413
Costa, R., Cardoso, P., Rigal, F.,
Borges, P.A. 2023b. Island spider origins show complex
vertical stratification patterns in Macaronesia. Insect Conservation and
Diversity 16: 886-895. https://doi.org/10.1111/icad.12686
Courchamp, F., Chapuis, J., Pascal, M. 2003. Mammal invaders on islands:
impact, control and control impact. Biological Reviews 78: 347-383. https://doi.org/10.1017/S1464793102006061
Cozzolino, S., Fineschi, S., Litto, M., Scopece, G., Trunschke, J., Schiestl,
F.P. 2015. Herbivory Increases Fruit Set in Silene latifolia: A
Consequence of Induced Pollinator-Attracting Floral Volatiles? Journal of
Chemical Ecology 41: 622-630. https://doi.org/10.1007/s10886-015-0597-3
Crawley, M.J. 1983. Herbivory. The dynamics of animal-plant interactions.
Blackwell Scientific Publications, Oxford, UK.
Cubas, J., Irl, S.D.H., Villafuerte,
R., Bello-Rodríguez, V., Rodríguez-Luengo, J.L., Del Arco, M., Martín-Esquivel,
J.L., González-Mancebo, J.M. 2019. Endemic plant species are
more palatable to introduced herbivores than non-endemics. Proceedings of
the Royal Society B: Biological Sciences 286: 1-9. https://doi.org/10.1098/rspb.2019.0136
Cursach, J., Besnard, A., Rita, J., Fréville, H. 2013. Demographic
variation and conservation of the narrow endemic plant Ranunculus weyleri.
Acta Oecologica 53: 102-109. https://doi.org/10.1016/j.actao.2013.09.010
Delavaux, C.S., Weigelt, P.,
Dawson, W., Essl, F., van Kleunen, M., König, C., Pergl, J., et al. 2021. Mycorrhizal types influence island biogeography of plants.
Communications Biology 4: 1128. https://doi.org/10.1038/s42003-021-02649-2
Díaz, S., Purvis, A., Cornelissen, J.H.C., Mace, G.M., Donoghue, M.J.,
Ewers, R.M., Jordano, P., et al. 2013. Functional traits, the phylogeny of
function, and ecosystem service vulnerability. Ecology and Evolution 3:
2958-2975. https://doi.org/10.1002/ece3.601
Díaz, S., Kattge, J., Cornelissen, J. H., Wright, I. J., Lavorel, S.,
Dray, S., Reu, B., et al. 2022. The global spectrum of plant form and function.
Nature 529: 167-171. https://doi.org/10.1038/nature16489
Dickie, I.A., Bolstridge, N., Cooper, J.A., Peltzer, D.A. 2010.
Co-invasion by Pinus and its mychorrhizal fungi. New Phytologist
187: 475-484. https://doi.org/10.1111/j.1469-8137.2010.03277.x
Dickie, I.A., Nuñez, M.A., Pringle, A., Lebel, T., Tourtellot, S.G.,
Johnston, P.R. 2016. Towards management of invasive ectomycorrhizal fungi.
Biological Invasions 18: 3383-3395. https://doi.org/10.1007/s10530-016-1243-x
Dickie, I.A., Bufford, J.L., Cobb, R.C., Desprez-Loustau, M.L., Grelet,
G., Hulme, P.E., Klironomos, J., et al. 2017a. The emerging science of linked
plant-fungal invasions. New Phytologist 215: 1314-1332. https://doi.org/10.1111/nph.14657
Dickie, I.A., Cooper, J.A., Bufford, J.L., Hulme, P.E., Bates, S.T. 2017b.
Loss of functional diversity and network modularity in introduced plant-fungal
symbioses. AoB PLANTS 9: plw084. https://doi.org/10.1093/aobpla/plw084
Doherty, T.S., Glen, A.S., Nimmo, D.G., Ritchie, E.G., Dickman, C.R. 2016.
Invasive predators and global biodiversity loss. Proceedings of the National
Academy of Sciences 113: 11261-11265. https://doi.org/10.1073/pnas.1602480113
Donoso, I., Sorensen, M.C., Blendinger, P.G., Kissling, W.D., Neuschulz,
E.L., Mueller, T., Schleuning, M. 2020. Downsizing of animal communities
triggers stronger functional than structural decay in seed-dispersal networks.
Nature Communications 11(1): 1582. https://doi.org/10.1038/s41467-020-15438-y
Duchicela, J., Bever, J.D., Schultz, P.A. 2020. Symbionts as filters of plant
colonization of islands: Tests of expected patterns and environmental
consequences in the Galapagos. Plants 9: 74. https://doi.org/10.3390/plants9010074
Dueñas, M., Hemming, D.J., Roberts, A., Diaz-Soltero, H. 2021. The threat
of invasive species to IUCN-listed critically endangered species: A systematic
review. Global Ecology and Conservation 26(e01476). https://doi.org/10.1016/j.gecco.2021.e01476
Duron, Q., Garcia-Iriarte, O.,
Brescia, F., Vidal, E. 2017. Comparative effects of native
frugivores and introduced rodents on seed germination in New-Caledonian
rainforest plants. Biological Invasions 19: 351-363. https://doi.org/10.1007/s10530-016-1284-1
Fernández-Palacios, J.M., Kreft, H., Irl, S. D., Norder, S., Ah-Peng, C., Borges, P.
A., Burns, K.C., et al. 2021. Scientists' warning-The outstanding biodiversity
of islands is in peril. Global Ecology and Conservation 31: e01847. https://doi.org/10.1016/j.gecco.2021.e01847
Fitzpatrick,
S.M., Keegan, W.F. 2007. Human impacts and
adaptations in the Caribbean Islands: an historical ecology approach. Earth
and Environmental Science Transactions of the Royal Society of Edinburgh
98(1): 29-45. https://doi.org/10.1017/S1755691007000096
Fleischmann, K. 1997. Invasion of alien woody plants on the islands of Mahé and
Silhouette, Seychelles. Journal of Vegetation Science 8(1): 5-12. https://doi.org/10.2307/3237236
Fritts, T.H.,
Rodda, G.H. 1998. The role of introduced species in
the degradation of island ecosystems: A case history of Guam. Annual Review
of Ecology and Systematics 29: 113-140. https://doi.org/10.1146/annurev.ecolsys.29.1.113
Fructuoso, G. 1561. Saudades da Terra, 2nd edn, Published in 6 volumes
from 1978 to 1983, ed. J.B.O. Rodrigues. Instituto Cultural de Ponta
Delgada, Azores, Portugal.
Furness, R.W., Hilton, G., Monteiro, L.R. 2000. Influences
of coastal habitat characteristics on the distribution of Cory's Shearwaters
Calonectris diomedea in the Azores archipelago. Bird Study 47: 257-265. https://doi.org/10.1080/00063650009461185
Fürst, M., McMahon, D., Osborne, J., Paxton, R.J., Brown, M.J.F. 2014.
Disease associations between honeybees and bumblebees as a threat to wild
pollinators. Nature 506: 364-366. https://doi.org/10.1038/nature12977
Gala, M.,
Lenoble, A. 2015. Evidence of the former existence
of an endemic macaw in Guadeloupe, Lesser Antilles. J Ornithol 156:
1061-1066. https://doi.org/10.1007/s10336-015-1221-6
Gerber,
G.P., Echternacht, A.C. 2000. Evidence for
asymmetrical intraguild predation between native and introduced Anolis
lizards. Oecologia 124: 599-607. https://doi.org/10.1007/s004420000414
Ghazoul, J. 2006. Floral diversity and the facilitation of pollination.
Journal of Ecology 94: 295-304. https://doi.org/10.1111/j.1365-2745.2006.01098.x
Gillespie,
R.G., Roderick, G.K. 2002. Arthropods on islands:
colonization, speciation, and conservation. Annual Review of Entomology
47: 595-632. https://doi.org/10.1146/annurev.ento.47.091201.145244
GISD. 2016. Global Invasive Species Database (GISD). Available
at: http://www.issg.org/database [accedido
10 December 2024].
Gizicki, Z.S., Tamez, V., Galanopoulou, A.P., Avramidis, P., Foufopoulos,
J. 2018. Long-term effects of feral goats (Capra hircus) on
Mediterranean island communities: results from whole island manipulations.
Biological Invasions 20: 1537-1552. https://doi.org/10.1007/s10530-017-1645-4
Glen, A.S., Atkinson, R., Campbell, K.J., Hagen, E., Holmes, N.D.,
Keitt, B.S., Parkes, J.P., et al. 2013. Eradicating multiple invasive
species on inhabited islands: The next big step in island restoration?
Biological Invasions 15: 2589-2603. https://doi.org/10.1007/s10530-013-0495-y
Govern de les Illes Balears. 2025. Servei de Protecció d'Espècies. Espècies
introduïdes invasores. Disponible en: https://www.caib.es/sites/proteccioespecies [Accedido 21 de enero de 2025].
Graystock, P., Blane, E.J., McFrederick, Q.S., Goulson, D., Hughes, W.O.H.
2016. Do managed bees drive parasite spread and emergence in wild bees?
International Journal for Parasitology: Parasites and Wildlife 5: 64-75. https://doi.org/10.1016/j.ijppaw.2015.10.001
Griffiths, C.J., Hansen, D.M., Jones, C.G., Zuël, N., Harris, S. 2011.
Resurrecting extinct interactions with extant substitutes. Current Biology
21 (9): 762-65. https://doi.org/10.1016/j.cub.2011.03.042
Groutsch, J.K., Miller, N.C., Tuiwawa, M., Hayes, S., Stevens, M.I.,
Schwarz, M.P. 2019. Not all exotic pollinator introductions are bad: an
introduced buzz-pollinating bee Amegilla pulchra (Hymenoptera: Apidae) in Fiji
indicates little potential for enhancing the spread of weeds. Austral
Entomology 58: 533-539. https://doi.org/10.1111/aen.12346
Grove, S., Haubensak, K.A., Gehring, C., Parker, I.M. 2017. Mycorrhizae,
invasions, and the temporal dynamics of mutualism disruption. Journal of
Ecology 105: 1496-1508. https://doi.org/10.1111/1365-2745.12853
Guimarães, P.R., Jordano, P., Thompson, J.N. 2011. Evolution and coevolution
in mutualistic networks. Ecology Letters 14: 877-85. https://doi.org/10.1111/j.1461-0248.2011.01649.x
Haas, S.M.,
Lortie, C.J. 2020. A systematic review of the
direct and indirect effects of herbivory on plant reproduction mediated by
pollination. PeerJ 8: 1-19. https://doi.org/10.7717/peerj.9049
Hansen, D.M., Olesen, J.M., Jones,
C.G. 2002. Trees, birds and bees in Mauritius:
Exploitative competition between introduced honey bees and endemic
nectarivorous birds? Journal of Biogeography 29: 721-734. https://doi.org/10.1046/j.1365-2699.2002.00720.x
Hanz, D.M., Cutts, V., Barajas‐Barbosa, M.P., Algar, A. C.,
Beierkuhnlein, C., Fernández‐Palacios, J. M., Field, R., et al. 2022. Climatic and
biogeographical drivers of functional diversity in the flora of the Canary
Islands. Global Ecology and Biogeography 31(7): 1313-1331 https://doi.org/10.1111/geb.13507
Harris, D.B. 2009. Review of negative effects of introduced rodents on
small mammals on islands. Biological Invasions 11: 1611-1630. https://doi.org/10.1007/s10530-008-9393-0
Hart, R.P., Freebury, G., Barrett, S. 2024. Phytophthora
cinnamomi: extent and impact in Two Peoples Bay Nature Reserve, Western
Australia (1983-2024). Pacific Conservation Biology 30: PC24028. https://doi.org/10.1071/PC24028
Harvey, J.A.,
Fortuna, T.M. 2012. Chemical and structural effects
of invasive plants on herbivore-parasitoid/predator interactions in native
communities. Entomologia Experimentalis et Applicata 144: 14-26. https://doi.org/10.1111/j.1570-7458.2012.01252.x
Hayward, J., Horton, T.R., Nuñez, M.A. 2015. Ectomycorrhizal fungal
communities coinvading with Pinaceae host plants in Argentina: Gringos bajo el
bosque. New Phytologist 208: 497-506. https://doi.org/10.1111/nph.13453
Henry, M., Leung, B., Cuthbert, R.N., Bodey, T.W., Ahmed, D.A., Angulo,
E., Balzani, P., et al. 2023. Unveiling the hidden economic toll of biological
invasions in the European Union. Environmental Sciences Europe
35:43. https://doi.org/10.1186/s12302-023-00750-3
Hervías-Parejo, S., Silva,
C., Pipa, T., Oliveira, N., Henriques, A., Geraldes, P., Mealha, S., et al.
2012. Invasive mammal species on Corvo Island: is their
eradication technically feasible. Airo 22: 12-28.
Hervias-Parejo, S., Ramos,
J.A., Nogales, M., Ruiz de Ybáñez, R. 2013a. Effect of exotic
mammalian predators on parasites of Cory's shearwater: ecological effect on
population health and breeding success. Parasitology research
112: 2721-2730. https://doi.org/10.1007/s00436-013-3443-y
Hervías-Parejo, S.,
Henriques, A., Oliveira, N., Pipa, T., Cowen, H., Ramos, J.A., Nogales, M., et
al. 2013b. Studying the effects of multiple invasive mammals
on Cory's shearwater nest survival. Biological Invasions
15: 143-155. https://doi.org/10.1007/s10530-012-0274-1
Hervías-Parejo, S., Oppel,
S., Medina, F.M., Pipa, T., Díez, A., Ramos, J.A., Ruiz de Ybáñez, R., et al.
2014a. Assessing the impact of introduced cats on island
biodiversity by combining dietary and movement analysis. Journal
of Zoology 292: 39-47. https://doi.org/10.1111/jzo.12082
Hervías-Parejo, S., Ceia,
F.R., Pipa, T., Nogales, M., de Ybáñez, R.R., Ramos, J.A. 2014b. How important are seabirds in the diet of black rats on islands with
a superpredator? Zoology 117:
171-178. https://doi.org/10.1016/j.zool.2013.12.003
Hervías-Parejo, S.,
Cuevas-Blanco, M., Lacasa, L., Traveset, A., Donoso, I., Heleno, R., Nogales,
M., et al. 2024. On the structure of species-function
participation in multilayer ecological networks. Nature Communications
15: 1-16. https://doi.org/10.1038/s41467-024-53001-1
Hinckley, A., Montes, E., Ayllón, E., Pleguezuelos, J.M. 2017. The fall of a
symbol? A high predation rate by the introduced horseshoe whip snake Hemorrhois
hippocrepis paints a bleak future for the endemic Ibiza wall lizard Podarcis
pityusensis. European Journal of Wildlife Research 63:13. https://doi.org/10.1007/s10344-016-1068-z
Hoffmeister, T. S., Vet, L. EM., Biere, A., Holsinger, K., Filser, J. 2005.
Ecological and Evolutionary Consequences of Biological Invasion and Habitat
Fragmentation. Ecosystems 8: 657-667. https://doi.org/10.1007/s10021-003-0138-8
Holt, R.D., Bonsall, M.B. 2017. Apparent competition. Annual Review
of Ecology, Evolution, and Systematics 48: 447-471. https://doi.org/10.1146/annurev-ecolsys-110316-022628
Holt, R.D., Grover, J., Tilman, D. 1994. Simple rules for interspecific
dominance in systems with exploitative and apparent competition. The
American Naturalist 144: 741-771. https://doi.org/10.1086/285705
Howe, H.F. Smallwood, J. 1982. Ecology of seed dispersal. Annual
Review of Ecology and Systematics 13: 201-228 https://doi.org/10.1146/annurev.es.13.110182.001221
Huang, S.C., Norval, G., Wei, C.S., Tso, I.M. 2008. Effects of the brown
anole invasion and betelnut palm planting on arthropod diversity in southern
Taiwan. Zoological Science 25: 1121-1129. https://doi.org/10.2108/zsj.25.1121
Huang, S., Lin, J., Chou, C., Liao, C., Hsu, J., Tsai, J., Liu, S.,
Huang, W. 2023. Dances with wolves: The demographic consequence of asymmetric
competition and intraguild predation in a native‐invasive
skink system. Functional Ecology 37: 614-624. https://doi.org/10.1111/1365-2435.14276
Huguet, V., Land, E., Casanova, J., Zimpfer, J., Fernandez, M. 2005. Genetic
Diversity of Frankia Microsymbionts from the Relict Species Myrica faya
(Ait.) and Myrica rivas-martinezii (S.) in Canary Islands and Hawaii.
Microbial Ecology 49: 617-625. https://doi.org/10.1007/s00248-004-0107-6
Hui, C., Richardson, D.M., Landi, P., Minoarivelo, H.O., Garnas, J.,
Roy, H.E. 2016. Defining invasiveness and invasibility in ecological networks.
Biological Invasions 18: 971-983. https://doi.org/10.1007/s10530-016-1076-7
Hulme, P.E. 2021. Unwelcome exchange: International trade as a direct and
indirect driver of biological invasions worldwide. One Earth 4: 666-679.
https://doi.org/10.1016/j.oneear.2021.04.015
Hume, B.C.C., D'Angelo, C., Cunnington, A., Smith, E.G., Wiedenmann, J.
2014. The corallivorous flatworm Amakusaplana acroporae: An
invasive species threat to coral reefs? Coral Reefs 33: 267-272. https://doi.org/10.1007/s00338-013-1101-6
Ing, K., Mogren, C.L. 2020. Evidence of competition between Honey Bees and Hylaeus
anthracinus (Hymenoptera: Colletidae), an endangered Hawaiian Yellow-faced
bee. Pacific Science 74: 75-85. https://doi.org/10.2984/74.1.6
Iwamura, T., Guzman-Holst, A., Murray, K.A. 2020. Accelerating invasion
potential of disease vector Aedes aegypti under climate change. Nature
Communications 11: 2130. https://doi.org/10.1038/s41467-020-16010-4
Jairus, T., Mpumba, R., Chinoya, S., Tedersoo, L. 2011. Invasion potential
and host shifts of Australian and African ectomycorrhizal fungi in mixed
eucalypt plantations. New Phytologist 192: 179-187. https://doi.org/10.1111/j.1469-8137.2011.03775.x
Jaramillo, P., Atkinson, R., Gentile, G. 2011. Evaluating genetic
diversity for the conservation of the threatened Galapagos endemic
Calandrinia galapagosa (Portulacaceae). Biotropica 43:
386-392. https://doi.org/10.1111/j.1744-7429.2010.00685.x
Jaroszewicz, B., Piroznikow,
E., Sondej, I. 2013. Endozoochory by the guild of ungulates in
Europe's primeval forest. Forest Ecology and Management 305: 21-28. https://doi.org/10.1016/j.foreco.2013.05.004
Johnson, S.D., Peter, C.I., Nilsson, L.A., Agren, J. 2003. Pollination
success in a deceptive orchid is enhanced by co-occurring rewarding magnet
plants. Ecology 84: 2919-2927. https://doi.org/10.1890/02-0471
Jordano, P. 2000. Fruits and frugivory. In: Fenner, M. (ed.), Seeds: The Ecology
of Regeneration in Natural Plant Communities, pp. 105-151. CAB
International, Wallingford, UK. https://doi.org/10.1079/9780851994321.0125
Kaiser-Bunbury, C.N., Memmott, J., Müller, C.B. 2009. Community structure of
pollination webs of Mauritian heathland habitats. Perspectives in Plant
Ecology, Evolution and Systematics 11: 241-254. https://doi.org/10.1016/j.ppees.2009.04.001
Kaiser-Bunbury, C.N., Traveset, A., Hansen, D.M. 2010. Conservation and
restoration of plant-animal mutualisms on oceanic islands. Perspectives in
Plant Ecology, Evolution and Systematics 12: 131-143. https://doi.org/10.1016/j.ppees.2009.10.002
Kaiser-Bunbury, C.N., Mougal, J., Whittington, A.E., Valentin, T., Gabriel, R.,
Olesen, J.M., Blüthgen, N. 2017. Ecosystem restoration strengthens pollination
network resilience and function. Nature 542(7640): 223-227. https://doi.org/10.1038/nature21071
Kalisz, S., Kivlin, S.N., Bialic-Murphy, L. 2021. Allelopathy is pervasive
in invasive plants. Biological Invasions 23: 367-371. https://doi.org/10.1038/nature21071
Karatayev, V.A., Karatayev, A.Y., Burlakova, L.E., Rudstam, L.G. 2014.
Eutrophication and Dreissena invasion as drivers of biodiversity: A century of
change in the mollusc community of Oneida Lake. PLoS ONE 9(7): e101388. https://doi.org/10.1371/journal.pone.0101388
Kardol, P., Dickie, I.A., St. John, M.G., Husheer, S.W., Bonner, K.I.,
Bellingham, P.J., Wardle, D.A. 2014. Soil-mediated effects of invasive
ungulates on native tree seedlings. J Ecol 102: 622-631. https://doi.org/10.1111/1365-2745.12234
Kato, M.,
Kawakita, A. 2004. Plant-pollinator interactions in
New Caledonia influenced by introduced honey bees. American Journal of
Botany 91: 1814-1827. https://doi.org/10.3732/ajb.91.11.1814
Kato, M., Shibata, A., Yasui, T., Nagamasu, H. 1999. Impact of introduced honeybees, Apis mellifera, upon native bee
communities in the Bonin (Ogasawara) Islands.
Population Ecology 41: 217-228. https://doi.org/10.1007/s101440050025
Kattge, J., Diaz, S., Lavorel, S., Prentice, I. C., Leadley, P., Bönisch,
G., Garnier, E., et al. 2011. TRY-a global database of plant traits. Global
change biology 17(9): 2905-2935. https://doi.org/10.1111/j.1365-2486.2011.02451.x
Kaushik, P., Pati, P.K., Khan, M. L., Khare, P.K. 2022. Plant functional
traits best explain invasive species' performance within a dynamic ecosystem-A
review. Trees, Forests and People 8: 100260. https://doi.org/10.1016/j.tfp.2022.100260
Keane, R.M.,
Crawley, M.J. 2002. Exotic plant invasions and the
enemy release hypothesis. Trends in Ecology & Evolution 17: 164-170.
https://doi.org/10.1016/S0169-5347(02)02499-0
Kemp, M.E. 2023. Defaunation and species introductions alter long-term
functional trait diversity in insular reptiles. Proceedings of the National
Academy of Sciences 120(7): e2201944119. https://doi.org/10.1073/pnas.2201944119
Kier, G., Kreft, H., Ming, T.M., Jetz, W., Ibisch, P.L., Nowicki, C.,
Mutke, J., Barthlott, W. 2009. A global assessment of endemism and species
richness across Island and mainland regions. Proceedings of the National
Academy of Sciences of the United States of America 106: 9322-9327. https://doi.org/10.1073/pnas.0810306106
Koskella, B., Hall, L.J., Metcalf, C.J.E. 2017. The microbiome beyond the
horizon of ecological and evolutionary theory. Nature Ecology and Evolution
1: 1606-1615. https://doi.org/10.1038/s41559-017-0340-2
Kossoff, A., Schueller, S., Nossan, H., Slack, I., Avramidis, P.,
Foufopoulos, J. 2024. Ecological Impacts of Introduced European Rabbits (Oryctolagus
cuniculus) on Island Ecosystems in the Mediterranean. Diversity
16(4): 244. https://doi.org/10.3390/d16040244
Kress, J.W. 1993. Coevolution of pants and animals: pollination of
flowers by primates in Madagascar. Current Science 65(3): 253-257.
Kuebbing, S.E. 2020. How direct and indirect non-native interactions can
promote plant invasions, lead to invasional meltdown and inform management
decisions. In: Traveset, A., Richardson,
D.M. (eds.), Plant invasions: the role of biotic interactions, pp.
153-176. CABI. Wallingford, UK https://doi.org/10.1079/9781789242171.0153
Kueffer, C., Schumacher, E., Fleischmann, K., Edwards, P.J., Dietz, H.
2007. Strong below-ground competition shapes tree regeneration in invasive
Cinnamomum verum forests. Journal of Ecology 95(2): 273-282. https://doi.org/10.1111/j.1365-2745.2007.01213.x
Kueffer, C., Daehler, C.C., Torres-Santana, C.W., Lavergne, C., Meyer, J.,
Otto, R., Silva, L. 2010. A global comparison of plant invasions on oceanic
islands. Perspectives in Plant Ecology, Evolution and Systematics 12(2):
145-161. https://doi.org/10.1016/j.ppees.2009.06.002
Kurle, C.M., Croll, D.A., Tershy, B.R. 2008. Introduced rats indirectly
change marine rocky intertidal communities from algae-to invertebrate-dominated.
Proceedings of the National Academy of Sciences 105: 3800-3804. https://doi.org/10.1073/pnas.0800570105
Landis, B. 2010. How CNPS developed a policy on native plants and fire
safety. Journal of the California native plant society 38(2): 7-15.
Lassnig, N., Colomar, V., Picó, G., Perelló, E., Febrer-Serra, M.,
Truyols-Henares, F., Pinya, S. 2020. Assessment of the invasion process
of the common raccoon Procyon lotor (Carnivora: Procyonidae) on a
Mediterranean island a decade after its introduction. Science of the Total
Environment 699: 134191. https://doi.org/10.1016/j.scitotenv.2019.134191
Lázaro, A., Müller, A., Ebmer, A.W., Dathe, H.H., Scheuchl, E., Schwarz,
M., Risch, S., et al. 2021. Impacts of beekeeping on wild bee diversity and
pollination networks in the Aegean Archipelago. Ecography 44:
1353-1365. https://doi.org/10.1111/ecog.05553
le Roux, J.J. 2021. Molecular ecology of plant-microbial interactions
during invasions: progress and challenges. In: Traveset, A., Richardson, D. M.
(eds.), Plant invasions: the role of biotic interactions, pp. 340-362.
CABI, Wallingford. https://doi.org/10.1079/9781789242171.0340
Leal, A.I., Bugalho, M.N., Palmeirim, J.M. 2022. Effects of ungulates on
oak regeneration in Mediterranean woodlands: A meta-analysis. Forest Ecology
and Management 509: 1-10. https://doi.org/10.1016/j.foreco.2022.120077
Levine, J.M., Bascompte, J., Adler, P.B., Allesina, S. 2017. Beyond pairwise mechanisms of species coexistence in complex
communities. Nature 546: 56-64. https://doi.org/10.1038/nature22898
Leza, M., Herrera, C., Picó, G.,
Morro, T., Colomar, V. 2021. Six years of controlling the
invasive species Vespa velutina in a Mediterranean island: The promising
results of an eradication plan. Pest Management Science 77: 2357-2384. https://doi.org/10.1002/ps.6264
Litchman, E. 2010. Invisible invaders: Non-pathogenic invasive microbes in
aquatic and terrestrial ecosystems. Ecology Letters 13: 1560-1572. https://doi.org/10.1111/j.1461-0248.2010.01544.x
López‐Bustamante, P., Rosa‐Santiago, A., Hulshof, C.M.,
Franklin, J. 2024. Tree functional traits across Caribbean
island dry forests are remarkably similar. Journal of Biogeography 51(9)
1646-1658. https://doi.org/10.1111/jbi.14743
Lorenzo, P.,
González, L. 2010. Alelopatía: una
característica ecofisiológica que favorece la capacidad invasora de las
especies vegetales. Ecosistemas 19 (1): 79-91. Recuperado a partir de https://www.revistaecosistemas.net/index.php/ecosistemas/article/view/57
Lowe, S., Browne, M., Boudjelas, S. 2000. 100 of the World's Worst
Invasive Alien Species: a selection from the Global Invasive Species Database.
The Invasive Species Specialist Group (ISSG) a specialist group of the
Species Survival Commission (SSC) of the World Conservation Union (IUCN), New
Zealand.
MacDougall,
A.S., Turkington, R. 2005. Are invasive
species the drivers or passengers of change in degraded ecosystems? Ecology
86: 42-55. https://doi.org/10.1890/04-0669
MacPhee,
R.D., Flemming, C. 1999. Requiem æternam: the last
five hundred years of mammalian species extinctions. In: Delson, E.,
MacPhee R.D.E. (eds.), Extinctions in near time: causes, contexts, and
consequences, pp. 333-371. Springer, Boston, MA, USA. https://doi.org/10.1007/978-1-4757-5202-1_13
Mainka, S.A.,
Howard, G.W. 2010. Climate change and invasive
species: double jeopardy. Integrative Zoology 5: 102-111. https://doi.org/10.1111/j.1749-4877.2010.00193.x
Maitner, B.S., Boyle, B., Casler, N., Condit, R., Donoghue II, J., Durán,
S.M., Guaderrama, D., et al. 2018. The BIEN R package: A tool to access
the Botanical Information and Ecology Network (BIEN) database. Methods in
Ecology & Evolution 9:373-379. https://doi.org/10.1111/2041-210X.12861
Mandon-Dalger, I., Clergeau, P., Tassin, J., Rivière, J.-N., Gatti, S. 2004.
Relationships between alien plants and an alien bird species on reunion island.
Journal of Tropical Ecology 20(6): 635-642. https://doi.org/10.1017/S0266467404001774
Maron, J.L., Vilà, M. 2001. When do herbivores affect plant invasion? Evidence for the
natural enemies and biotic resistance hypotheses. Oikos 95: 361-373. https://doi.org/10.1034/j.1600-0706.2001.950301.x
Mathakutha, R., Steyn, C., le Roux, P.C., Blom, I.J., Chown, S.L., Daru, B.
H., Ripley, B.S., et al. 2019. Invasive species differ in key functional traits
from native and non‐invasive alien plant species. Journal of Vegetation Science
30(5): 994-1006. https://doi.org/10.1111/jvs.12772
Matsuzaki, S I.S., Sasaki, T., Akasaka, M. 2013. Consequences of the
introduction of exotic and translocated species and future extirpations on the
functional diversity of freshwater fish assemblages. Global Ecology and
Biogeography 22(9): 1071-1082. https://doi.org/10.1111/geb.12067
Maunder, M., Leiva, A.,
Santiago-Valentín, E., Stevenson, D. W., Acevedo-Rodríguez, P., Meerow, A. W.,
Mejía, M., et al. 2008. Plant conservation in the Caribbean
island biodiversity hotspot. The Botanical Review 74(1): 197-207. https://doi.org/10.1007/s12229-008-9007-7
Mayol, J., Álvarez, C., Manzano, X.
2009. Presència i control del coatí, Nasua nasua L., i d'altres carnívors
introduïts en època recent a Mallorca. Bolleti de la Societat d'Historia
Natural de les Balears 52: 183-191.
McCary, M.A., Mores, R., Farfan,
M.A., Wise, D.H. 2016. Invasive plants have different effects
on trophic structure of green and brown food webs in terrestrial ecosystems: A
meta-analysis. Ecology Letters 19: 328-335. https://doi.org/10.1111/ele.12562
Menezes de Sequeira, M.,
Jardim, R., Gouveia, M., Góis-Marques, C.A., Eddie, W.M.M. 2021. Population decline in the Critically Endangered Musschia isambertoi (Campanulaceae)
endemic to Desertas Islands (Madeira Archipelago) calls for urgent conservation
management. Journal for Nature Conservation 60: 1-9. https://doi.org/10.1016/j.jnc.2021.125955
Monteiro, L., Ramos, J., Furness, R. 1996. Past and present status and
conservation of the seabirds breeding in the Azores archipelago. Biological
Conservation 78: 319-328. https://doi.org/10.1016/S0006-3207(96)00037-7
Montero-Castaño,
A., Vilà, M. 2017. Influence of the honeybee and
trait similarity on the effect of a non-native plant on pollination and network
rewiring. Functional Ecology 31: 142-152. https://doi.org/10.1111/1365-2435.12712
Moquet, L., Jobart, B., Fontaine, R., Delatte, H. 2023. Tri‐trophic
interactions among Fopius arisanus, Tephritid species and host plants
suggest apparent competition. Ecology and Evolution 13: e9742. https://doi.org/10.1002/ece3.9742
Morales,
C.L., Traveset, A. 2009. A meta-analysis of impacts
of alien vs. native plants on pollinator visitation and reproductive success of
co-flowering native plants. Ecology Letters 12: 716-728. https://doi.org/10.1111/j.1461-0248.2009.01319.x
Moreira, X., Castagneyrol, B., Abdala-Roberts, L., Traveset, A. 2019. A
meta-analysis of herbivore effects on plant attractiveness to pollinators.
Ecology 100: 1-8. https://doi.org/10.1002/ecy.2707
Muñoz-Gallego, R. 2023. The impact of two contrasting invasive non-native
herbivores on the reproductive performance of a Mediterranean keystone species.
Tesis Doctoral, Universidad de las Islas Baleares, España.
Muñoz-Gallego, R., Fedriani,
J.M., Traveset, A. 2019. Non-native mammals are the main seed
dispersers of the ancient Mediterranean palm Chamaerops humilis L. in
the Balearic Islands: rescuers of a lost seed dispersal service? Frontiers
in Ecology and Evolution 7: 1-16. https://doi.org/10.3389/fevo.2019.00161
Muñoz-Gallego, R., Fedriani, J.M., Serra, P.E., Traveset, A. 2022. Nonadditive
effects of two contrasting introduced herbivores on the reproduction of a
pollination-specialized palm. Ecology 103: 1-12. https://doi.org/10.1002/ecy.3797
Muñoz-Gallego, R., Wiegand, T., Traveset, A., Fedriani, J.M. 2023a. From seed
dispersal service to reproductive collapse: density- dependent outcome of a
palm-mammal interaction. Oikos 2023: 1-15. https://doi.org/10.1111/oik.10002
Muñoz-Gallego, R., Wiegand, T., Traveset, A., Fedriani, J.M. 2023b. Sex-driven
neighborhood effects on herbivory in the dioecious Mediterranean palm
Chamaerops humilis L. Oecologia 203: 151-165. https://doi.org/10.1007/s00442-023-05457-z
Muñoz-Gallego, R., Traveset, A., Fedriani, J.M. 2025. Trait-mediated
effects driven by an invasive herbivore alter functionally diverse
plant-frugivore interactions. Functional Ecology 00:1-13. https://doi.org/10.1111/1365-2435.70220
Najberek, K., Olszańska, A., Tokarska-Guzik, B., Mazurska, K., Dajdok, Z.,
Solarz, W. 2022. Invasive alien species as reservoirs for pathogens.
Ecological Indicators 139: 108879. https://doi.org/10.1016/j.ecolind.2022.108879
Nieto-Blázquez, M. E.,
Antonelli, A., Roncal, J. 2017. Historical biogeography
of endemic seed plant genera in the Caribbean: Did GAAR landia play a role? Ecology and Evolution 7(23):
10158-10174. https://doi.org/10.1002/ece3.3521
Nock, C.A., Vogt, R.J., Beisner, B.E. 2016. Functional traits.
John Wiley & Sons, Ltd: Chichester. https://doi.org/10.1002/9780470015902.a0026282
Nogales, M., McConkey, K.R.,
Carlo, T.A., Wotton, D.M., Bellingham, P.J., Traveset, A., González-Castro, A.,
et al. 2024. A review on the state of the art in frugivory and
seed dispersal on islands and the implications of global change. The
Botanical Review 90: 160-185. https://doi.org/10.1007/s12229-023-09296-8
Nowak, L., Fricke, E.C, Traveset, A. Donoso, I. 2025. Impacts of species
introductions on the trait diversity of interacting avian frugivores and
fleshy-fruited plants. bioRxiv (preprint). https://doi.org/10.1101/2025.01.18.633718
Nuñez, M.A., Hayward, J., Horton,
T.R., Amico, G.C., Dimarco, R.D., Barrios-Garcia, M.N., Simberloff, D. 2013. Exotic Mammals Disperse Exotic Fungi That Promote Invasion by Exotic
Trees. PLoS ONE 8: e66832. https://doi.org/10.1371/journal.pone.0066832
Olesen, J.M., Jordano, P.
2002. Geographic Patterns in Plant-Pollinator Mutualistic
Networks. Ecology 83: 2416-2424. https://doi.org/10.1890/0012-9658(2002)083[2416:GPIPPM]2.0.CO;2
Oliveira, B.F., São-Pedro, V.A.,
Santos-Barrera, G., Penone, C., Costa, G.C. 2017. AmphiBIO, a
global database for amphibian ecological traits. Scientific data 4(1):
1-7. https://doi.org/10.1038/sdata.2017.123
Ollerton, J., Winfree, R., Tarrant, S. 2011. How many flowering
plants are pollinated by animals? Oikos 120: 321-326. https://doi.org/10.1111/j.1600-0706.2010.18644.x
Oppel, S., Hervías-Parejo, S.,
Oliveira, N., Pipa, T., Cowen, H., Silva, C., Geraldes, P. 2012. Estimating feral cat density on Corvo Island, Azores, to assess the
feasibility of feral cat eradication. Airo 22: 3-11.
Oppel, S., Hervias-Parejo, S.,
Oliveira, N., Pipa, T., Silva, C., Geraldes, P., Goh, M., et al. 2014. Estimating population size of a nocturnal burrow-nesting seabird
using acoustic monitoring and habitat mapping. Nature Conservation 7:
1-13. https://doi.org/10.3897/natureconservation.7.6890
Padrón, B., Traveset, A., Biedenweg, T., Díaz, D., Nogales, M., Olesen,
J.M. 2009. Impact of alien plant invaders on pollination networks in two
archipelagos. PLoS ONE 4(7): e6275. https://doi.org/10.1371/journal.pone.0006275
Pagad, S., Genovesi, P., Carnevali,
L., Schigel, D., McGeoch, M.A. 2018. Introducing the Global
Register of Introduced and Invasive Species. Scientific Data 5:170202. https://doi.org/10.1038/sdata.2017.202
Paige, K.N.,
Whitham, T.G. 1987. Overcompensation in response to
mammalian herbivory: the advantage of being eaten. American Naturalist
129: 407-416. https://doi.org/10.1086/284645
Parker, J., Hay, M. 2005. Biotic resistance to plant invasions? Native herbivores
prefer non-native plants. Ecology Letters 8: 959-967. https://doi.org/10.1111/j.1461-0248.2005.00799.x
Pimentel, D., McNair, S., Janecka, J., Wightman, J., Simmonds, C.,
O'Connell, C., Wong, E., et al. 2001. Economic and environmental threats of
alien plant, animal, and microbe invasions. Agriculture, Ecosystems and
Environment 84: 1-20. https://doi.org/10.1016/S0167-8809(00)00178-X
Pineda, A., Zheng, S.J., van Loon, J.J.A., Pieterse, C.M.J., Dicke, M.
2010. Helping plants to deal with insects: The role of beneficial soil-borne
microbes. Trends in Plant Science 15: 507-514. https://doi.org/10.1016/j.tplants.2010.05.007
Pinya, S.,
Lassnig, N. 2018. First record of
free-ranging fallow deer (Dama dama) in Mallorca (Balearic Islands,
Spain). Galemys, Spanish Journal of Mammalogy 30: 63-65. https://doi.org/10.7325/Galemys.2018.N2
Policelli, N., Bruns, T.D., Vilgalys, R., Nuñez, M.A. 2019. Suilloid fungi as
global drivers of pine invasions. New Phytologist 222: 714-725. https://doi.org/10.1111/nph.15660
Polis, G.A., Myers, C.A., Holt, R.D. 1989. The ecology and evolution of
intraguild predation: potential competitors that eat each other. Annual
Review of Ecology and Systematics 20: 297-330. https://doi.org/10.1146/annurev.ecolsys.20.1.297
Põlme, S., Abarenkov, K., Henrik Nilsson, R., Lindahl, B.D., Engelbrecht
Clemmensen, K., Kauserud, H., Nguyen, N., et al. 2020. FungalTraits: a
user-friendly traits database of fungi and fungus-like stramenopiles. Fungal
Diversity 105, 1-16. https://doi.org/10.1007/s13225-020-00466-2
Potts, S.G., Biesmeijer, J.C., Kremen, C., Neumann, P., Schweiger, O.,
Kunin, W.E. 2010. Global pollinator declines: trends, impacts and drivers.
Trends in Ecology and Evolution 25: 345-353. https://doi.org/10.1016/j.tree.2010.01.007
Poulakakis, N., Russello, M., Geist, D., Caccone, A. 2012. Unravelling the
peculiarities of island life: Vicariance, dispersal and the diversification of
the extinct and extant giant Galápagos tortoises. Molecular Ecology 21:
160-173. https://doi.org/10.1111/j.1365-294X.2011.05370.x
Pringle, A.,
Vellinga, E.C. 2006. Last chance to know?
Using literature to explore the biogeography and invasion biology of the death
cap mushroom Amanita phalloides (Vaill. ex Fr. :Fr.) link. Biological
Invasions 8: 1131-1144. https://doi.org/10.1007/s10530-005-3804-2
Pyšek, P., Jarošík, V., Hulme, P.E., Pergl, J., Hejda, M., Schaffner, U.,
Vilà, M. 2012. A global assessment of invasive plant impacts on resident
species, communities and ecosystems: the interaction of impact measures,
invading species' traits and environment. Global change
biology 18(5): 1725-1737. https://doi.org/10.1111/j.1365-2486.2011.02636.x
Quetglas, B., Olmo, D., Nieto,
A., Borràs, D., Adrover, F., Pedrosa, A., Montesinos, M., et al. 2022. Evaluation of Control Strategies for Xylella fastidiosa in
the Balearic Islands. Microorganisms 10: 2393. https://doi.org/10.3390/microorganisms10122393
Rabitsch, W., Werenkraut, V., Kenis, M., Roques, A., Roy, H.E. 2024. Chapter
Six - Invasive alien insects and insect decline. In:
Rodríguez, J., Pyšek, P., Novoa, A. (eds.), Biological
Invasions and Global Insect Decline, pp. 143-171.
Academic Press. https://doi.org/10.1016/B978-0-323-99918-2.00006-9
Rego, C., Boieiro, M., Rigal, F., Ribeiro, S.P., Cardoso, P., Borges,
P.A.V. 2019. Taxonomic and functional diversity of insect herbivore assemblages
associated with the canopy-dominant trees of the Azorean native forest. PLoS
ONE 14: 1-20. https://doi.org/10.1371/journal.pone.0219493
Ripple, W.J., Estes, J.A., Schmitz, O.J., Constant, V., Kaylor, M.J.,
Lenz, A., Motley, J.L., et al. 2016. What is a trophic cascade?
Trends in Ecology & Evolution 31: 842-849. https://doi.org/10.1016/j.tree.2016.08.010
Roche, M.D., Pearse, I.S., Sofaer, H.R., Kivlin, S.N., Spyreas, G., Zaya,
D.N., Kalisz, S. 2023. Invasion-mediated mutualism disruption is evident across
heterogeneous environmental conditions and varying invasion intensities. Ecography
2023: e06434. https://doi.org/10.1111/ecog.06434
Rodríguez, J., Thompson, V.,
Rubido-Bará, M., Cordero-Rivera, A., González, L. 2019. Herbivore
accumulation on invasive alien plants increases the distribution range of
generalist herbivorous insects and supports proliferation of non-native insect
pests. Biological Invasions 21: 1511-1527. https://doi.org/10.1007/s10530-019-01913-1
Rodríguez, J., Cordero-Rivera,
A., González, L. 2021. Impacts of the invasive plant Carpobrotus
edulis on herbivore communities on the Iberian Peninsula. Biological
Invasions 23: 1425-1441. https://doi.org/10.1007/s10530-020-02449-5
Rodríguez, J., Novoa, A., Pyšek, P. 2024. Chapter Nine - Microorganisms and
disease-mediated invasions affecting native insect conservation. In: Rodríguez,
J., Pyšek, P., Novoa, A. (eds.), Biological Invasions and Global Insect
Decline, pp. 225-255. Academic Press. https://doi.org/10.1016/B978-0-323-99918-2.00009-4
Rodríguez-Echeverría, S.
2009. Organismos del suelo: la dimensión invisible de las invasiones por
plantas no nativas. Ecosistemas 18(2):32-43. Recuperado a partir de https://www.revistaecosistemas.net/index.php/ecosistemas/article/view/63
Rodríguez-Echeverría, S. 2010. Rhizobial hitchhikers from Down Under: invasional
meltdown in a plant-bacteria mutualism? Journal of Biogeography 37:
1611-1622. https://doi.org/10.1111/j.1365-2699.2010.02284.x
Rodríguez-Echeverría,
S., Traveset, A. 2015. Putative linkages between
below- and aboveground mutualisms during alien plant invasions. AoB
PLANTS 7: plv062. https://doi.org/10.1093/aobpla/plv062
Rodríguez-Padrón, C.,
Siverio, F., Pérez-Sierra, A., Rodríguez, A. 2018. Isolation
and pathogenicity of Phytophthora species and Phytopythium vexans
recovered from avocado orchards in the Canary Islands, including Phytophthora
niederhauserii as a new pathogen of avocado. Phytopathologia
Mediterranea 57: 89-106.
Rogers, H.S., Buhle, E.R., HilleRisLambers, J., Fricke, E.C., Miller,
R.H., Tewksbury, J.J. 2017. Effects of an Invasive Predator Cascade to Plants
via Mutualism Disruption. Nature Communications 8
(1):14557. https://doi.org/10.1038/ncomms14557
Ruiz-Guerra, B., Aguilar-Chama,
A., González de León, S., Guevara, R. 2019. Invasive Species
Appear to Disrupt the Top-Down Control of Herbivory on a Mexican Oceanic Island.
Pacific Science 73(1):1-16. https://doi.org/10.2984/73.1.1
Russell, J. 2011. Indirect effects of introduced predators on seabird
islands. In: Christa P. H. Mulder, and others (eds), Seabird Islands:
Ecology, Invasion, and Restoration, online edn, Oxford Academic, New York,
USA. https://doi.org/10.1093/acprof:osobl/9780199735693.003.0009
Russell,
J.C., Kaiser-Bunbury, C.N. 2019. Consequences of
multispecies introductions on island ecosystems. Annual Review of Ecology,
Evolution, and Systematics 50: 169-190. https://doi.org/10.1146/annurev-ecolsys-110218-024942
Russell,
J.C., Kueffer, C. 2019. Island biodiversity in the
Anthropocene. Annual Review of Environment and Resources 44(1): 31-60. https://doi.org/10.1146/annurev-environ-101718-033245
Russell, J.C., Meyer, J.., Holmes, N.D., Pagad, S. 2017. Invasive alien
species on islands: Impacts, distribution, interactions and management.
Environmental Conservation 44: 359-370. https://doi.org/10.1017/S0376892917000297
Saffer, A., Worm, T., Takeuchi, Y., Meentemeyer, R. 2024. GIataR: a
Spatio-temporal Dataset of Global Invasive and alien Species and their traits.
Scientific Data 11(1): 991. https://doi.org/10.1038/s41597-024-03824-w
Santos de Araújo, W.,
Bergamini, L.L., Almeida-Neto, M. 2024. Global effects of
land-use intensity and exotic plants on the structure and phylogenetic signal
of plant-herbivore networks. Science of The Total Environment 944:
1-8. https://doi.org/10.1016/j.scitotenv.2024.173949
Sapsford, S.J., Wakelin, A., Peltzer, D.A., Dickie, I.A. 2022. Pine invasion
drives loss of soil fungal diversity. Biological Invasions 24: 401-414.
https://doi.org/10.1007/s10530-021-02649-7
Sarto i
Monteys, V., Aguilar, L. 2005. The Castniid
Palm Borer, Paysandisia archon (BURMEISTER, 1880), in Europe:
Comparative biology, pest status and possible control methods (Lepidoptera:
Castniidae). Nachrichten des Entomologischen Vereins Apollo 26: 61-94.
Sax, D.F., Schlaepfer, M.A., Olden, J.D. 2022. Valuing the
contributions of non-native species to people and nature. Trends in Ecology
and Evolution 37(12): 1058-1066. https://doi.org/10.1016/j.tree.2022.08.005
Sayol, F., Cooke, R.S., Pigot, A.L., Blackburn, T.M., Tobias, J.A.,
Steinbauer, M.J., Antonelli, A., et al. 2021. Loss of functional diversity
through anthropogenic extinctions of island birds is not offset by biotic
invasions. Science Advances 7(46): eabj5790. https://doi.org/10.1126/sciadv.abj5790
Schemske, D.W. 1981. Floral convergence and pollinator sharing in two
bee-pollinated tropical herbs. Ecology 62: 946-954. https://doi.org/10.2307/1936993
Schleuning, M., Fründ, J., García, D. 2015. Predicting ecosystem functions
from biodiversity and mutualistic networks: an extension of trait‐based
concepts to plant-animal interactions. Ecography 38(4): 380-392. https://doi.org/10.1111/ecog.00983
Schleuning, M., Neuschulz, E.L., Albrecht, J., Bender, I. M., Bowler, D.E.,
Dehling, D.M., Fritz, S.A., et al. 2020. Trait-based assessments of
climate-change impacts on interacting species. Trends in Ecology &
Evolution 35(4): 319-328. https://doi.org/10.1016/j.tree.2019.12.010
Schoener,
T.W., Spiller, D.A. 1999. Indirect effects in an
experimentally staged invasion by a major predator. American Naturalist
153: 347-358. https://doi.org/10.1086/303177
Schrader, J., Weigelt, P., Cai, L., Westoby, M., Fernández-Palacios, J.M.,
Cabezas, F.J., Plunkett, G. M., et al. 2024. Islands are key for protecting the
world's plant endemism. Nature 634: 868-874. https://doi.org/10.1038/s41586-024-08036-1
Schumacher, E., Kueffer, C., Edwards, P.J., Dietz, H. 2009. Influence of light
and nutrient conditions on seedling growth of native and invasive trees in the
Seychelles. Biological Invasions 11(8): 1941-1954. https://doi.org/10.1007/s10530-008-9371-6
Shi, H., Singh, A., Kant, S., Zhu, Z., Waller, E. 2005. Integrating
habitat status, human population pressure, and protection status into
biodiversity conservation priority setting. Conservation Biology 19(4):
1273-1285. https://doi.org/10.1111/j.1523-1739.2005.00225.x
Simberloff,
D., Von Holle, B. 1999. Positive interactions of
nonindigenous species: invasional meltdown? Biological invasions 1:
21-32. https://doi.org/10.1023/A:1010086329619
Simberloff, D., Martin, J.L., Genovesi, P., Maris, V., Wardle, D.A., Aronson,
J., Courchamp, F., et al. 2013. Impacts of biological invasions: what's what
and the way forward. Trends in Ecology and Evolution 28: 58-66. https://doi.org/10.1016/j.tree.2012.07.013
Soares, F.C., Palmeirim, J. M.,
Rodrigues, A.S., Cardoso, P., de Lima, R.F. 2022. Bird
extinctions and introductions are causing taxonomic and functional
homogenization in oceanic islands. Functional Ecology 36(12):
2892-2905. https://doi.org/10.1111/1365-2435.14196
Sobral, M., Schleuning, M., Cortizas, A.M. 2023. Trait diversity shapes
the carbon cycle. Trends in Ecology & Evolution 38(7): 602-604. https://doi.org/10.1016/j.tree.2023.03.007
Spatz, D.R., Zilliacus, K.M., Holmes, N.D., Butchart, S.H.M., Genovesi,
P., Ceballos, G., Tershy, B.R., Croll, D.A. 2017. Globally threatened
vertebrates on islands with invasive species. Science Advances 3: 1-13.
https://doi.org/10.1126/sciadv.1603080
Spatz, D.R., Holmes, N.D., Will, D.J., Hein, S., Carter, Z.T., Fewster,
R.M., Keitt, B., et al. 2022. The global contribution of invasive vertebrate
eradication as a key island restoration tool. Scientific Reports 12:
1-11. https://doi.org/10.1038/s41598-022-14982-5
Sridhara, S., McConkey, K., Corlett, R.T. 2016. Frugivory and seed dispersal
by large herbivores of Asia. In: Ahrestani, F.,
Sankaran, M. (eds), The ecology of large herbivores
in South and Southeast Asia, pp. 121-150. Springer,
New York, USA. https://doi.org/10.1007/978-94-017-7570-0_5
Stephens, A.E.A., Srivastava, D.S., Myers, J.H. 2013. Strength in numbers?
Effects of multiple natural enemy species on plant performance. Proceedings
of the Royal Society B: Biological Sciences 280: 1-9. https://doi.org/10.1098/rspb.2012.2756
Strauss, S. 1991. Direct, indirect, and cumulative effects of three native
herbivores on a shared host plant. Ecology 72: 543-558. https://doi.org/10.2307/2937195
Strong, D.R. 1992. Are trophic cascades all wet? Differentiation and
donor-control in speciose ecosystems. Ecology 73: 747-754. https://doi.org/10.2307/1940154
Sullivan, L.L.,
Shaw, A.K. 2023. Take me for a ride: Herbivores can
facilitate plant reinvasions. Ecology 104: 1-11. https://doi.org/10.1002/ecy.4132
Thakur, M.P., van der Putten, W.H., Cobben, M.M.P., van Kleunen, M.,
Geisen, S. 2019. Microbial invasions in terrestrial ecosystems. Nature
Reviews Microbiology 17: 621-631. https://doi.org/10.1038/s41579-019-0236-z
Tiffney, B.H.
Mazer, S.J. 1995. Angiosperm growth habit,
dispersal and diversification reconsidered. Evolutionary Ecology 9:
93-117. https://doi.org/10.1007/BF01237700
Tobias, J.A., Sheard, C., Pigot, A.L., Devenish, A.J., Yang, J., Sayol,
F., Neate-Clegg, M.H.C. et al., 2022. AVONET: morphological, ecological and
geographical data for all birds. Ecology Letters 25(3): 581-597. https://doi.org/10.1111/ele.13898
Torres-Santana, C.W.,
Santiago-Valentín, E., Sánchez, Á.T.L., Peguero, B., Clubbe, C. 2010. Conservation status of plants in the Caribbean Island Biodiversity
Hotspot. Proceedings of the 4th Global Botanic Gardens Congress
4: 1-15.
Traveset, A. 2015. Impacto de las especies exóticas sobre las
comunidades mediado por interacciones mutualistas. Ecosistemas 24: 67-75. https://doi.org/10.7818/ECOS.2015.24-1.11
Traveset,
A., Richardson, D.M. 2014. Mutualistic interactions
and biological invasions. Annual Review of Ecology, Evolution, and
Systematics 45: 89-113. https://doi.org/10.1146/annurev-ecolsys-120213-091857
Traveset,
A., Richardson, D.M. 2020. Plant Invasions: The
Role of Biotic Interactions. CAB International, Wallingford, UK.
Traveset, A., Riera, N., Mas, R.E. 2001. Passage
through bird guts causes interspecific differences in seed germination
characteristics. Functional Ecology 15: 669-675. https://doi.org/10.1046/j.0269-8463.2001.00561.x
Traveset, A., Nogales, M.,
Alcover, J.A., Delgado, J.D., López-Darias, M., Godoy, D., Igual, J.M., et al.
2009. A review on the effects of alien rodents in the
Balearic (Western Mediterranean Sea) and Canary islands
(Eastern Atlantic Ocean). Biological Invasions 11:
1653-1670. https://doi.org/10.1007/s10530-008-9395-y
Traveset, A., Heleno, R.H.,
Chamorro, S., Vargas, P., McMullen, C.K., Castro-Urgal, R., Nogales, M., et al.
2013. Invaders of pollination networks in the Galapagos
Islands: emergence of novel communities. Proceedings of the Royal Society B:
Biological Sciences 280: 20123040. https://doi.org/10.1098/rspb.2012.3040
Traveset, A., Chamorro, S.,
Olesen, J.M., Heleno, R. 2015. Space, time and aliens:
charting the dynamic structure of Galápagos pollination networks. AoB Plants
7: plv068. https://doi.org/10.1093/aobpla/plv068
Traveset, A., Tur, C., Trøjelsgaard, K., Heleno, R., Castro-Urgal, R.,
Olesen, J.M. 2016. Global patterns of mainland and insular pollination networks.
Global Ecology and Biogeography 25: 880-890. https://doi.org/10.1111/geb.12362
Tye, A., Soria, M.C., Gardener, M.R.
2002. A strategy for Galapagos weeds. En: Turning
the tide: the eradication of invasive species. IUCN
SSC Invasive Species Specialist Group. IUCN, Gland, Switzerland and
Cambridge, UK.
Valido, A., Rodríguez-Rodríguez,
M.C., Jordano, P. 2019. Honeybees disrupt the structure and
functionality of plant-pollinator networks. Scientific Reports 9: 1-11.
https://doi.org/10.1038/s41598-019-41271-5
Van Der Putten, W.H., Klironomos, J.N., Wardle, D.A. 2007. Microbial ecology of
biological invasions. ISME Journal 1: 28-37. https://doi.org/10.1038/ismej.2007.9
Van Leeuwen, J.F.N., Froyd, C.A., Van Der Knaap, W.O., Coffey, E.E., Tye, A.,
Willis, K.J. 2008. Fossil pollen as a guide to conservation in the Galápagos.
Science 322: 1206. https://doi.org/10.1126/science.1163454
Vilà, M., Hulme, P.E. 2017. Impact of biological invasions on ecosystem
services. Springer International Publishing, Switzerland. https://doi.org/10.1007/978-3-319-45121-3
Villamagna,
A.M., Murphy, B.R. 2010. Ecological and
socio-economic impacts of invasive water hyacinth (Eichhornia crassipes):
A review. Freshwater Biology 55: 282-298. https://doi.org/10.1111/j.1365-2427.2009.02294.x
Violle, C., Navas, M.L., Vile, D., Kazakou, E., Fortunel, C., Hummel, I.,
Garnier, E. 2007. Let the concept of trait be functional!. Oikos
116(5): 882-892. https://doi.org/10.1111/j.0030-1299.2007.15559.x
Vitali, A., Ruiz-Suarez, S.,
Vázquez, D.P., Schleuning, M., Rodríguez-Cabal, M.A., Sasal, Y., Pilosof Id, S.
2023. Invasive species modulate the structure and stability of
a multilayer mutualistic network. Proceedings B 290: 1-9. https://doi.org/10.1098/rspb.2023.0132
Vitousek,
P.M., Walker, L.R. 1989. Biological Invasion by
Myrica Faya in Hawai'i: Plant Demography, Nitrogen Fixation, Ecosystem
Effects. Ecological Monographs 59: 247-265. https://doi.org/10.2307/1942601
Vives, J.A., Baraza, E. 2010.
La cabra doméstica asilvestrada (Capra hircus) en Mallorca ¿Una especie
a erradicar? Galemys 22: 193-205. https://doi.org/10.7325/Galemys.2010.NE.A11
Vizentin-Bugoni, J.,
Tarwater, C.E., Foster, J.T., Drake, D.R., Gleditsch, J.M., Hruska, A.M.,
Kelley, J. P., et al. 2019. Structure, spatial dynamics, and
stability of novel seed dispersal mutualistic networks in Hawai'i. Science
364, 78-82. https://doi.org/10.1126/science.aau8751
Vizentin-Bugoni, J., Sperry, J.H., Kelley, J.P., Gleditsch, J.M., Foster, J.T.,
Drake, D.R., Hruska, A.M., et al. 2021. Ecological correlates of species' roles
in highly invaded seed dispersal networks. Proceedings of the National
Academy of Sciences of the United States of America 118: e2009532118. https://doi.org/10.1073/pnas.2009532118
Vollstädt, M.G., Galetti, M., Kaiser‐Bunbury, C.N., Simmons, B.I.,
Gonçalves, F., Morales‐Pérez, A.L., Navarro, L., et al. 2022. Plant-frugivore interactions
across the Caribbean islands: Modularity, invader complexes and the importance
of generalist species. Diversity and Distributions 28(11): 2361-2374. https://doi.org/10.1111/ddi.13636
Weidenhamer,
J.D., Callaway, R.M. 2010. Direct and indirect
effects of invasive plants on soil chemistry and ecosystem function. Journal
of Chemical Ecology 36: 59-69. https://doi.org/10.1007/s10886-009-9735-0
Weigelt, P., König, C., Kreft, H. 2020. GIFT-A global inventory of floras
and traits for macroecology and biogeography. Journal of Biogeography
47(1): 16-43. https://doi.org/10.1111/jbi.13623
Westoby, M. 2025. Trait‐based ecology, trait‐free ecology, and in between. New Phytologist 245: 33-39. https://doi.org/10.1111/nph.20197
White, E.M., Wilson, J.C., Clarke, A.R. 2006. Biotic indirect effects: a
neglected concept in invasion biology. Diversity and Distributions 12:
443-455. https://doi.org/10.1111/j.1366-9516.2006.00265.x
Whitehead,
S.R., Poveda, K. 2011. Herbivore-induced changes in
fruit-frugivore interactions. Journal of Ecology 99: 964-969. https://doi.org/10.1111/j.1365-2745.2011.01819.x
Whittaker, R.J., Fernández-Palacios, J.M. 2007. Island biogeography:
ecology, evolution, and conservation. Oxford University Press. https://doi.org/10.1093/oso/9780198566113.001.0001
Whittaker, R.J., Rigal, F., Borges, P.A., Cardoso, P., Terzopoulou, S.,
Casanoves, F., Pla, L., et al. 2014. Functional biogeography of oceanic islands
and the scaling of functional diversity in the Azores. Proceedings of the
National Academy of Sciences 111(38): 13709-13714. https://doi.org/10.1073/pnas.1218036111
Wilman, H., Belmaker, J., Simpson,
J., de la Rosa, C., Rivadeneira, M.M., Jetz, W. 2014. EltonTraits 1.0: Species‐level
foraging attributes of the world's birds and mammals: Ecological Archives E095‐178.
Ecology 95(7): 2027. https://doi.org/10.1890/13-1917.1
Wootton, J.T. 1994. The nature and consequences of indirect effects in
ecological communities. Annual Review of Ecology and Systematics 25:
443-466. https://doi.org/10.1146/annurev.ecolsys.25.1.443
Wootton, J.T. 2002. Indirect effects in complex ecosystems: recent progress
and future challenges. Journal of Sea Research 48: 157-172. https://doi.org/10.1016/S1385-1101(02)00149-1
![]() ,
Marta Correia1
,
Marta Correia1 ![]() , Alba Costa1
, Alba Costa1 ![]() , Isabel Donoso3,4
, Isabel Donoso3,4 ![]() , Sandra Hervías-Parejo1
, Sandra Hervías-Parejo1 ![]() , Alejandro Mieles1
, Alejandro Mieles1 ![]() ,
Marta Quitián1
,
Marta Quitián1 ![]() , Maximilian Vollstädt1
, Maximilian Vollstädt1 ![]() , Anna
Traveset1
, Anna
Traveset1 ![]()




