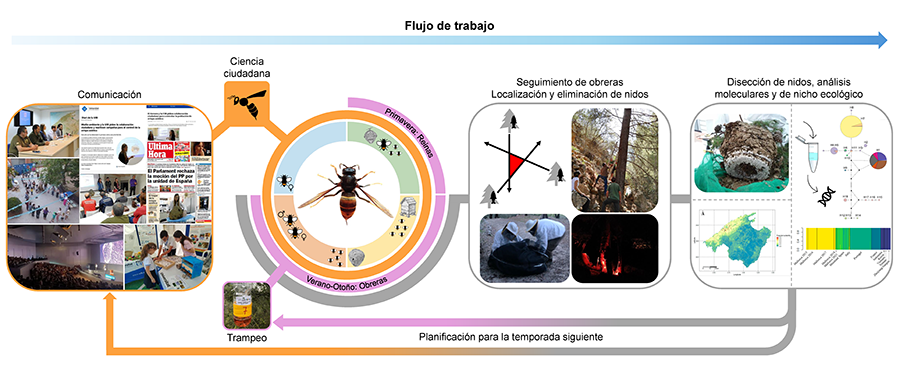
Figura 1. Flujo de trabajo que ilustra la estrategia de erradicación de Vespa
velutina en la isla de Mallorca. El flujo de trabajo incluyó trampeo
(captura de reinas en primavera y detección de adultos), comunicación y el uso
de ciencia ciudadana para la detección, seguimiento de adultos mediante puntos
de alimentación artificiales y localización de nidos mediante métodos de
triangulación, destrucción de nidos mediante métodos mecánicos, y análisis
posteriores.
Figure 1. Workflow
illustrating the eradication strategy of Vespa
velutina on the island of Mallorca. The workflow
included trapping (spring trapping of queens and detection of adults),
communication and the use of citizen science for detection, tracking adults
using artificial feeding points and nest localization using triangulation
methods, nest destruction using mechanical methods and subsequent analyses.
La detección de individuos en
campo mediante trampeo puede dividirse en dos períodos clave: (1) primavera
para la captura de reinas, y (2) verano-otoño para la captura de obreras. El
primer año de detección (octubre de 2015), se realizó un muestreo intensivo de
adultos en un radio de 35 km alrededor del foco inicial de la invasión. Los
siguientes años (2016 – 2020), se instalaron trampas (hechas a mano, Fig. 1) en un área de 486 km2. Concretamente, 72
trampas para obreras en 2016, 79 trampas para reinas y 250 trampas para obreras
en 2017, 561 trampas para reinas y 582 trampas para obreras en 2018, 578
trampas para reinas y mismo número de trampas para obreras en 2019, y 283
trampas para reinas y mismo número de trampas para obreras en 2020. Se
colocaban cada 300 m en puntos accesibles de zonas rurales, urbanas y boscosas,
a alturas de 1.5 - 2 m y se revisaban quincenalmente. Las características del
trampeo (trampeo de reinas u obreras, período, número y tipo de trampas, el
área monitorizada y la densidad de trampas) pueden consultarse en (Leza et al. 2021). Durante la campaña de trampeo para la captura de
reinas de 2017, todos los insectos capturados fueron almacenados para
determinar las tasas de captura de insectos no objetivo (Tabla 1).
La implementación de esta
estrategia de gestión intensiva permitió la captura de 25 reinas mediante
trampas en primavera entre 2015 y 2018 (Leza et al. 2021). Por un lado, en 2017 el trampeo de reinas tuvo un
rendimiento de 0.031 reinas por trampa por semana (0.086 a 0.356 si solo se
tienen en cuenta las trampas positivas). Por otro lado, en 2018 tuvo un
rendimiento de 2.36·10-3 reinas por trampa por semana (0.002 a 0.012
únicamente en trampas positivas). Durante 2019 y 2020 no se capturaron reinas.
Muchos estudios han
argumentado que el trampeo de reinas en primavera es controvertido o incluso
ineficaz, ya que tiene un impacto mínimo en la reducción de las poblaciones de
la especie invasora, representa riesgos para la entomofauna local y puede ser menos
efectivo que la competencia natural entre las fundadoras en primavera (Monceau et al. 2012; Monceau y Thiéry 2016; Rojas-Nossa et al. 2018). Sin embargo, la
experiencia en Mallorca difiere de la invasión en otras islas, como Islas del
Canal (Reino Unido), donde los esfuerzos centrados en el trampeo de reinas y la
localización y destrucción de nidos han conseguido reducir las poblaciones de V.
velutina, aunque sin alcanzar la erradicación completa. En estas islas, la
proximidad al continente europeo permite la llegada continua de nuevas reinas
desde Francia, ya que esta especie es capaz de cruzar distancias marítimas de
entre 15 y 40 km por sus propios medios (Robinet et al. 2019), lo que dificulta el éxito de los programas de
erradicación (Otis et al. 2023). En contraste, la situación geográfica de Mallorca
(ubicada a 176 km del continente) impide la inmigración natural de nuevas
fundadoras. Este aislamiento, combinado con datos que indicaban una baja
densidad poblacional de V. velutina, ofrecía un contexto particularmente
favorable para plantear la erradicación de la especie en la isla y la
implementación del trampeo de reinas.
En
cuanto al trampeo de obreras, se capturaron cinco en 2016, 56 en 2017 y solo
dos en 2018. La última obrera fue capturada el 27 de junio de 2018. En general,
en 2016 se detectaron 0.006 obreras por trampa por semana, y en 2017 se
detectaron 0.037 obreras por trampa por semana. Estos valores oscilan entre
0.001 y 0.055 si solo se consideran las trampas positivas. Se recibieron un
total de 1024 avisos.
Tabla 1. Impacto
del trampeo de primavera de Vespa velutina sobre la entomofauna no diana
en 2017. Número de individuos, porcentaje, clase de dominancia y media con
error estándar de individuos por trampa por mes recolectados. La dominancia de
cada orden se calculó para todo el período de captura de primavera, según (Engelmann 1978): eudominante (40.0 – 100.0 %),
dominante (12.5 – 39.9 %), subdominante (4.0 – 12.4 %), recedente (1.3 – 3.9 %)
y subrecedente (menos de 1.3 %).
Table 1. Vespa velutina spring trapping impact on non-taget entomofauna in 2017. Number of
individuals, percentage, dominance class and mean with standard error of
individuals per trap per month collected during the spring trapping campaign.
Dominance of each order was calculated for all spring trapping period,
according to (Engelmann
1978): eudominant
(40.0 – 100.0%), dominant (12.5 – 39.9%), subdominant (4.0 – 12.4%), recedent
(1.3 – 3.9%), and subrecedent (under 1.3%).
Un total
de 135 012 individuos de entomofauna no diana fueron capturados durante el
trampeo de primavera en 2017 (Tabla 1). De estos, 77.52 %
correspondían a Diptera (104 659), 13.48 % a Hymenoptera (18 201), 6.21 % a
Lepidoptera (8385) y 2.54 % a Coleoptera (3425). El resto de los grupos son
minoritarios, con un porcentaje inferior al 1 %: Neuroptera (211), Araneae
(29), Blattodea (12) y Dermaptera (2). Otros taxones, como arácnidos,
miriápodos, ortópteros y hemípteros, se encontraron en menor cantidad (Tabla 1). Inferior al 0.001 % fueron
individuos de V. velutina (17).
Por otro lado, se llevó a
cabo una importante labor de información comunitaria mediante folletos
informativos y medios de comunicación locales. Además, se habilitó un número de
teléfono disponibles las 24 horas para que los ciudadanos llamaran o enviaran
un mensaje para notificar un posible positivo. En 2016, se desarrolló una
aplicación llamada Vespapp que permitía a los ciudadanos enviar fotos para
detectar individuos o nidos de V. velutina. Una vez recibido un posible
positivo, el panel experto responsable de la aplicación se encargaba de
confirmar o descartar el aviso. Además, los apicultores y 54 agentes
ambientales realizaban observaciones visuales en los colmenares y en zonas
naturales de toda la isla. Es destacable que se enviaron 1024 avisos empleando
Vespapp entre 2016 y 2020 (322 en 2016, 148 en 2017, 300 en 2018, 247 en 2019 y
7 en 2020). El porcentaje de avisos positivos a través de la aplicación fue
inferior al 8 % (4.3 % en 2016, 7.4 % en 2017, 3.3 % en 2018, 0 % en 2019 y 0 %
en 2020), aunque en 2017 el número de informes positivos fue aproximadamente el
doble que en 2016 y 2018. La primavera y el verano fueron las estaciones con
mayor número de avisos, y el menor número de avisos se detectó en invierno. Se
relacionaron todos los picos de avisos con eventos de comunicación (sesiones de
concienciación, noticias en prensa o charlas científicas (Leza et al. 2021)).
Cuando se encuentra un
ejemplar de la especie, el paso siguiente es la detección de los nidos. Para
ello hay que realizar el seguimiento de los avispones. Así, una vez se detectan
ejemplares de V. velutina en una zona, se instalan estaciones abiertas
de cebo proteico (pescado crudo) para monitorear las rutas de vuelo. En
general, se necesitan al menos tres rutas de vuelo partiendo de tres estaciones
de cebo proteico diferentes para localizar los nidos mediante triangulación (Fig. 1). En nuestra experiencia, el seguimiento visual se
realizaba con binoculares, y los nidos, típicamente altos en los árboles, se
eliminaban mecánicamente por la noche (Fig. 1).
La eliminación del nido entero y retirado por la noche es crucial como medida
de gestión de esta especie. Por seguridad, los nidos se colocaban primero en un
saco de contención, luego se embolsaban doblemente en plástico y se congelaban
a -20 ºC durante al menos 48 horas. También es importante realizar revisiones
semanales posteriores para garantizar que los nidos no se reconstruyan (Leza et al. 2021). Es importante destacar que el 58.06 % de los nidos
localizados entre 2016 y 2021 fue gracias a avisos de particulares, poniendo en
relieve el papel clave de la ciudadanía como miembro crucial del equipo de
erradicación (Leza et al. 2021).
En el caso de Mallorca, el
primer nido fue detectado el 30 de octubre de 2015 y eliminado por completo. Al
año siguiente (2016) se localizaron nueve nidos más en la misma zona, y en 2017
veinte nidos más, y nuevamente todos fueron eliminados. Como ya se ha
comentado, el método de eliminación elegido fue la destrucción manual de nidos
durante la noche, una estrategia muy diferente a la de Europa continental (en
donde suelen eliminarse mediante disparos o usando insecticidas). Todos los
nidos se detectaron en especies de árboles de hoja perenne (pinos, encinas y
cipreses comunes) en la Sierra de Tramuntana, una cadena montañosa situada al
noroeste de la isla de Mallorca (3667 km²). En total, se localizaron y
eliminaron 30 nidos secundarios entre 2015 y 2017. En julio de 2018 se detectó
y eliminó un solo nido embrionario, el primer nido embrionario ocupado
localizado de V. velutina en la isla. Entre 2015 y 2017, V. velutina
en Mallorca alcanzó una tasa promedio de propagación de 4.52 ± 0.51 km/año, con
un aumento del área invadida de 33.63 km² en 2016 a 314.53 km² en 2017 (Leza et al. 2021). Un 56.67 % de los nidos secundarios fueron
eliminados antes de la emergencia de machos en otoño, tras revisar cada
individuo dentro de los nidos para distinguir hembras y machos mediante
diferencias morfológicas. En nuestras condiciones mediterráneas, estos nidos
fértiles se recolectaron de septiembre a noviembre, y los machos fueron
detectados ambos años en la misma fecha (21 de septiembre). Todos los nidos
eliminados mecánicamente eran nidos secundarios, excepto el nido embrionario de
2018.
Después de estas
intervenciones, no se detectaron ni ejemplares ni nidos durante dos años
consecutivos, y la especie fue declarada oficialmente erradicada en noviembre
de 2020. Sin embargo, en julio de 2021 gracias al aviso de un ciudadano se
detectó y eliminó un nuevo nido secundario en la isla. De nuevo, y por un
periodo de otros dos años no se detectó la especie en las islas. En el momento
de redactar este documento (año 2024) se habían encontrado nuevos nidos de V.
velutina en la isla. Los resultados de este 2024 no se incluyen en este
documento por falta de tiempo en el análisis de estos.
Análisis complementarios: análisis de nidos, genéticos y
espaciales
Una tarea esencial fue el
trabajo de gabinete y de laboratorio, que se resume en tres tareas principales:
(1) análisis descriptivo de los nidos y determinación de la presencia de
machos; (2) análisis genético para determinar las vías de introducción; y (3)
cuantificación espacial para identificar áreas susceptibles a la invasión (Fig. 1).
Referente al análisis de los
nidos, se incluyó el estudio de la morfología externa de los nidos y la
descripción cuantitativa de la población que incluía. El número de celdas se
estimó con la fórmula de Latter (Latter 1935): N = (3n/2 + 1) · n/2, donde N es el número total de
celdas en una capa del nido y n es el número de celdas contadas a lo largo de
su diámetro máximo. Esta fórmula se extrapoló para estimar el número de huevos,
larvas, pupas y meconios (contenido intestinal eliminado inmediatamente cuando
un individuo muda de estadio larval a pupal. Solo se registró su presencia o
ausencia, indicando que al menos un individuo había emergido) (Herrera et al. 2019). El número de adultos se contó manualmente,
distinguiendo hembras y machos por diferencias morfológicas (el ápice del
último esternito es agudo en las hembras y bilobulado en los machos) (Rome et al. 2015). La Tabla 2
presenta las características de los nidos secundarios eliminados de los árboles
y analizados entre agosto y noviembre de 2016 y 2017. La presencia de machos
indica que las reinas del año siguiente podrían haberse apareado y dispersado;
por ello, las áreas con presencia de machos se designaron como zonas
prioritarias de muestreo para el año siguiente.
Tabla 2.
Estimación del número medio (Χ), mínimo y máximo (Min-Max) de capas,
celdas, individuos, machos e individuos producidos por nido secundario de Vespa
velutina eliminado mecánicamente, de todos los nidos de 2016 y doce nidos
de 2017. N= número de nidos analizados; Sept.= septiembre; Oct.= octubre; Nov.=
noviembre.
Table 2. Mean (Χ), minimum and maximum (Min-Max) estimated numbers of combs,
cells, individuals, males and individuals produced per Vespa velutina secondary nests removed
mechanically, from August to November from all nests in 2016 and twelve nests
in 2017. N= number of nests analysed; Agosto = August; Sept.= September; Oct.= October;
Nov.= November.
Los
análisis genéticos ofrecen información sobre la dinámica de la invasión y sobre
las posibles vías de introducción, lo que resulta especialmente interesante en
el caso de una isla como Mallorca. En el caso de Mallorca, los análisis
realizados de los especímenes recolectados durante la eliminación de nidos se
basaron en marcadores de ADN mitocondrial (cox1) y nuclear (short
tandem repeats, STRs) (Herrera et al. 2024a). Estos
análisis incluyeron poblaciones genotipadas de regiones nativas (provincias
chinas de Yunnan y Zhejiang/Jiangsu, Indonesia y Vietnam) (Arca et al. 2015) y de regiones introducidas, donde la especie se
considera invasora (Corea del sur, Francia, Italia, Portugal y España,
incluyendo la población de las Islas Baleares, concretamente Mallorca) (Arca et al. 2015; Quaresma et al. 2022; Herrera et al. 2024a).
El análisis de ADN
mitocondrial (cox1) mostró que todos los especímenes de Mallorca
compartían un haplotipo mitocondrial común, consistente con el haplotipo
encontrado en otras poblaciones invasoras en Europa y en muestras asiáticas de
Zhejiang/Jiangsu, China (Herrera et al. 2024a). Los
marcadores nucleares (STRs) mostraron mayor diversidad genética en las
poblaciones nativas de Asia en comparación con las europeas, lo que sugiere un
cuello de botella genético típico de poblaciones invasoras con diversidad
restringida, y una reducción en la riqueza alélica a medida que V. velutina
se expandió en Europa (Herrera et al. 2024c).
Los análisis de estructura
poblacional distinguieron claramente las poblaciones asiáticas y europeas, con
subdivisiones genéticas adicionales dentro de Europa (Perrard et al. 2014; Herrera et al. 2024a).
Específicamente, las muestras de Mallorca entre 2015 y 2018 mostraron una
similitud genética con las poblaciones italianas, mientras que las muestras
mallorquinas de 2021 estuvieron más relacionadas con las de la península
ibérica, particularmente Cataluña. Estos resultados sugieren que Mallorca
experimentó dos introducciones separadas de V. velutina, en lugar de una
propagación continua desde una única población originaria. Los dos eventos de
introducción independientes de V. velutina resaltan la necesidad de
mantener la monitorización y aplicar medidas proactivas para prevenir el
establecimiento y la propagación de V. velutina en áreas sensibles. Esta
información resulta clave para anticipar posibles dinámicas de expansión y
orientar las acciones de detección temprana y control, tal como se propone en (Leza et al. 2021).
Aunque los cuellos de botella
suelen reducir el potencial adaptativo y la aptitud, el sistema de apareamiento
poliándrico de V. velutina puede ayudar a mantener la diversidad
genética, favoreciendo el establecimiento a pesar de la variabilidad genética
reducida (Arca et al. 2015; Herrera et al. 2024a). Además, en el
caso de Mallorca, se identificaron múltiples padres por nido, con hasta diez
linajes paternos distintos, lo que podría mitigar los efectos adversos de los
cuellos de botella genéticos y respaldar la resiliencia en contextos de
invasión.
La reducción de la diversidad
genética en el locus sexual aumenta la probabilidad de producir machos
diploides estériles, como se ha observado en otras poblaciones invasoras de V.
velutina (Darrouzet et al. 2015). Los machos
estériles de V. velutina se caracterizan por llevar dos juegos
cromosómicos a los núcleos de sus células en lugar de sólo uno (es decir, son
diploides). Hay casos en los que machos diploides pueden ser fértiles, sin
embargo producen espermatozoides diploides que generan progenie femenina
triploide estéril (Darrouzet et al. 2015). En un
subconjunto de nidos eliminado en Mallorca (7.69 %) se detectó la presencia de
machos diploides. Dado que estos machos no pueden contribuir a la expansión
poblacional, es improbable que los nidos detectados originen nuevas colonias
viables y, en caso de producir descendencia, ésta será estéril, por lo que esta
zona no se considera prioritaria en la campaña de actuación del próximo año.
Por otro lado, los análisis
espaciales permiten identificar los factores ecológicos que determinan las
áreas potencialmente aptas para la invasión. En el estudio de Mallorca se usó
la localización de nidos localizados de V. velutina. Como las invasiones
recientes constituyen un desafío para la aplicación de modelos de nicho
ecológico, aplicamos el enfoque de conjunto de modelos pequeños (ensemble of
small models) (Breiner et al. 2018), junto con variables climáticas, topográficas, y antropogénicas,
para predecir la distribución potencial de V. velutina (Herrera et al. 2023).
Mallorca se caracteriza por
un clima mediterráneo y una geografía diversa que influye en sus ecosistemas
locales. La llegada V. velutina se documentó por primera vez el noroeste
de la isla, una región con características climáticas y geomorfológicas
distintivas, como elevada precipitación (1400–1600 mm anuales) y temperaturas
más frías (temperatura media anual de 16.5°C). Además, la vegetación de esta
área difiere del resto de la isla y ofrece un entorno único que podría haber
facilitado el establecimiento (Leza et al. 2021).
El modelado de nicho
ecológico aplicado es este caso de estudio, reveló que áreas con alta pendiente
del terreno y una baja variación de temperatura a lo largo del año son
idóneas para V. velutina (Herrera et al. 2023). Además, su alta adaptabilidad en diferentes usos del
suelo, desde áreas boscosas hasta tierras agrícolas, demuestra la flexibilidad
de V. velutina y su capacidad para prosperar en diversos hábitats
mediterráneos (Franklin et al. 2017; Carvalho et al. 2020). La idoneidad
en áreas antropizadas también señaló el papel de los paisajes modificados, que
facilitan la dispersión de las especies invasoras al aumentar la perturbación y
la disponibilidad de hábitats (Monceau et al. 2014; Robinet et al. 2017, 2019; Alaniz et al. 2021). Los valores
de idoneidad variaron en toda la isla, destacando que las zonas de la Serra de
Tramuntana ofrecían condiciones adecuadas para la especie (correspondientes al
área bajo un proceso de invasión).
La ausencia de competidores,
depredadores o patógenos puede conducir a un cambio en el nicho realizado de
una especie invasora (Snyder y Evans 2006; Medley 2010). Por ejemplo, V.
velutina fue detectada en Corea del Sur (Asia) y Francia (Europa) en el
mismo periodo, 2003 y 2004 respectivamente (Jung et al. 2008; Villemant et al. 2011b). En Corea del
sur, V. velutina convive con otras seis especies de avispones (entre
ellas Vespa mandarinia, avispón dominante en la competencia por alimento
con otras especies de avispones (Matsuura y Yamane 1990)), frente a una
única especie de avispón (Vespa crabro) en Francia. Por ello, parece que
esta EEI se ha dispersado más rápido en Francia que en Corea del sur (Villemant et al. 2011a).
La existencia de áreas
ecológicamente idóneas para V. velutina, abundancia de una de sus
principales presas (Apis mellifera) y la ausencia de competencia
interespecífica (debido a que no hay especies de avispones nativos ni invasores
en la isla) sugiere que de no haber aplicado una estrategia de detección,
control y erradicación, la propagación de esta EEI en Mallorca podría haber
conducido a un establecimiento generalizado en el noroeste de la isla, como
sugieren estudios previos (Robinet et al. 2019). Entre 2015 y
2017, el aumento en el número de nidos (un nido en 2015, nueve en 2016 y veinte
en 2017), junto con patrones similares observados en otros sitios de invasión,
subraya la rapidez con que puede expandirse en condiciones idóneas (Bertolino et al. 2016; Monceau y Thiéry 2016).
Los hallazgos proporcionaron
información clave sobre cómo esta especie invasora se adapta a climas
mediterráneos, ajustándose rápidamente a nichos ecológicos específicos y
demostrando una capacidad para establecerse en paisajes diversos (Herrera et al. 2023). A pesar de ello, la gestión continua y el monitoreo
de los puntos de entrada, particularmente las rutas marítimas, son esenciales
para mitigar el riesgo de futuras invasiones en Mallorca y otras islas
mediterráneas.
Sistema de detección temprana y respuesta rápida como
medida de post-erradicación
Tras la reintroducción de V.
velutina en 2021, se decidió implementar un programa científico basado en
un sistema de detección temprana y respuesta rápida (DTRR, Early Detection
and Rapid Response en inglés) mediante una red de trampas en Mallorca,
específicamente en áreas asociadas con la entrada y distribución de material
vegetal (Herrera et al. 2024b). Este enfoque
buscó monitorear y mitigar potencialmente la propagación de la especie,
enfocándose en zonas de alto riesgo donde es más probable que ocurran
introducciones. Este sistema DTRR no solo estaba dirigido a V. velutina,
sino también a otras 20 especies de insectos exóticos e invasores (Herrera et al. 2024b).
La metodología consistió en
instalar doce estaciones de trampeo en ubicaciones críticas como puertos y
centros de jardinería, con inspecciones quincenales. Las trampas y atrayentes
utilizados fueron los más específicos disponibles en el mercado para las especies
objetivo, aunque también capturaron accidentalmente insectos no diana. La lista
de insectos diana incluidos y las características del sistema de DTRR se pueden
consultar en (Herrera et al. 2024b). Por ejemplo,
utilizamos VelutinaTrap para la detección de V. velutina, que consiste
en un embudo amarillo, una tapa verde y una base transparente con un
dispositivo dentro de la base que evita que los avispones capturados entren en
contacto con el atrayente alimenticio. Entre julio y diciembre de 2022, la red
registró 2389 capturas de insectos en las trampas de V. velutina, siendo
los himenópteros una proporción significativa.
A través de este sistema, se
detectó la presencia de V. crabro, una especie que no estaba en la lista
inicial de especies objetivo (Herrera et al. 2024b). Nativo de
Eurasia, esta especie no había sido documentada previamente ni en las Islas
Baleares ni en las Islas Canarias. Su detección en un puerto del norte de
Mallorca llevó a las autoridades de gestión de especies exóticas a clasificarla
como una especie potencialmente invasora, por el principio de precaución,
iniciando de inmediato una búsqueda para localizar su nido. La administración
competente localizó y eliminó el nido siguiendo el protocolo aplicado para V.
velutina. Desde entonces no se ha vuelto a detectar a V. crabro en
la isla.
Discusión
Las EEI representan una
amenaza global significativa debido a su impacto en la biodiversidad, el
funcionamiento de los ecosistemas y la sociedad humana (Mazza et al. 2014; Bacher et al. 2018; Carpenter et al. 2018). Se consideran
la segunda mayor causa de pérdida de biodiversidad (IPBES 2023) y son particularmente perjudiciales para los
ecosistemas insulares y las regiones aisladas (Brooke et al. 2007). Desde la década de 1980, la Unión Europea ha
implementado regulaciones preventivas para controlar la propagación de EEI (Genovesi y Shine 2004); sin embargo,
las introducciones accidentales siguen siendo un problema debido a las redes
globales de comercio (Sardain et al. 2019).
En este artículo se destaca
la erradicación de V. velutina en la isla de Mallorca mediante la
búsqueda activa de adultos y nidos y la eliminación física de estos. La
detección temprana fue crucial para minimizar los daños ecológicos, y la
ciencia ciudadana ha demostrado ser inestimable para rastrear la propagación y
presencia de V. velutina (Leza et al. 2021). (Wade et al. 2025) destacan que
la falta de conocimientos entomológicos entre el público y las frecuentes
confusiones en la identificación de especies pueden dificultar la fiabilidad de
los datos proporcionados por la ciencia ciudadana para la gestión efectiva de
especies invasoras. Sin embargo, en (Leza et al. 2021) todos los avisos fueron revisados por expertos
entomólogos, lo que garantiza una mayor fiabilidad en la gestión de la invasión
de V. velutina.
La gestión efectiva de EEI
requiere tanto de una intervención sólida desde la etapa de introducción como
de una estrategia posterior a la erradicación (Blackburn et al. 2011). Aunque la
captura de reinas y la eliminación de nidos pueden reducir significativamente
las poblaciones invasoras de V. velutina en etapas de introducción, el
monitoreo constante es esencial. Esto se evidenció con la reaparición de un
nido de V. velutina en 2021, después de que la especie fuera declarada
erradicada en 2020. Los análisis genéticos confirmaron que se trataba de una
nueva introducción y que los machos hallados en el nido de 2021 eran diploides
y estériles, lo que significaba que el nido no representaba una amenaza
reproductiva (Heimpel y De Boer 2008; Darrouzet et al. 2015), lo cual
sirvió para ajustar las estrategias de gestión futuras.
La evidencia genética señaló
un marcado efecto fundador y cuello de botella en las poblaciones mallorquinas (Herrera et al. 2024a), que, aunque
significativo, no impidió que la especie se dispersara a otras regiones.
Asimismo, los análisis moleculares sugirieron que el transporte mediado por
humanos probablemente facilitó esta dispersión a larga distancia, similar al
caso de la invasión de la hormiga argentina (Linepithema humile Gustav
Mayr, 1868) (que también se determinó que entró por Sóller) a través de rutas
marítimas (Bernard 1956). La predicción de las rutas de invasión es clave para
el control de especies invasoras, por lo que se aplicó un modelo para estimar
hábitats potencialmente adecuados basándose en las ubicaciones de nidos
localizados, identificando áreas vulnerables de la isla para la colonización (Herrera et al. 2023). El nido de 2021 se encontró dentro del hábitat
idóneo para V. velutina en Mallorca, lo que sugiere que, si los machos
no hubieran sido estériles y sin una acción rápida, podría haberse dispersado.
(Robinet et al. 2019) exploraron la dispersión de V. velutina
mediada por el ser humano y concluyeron que las islas mediterráneas no podían
ser colonizadas de forma natural; esta especie invasora solo podría llegar a
ellas mediante una introducción accidental. La probabilidad calculada de
introducir esta EEI en las islas mediterráneas es relativamente baja en este
estudio: en Sicilia fue del 0.925 %, en Cerdeña del 0.206 %, en Mallorca del
0.095 % y en Córcega del 0.032 %. Sin embargo, V. velutina llegó a
Mallorca en dos eventos de introducción independientes (Herrera et al. 2024a), a pesar de la
baja probabilidad de introducción. Ante la nueva detección de V. velutina
en 2024, podría suponer la tercera incursión de esta especie en la isla de
Mallorca.
Este caso resalta la
necesidad de sistemas de DTRR para gestionar invasiones biológicas,
particularmente en entornos insulares ecológicamente sensibles (Herrera et al. 2024b). Por ejemplo,
el trampeo puede constituir una herramienta valiosa para la detección temprana
de V. velutina en ecosistemas insulares, especialmente ante posibles
llegadas recurrentes. Su efectividad como medida de control inicial es
reconocida, aunque su utilidad disminuye como estrategia de erradicación en
poblaciones establecidas (Rojas-Nossa et al. 2018). Además, su aplicación sostenida requiere una
evaluación cuidadosa debido a posibles impactos sobre la entomofauna no diana.
Según estudios previos realizados en diferentes regiones y estaciones del año,
los porcentajes de captura de V. velutina con trampas, en comparación
con la entomofauna no diana, son muy variables (0-70 %), incluso cuando los
nidos alcanzan su tamaño máximo en verano-otoño y las obreras son muy activas
en el campo (Monceau et al. 2012, 2013; Rojas-Nossa et al.
2018). Por ello, debe integrarse en programas de gestión adaptativos y
optimizados, que equilibren eficacia de control y conservación de la
biodiversidad (Leza et al. 2021). Este trabajo enfatiza la importancia de estrategias
coordinadas y proactivas, así como protocolos de bioseguridad, para mitigar las
amenazas de EEI empleando V. velutina como especie modelo. En
colaboración con el gobierno y organizaciones locales, nuestro trabajo destacó
la relevancia de estas acciones coordinadas para la gestión efectiva de
especies invasoras y ofreció ideas para mejorar los métodos de detección y respuesta
para proteger la biodiversidad.
A pesar de los esfuerzos
exitosos de erradicación en las Islas Baleares, la capacidad de la especie para
propagarse entre regiones indica la necesidad de mejorar la coordinación
internacional y los controles fronterizos para prevenir incursiones futuras de V.
velutina. En las islas, las especies invasoras representan un riesgo debido
a la vulnerabilidad inherente de los ecosistemas, lo que hace esencial la
vigilancia en los puntos de entrada. Las redes de colaboración entre naciones
afectadas permitirían respuestas más rápidas y consistentes a nuevas
incursiones, reduciendo los riesgos de reinvasión y mejorando la resiliencia a
largo plazo de los ecosistemas frente a amenazas invasoras.
Contribución de los autores
Cayetano Herrera y Mar Leza Salord: Conceptualización, curación
de datos, análisis formal, obtención de financiamiento, investigación,
metodología, administración del proyecto, desarrollo de software, provisión de
recursos, supervisión, validación, visualización, redacción – borrador original,
redacción – revisión y edición. José A. Jurado-Rivera:
Conceptualización, curación de datos, análisis formal, obtención de
financiamiento, investigación, metodología, administración del proyecto,
desarrollo de software, provisión de recursos, supervisión, validación,
visualización, redacción – revisión y edición.
Disponibilidad de datos y código
Los datos que respaldan la
información contenida en este trabajo están disponibles en artículos
científicos publicados (Leza et al.
2021; Herrera et al. 2023; Herrera et al. 2024a; Herrera et al. 2024b; Herrera et al. 2024c).
Financiación, permisos requeridos, potenciales
conflictos de interés y agradecimientos
Este trabajo ha sido posible
gracias a un contrato predoctoral FPI (FPI_014_2020) de la Conselleria
d'Educació, Universitat i Recerca y postdoctoral Margalida Comas
(POSTDOC2024_4) de la Conselleria d’Educació i Universitats del Govern de
les Illes Balears i por el Fondo Social Europeo +. Este estudio ha contado
con el apoyo de: la Fundación Biodiversidad del Ministerio para la Transición
Ecológica y el Reto Demográfico, a través del proyecto titulado "STOP Vespa
velutina: descifrando de dónde ha llegado y cómo se dispersa para
establecer mecanismos de gestión de esta especie exótica invasora que amenaza a
las abejas", la Direcció General de Recerca, Innovació i Transformació
Digital de la Comunitat Autònoma de les Illes Balears, a través de
fondos de la Ley de la Ecotasa (PDR2020/25 - ITS2017-006), la Conselleria
d'Innovació, Recerca i Turisme del Govern de les Illes Balears
(AAEE47/2015). Este trabajo ha sido cofinanciado por el FEDER, "Una manera
de hacer Europa". Este trabajo contó con el apoyo de Habitissimo y la
Cátedra Santander-UIB.
Los autores/as declaran no
tener ningún conflicto de intereses.
Los autores desean agradecer
a los apicultores y al Museu Balear de Ciències Naturals por su
colaboración. Agradecemos a los Agents Rurals de Catalunya por su ayuda
en las primeras detecciones. Un agradecimiento especial al personal técnico del
grupo de trabajo: Servei de Protecció d'Espècies del Govern de les Illes
Balears, COFIB, Agents de Medi Ambient del Govern de les Illes Balears
y a todos los ciudadanos que nos han apoyado.
El sistema DTRR se llevó a
cabo con la colaboración de la Conselleria d'Agricultura, Pesca i
Alimentació, Conselleria de Medi Ambient i Territori, Centre Forestal de Menut,
AENA, Autoritat Portuària de Balears y Ports de les Illes Balears,
Mercapalma, las empresas Cultivar, Agroilla, Palmafruit y SAO, y los municipios
de Calvià, Manacor y Santa Maria. Los autores están agradecidos por la ayuda
del personal técnico del laboratorio y los estudiantes colaboradores. Sin su
valioso trabajo estos estudios no hubieran podido llevarse a cabo.
Actualmente se enmarca dentro
del proyecto PID2023-149487OA-I00 financiado por
MICIU/AEI/10.13039/501100011033/ y por FEDER/UE.
Referencias
Alaniz, A.J., Carvajal, M.A.,
Vergara, P.M. 2021. Giants are coming? Predicting the
potential spread and impacts of the giant Asian hornet (Vespa mandarinia,
Hymenoptera:Vespidae) in the USA. Pest Management Science 77: 104-112. https://doi.org/10.1002/ps.6063
Arca, M.,
Mougel, F., Guillemaud, T., Dupas, S., Rome, Q., Perrard, A., Muller, F.
et al. 2015. Reconstructing the invasion and the demographic history of
the yellow-legged hornet, Vespa velutina, in Europe. Biological
Invasions 17: 2357-2371. https://doi.org/10.1007/s10530-015-0880-9
Archer, M.E. 2012. Vespine Wasp of the World: Behaviour, Ecology &
Taxonomy of the Vespinae. Penney, D. (ed.), Siri Scientific Press,
Manchester, UK.
Bacher, S., Blackburn, T.M., Essl, F., Genovesi, P., Heikkilä, J.,
Jeschke, J.M., Jones, G. et al. 2018. Socio-economic impact classification
of alien taxa (SEICAT). Methods in Ecology and Evolution 9: 159-168. https://doi.org/10.1111/2041-210X.12844
Barbet-Massin, M., Salles, J.M., Courchamp, F. 2020. The economic cost of control
of the invasive yellow-legged Asian hornet. NeoBiota 55: 11-25. https://doi.org/10.3897/NEOBIOTA.55.38550
Beggs, J.R., Brockerhoff, E.G., Corley, J.C., Kenis, M., Masciocchi, M.,
Muller, F., Rome, Q., Villemant, C. 2011. Ecological effects and management of
invasive alien Vespidae. BioControl 56: 505-526. https://doi.org/10.1007/s10526-011-9389-z
Bernard, F. 1956. Remarques sur le
peuplement des Baléares en Fourmis. Bulletin de la Société d'Histoire
Naturelle de l'Afrique du Nord 47, 254-266.
Bertolino, S., Lioy, S.,
Laurino, D., Manino, A., Porporato, M. 2016. Spread of the
invasive yellow-legged hornet Vespa velutina (Hymenoptera: Vespidae) in
Italy. Applied Entomology and Zoology 51: 589-597. https://doi.org/10.1007/s13355-016-0435-2
Blackburn, T.M., Pyšek, P., Bacher, S., Carlton, J.T., Duncan, R.P., Jarošík,
V., Wilson, J.R.U. et al. 2011. A proposed unified framework for biological
invasions. Trends in Ecology and Evolution 26: 333-339. https://doi.org/10.1016/j.tree.2011.03.023
Blondel, J., Aronson, J., Bodiou, J.-Y., Boeuf, G. 2010. The
Mediterranean Region: Biological Diversity in Space and Time. Oxford
University Press Inc., Oxford, New York, USA.
Breiner, F.T., Nobis, M.P., Bergamini, A., Guisan, A. 2018. Optimizing
ensembles of small models for predicting the distribution of species with few
occurrences. Methods in Ecology and Evolution 9: 802-808. https://doi.org/10.1111/2041-210X.12957
Broennimann, O., Treier, U.A., Müller-Schärer, H., Thuiller, W., Peterson,
A.T., Guisan, A. 2007. Evidence of climatic niche shift during biological
invasion. Ecology Letters 10: 701-709. https://doi.org/10.1111/j.1461-0248.2007.01060.x
Brooke, M. de L., Hilton, G.M., Martins, T.L.F. 2007. Prioritizing the
world’s islands for vertebrate-eradication programmes. Animal Conservation
10: 380-390. https://doi.org/10.1111/j.1469-1795.2007.00123.x
Carpenter, J.K., Kelly, D., Moltchanova, E., O’Donnell, C.F.J. 2018.
Introduction of mammalian seed predators and the loss of an endemic flightless
bird impair seed dispersal of the New Zealand tree Elaeocarpus dentatus.
Ecology and Evolution 8: 5992-6004. https://doi.org/10.1002/ece3.4157
Carvalho, J., Hipólito, D., Santarém, F., Martins, R., Gomes, A., Carmo, P.,
Rodrigues, R. et al. 2020. Patterns of Vespa velutina invasion in
Portugal using crowdsourced data. Insect Conservation and Diversity 13:
501-507. https://doi.org/10.1111/icad.12418
Dana, E.D., García-de-Lomas, J., Verloove, F., Vilà, M. 2019. Common
deficiencies of actions for managing invasive alien species: A decision-support
checklist. NeoBiota 112: 97-112. https://doi.org/10.3897/neobiota.48.35118
Darrouzet, E., Gévar, J.,
Guignard, Q., Aron, S. 2015. Production of early diploid males
by European colonies of the invasive hornet Vespa velutina nigrithorax. PLoS
ONE 10: 1-9. https://doi.org/10.1371/journal.pone.0136680
Engelmann, H.-D. 1978. Zur Dominanzklassifizierung von Bodenarthropoden. Pedobiologia
18: 378-380. https://doi.org/10.1016/j.toxicon.2009.08.005
Franklin, D.N., Brown, M.A., Datta, S., Cuthbertson, A.G.S., Budge, G.E.,
Keeling, M.J. 2017. Invasion dynamics of Asian hornet, Vespa velutina
(Hymenoptera: Vespidae): a case study of a commune in south-west France. Applied
Entomology and Zoology 52: 221-229. https://doi.org/10.1016/s0031-4056(23)00612-1
García-Díaz, P., Ross, J. V., Ayres, C., Cassey, P. 2015. Understanding the
biological invasion risk posed by the global wildlife trade: Propagule pressure
drives the introduction and establishment of Nearctic turtles. Global Change
Biology 21: 1078-1091. https://doi.org/10.1007/s13355-016-0470-z
Genovesi, P.,
Shine, C. 2004. European strategy on invasive
alien species: Convention on the Conservation of European Wildlife and Habitats
(Bern Convention). https://doi.org/10.1111/gcb.12790
de Haro, L., Labadie, M., Chanseau, P., Cabot, C., Blanc-Brisset, I.,
Penouil, F. 2010. Medical consequences of the Asian black hornet (Vespa
velutina) invasion in Southwestern France. Toxicon 55:
650-652.
Haxaire, J., Tamisier, J.-P.,
Bouguet, J.-P. 2006. Vespa velutina Lepeletier, 1836, une redoutable
nouveauté pour la faune de France (Hym., Vespidae). Bulletin de la Société
entomologique de France 111: 194-194.
Heimpel, G.E., De Boer,
J.G. 2008. Sex determination in the hymenoptera. Annual
Review of Entomology 53: 209-230. https://doi.org/10.1146/annurev.ento.53.103106.093441
Herrera, C., Marqués, A., Colomar, V., Leza, M.M. 2019. Analysis of the secondary nest of the yellow-legged hornet found in
the Balearic Islands reveals its high adaptability to Mediterranean isolated
ecosystems. In: Veitch, C.R., Clout, M.N., Martin, A.R., Russel, J.C., West,
C.J. (eds.), Island invasives: scaling up to meet the challenge. Proceedings
of the international conference on island invasives 2017, pp. 375-380.
International Union for Conservation of Nature (IUCN), Gland, Switzerland.
Herrera, C., Jurado-Rivera, J.A.,
Leza, M. 2023. Ensemble of small models as a tool for alien
invasive species management planning: evaluation of Vespa velutina
(Hymenoptera: Vespidae) under Mediterranean island conditions. Journal of
Pest Science 96: 359-371. https://doi.org/10.1007/s10340-022-01491-7
Herrera, C., Ferragut, J.F., Leza, M., Jurado-Rivera, J.A. 2024a. Invasion genetics of the yellow ‑ legged hornet Vespa velutina
in the Westernmost Mediterranean archipelago. Journal of Pest Science
97: 645-656. https://doi.org/10.1007/s10340-023-01680-y
Herrera, C., Hervías-Parejo, S., Traveset, A., Leza, M. 2024b. First detection of a potentially invasive species using a
multi-threat early detection trap network. Biological Invasions
26: 365-370. https://doi.org/10.1007/s10530-023-03197-y
Herrera, C., Pinto, M.A., Leza,
M., Alemany, I., Jurado-Rivera, J.A. 2024c. Niche modelling
and landscape genetics of the yellow-legged hornet (Vespa velutina): An
integrative approach for evaluating central–marginal population dynamics in
Europe. Ecology and Evolution 14: 1-11. https://doi.org/10.1002/ece3.70029
Ikegami, M., Tsujii, K., Ishizuka, A., Nakagawa, N., Kishi, S., Sakamoto,
Y., Sakamoto, H. et al. 2020. Environments, spatial structures, and species
competitions: determining the impact of yellow-legged hornets, Vespa
velutina, on native wasps and bees on Tsushima Island, Japan. Biological
Invasions 22: 3131-3143. https://doi.org/10.1007/s10530-020-02314-5
IPBES. 2023. Thematic Assessment Report on Invasive Alien Species and their
Control of the Intergovernmental Science-Policy Platform on Biodiversity and
Ecosystem Services. Roy, H.E., Pauchard, A., Stoett, P., Renard Truong, T.
(eds.), IPBES secretariat, Bonn, Germany.
Jackson, S.T.,
Sax, D.F. 2010. Balancing biodiversity in a
changing environment: extinction debt, immigration credit and species turnover.
Trends in Ecology and Evolution 25: 153-160. https://doi.org/10.1016/j.tree.2009.10.001
Jung, C., Kim, D., Lee, H.-S., Baek, H. 2008. Some biological
characteristics of a new honeybee pest, Vespa velutina nigrithorax
Buysson 1905 (Hymenoptera: Vespidae). Korean Journal of Apiculture 24:
61-65.
Latter, O.H. 1935. A reason for the order in which the queen wasp
constructs the cells of the comb, a method for computing the number of cells in
a comb, and an instance of the limitation of the instincts of wasps. Proceedings
of the Royal Entomological Society of London 10: 74-78.
Laurino, D., Lioy, S., Carisio,
L., Manino, A., Porporato, M. 2020. Vespa velutina: An alien driver of honey bee colony losses. Diversity
12: 1-15. https://doi.org/10.3390/D12010005
Leza, M., Herrera, C., Picó, G.,
Morro, T., Colomar, V. 2021. Six years of controlling the
invasive species Vespa velutina in a Mediterranean island: The promising
results of an eradication plan. Pest Management Science 77: 2375-2384. https://doi.org/10.1002/ps.6264
Lueje, Y.R., Jácome, M.A., Servia,
M.J. 2024. New problems for old vineyards: Mitigating the
impacts of yellow-legged hornets (Vespa velutina) in a historical
wine-producing area. Agriculture, Ecosystems and Environment 367: . https://doi.org/10.1016/j.agee.2024.108969
Matsuura,
M., Yamane, S. 1990. Biology of the Vespine
Wasps. Springer-Verlag, Berlin, Germany.
Mazza, G., Tricarico, E., Genovesi, P., Gherardi, F. 2014. Biological
invaders are threats to human health: An overview. Ethology Ecology and
Evolution 26: 112-129. https://doi.org/10.1080/03949370.2013.863225
Medley, K.A. 2010. Niche shifts during the global invasion of the Asian
tiger mosquito, Aedes albopictus Skuse (Culicidae), revealed by
reciprocal distribution models. Global Ecology and Biogeography 19:
122-133. https://doi.org/10.1111/j.1466-8238.2009.00497.x
Monceau, K.,
Thiéry, D. 2016. Vespa velutina nest
distribution at a local scale: An 8-year survey of the invasive honeybee
predator. Insect Science
0: 1-12. https://doi.org/10.1111/1744-7917.12331
Monceau, K., Bonnard, O., Thiéry, D. 2012. Chasing the queens of the alien
predator of honeybees: A water drop in the invasiveness ocean. Open Journal
of Ecology 02: 183-191. https://doi.org/10.1007/s10340-013-0537-3
Monceau, K., Maher, N., Bonnard, O., Thiéry, D. 2013. Predation pressure
dynamics study of the recently introduced honeybee killer Vespa velutina:
Learning from the enemy. Apidologie 44: 209-221. https://doi.org/10.1007/s13592-012-0172-7
Monceau, K., Bonnard, O., Thiéry, D. 2014. Vespa velutina: A new
invasive predator of honeybees in Europe. Journal of Pest Science 87:
1-16. https://doi.org/10.4236/oje.2012.24022
Nave, A., Godinho, J., Fernandes, J., Garcia, A.I., Ferreira Golpe,
M.A., Branco, M. 2024. Vespa velutina: a menace for Western Iberian fruit production. Cogent Food and
Agriculture 10 (1). https://doi.org/10.1080/23311932.2024.2313679
Otis, G.W., Taylor, B.A., Mattila, H.R. 2023. Invasion potential of
hornets (Hymenoptera: Vespidae: Vespa spp.). Frontiers in Insect Science
3: 1-21. https://doi.org/10.3389/finsc.2023.1145158
Paini, D.R., Sheppard, A.W., Cook, D.C., De Barro, P.J., Worner, S.P.,
Thomas, M.B. 2016. Global threat to agriculture from invasive species. Proceedings
of the National Academy of Sciences of the United States of America 113:
7575-7579. https://doi.org/10.1073/pnas.1602205113
Pedersen, S., Kennedy, P.J., O’Shea-Wheller, T.A., Poidatz, J., Christie,
A., Osborne, J.L., Tyler, C.R. 2025. Broad ecological threats of an invasive
hornet revealed through a deep sequencing approach. Science of the Total
Environment 970: 178978. https://doi.org/10.1016/j.scitotenv.2025.178978
Pejchar, L.,
Mooney, H.A. 2009. Invasive species, ecosystem
services and human well-being. Trends in Ecology and Evolution 24:
497-504. https://doi.org/10.1016/j.tree.2009.03.016
Perrard, A., Arca, M., Rome, Q.,
Muller, F., Tan, J., Bista, S., Nugroho, H. et al. 2014. Geographic
variation of melanisation patterns in a hornet species: Genetic differences,
climatic pressures or aposematic constraints? PLoS ONE 9: 1-16. https://doi.org/10.1371/journal.pone.0094162
Peterson,
A.T., Robins, C.R. 2003. Using Ecological-Niche
Modeling to Predict Barred Owl Invasions with Implications for Spotted Owl
Conservation. Conservation Biology 17: 1161-1165. https://doi.org/10.1046/j.1523-1739.2003.02206.x
Quaresma, A., Henriques, D., Godinho, J., Gmaside, X., Bortolotti, L.,
Pinto, M.A. 2022. Invasion genetics of the Asian hornet Vespa velutina nigrithorax
in Southern Europe. Biological Invasions 24: 1479-1494. https://doi.org/10.1007/s10530-022-02730-9
Requier, F., Rome, Q., Chiron, G.,
Decante, D., Marion, S., Menard, M., Muller, F. et al. 2019. Predation of the invasive Asian hornet affects foraging activity and
survival probability of honey bees in Western Europe. Journal of Pest
Science 92: 567-578. https://doi.org/10.1007/s10340-018-1063-0
Robinet, C., Suppo, C., Darrouzet, E. 2017. Rapid spread of the invasive
yellow-legged hornet in France: the role of human-mediated dispersal and the
effects of control measures. Journal of Applied Ecology 54: 205-215. https://doi.org/10.1111/1365-2664.12724
Robinet, C., Darrouzet, E., Suppo, C. 2019. Spread modelling: a suitable
tool to explore the role of human-mediated dispersal in the range expansion of
the yellow-legged hornet in Europe. International Journal of Pest Management
65: 258-267. https://doi.org/10.1080/09670874.2018.1484529
Rojas-Nossa,
S. V., Calviño-Cancela, M. 2020. The invasive hornet Vespa velutina affects pollination of a
wild plant through changes in abundance and behaviour of floral visitors. Biological
Invasions 22: 2609-2618. https://doi.org/10.1007/s10530-020-02275-9
Rojas-Nossa, S. V., Novoa, N.,
Serrano, A., Calviño-Cancela, M. 2018. Performance of baited
traps used as control tools for the invasive hornet Vespa velutina and
their impact on non-target insects. Apidologie 49: 872-885. https://doi.org/10.1007/s13592-018-0612-0
Rojas-Nossa, S. V.,
O’Shea-Wheller, T.A., Poidatz, J., Mato, S., Osborne, J., Garrido, J. 2023. Predator and pollinator? An invasive hornet alters the pollination
dynamics of a native plant. Basic and Applied Ecology 71: 119-128. https://doi.org/10.1016/j.baae.2023.07.005
Rome, Q., Muller, F.J., Touret-Alby, A., Darrouzet, E., Perrard, A.,
Villemant, C. 2015. Caste differentiation and seasonal changes in Vespa
velutina (Hym.: Vespidae) colonies in its introduced range. Journal of
Applied Entomology 139: 771-782. https://doi.org/10.1111/jen.12210
Sardain, A., Sardain, E., Leung, B. 2019. Global forecasts of shipping
traffic and biological invasions to 2050. Nature Sustainability 2:
274-282. https://doi.org/10.1038/s41893-019-0245-y
Snyder, W.E.,
Evans, E.W. 2006. Ecological effects of invasive
arthropod generalist predators. Annual Review of Ecology, Evolution, and
Systematics 37: 95-122. https://doi.org/10.1146/annurev.ecolsys.37.091305.110107
Traveset,
A., Richardson, D.M. 2006. Biological invasions as
disruptors of plant reproductive mutualisms. Trends in Ecology and Evolution
21: 208-216. https://doi.org/10.1016/j.tree.2006.01.006
Traveset,
A., Richardson, D.M. 2014. Mutualistic interactions
and biological invasions. Annual Review of Ecology, Evolution, and
Systematics 45: 89-113. https://doi.org/10.1146/annurev-ecolsys-120213-091857
Traveset, A., Escribano-Avila,
G., Gómez, J.M., Valido, A. 2019. Conflicting selection on Cneorum
tricoccon (Rutaceae) seed size caused by native and alien seed dispersers. Evolution
73: 2204-2215. https://doi.org/10.1111/evo.13852
Turchi, L.,
Derijard, B. 2018. Options for the biological and
physical control of Vespa velutina nigrithorax (Hym.: Vespidae)
in Europe: A review. Journal of Applied Entomology 142: 553-562. https://doi.org/10.1111/jen.12515
Vilà, M., Espinar, J.L., Hejda, M., Hulme, P.E., Jarošík, V., Maron,
J.L., Pergl, J. et al. 2011. Ecological impacts of invasive alien plants:
A meta-analysis of their effects on species, communities and ecosystems. Ecology
Letters 14: 702-708. https://doi.org/10.1111/j.1461-0248.2011.01628.x
Villemant, C., Barbet-Massin, M., Perrard, A., Muller, F., Gargominy, O.,
Jiguet, F., Rome, Q. 2011a. Predicting the invasion risk by the alien
bee-hawking Yellow-legged hornet Vespa velutina nigrithorax across
Europe and other continents with niche models. Biological Conservation
144: 2142-2150. https://doi.org/10.1016/j.biocon.2011.04.009
Villemant, C., Muller, F., Haubois, S. 2011b. Bilan des travaux (MNHN
et IRBI) sur l’invasion en France de Vespa velutina, le frelon asiatique
prédateur d’abeilles. Journée Scientifique Apicole 3-12.
Wade, L.C., Russell, F.J., Aranha, A.L., Knight, M.E., Ellis, J.S. 2025.
The influence of climate on the invasion of the Asian hornet (Vespa velutina)
to Guernsey, Channel Islands: citizen science and misidentified aliens. Journal
of Insect Conservation 29: 3-8. https://doi.org/10.1007/s10841-024-00637-5
![]() , José A.
Jurado-Rivera2
, José A.
Jurado-Rivera2 ![]() , Mar Leza1,*
, Mar Leza1,* ![]()
