Ácaros mesostigmátidos parásitos
de aves
Mesostigmata G.
Canestrini, 1891 es un grupo de ácaros relevante dentro de los Parasitiformes
debido al gran número de especies descritas, como a las diversas funciones
ecológicas que desempeñan (Radovsky 1994; Walter
y Proctor 2013). Hasta el año
2013, el número total de especies de ácaros mesostigmátidos reportadas ha sido
de 12 017, con una estimación de 71 000 a 138 000 especies (Walter y Proctor
2013). Entre los ácaros
mesostigmátidos, la mayoría son predadores de vida libre, otros son fitófagos o
fungívoros, mientras que algunos grupos establecen asociaciones simbióticas de
distinto tipo con otros animales, tanto artrópodos como vertebrados (Lindquist et al. 2009).
El parasitismo de ácaros mesostigmátidos en vertebrados se
encuentra, con pocas excepciones, dentro de la superfamilia Dermanyssoidea
Kolenati, 1859 (Dowling 2006). La mayoría de los
linajes parásitos de este grupo son considerados parásitos externos, con
excepción de ciertos linajes asociados al sistema respiratorio de aves
(Rhinonyssidae Trouessart, 1895 y ciertas especies de Dermanyssidae Kolenati,
1859; Fain y Lukoschu 1979 y lepidosaurios
(ciertas especies de Laelapidae Berlese, 1892 y Entonyssidae Ewing, 1923; Fain 1961), y sistema respiratorio y canal auditivo de
mamíferos (Halarachnidae Oudemans, 1906; Radovsky 1969).
El origen del parasitismo en Dermanyssoidea aún no está
claro. Se plantea que el estado plesiomórfico es de vida libre, sin embargo,
análisis filogenéticos demuestran que el parasitismo podría haber surgido muy
temprano en el grupo, y luego repetidas veces a lo largo de su evolución (Dowling y O’Connor 2010). De acuerdo con sus
características anatómicas, los representantes de Dermanyssoidea están
pre-adaptados para el parasitismo, dado que los quelíceros en grupos basales de
vida libre presentan diferencias muy sutiles con respecto a los de vida
parásita, habiendo sido únicamente necesario en el curso de su evolución el
contacto con un potencial hospedador para alimentarse de sus tejidos (Dowling 2015). Asimismo, también se ha especulado que el
parasitismo de vertebrados en este grupo posiblemente haya surgido a partir de
ácaros de vida libre que ocupaban el microhábitat del nido de vertebrados (Radovsky 1969). Muchas de las especies de vida libre
en los linajes donde también se encuentran especies con un estilo de vida
parasitario son, de hecho, nidícolas. Por ejemplo, dentro de una misma familia,
como es el caso de algunos ácaros de la familia Laelapidae, es posible
encontrar especies con diferentes estilos de vida, desde vida libre, a
parásitas facultativas y parásitas obligadas (Dowling 2006;
De Moraes 2022).
El cuerpo de las aves y sus nidos constituyen el hábitat de
un sinnúmero de ácaros de distintos grupos y han representado un modelo para el
estudio de las relaciones parásito-hospedador (Proctor
y Owens 2000). En especial, la relación entre ácaros parásitos
mesostigmátidos y aves ha sido ampliamente estudiada en el pasado. En
particular, este grupo ha cobrado relevancia en lo que respecta a las aves de
corral en sistemas productivos.
Parasitismo por ácaros mesostigmátidos en aves de corral
de Sudamérica
En las aves domésticas, los ácaros mesostigmátidos
ectoparásitos hematófagos han sido ampliamente estudiados en los ambientes
relacionados a la producción avícola de Gallus gallus domesticus
Linnaeus, 1758, dada la alta rentabilidad económica y distribución a nivel
mundial de su producción (ej. Axtell y Arends 1990;
Sparagano et al. 2009; Murillo
y Mullens 2017; Sparagano y Ho 2020). De
hecho, este tipo de producción animal es la de mayor expansión en las últimas
décadas (FAO 2024). En particular, los sistemas
comerciales de batería de jaulas para la producción de huevos son de gran
interés, posiblemente por la permanencia de las aves en un mismo recinto por un
largo periodo de tiempo, lo que permite un considerable crecimiento de la
población de ácaros (Axtell y Arends 1990). Las
especies de ácaros parásitos más comúnmente reportadas en sistemas comerciales
alrededor del mundo son el ácaro rojo de las gallinas, Dermanyssus gallinae
De Geer, 1778 (Mesostigmata: Dermanyssidae), la cual predomina en sistemas de
producción europeos y asiáticos (Wang et al. 2010; Sparagano et al. 2014), y el ácaro de las aves del
norte, Ornithonyssus sylviarum Canestrini y Fanzago, 1877 (Mesostigmata:
Macronyssidae), la cual es más comúnmente hallada en aves de corral de América
del Norte (Murillo y Mullens 2017). En Asia
también pueden hallarse ácaros del género Ornithonyssus, tanto O.
sylviarum como el ácaro de las aves tropicales, Ornithonyssus bursa
Berlese 1888 (Mesostigmata: Macronyssidae), dependiendo la zona geográfica y el
tipo de producción (Sparagano y Ho 2020).
Ornithonyssus bursa era la única especie reportada en
aves de corral de Brasil (Reis et al. 1934; Vas 1935) y Argentina (Da Fonseca
1947), hasta que, en la década de 1970, O. sylviarum y D.
gallinae fueron reportadas en granjas comerciales de gallinas ponedoras de
Brasil (Oliveira 1972; Pereira
et al. 1977; Faccini y Massard 1974; Faccini 1987; Tucci et al. 1998).
Puede que estas dos últimas especies cosmopolitas actualmente predominen al
menos en sistemas comerciales de producción de huevos de Argentina y Brasil (Doti y Muzureta 1989; Horn et
al. 2018; Corbalán et al. 2019; Arce et al. 2020), habiendo reemplazado parcialmente a O.
bursa. Sin embargo, al menos en Brasil, nuevos estudios continúan
reportando la presencia de O. bursa en gallinas en sistemas de
producción comercial de huevos (Oliveira et al. 2020).
En Sudamérica, actualmente las tres especies han sido reportadas en relación a
granjas de aves de corral (Tabla A1; Fig. 1): O.
bursa en Argentina y Brasil (ej. Reis et al. 1934;
da Fonseca 1947), y O. sylviarum y D.
gallinae en Argentina, Brasil y Colombia (ej. Reis 1939;
Mauri 1965; Faccini y
Massard 1974; Doti y Muzureta 1989; Marín-Gómez y Benavides-Montaño 2007;
Torres y Hernández 2018). Si consideramos
otras aves domésticas, D. gallinae ha sido también reportada en canarios
(Serinus canaria Linnaeus, 1758) en Brasil y Argentina (Fonseca 1938; Roveda y
Ringuelet 1947), y O. sylviarum en canarios de Brasil (Faccin y Leite 1991). Los canarios también son
hospedadores del ácaro nasal Sternostoma tracheacolum (Rhinonyssidae) en
Brasil y Chile (Tabla A1; Fain y Hyland 1962; González-Hein
et al. 2007).
Los ciclos de vida son cortos en ácaros dermanísidos (8-9
días en condiciones de laboratorio) y, en especial, en macronísidos (5-7 días
en condiciones de laboratorio), estos últimos con un rápido desarrollo de
deutoninfa a adultos sin necesidad de alimentarse (Sikes y Chamberlain 1954). Esto lleva a que
en sistemas de producción las cargas parasitarias por individuo pueden llegar a
ser muy altas (Matthysse et al. 1974). De
acuerdo con estudios realizados en Norteamérica con O. sylviarum, los
ácaros son capaces de generar una reducción en el conteo de glóbulos rojos (Matthysse et al. 1974) y en la masa corporal de sus
hospedadores (DeVaney 1979). En lotes de gallinas
con una intensidad parasitaria elevada de ácaros mesotigmátidos parásitos,
estudios tanto en Norteamérica como en Europa han llegado a la conclusión de
que las pérdidas económicas pueden ser importantes al reducir la producción y el
tamaño de los huevos, y aumentar el consumo de agua y alimento (DeVaney 1979; Mullens et al.
2009; Sigognault Flochlay et al. 2017).
En consecuencia, la infestación por ácaros mesostigmátidos parásitos lleva a
una reducción en la conversión de alimento (Mullens et
al. 2009). Además, a través de su alimentación, los ácaros inducen la
activación inmune causando inflamación, irritación, anemia y, rara vez, la
muerte (Mullens et al. 2009; Owen
et al. 2009).
El conocimiento de los efectos de ácaros mesostigmátidos en
gallinas ponedoras es conocida a partir de granjas infestadas por O.
sylviarum en Estados Unidos (DeVaney 1979; Mullens et al. 2009) y por D. gallinae en el
norte de Europa (Sigognault Flochlay et al.
2017; Pavićević et al. 2021). Sin embargo, es
poco lo que se investiga sobre otros sistemas, como de recría, pollo parrillero
y aves de traspatio, así como también en sistema de cría de otras aves
distintas a las gallinas. En Sudamérica, la falta de conocimiento es aún más
marcada, y poco se conoce de los efectos en la producción de cualquier tipo.
Debido a diferencias entre distintos puntos geográficos en lo que respecta al
ambiente, el clima, los sistemas productivos, las líneas genéticas de aves
usadas, la comunidad de artrópodos en los recintos, entre otros, es necesario
establecer si las consecuencias de las infestaciones por ácaros halladas en el
norte global difieren de lo que sucede en Sudamérica. Puede que estas
infestaciones no sean relevantes para la producción en cuanto a pérdidas
económicas o, por el contrario, se podría estar ignorando un aspecto clave que
esté llevando a mayores pérdidas económicas de las que se asume.
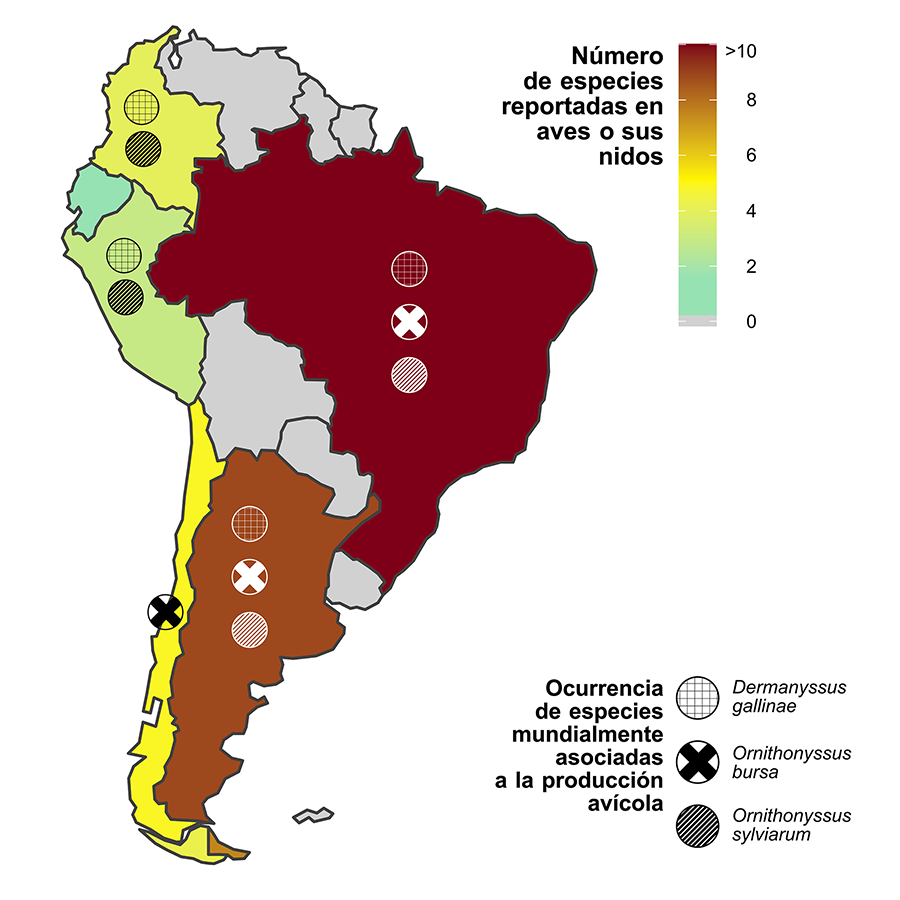
Figura
1. Número de especies
reportadas de ácaros mesostigmátidos hematófagos parásitos en aves o sus nidos
(Tabla
A1) y ocurrencia de
las tres especies de mayor relevancia para la producción avícola (se incluyen
los casos reportados en humanos) por país en Sudamérica.
Figure 1. Number of reported species of
hematophagous mesostigmatid mites parasitizing birds or their nests (Table
A1),
and occurrence of the three species most relevant to poultry production
(including cases reported in humans) by country in South America.
Los factores asociados a una mayor o menor abundancia de
ácaros en gallinas de producción de huevos han sido escasamente estudiados en
Sudamérica, a excepción de un estudio reciente realizado en Argentina sobre O.
sylviarum (Arce et al. 2022). Este estudio arrojó
como resultado, por ejemplo, diferencias en el patrón de estacionalidad de la
abundancia de O. sylviarum con respecto a estudios realizados en el
hemisferio norte, resaltando así la importancia de generar conocimiento a nivel
local. Hallar cuáles son los factores relacionados a la abundancia de ácaros en
la producción avícola podría asistir a un plan holístico de control poblacional
de este parásito que reemplace el uso de insecticidas potencialmente tóxicos y
poco eficaces (Yazwinski et al. 2005; Sigognault Flochlay et al. 2017; Decru et al. 2020), a los que los ácaros han
desarrollado resistencia (Mullens et al. 2004), y
cuyo uso actualmente se intenta restringir legalmente. Según Rezende (2013), el control de ácaros en granjas de
gallinas ponedoras en Brasil se ha basado tradicionalmente en el uso de
pesticidas como carbamatos, piretroides y organofosfatos, en un contexto de
escasa regulación sobre los residuos de estos compuestos en los huevos. No
obstante, los estudios sobre el uso y la efectividad de pesticidas químicos
contra ácaros mesostigmátidos hematófagos en Sudamérica siguen siendo limitados
(ej. Doti y Muzureta 1989; Hamann 1990). En línea con la tendencia a nivel mundial
de encontrar alternativas más seguras para el alimento, el ambiente y la salud
ocupacional de los trabajadores en los establecimientos de cría de aves de
corral, recientemente se han comenzado a reportar en la región evaluaciones
sobre la efectividad de métodos de control alternativos, como tierra de
diatomeas (Alves et al. 2020), extractos de plantas
(ej. Morrone et al. 2001; Soares
et al. 2008; Schmidt et al. 2025) u hongos
entomopatógenos (Kasburg et al. 2016).
Pese a que O. bursa es considerada actualmente de
menor importancia en sistemas comerciales de aves de corral de Sudamérica, esta
especie podría tener una mayor relevancia en aves de corral de traspatio
(‘free-range’). En estos sistemas, el aislamiento de las aves respecto a su
entorno es de menor medida con respecto a sistemas comerciales, por lo cual su
interacción con hospedadores silvestres, en los que O. bursa predomina
(ver debajo), es mayor. Sin embargo, la posibilidad de que las aves realicen
baños de tierra en este tipo de cría también aumenta las posibilidades de que
las mismas puedan eliminar parásitos como O. sylviarum, especie que está
mayor tiempo sobre el hospedador (Kirkwood 1963).
Este comportamiento, no obstante, no sería efectivo para reducir las
infestaciones por D. gallinae, ya que esta especie habita mayormente en
rajaduras y su alimentación se produce de noche (Kirkwood
1963; Chauve 1998). En este tipo de cría, en un
estudio en Brasil se halló que la diversidad de la acarofauna es mayor que en
recintos comerciales, pero que la intensidad parasitaria es menor (Horn et al. 2016). Es aún poco lo que se conoce sobre la
acarofauna en sistemas de cría de aves de corral de traspatio, en el mundo y en
Sudamérica. En esta última región, así como en otras zonas geográficas donde el
ingreso per cápita es reducido, la cría de traspatio cobra mayor relevancia
como método de subsistencia en zonas rurales, ya que permite un acceso continuo
a alimentos (González Ortiz 2014).
Parasitismo por ácaros mesostigmátidos en aves
silvestres de Sudamérica
A nivel mundial la
diversidad de ácaros mesostigmátidos parásitos en aves silvestres es mayor que
la hallada en aves de corral, comprendiendo no solo las familias Macronyssidae
Oudemans, 1936 y Dermanyssidae, sino también Laelapidae y Rhinonyssidae (Proctor y Owens 2000). Estas cuatro familias de ácaros se hallan en
Sudamérica, siendo las más frecuentemente reportadas en asociación con aves
silvestres Macronyssidae y Rhinonyssidae, mientras que Dermanyssidae y
Laelapidae parecen ser excepcionales (Tabla A1). El país con mayor cantidad de especies de ácaros mesostigmátidos
parásitos de aves reportadas a partir de muestras obtenidas de aves o sus nidos
es, por amplia diferencia, Brasil, con 123 especies (Tabla A1; Fig. 1). Le siguen Argentina, con nueve especies
reportadas, Chile con cinco, Colombia con cuatro, Perú con tres y por último
Ecuador, únicamente con una especie (Tabla A1; Fig. 1). Una de las especies más comúnmente reportada es
O. bursa, siendo hallada en diversos taxones de aves de Brasil y
Argentina (ej. Arrabal
et al. 2012; Santillán et al. 2015; Silva et al. 2018a; Tabla A1). Incluso ha sido reportada en aves introducidas en Chile (Briceño et al. 2021; Oyarzún-Ruiz et al. 2021; Tabla A1).
Los representantes de Rhinonyssidae son parásitos obligados
que se alimentan de la sangre de sus hospedadores, y se encuentran en los
conductos nasales de aves no ratites (Knee y Proctor
2010). Este es un grupo diverso en cuanto al número de especies, con 510
especies reportadas hasta 2011, en comparación con las 233 especies reportadas
de Macronyssidae y las 26 especies de Dermanyssidae (Zhang
2011). En Sudamérica, hay algunos reportes de representantes de
Rhinonyssidae en Chile y Argentina, pero la mayoría provienen principalmente de
Brasil (Tabla A1). En este último país los
reportes alcanzan un total de 116 especies, mientras que en Chile son cuatro y
en Argentina dos, sin ningún reporte hallado en el resto de los países
sudamericanos. Es posible que el desbalance en el número de especies reportadas
entre países se deba al esfuerzo de ciertos autores en áreas geográficas
particulares (ej. Amaral 1968; Fain y Aitken 1968; 1969;
1971; Amaral y
Reboucas 1974), lo que evidencia una disparidad en la investigación de este
grupo entre los distintos países.
Una familia adicional de ácaros mesostigmátidos reportados
en aves de Colombia es Protodinychidae Evans, 1957, representada por un
espécimen de Protodinychus sp. Evans, 1957 colectado de periquito
bronceado obtenido de decomisos (Brotogeris jugularis Müller, 1776; Parra-Henao et al. 2009). Protodinychidae pertenece
a Uropodina Kramer, 1881, un grupo de ácaros edáficos de vida libre, a
excepción de uno de sus estadios ninfales el que suele ser forético en
artrópodos y, rara vez, en pequeños vertebrados (Lindquist
et al. 2009). Algunas especies de ácaros pertenecientes a Uropodina son
considerados nidícolas, estando asociados al ambiente del nido de vertebrados,
entre ellos las aves (Bloszyk et al. 2006). Dado a
que el reporte de esta especie de ácaro se basa en la ocurrencia de un solo
espécimen en una muestra de ave obtenida a partir de un decomiso, de la que se
desconoce su procedencia, puede que el ácaro se haya encontrado en el ambiente,
y no estar asociada directamente con el ave.
En cuanto a estudios sobre la ecología de ácaros
mesostigmátidos de Sudamérica, los mismos son aun sumamente escasos. Los
conocimientos actuales se circunscriben a algunos pocos estudios enfocados en
datos epidemiológicos de especies de ácaros en distintos hospedadores como, por
ejemplo, la prevalencia de O. bursa en comunidades de aves silvestres de
Argentina (ej. Arrabal et al. 2012; Santillán et al. 2015), o la prevalencia de distintas
especies de ácaros nasales (Rhinonyssidae) en anátidas del sur de Brasil (Sinkoc et al. 2016). También en Brasil se ha comparado
la diversidad de ácaros mesostigmátidos en nidos de aves silvestres en
distintos tipos de ambientes (Silva et al. 2018a).
Otros estudios realizados en el centro de Argentina ahondaron en los factores
que inciden en la abundancia de O. bursa en ciertas especies de aves
paseriformes, como la especie o la edad del hospedador, entre otros (Arce et al. 2018), y en la abundancia y co-infestación de
distintos ectoparásitos, entre ellos ácaros laelapidios, en el estrígido Athene
cunicularia Molina, 1782 (Sáez-Ventura et al.
2022).
Quizás el aspecto menos explorado en la relación
parásito-hospedador entre ácaros mesostigmátidos y aves silvestres en
Sudamérica, con respecto a otras regiones del mundo, es el efecto que ocasionan
en sus hospedadores. Los estudios en la región son muy escasos y superficiales,
únicamente centrados en ácaros nasales. Hasta el momento se ha analizado el
efecto directo de ácaros nasales del género Sternostoma Berlese y
Trouessart, 1889 sobre los tejidos de los hospedadores (Bassini-Silva et al. 2019a), así como la
enfermedad respiratoria causada por Sternostoma tracheacolum Lawrence,
1948 sobre un grupo de aves exóticas en cautiverio (González-Hein
et al. 2007). No obstante, en Sudamérica no hay aún estudios que se centren
en efectos sobre la biología reproductiva de las aves y su fitness. En lo que
respecta a estudios de este tipo en otras regiones del mundo, los mismos
revelan que el parasitismo por parte de ácaros mesostigmátidos puede tener un
efecto deletéreo en las aves, aunque los resultados obtenidos son poco
consistentes. De acuerdo con algunos estudios, los ácaros mesostigmátidos
tienen un efecto significativo sobre la condición (ej. Moreno
et al. 2002), el peso (ej. Møller 1990; Stoehr et al. 2000; Eisner
Pryor y Casto 2015), el tamaño (ej. Moreno et al.
1999; Moreno et al. 2002; Eisner Pryor y Casto 2015), el nivel de
hematocrito (ej. Stoehr et al. 2000; Szabó et al. 2002), la reacción del sistema inmune (ej. Szabó et al. 2002), los niveles de estrés (ej. Lobato et al. 2005), la supervivencia (ej. Møller 1990; Moreno et al. 1999),
entre otras factores relacionados al desarrollo de los polluelos de aves en los
nidos (ej. Møller 1990; López-Arrabé
et al. 2012). Sin embargo, otras investigaciones no detectaron efectos de
relevancia (ej. Powlesland 1977; Johnson y Albrecht 1993; Pacejka et al. 1998; Szabó et
al. 2002), quizás a expensas de una compensación por parte de los padres (Johnson y Albrecht 1993). Dado que el efecto
de los ácaros en sus hospedadores silvestres es altamente variable, y
posiblemente dependa de diversos factores, resulta de particular relevancia
comprender cómo estos parásitos pueden afectar el fitness y la salud de las
aves en la región sudamericana en el contexto de su particular comunidad de
aves y diversidad de nidos, las variables ambientales y condiciones climáticas
de la región, y las posibles interacciones con el ensamble de parásitos
internos y externos que albergan dichos hospedadores. También es interesante
explorar las nuevas relaciones parásito-hospedador que surgen como resultado de
la posible introducción de ácaros mesostigmátidos a nuevos ambientes, ya sea
desde aves domésticas (ver debajo), por o por la introducción de aves exóticas
provenientes de otra región (Briceño et al. 2021).
Posibles eventos de ‘spillover’ y ‘spillback’ entre aves
silvestres y de corral en Sudamérica
Tradicionalmente las aves silvestres han sido consideradas
una fuente posible de ácaros mesostigmátidos para las aves de corral (Mullens et al. 2004). Se las ha señalado como las
responsables de trasladar ácaros de importancia económica entre lotes de
gallinas dentro de una misma granja, así como también, entre distintas granjas;
e incluso como posibles responsables de producir infestaciones y reinfestaciones
en los recintos. Estudios previos han hallado una variedad de resultados. Según
Øines y Brännström (2011), en especímenes de D.
gallinae colectados en Suecia de aves silvestres y de gallinas ponedoras
las distancias genéticas halladas entre los hospedadores no apoyan la hipótesis
de un movimiento de ácaros entre ambos hospedadores. También mediante técnicas
moleculares, Roy y Buronfosse (2011) hallaron
que las aves silvestres no parecen ser la fuente de D. gallinae en
granjas comerciales de gallinas ponedoras en Europa y Australia. De acuerdo con
una investigación llevada a cabo en Estados Unidos en base a técnicas
moleculares usando marcadores microsatélites, en una de las tres granjas bajo
estudio había intercambio de O. sylviarum entre las aves silvestres y
las gallinas ponedoras (McCulloch et al. 2020).
En Sudamérica, un estudio realizado en el sur de Brasil
reveló que las aves silvestres del ambiente de las granjas comerciales de aves
de corral eran parasitadas por O. bursa, pese a que en las gallinas
únicamente se halló O. sylviarum (Horn et al. 2018).
Similar es el caso de un estudio realizado en granjas de gallinas ponedoras del
centro de Argentina, donde en gallinas se halló únicamente O. sylviarum
(Arce et al. 2020). Asimismo, las aves silvestres que
habitaban dichas granjas, tanto polluelos como adultos, también eran
parasitadas por O. sylviarum, entre otras especies de ácaros. Análisis
moleculares mostraron que O. sylviarum presentes en aves de corral y
silvestres presentaban idéntico haplotipo de ARNr 16S (Arce et al. 2020), lo cual sugiere un posible intercambio
entre estos distintos hospedadores. Esta evidencia también se ve respaldado por
el hecho de que O. sylviarum no ha sido hallada en aves silvestres en
ambientes naturales cercanos a dichas granjas (Arrabal
et al. 2012; Arce et al. 2018). Ornithonyssus
sylviarum también ha sido reportado en palomas de la ciudad de Lima en Perú
(Téllez et al. 2008) y en jote de cabeza negra (Coragyps
atratus Bechstein, 1793) nidificando en cercanía a granjas comerciales de
aves de corral en el sur de Brasil (Serafini et al.
2003).
La distribución de O. sylviarum está principalmente
ligada a regiones templadas (Murillo y Mullens
2017). El hecho de que los reportes de esta especie en Sudamérica han sido
siempre en relación con ambientes antrópicos y la producción de aves de corral
sugiere su introducción en algún momento a la región, produciéndose un
‘spillback’ de aves de corral a aves silvestres. Sin embargo, queda aún por
esclarecer si su presencia en aves silvestres de Sudamérica precede a la
introducción de aves de corral.
Similar es el caso de D.
gallinae que, de acuerdo con los reportes publicados, parece estar
relacionada a aves de corral, canarios utilizados como mascotas y palomas
domésticas (Columba livia Gmelin, 1789) introducidas en Sudamérica (ej. Fonseca 1938; Roveda y Ringuelet 1947; Tabla A1). Curiosamente, también se ha hallado D. gallinae en C.
atratus en el área metropolitana de la ciudad de Bucamaranga, al nordeste
de Colombia, mismo hospedador silvestre que O. sylviarum en Brasil (Villalobos-Moreno
et al. 2020). También se ha
reportado D. gallinae en Falco sparverius Linnaeus, 1758, Bubo
virginianus Gmelin, 1788 y Pulsatrix perspicillata Latham, 1790 de
Perú (Hinostroza
Fernández 2013). Sin embargo, la
recolección de los ácaros en este último estudio ha sido realizada en
condiciones de cautiverio, sin quedar clara la procedencia original de las aves
y sus parásitos. Por lo tanto, no puede descartarse una infestación desde otras
aves domésticas. Se especula que el mismo proceso de introducción de O.
bursa puede haber sucedido en Europa, cuyos reportes de esta especie
provienen únicamente de ciertos puntos geográficos del continente, en
asociación a zonas rurales y urbanas (Castelli et al. 2015). Es interesante destacar, no obstante, que Roy y Buronfosse
(2011) hallaron hibridación de las
poblaciones de D. gallinae de aves silvestres y gallinas ponedoras de
Brasil de acuerdo con el marcador genético citocromo oxidasa I (COI). Se
encontró que los haplotipos provenientes de aves silvestres y de gallinas son
más similares entre sí en Brasil que las comparaciones realizadas con muestras
de Australia y Francia. Sus resultados también indican un escenario complejo de
posibles múltiples eventos de introducción de D. galllinae al país.
Para llegar a conclusiones más certeras sobre el intercambio
de O. bursa, O. sylviarum y D. gallinae entre aves
silvestres y de corral es necesario profundizar sobre el análisis de los ácaros
provenientes de ambos tipos de hospedadores a un nivel poblacional (McCulloch et al. 2020). Es también necesario
continuar indagando sobre la presencia de O. sylviarum y D. gallinae en
aves silvestres por fuera de los ambientes productivos y urbanos. Asimismo, aún
queda por conocer cuán frecuente es el intercambio de estos ácaros entre las
aves de corral y las silvestres, así como las implicancias para estos
hospedadores y los sistemas productivos.
Gamasoidosis y ácaros mesostigmátidos como vectores de
agentes patógenos en Sudamérica
Los ácaros pueden ingresar a zonas habitadas por humanos
cuando las aves que los hospedan construyen sus nidos en cercanía a ingresos de
edificaciones o sistemas de ventilaciones, como aire acondicionado o ventanas.
Los ácaros O. bursa, O. sylviarum y D. gallinae pueden ser
parásitos accidentales de mamíferos (Miller y Price
1977), y pueden ocasionalmente intentar alimentarse de humanos (Bellanger et al. 2008; Sioutas
et al. 2021). Las infestaciones por estos ácaros en humanos generan una
enfermedad dermatológica a la que se refiere como gamasoidosis. Las lesiones
generadas por los ácaros al alimentarse pueden ser dolorosas y generar prurito,
eczema, pápulas enrojecidas, entre otros síntomas de dermatitis (McClain et al. 2009).
Aunque la gamasoidosis es aún una afección ampliamente
ignorada por los trabajadores de la salud y la literatura médica, ha habido
reportes de infestaciones de ácaros en humanos en la región de Sudamérica desde
la década de 1980. Hasta el momento estos reportes provienen únicamente de
Brasil (ej. Guimarães et al. 2001; Wambier y Wambier 2012; Bassini-Silva et al. 2019b; 2022; Pavan 2022;
revisión por Mesquita-Sousa et al. 2020),
Argentina (ej. Mauri y de Alzuet 1978; Mauri y Mosquera 1985; Semenas y Angaut Rocha 1998; Oxilia et al. 2021) y Perú (Téllez
et al. 2008). Los ácaros asociados a los casos de gamasoidosis en
Sudamérica han sido identificados como O. bursa (ej. Semenas y Angaut Rocha 1998; Wambier y Wambier 2012; Bassini-Silva et al. 2022), O. sylviarum
(ej. Téllez et al. 2008; Teixeira
et al. 2020), D. gallinae (ej. Mauri y
de Alzuet 1978; de Oliveira
Alves y Filho 2018; Minagawa et al. 2024) y Dermanyssus
sp. (Téllez et al. 2008); sin embargo, los mismos no
son siempre identificados hasta nivel de especie (ej. Oxilia
et al. 2021). Asimismo, en muchos de los casos reportados se infiere la
especie de ave hospedadora de los ácaros solo en base a la presencia de nidos
en cercanías de zonas de ventilación o por el uso de la estructura de la
edificación afectada (ej. O. bursa de nidos de Columbina minuta
Linnaeus, 1766 y Thraupis palmarum Wied, 1821 en Bassini-Silva et al. 2022; O. bursa del
nido de Furnarius rufus Gmelin, 1788 en Mentz et
al. 2015; D. gallinae del nido de Zenaida auriculata en Minagawa et al. 2024), aunque en algunos casos la
identificación del ave resulta más elusiva (ej. O. sylviarum y Dermanyssus
sp. de nido de palomas en Téllez et al. 2008, restos
de nido de paloma en Oxilia et al. 2021). Dado que
los ácaros hematófagos pueden generar gamasoidosis en humanos, su presencia en
granjas de gallinas ponedoras representa un potencial problema de salud para
los trabajadores de dicho sector (George et al. 2015;
Teixeira et al. 2020).
Las infestaciones de ácaros en humanos son de particular
relevancia dado que existe evidencia a nivel mundial que señala a los ácaros
mesostigmátidos como posibles vectores de virus y bacterias patogénicas.
Algunos de los microorganismos reportados incluyen agentes patógenos para
humanos y animales, como los virus de encefalitis equina del este, encefalitis
equina del oeste, y encefalitis de St. Louis en D. gallinae, O. bursa
y O. sylviarum, la bacteria causante de la fiebre Q (Coxiella
burnetti), de la listeriosis (Listeria monocytogenes), de la
erisipeloides (Erysopelothrix rhusiopathiae), entre otros patógenos, en D.
gallinae (ej. Durden et al. 1993; Valiente Moro et al. 2005; Mullen y O’Connor 2009; Chaisiri
et al. 2015). Algunos de los patógenos cuya presencia se ha asociado a
ácaros mesostigmátidos son causantes de enfermedades ampliamente distribuidas
en establecimientos de aves de corral, como la enfermedad de Newcastle (Arzey 1990), la espiroquetosis (Reshetnikov
1967) o la salmonelosis (Cocciolo et al. 2020).
Queda aún mucho por explorar sobre el rol ecológico de los
ácaros mesostigmátidos como transmisores de agentes patógenos a nivel mundial,
y en particular, en Sudamérica. Los escasos estudios hasta el momento en esta
región se han centrado únicamente en O. bursa colectados de aves
silvestres, y han arrojado resultados negativos para virus Alphavirus,
Flavivirus y Bunyaviales (Santillán et al. 2015) y
para las bacterias Rickettsia da Rocha-Lima, 1916, Bartonella
Strong et al. 1915 y Borrelia Swellengrebel, 1907 (Lareschi et al. 2017). Lareschi
et al. (2017) hallaron que muestras de O. bursa eran positivas para Wolbachia
Hertig, 1936, una bacteria endosimbionte que no es zoonótica y que puede
alterar la reproducción en invertebrados. Recientemente, un estudio exhaustivo
realizado en Brasil halló una diversa flora bacterial asociada a D. gallinae
provenientes de un establecimiento comercial de gallinas ponedoras del sur de
Brasil y a O. bursa asociados a un caso de gamasoidosis en la región
sudeste de Brasil (Belleboni et al. 2024). Entre
ellas se destaca la presencia de diferentes genotipos de Bartonella en
ambas especies de ácaros, una bacteria asociada a enfermedades infecciosas en
humanos. También se hallaron bacterias endosimbiontes como Wolbachia y Spiroplama
Saglio et al. 1973 en O. bursa, aunque no se pudo confirmar la
presencia de Salmonella en ninguna de las dos especies de ácaros.
Discusión y conclusiones
La diversidad y ecología de los ácaros mesostigmátidos
parásitos y su interacción con las aves silvestres y de corral está aun
insuficientemente explorada, en particular en Sudamérica. Hasta el momento, son
pocos los países en los que se ha reportado su identificación de acuerdo con
nuestro conocimiento. Es notable, a su vez, la falta de información de ciertos
países y regiones geográficas del continente, así como la concentración de
reportes de representantes de Rhinonyssidae en Brasil, lo que evidencia la
inequidad en cuanto a la generación de conocimiento entre los distintos países
de la región. Del total de 13 países que constituyen el continente
sudamericano, únicamente se hallan reportes de ácaros mesostigmátidos parásitos
de aves en 6 países (46%) (ej. Fain 1964; Amaral 1968; Parra-Henao et
al. 2009; Arrabal et al. 2012; Silva et al. 2018a; Tabla A1).
Las evidencias de posibles eventos de ‘spillover’ y
‘spillback’ entre aves silvestres y de corral, que aún no han sido
esclarecidos, resaltan la complejidad de las interacciones entre ambientes
naturales y antrópicos. Aún se requieren estudios detallados que aborden
aspectos moleculares, poblacionales y ecológicos para comprender mejor estos
procesos (Horn et al. 2018; Arce et
al. 2020). Sus implicancias son aún más relevantes al considerar la
potencialidad de los ácaros mesostigmátidos, en particular los hematófagos,
como vectores de bacterias y virus patógenos (Valiente
Moro et al. 2005; Chaisiri et al. 2015; Belleboni et al. 2024). Esto cobra mayor importancia
en zonas geográficas como Sudamérica, donde podrían ser parte del ciclo
epidemiológico de enfermedades desatendidas, tales como las rickettsiosis,
bartonellosis, salmonelosis, entre otras, que son prevalentes en el continente
sudamericano (ej. Seijo et al. 2007; Minick 2014; Rosso et al. 2023).
De las particularidades del continente en cuanto a prácticas
agropecuarias podrían surgir diferencias con relación a la epidemiología de los
ácaros en aves de corral, con respecto a resultados hallados en otras partes
del mundo. Siendo Sudamérica uno de los continentes con la mayor diversidad de
especies de aves del mundo (Lepage 2025), es
indiscutible la relevancia que cobra el estudio de sus parásitos, y es evidente
que su conocimiento es aún insuficiente. Estas investigaciones contribuirían al
conocimiento de la relación parásito-hospedador entre ácaros mesostigmátidos y
aves, lo cual aportaría al conocimiento de la biodiversidad de la región.
Profundizar en el estudio de los ácaros mesostigmátidos parásitos es también de
relevancia para la salud pública, dado que esta información sería útil para
implementar medidas de prevención y control en la producción avícola y en
ambientes sinantrópicos, donde la salud humana puede verse afectada.
Contribución de los autores
Sofía I. Arce: Conceptualización, Redacción – borrador
original, Redacción – revisión y edición; María José Saravia-Pietropaolo:
Redacción – borrador original, Redacción – revisión y edición; Valeria
Corbalán: Redacción – borrador original, Redacción – revisión y edición;
Marcela Lareschi: Redacción – borrador original, Redacción – revisión y
edición.
Financiación, permisos requeridos, potenciales
conflictos de interés y agradecimientos
Agradecemos a los editores del monográfico ‘Ecología del
ectoparasitismo’, Jorge Garrido-Bautista, Santiago Merino y Francisco
Castaño-Vázquez, por su invitación a participar del mismo.
Los autores declaran no tener conflictos de interés.
Disponibilidad de datos
Este artículo no ha usado datos.
Referencias
Alves, L.F.A., De Oliveira,
D.G.P., Pares, R.B., Sparagano, O.A.E., Godinho, R.P. 2020. Association
of mechanical cleaning and a liquid preparation of diatomaceous earth in the
management of poultry red mite, Dermanyssus gallinae (Mesostigmata:
Dermanyssidae). Experimental and Applied Acarology 81(2), 215-222. https://doi.org/10.1007/s10493-020-00497-z
Amaral, V. 1962a. Sternostoma augei n. sp. (Acarina: Rhinonyssidae
Vitz.,1935) e identificação das espécies Rhinoecius bisetosus
Strandtmann, 1952 e Rhinoecius grandis Strandtmann, 1952. Arquivos
do Instituto Biológico 29, 69-81.
Amaral, V. 1962b. Rallinyssoides
trappi n. sp. (Acarina: Rhinonyssidae Vitz.1935) parasita da saracura-sana
(Ortygonyx nigricans (Vieillot). Arquivos do Instituto Biológico
29, 185-191.
Amaral, V. 1963. Notas sobre ácaros
nasais com a descrição de uma nova espécie (Acarina: Rhinonyssidae Vitz, 1935).
Arquivos do Instituto Biologico 30, 103-108.
Amaral, V. 1968. Notas sobre ácaros
nasais com a descrição de duas novas espécies: Ptilonyssus zeferinoi n.
sp. e Sternostoma clementei n. sp. (Acarina: Rhinonyssidae). Lista das
espécies descritas no Brasil e seus hospedeiros. Arquivos do Instituto
Biológico 35(3), 107-126.
Amaral, V. 1973a. Três espécies
novas de rinoníssideos pertencentes ao gênero Ptilonyssus Berlese &
Trouessart, 1889 (Mesostigmata: Rhinonyssidae). Arquivos do Instituto
Biológico 40, 109-127.
Amaral, V. 1973b. Três espécies
novas de rhinonissídeos de aves brasileiras (Acari: Rinonyssidae). Arquivos
do Instituto Biológico 40, 209-226.
Amaral, V. 1973c. Descrição de
duas espécies novas de acaros nasais (Rhinonyssidae: 457 Mesostigmata).
Arquivos do Instituto Biológico 40, 67-77.
Amaral, V., Baquer, S.R.
1963. Tinaminyssus chiarellii n. sp. (Acarina: Rhinonyssidae Vitz, 1935)
parasita da gralha-do-mato (Cyanocorax chrysops chrysops). Arquivos
do Instituto Biológico 30, 65-67.
Amaral, V., Rebouças,
M.M. 1974. Notas sobre ácaros rinonissídeos de aves brasileiras (Mesostigmata:
Rhinonyssidae). O Biológico 40, 52-56.
Aramburú, R., Calvo, S.,
Alzugaray, M.E., Cicchino, A. 2003. Ectoparasitic load of monk
parakeet (Myiopsitta monachus, Psittacidae) nestlings. Ornitologia
Neotropical 14, 415-418.
Arce, S.I., Manzoli, D.E.,
Saravia-Pietropaolo, M.J., Quiroga, M.A., Antoniazzi, L.R., Lareschi, M.,
Beldomenico, P.M. 2018. The tropical fowl mite, Ornithonyssus
bursa (Acari: Macronyssidae): environmental and host factors associated
with its occurrence in Argentine passerine communities. Parasitology
Research 117, 3257-3267. https://doi.org/10.1007/s00436-018-6025-1
Arce, S.I., Monje, L.D.,
Antoniazzi, L.R., Sosa, C.C., Fasano, A.A., Quiroga, M.A., Lareschi, M., et al.
2020. Mesostigmatid mites (Acari: Mesostigmata) at the
domestic-wildlife interface: poultry and passerine birds of central Argentina. Veterinary
Parasitology 284, 109203. https://doi.org/10.1016/j.vetpar.2020.109203
Arce, S.I., Antoniazzi, L.R.,
Fasano, A.A., Manzoli, D.E., Gomez, M., Sosa, C.C., Quiroga, M.A., et al. 2022.
Factors associated with prevalence and intensity of the
northern fowl mite (Ornithonyssus sylviarum) in commercial poultry farms
of Argentina. Parasitology Research 121(5), 1281-1293. https://doi.org/10.1007/s00436-022-07484-w
Arrabal, J.P., Manzoli, D.E., Antoniazzi, L.R., Lareschi, M., Beldomenico,
P.M. 2012. Prevalencia del ácaro Ornithonyssus bursa Berlese,
1888 (Mesostigmata: Macronyssidae) en un ensamble de aves (Passeriformes) de
bosques del centro de la Provincia de Santa Fe, Argentina. Revista
Ibero-latinoamericana de Parasitología 71, 172-178.
Arzey, G. 1990. Mechanism of spread of Newcastle disease. Technical
bulletin—New South Wales, Agriculture and Fisheries 42, Sydney.
Axtell, R.C.,
Arends, J.J. 1990. Ecology and management of
arthropod pests of poultry. Annual Review of Entomology 35, 101-126.
Bassini-Silva, R., Jacinavicius, F.D.C., Pereira, J.S., Werther, K., Spicer,
G.S., Barros-Battesti, D.M. 2019a. Parasitism of the nasal mite Sternostoma
tracheacolum Lawrence, 1948 (Mesostigmata: Rhinonyssidae) in captive birds
in Brazil. Revista Brasileira de Parasitologia Veterinária 28,
754-759. https://doi.org/10.1590/S1984-29612019053
Bassini-Silva, R.,
Jacinavicius, F.D.C., Hernandes, F.A., Ochoa, R., Bauchan, G.R., Dowling, A.P.,
Barros-Battesti, D.M. 2019b. Dermatitis in humans caused by Ornithonyssus
bursa (Berlese 1888) (Mesostigmata: Macronyssidae) and new records from
Brazil. Revista Brasileira de Parasitologia Veterinária 28,
134-139. https://doi.org/10.1590/S1984-296120180097
Bassini-Silva, R.,
Jacinavicius, F.D.C., Joppert, A.M., Dowling, A.P.G., Barros-Battesti, D.M.
2019c. New host association and locality record for Pellonyssus
gorgasi Yunker and Radovsky, 1966 (Mesostigmata: Macronyssidae) in the
state of São Paulo, Brazil. International Journal of Acarology 45(4),
235-237. https://doi.org/10.1080/01647954.2019.1604801
Bassini-Silva, R., Castro-Santiago, A.C., Calchi, A.C., Perles, L., Takatsu,
J.C., Alencar, I.D.C.C., Ochoa, R., et al. 2022. Sleeping
with the enemy: case reports of Ornithonyssus bursa (Berlese, 1888)
(Mesostigmata: Macronyssidae) causing human dermatitis in Brazil. Parasitology
Research 121, 2641-2649. https://doi.org/10.1007/s00436-022-07589-2
Bellanger, A.P., Bories, C., Foulet, F., Bretagne, S., Botterel, F. 2008.
Nosocomial dermatitis caused by Dermanyssus gallinae. Infection
Control and Hospital Epidemiology 29(3), 282-283. https://doi.org/10.1086/528815
Belleboni, T., Bassini-Silva, R., Sulzbach, A., Scherer, A.L., Trebien, E.C.,
Schneider, M., Cesca, F., et al. 2024. Pathogenic and
endosymbiotic bacteria associated with the ectoparasite mites Dermanyssus
gallinae (Dermanyssidae) and Ornithonyssus bursa (Macronyssidae). Biologia
79(7), 2245-2252. https://doi.org/10.1007/s11756-024-01708-3
Berkunsky, I., Formoso, A.Y. Aramburú, R.M. 2005. Ectoparasitic load of
Blue-Fronted Parrot (Amazona aestiva, Psittacidae) nestlings. Ornitología
Neotropical 16, 573-578.
Bernardon, F.F., Müller, G.,
Mascarenhas, C.S. 2013. Rhinonyssidae (Acari: Gamasida) in Ardeidae (Aves:
Pelicaniformes) in Brazil. Brazilian Journal of Biology 73(3), 673-674. https://doi.org/10.1590/S1519-69842013000300029
Bernardon, F.F., Müller, G., Mascarenhas, C.S. 2017. Rhinonyssidae in Chrysomus
ruficapillus (Vieillot, 1819) (Passeriformes: Icteridae) from Southern
Brazil. Comparative Parasitology 84(1), 67-71. http://dx.doi.org/10.1654/1525-
2647-84.1.67
Bloszyk, J., Bajerlein, D., Gwiazdowicz, D.J., Halliday, R.B., Dylewska, M.
2006. Uropodine mite communities (Acari: Mesostigmata) in birds' nests in
Poland. Belgian Journal of Zoology 136(2), 145.
Briceño, C., Yévenes, K.,
Larraechea, M., Sandoval-Rodríguez, A., Silva-De la Fuente, M.C., Fredes, F.,
Hidalgo, H., et al. 2021. First record of Ornithonyssus
bursa (Berlese, 1888) (Mesostigmata: Macronyssidae) parasitizing invasive
monk parakeets in Santiago, Chile. Revista Brasileira de
Parasitologia Veterinaria 30(1), 1-10. https://doi.org/10.1590/s1984-29612021023
Castelli, E., Viviano, E.,
Torina, A., Caputo, V., Bongiorno, M.R. 2015. Avian mite
dermatitis: an Italian case indicating the establishment and spread of Ornithonyssus
bursa (Acari: Gamasida: Macronyssidae) (Berlese, 1888) in Europe. International
Journal of Dermatology 54(7), 795-799. https://doi.org/10.1111/ijd.12739
Castillo, G.N., Gonzalez,
C.J., Acosta, J.C. 2021. Parasitismo de Oreotrochilus leucopleurus
(Trochilidae) en la Reserva Provincial de San Juan, Argentina. Revista Veterinaria 32(2), 202-205. https://doi.org/10.30972/vet.3225743
Chaisiri, K., McGarry, J.W., Morand, S. Makepeace, B.L. 2015. Symbiosis in
an overlooked microcosm: A systematic review of the bacterial flora of mites. Parasitology
142, 1152-1162. https://doi.org/10.1017/s0031182015000530
Chauve, C. 1998. The poultry red mite Dermanyssus gallinae (De
Geer, 1778): Current situation and future prospects for control. Veterinary
Parasitology 79(3), 239-245. https://doi.org/10.1016/S0304-4017(98)00167-8
Cocciolo, G., Circella, E., Pugliese, N., Lupini, C., Mescolini, G.,
Catelli, E., Borchert-Stuhlträger, M., et al. 2020. Evidence of vector borne
transmission of Salmonella enterica enterica serovar Gallinarum and fowl
typhoid disease mediated by the poultry red mite, Dermanyssus gallinae
(De Geer, 1778). Parasites and Vectors 13(1), 1-10. https://doi.org/10.1186/s13071-020-04393-8
Coimbra, M., Mascarenhas, C., Müller, G., Brum, J. 2012. Phthiraptera and
Gamasida parasites of Columbina picui (Temminck) (Columbiformes:
Columbidae) in the State of Rio Grande do Sul, Southern Brazil. Brazilian
Journal of Biology 72, 583-585. https://doi.org/10.1590/S1519-567
69842012000300022
Corbalán, V., Gamboa, M.I., Lareschi, M., Radman, N.E. 2019. Prevalencia
de los ácaros Mesostigmata en gallinas ponedoras de huevos comerciales el
partido de La Plata, provincia de Buenos Aires. Revista Argentina de
Parasitología, Número Especial, 102.
Da Fonseca, F. 1947. A
Monograph of the genera and species of Macronyssidae Oudemans, 1936 (synom.:
Liponissidae Vitzthum, 1931) (Acari). Proceedings of the
Zoological Society of London 118, 249-334. https://doi.org/10.1111/j.1096-3642.1948.tb00378.x
Decru, E., Mul, M., Nisbet, A.J., Vargas Navarro, A.H., Chiron, G.,
Walton, J., Norton, T., et al. 2020. Possibilities for IPM strategies in
European laying hen farms for improved control of the poultry red mite (Dermanyssus
gallinae): Details and state of affairs. Frontiers in Veterinary Science
7, 565866. https://doi.org/10.3389/fvets.2020.565866
de Oliveira Alves, A., Bernardes Filho,
F. 2018. Gamasoidosis (bird mite dermatitis): A case series in a family. Pediatrics
and Neonatology 59(1), 102-103. https://doi.org/10.1016/j.pedneo.2017.08.001
DeVaney, J.A. 1979. The effects of the northern fowl mite, Ornithonyssus
sylivarium on egg production and body weight of caged white leghorn hens. Poultry
Science 58, 191-194. https://doi.org/10.3382/ps.0580191
De Moraes, G.J., Moreira, G.F., Freire, R.A.P., Beaulieu, F., Klompen, H.,
Halliday, B. 2022. Catalogue of the free-living and arthropod-associated
Laelapidae Canestrini (Acari: Mesostigmata), with revised generic concepts and
a key to genera. Zootaxa 5184(1), 1-509. https://doi.org/10.11646/zootaxa.5184.1.1
Dimov, I., Mascarenhas,
C.S. 2012. Co-parasitism of mites in Passeriformes birds from
northwest Russia and southern Brazil. Journal of Science and Practice 1,
7-10.
dos Santos, L.S.S, Mascarenhas, C.S., Santos, P.R.S., Farias, N.A.R. 2018.
Rhinonyssidae (Acari) in the house sparrows, Passer domesticus
(Linnaeus, 1758) (Passeriformes: Passeridae), from southern Brazil. Revista
Brasileira de Parasitologia Veterinária 27(4), 597-603. http://dx.doi.org/10.1590/s1984-296120180064
Doti, F., Muzureta, A.
1989. Ensayo a campo con flumetrina pour-on en Argentina contra ácaros de la
subfamilia Dermanyssinae - nuevo método de control de ectoparásitos en la
gallina. Veterinaria Argentina
6, 122-122.
Dowling, A.P.G. 2006. Mesostigmatid mites as parasites of small mammals:
Systematics, ecology, and the evolution of parasitic associations. En: Morand,
S., Krasnov, B.R., Poulin, R. (Eds.), Micromammals and Macroparasites,
pp. 103-117. Springer Japan. https://doi.org/10.1007/978-4-431-36025-4_7
Dowling, A. 2015. The evolution of parasitism and host associations in
mites. En: Morand, S., Krasnov, B.R., Littlewood, D.T.J. (Eds.), Parasite
Diversity and Diversification: Evolutionary Ecology Meets Phylogenetics,
pp. 265-288. Cambridge University Press.
Dowling,
A.P.G., O’Connor, B.M. 2010. Phylogeny of
Dermanyssoidea (Acari: Parasitiformes) suggests multiple origins of parasitism.
Acarologia 50(1), 113-129. https://doi.org/10.1051/acarologia/20101957
Durden, L.A., Linthicum, K.J., Monath, T.P. 1993. Laboratory transmission
of eastern equine encephalomyelitis virus to chickens by chicken mites (Acari:
Dermanyssidae). Journal of Medical Entomology 30, 281-285. https://doi.org/10.1093/jmedent/30.1.281
Eisner
Pryor, L.J., Casto, J.M. 2015. Blood-feeding
ectoparasites as developmental stressors: Does corticosterone mediate effects
of mite infestation on nestling growth, immunity, and energy availability?
Journal of Experimental Zoology Part A: Ecological Genetics and Physiology
323(7), 466-477. https://doi.org/10.1002/jez.1942
Faccini, J.L.H. 1987. Ácaros
hematófagos: parasitos de aves de postura (Gallus gallus) no Brasil.
Diversificação, biologia e controle. Arquivo Fluminense de Medicina
Veterinária 2(1), 29-31.
Faccini, J.L.H., Leite, R.C.
1991. Sobre três casos de parasitismo por ácaros. Arquivos da Universidade
Federal Rural do Rio de Janeiro 14, 97-100.
Faccini, J.L.H., Massard,
C.L. 1974. Nota sobre a ocorrência de Ornithonyssus sulviarum
(Canestrini & Fanzago) (Mesostigmata: Mascronyssidae) em Gallus gallus
no Brasil. Arquivos da Universidade Federal Rural do Rio de Janeiro 4,
39-40.
Fain, A. 1961. Les Acariens parasites
endopulmonaires des Serpents (Entonyssidae: Mesostigmata). Bulletin de
I’lnstitut Royal des Sciences Naturelles de Belgique 37, 1-135.
Fain, A. 1966. Notes sur quelques
Rhinonyssidae (Acari: Mesostigmata). Revue de Zoologie et de Botanique
Africaines 74(1-2), 83-96.
Fain, A. 1964. Notes sur quelques
acariens parasites des voies respiratoires d'oiseaux sud-americains
(Rhinonyssidae: Mesostigmata). Bulletins de la Société Royale de Zoologie
d’Anvers 33, 1-12.
Fain, A. 1972. Nouveaux Rhinonyssidae
(Acarina: Mesostigmata). Acarologia 14, 357-364.
Fain, A.,
Aitken, T.H.G. 1968. Acariens nasicoles
d'oiseaux et de mammifères du Brésil. I. Rhinonyssidae de la région de Belém
(Nord Brésil). Bulletin de l'Institut Royal des Sciences Naturelles de
Belqique 44, 1-28.
Fain, A.,
Aitken, T.H.G. 1969. Acariens nasicoles
d'oiseaux et de mammifères du Brésil. III. Nouvelles espèces de Rhinonyssidae
de la région de Belém (Nord Brésil). Bulletin et Annales de la Société
Royale Entomologique de Belgique 105, 342-416.
Fain, A.,
Aitken, T.H.G. 1971. Acariens nasicoles
d’oiseaux et de mammifères du Brésil. V. Nouveaux Rhinonyssidae de la region de
Belém (Nord Brésil). Bulletin et annales de la Société
Royale d'Entomologie de Belgique 107,
27-46.
Fain, A.,
Hyland, K.E. 1962. The
mites parasitic in the lungs of birds. The variability of Sternostoma
tracheacolum Lawrence, 1948, in domestic and wild birds. Parasitology
52(3-4), 401-424. http://dx.doi.org/10.1017/S0031182000027232
Fain, A., Lukoschus, F.S.
1979. Nasal mites from birds (Acarina: Rhinonyssidae,
Dermanyssidae, Ereynetidae and Cytoditidae). Records of the Western Australian
Museum 7(1), 9-27.
FAO 2024. Statistical Yearbook 2024. World Food and Agriculture, Rome, Italy. https://doi.org/10.4060/cd2971en
Fonseca, F. 1938. Notas de
Acarologia. Boletin biologico 3, 132.
Gastal, S.B., Mascarenhas, C.S., Vanstreels, R.E.T., Ruas, J.L. 2018. Rhinonyssus
sphenisci (Acari: Rhinonyssidae) in magellanic penguin (Spheniscus
magellanicus). Polar Biology 41, 487-490. https://doi.org/10.1007/s00300-017-2208-y
Gastal, S.B., Mascarenhas, C.S.,
Bugoni, L. 2022. Two new species of nasal mites of the genus Rhinonyssus
(Acari, Mesostigmata, Rhinonyssidae) from shearwaters. Systematic and
Applied Acarology 27(1), 9-23. https://doi.org/10.11158/saa.27.1.2
Gastal, S.B., Mascarenhas, C.S., Bugoni, L. 2023. Rhinonyssus nenecoi
sp. nov. (Mesostigmata: Rhinonyssidae); a new nasal mite from Daption
capense (Procellariiformes: Procellariidae). Zootaxa 5301(2),
269-276. https://doi.org/10.11646/zootaxa.5301.2.7
George, D.R., Finn, R.D., Graham, K.M., Mul, M.F., Maurer, V., Moro, C.V.,
Sparagano, O.A. 2015. Should the poultry red mite Dermanyssus gallinae
be of wider concern for veterinary and medical science? Parasite and
Vectors 8, 1-10. https://doi.org/10.1186/s13071-015-0768-7
González-Acuña, D.,
Moreno, L., Cicchino, A., Mironov, S., Kinsella, M. 2010. Checklist
of the parasites of the black-necked swan, Cygnus melanocoryphus (Aves:
Anatidae), with new records from Chile. Zootaxa 2637(1), 55-68. http://dx.doi.org/10.11646/zootaxa.2637.1.3
González-Hein G, Fredes F, Hidalgo H. 2007. Diagnostic challenge. Journal of
Exotic Pet Medicine 16(4), 270-272. http://dx.doi.org/10.1053/j.jepm.2007.09.006
González Ortiz, F., Pérez
Magaña, A., Ocampo Fletes, I., Paredes Sánchez, J.A., de la Rosa Peñaloza, P.
2014. Contribuciones de la producción en traspatio a los grupos domésticos
campesinos. Estudios sociales (Hermosillo, Son.) 22(44), 146-170.
Guimarães, J.H., Tucci, E.C.,
Barros-Battesti, D.M. 2001. Ectoparasitos de importância veterinária.
Editora Plêiade/FAPESP, São Paulo, Brazil.
Hamann, W. 1990. Sensibilidade
in vitro do Dermanyssus gallinae (De Geer, 1778) e Ornithonyssus sylviarum
(Canestrini e Fanzago, 1877) (Acari: Gamasida) frente a acaricidas fosforados,
piretróides e amidinas, com observações sobre o ciclo biológico. 42f.
Dissertação (Mestrado em Ciências, em Medicina Veterinária - Parasitologia
Veterinária). Curso de Pós-graduação em Medicina Veterinária, Universidade
Federal Rural do Rio de Janeiro, RJ.
Hinostroza Fernández, P.
2013. Ectoparásitos en aves Falconiformes y Estrigiformes en el Centro
Ecológico Recreacional y Experimental "La Totorilla". Universidad
Nacional de San Cristóbal de Huamanga. Ayacucho, Perú.
Horn,
T.B., Körbes, J.H., Granich, J., Senter, M., Ferla, N.J. 2016. Influence of laying hen systems on the mite fauna (Acari) community
of commercial poultry farms in southern Brazil. Parasitology Research
115(1), 355-366. https://doi.org/10.1007/s00436-015-4756-9
Horn, T.B., Granich, J., Körbes, J.H.,
Da Silva, G.L., Ferla, N.J. 2018. Mite fauna (Acari)
associated with the poultry industry in different laying hen management systems
in Southern Brazil: A species key. Acarologia 58, 140-158. https://doi.org/10.24349/acarologia/20184233
Johnson,
L.S., Albrecht, D.J. 1993. Effects of
haematophagous ectoparasites on nestling house wrens, Troglodytes aedon:
Who pays the cost of parasitism? Oikos 66(2), 255. https://doi.org/10.2307/3544812
Kasburg, C., Alves, L., Oliveira, D., Rohde, C. 2016. Activity of some
Brazilian isolates of entomopathogenic fungi against the poultry red mite Dermanyssus
gallinae De Geer (Acari: Dermanyssidae). Revista Brasileira de
Ciência Avícola 18(3), 457-460. https://doi.org/10.1590/1806-727
9061-2015-0120
Kirkwood, A. 1963. Longevity of the mites Dermanyssus gallinae and Liponyssus
sylviarum. Experimental Parasitology 14(3), 358-366. https://doi.org/10.1016/0014-4894(63)90043-2
Knee, W.,
Proctor, H. 2010. Interactive HTML-based
Dichotomous Key to Female Rhinonyssidae (Mesostigmata) from Birds in Canada. Canadian
Journal of Arthropod Identification 9, 1-64. https://doi.org/10.3752/cjai.2010.09
Kun, M.E., Vega, R.M. 2016. First record of the nasal mite Rallinyssus
caudistigmus Strandtmann (Acari: Rhinonyssidae) from Argentina. Revista
de la Sociedad Entomológica Argentina 75(1-2), 97-100.
Lareschi, M., Cicuttin, G.L., De
Salvo, M.N., Ibañez, L., Montalti, D. 2017. The tropical fowl
mite Ornithonyssus bursa (Acari: Mesostigmata: Macronyssidae)
parasitizing the European starling Sturnus vulgaris (Aves:
Passeriformes: Sturnidae), an invasive bird in central Argentina. An approach
to the bacterial fauna of this mite. Revista Mexicana de Biodiversidad
88, 454-458. https://doi.org/10.1016/j.rmb.2017.03.022
Lepage, D. 2025. Avibase - Bird Checklists of the World – South America,
https://avibase.bsc-eoc.org/checklist.jsp?region=SAM
[Consulta: 21 de abril de 2025].
Liébana, M.S., Santillán, M.Á.,
Cicchino, A.C., Sarasola, J.H., Martínez, P., Cabezas, S., Bó, M.S. 2011. Ectoparasites in free-ranging American Kestrels in Argentina:
implications for the transmission of viral diseases. Journal of Raptor
Research 45(4), 335-341. http://dx.doi.org/10.3356/JRR-11-26.1
Lindquist, E.E., Krantz, G.W., Walter, D.E. 2009. Chapter Twelve. Order
Mesostigmata. En: Krantz, G.W., Walter, D.E. (Eds), A Manual of Acarology,
pp. 124-232. 3rd ed., Texas University Press, Texas.
Lobato, E., Moreno, J., Merino, S., Sanz, J.J., Arriero, E. 2005.
Haematological variables are good predictors of recruitment in nestling pied
flycatchers (Ficedula hypoleuca). Ecoscience 12, 27-34. https://doi.org/10.2980/i1195-6860-12-1-27.1
López-Arrabé, J., Cantarero,
A., González-Braojos, S., Ruiz-De-Castañeda, R., Moreno, J. 2012. Only some ectoparasite populations are affected by nest re-use: an
experimental study on Pied Flycatchers. Ardeola 59,
253-266. https://doi.org/10.13157/arla.59.2.2012.253
Marín-Gómez, S.Y.,
Benavides-Montaño, J.A. 2007. Parásitos en aves domésticas (Gallus
domesticus) en el Noroccidente de Colombia. Veterinaria y Zootecnia
1, 43-51.
Mascarenhas, C.S., Kruger, C.,
Pesenti, T.C., Brum, J.G.W. 2007. Ácaros hematófagos parasitos em ninhos de
aves silvestres no município de Capão do Leão, Rio Grande do Sul, Brasil.
XVI Congresso de Iniciação Científica. UFPel, RS, Brasil.
Mascarenhas, C.S., Brum, J.G.,
Coimbra, M.A., Sinkoc, A.L. 2009a. Novos hospedeiros para o ácaro nasal Rhinonyssus
rhinolethrum (Trouessart) (Gamasida: Rhinonyssidae) no Brasil. Neotropical
Entomology 38, 695-696. https://doi.org/10.1590/S1519-566X2009000500024
Mascarenhas, C.S., Coimbra,
M.A.A., Müller, G., Brum, J.G. W. 2009b. Ocorrência de Ornithonyssus bursa
(Berlese, 1888) (Acari: Macronyssidae) em flhotes de Megascops (choliba
orujinha-do-mato) e Pitangus sulphuratus (bem-te-vi), no Rio Grande do
Sul. Revista Brasileira de Parasitologia Veterinária 18, 69-70. https://doi.org/10.4322/rbpv.01804013
Mascarenhas, C.S., Coimbra,
M.A.A., Müller, G., Brum, J.G.W. 2011. Nasal mites (Gamasida: Rhinonyssidae) of
Paroaria coronata (Miler) (Passeriformes: Emberezidae). Neotropical
Entomology 40(4), 507-508. http://dx.doi.org/10.1590/S1519-566X2011000400016
Matthysse, J.G., Jones, C.J.
Purnasiri, A. 1974. Development of northern fowl mite populations
on chickens, effects on the host, and immunity., Ithaca, NY, Cornell
University.
Mauri, R.A. 1965. Ácaros
mesostigmátidos parásitos de vertebrados en la República Argentina. Segunda
Jornadas Entomoepidemiológicas Argentinas 1, 65-73.
Mauri, R., de Alzuet,
A.B. 1978. Ácaros que invaden viviendas. Revista de la Sociedad Entomológica
Argentina 37(1-4), 73-75.
Mauri, R.A., Mosquera,
S.N. 1985. Dos ácaros dermanissidos que invaden viviendas y atacan a sus
ocupantes. Neotropica
31, 101-105.
McClain, D., Dana, A.N., Goldenberg, G. 2009. Mite infestations. Dermatologic
Therapy 22, 327-346. https://doi.org/10.1111/j.1529-8019.2009.01245.x
McCulloch, J.B., Jeb, P., Hinkle, N.C., Mullens, B.A., Busch, J.W. 2020.
Genetic structure of Northern Fowl Mite (Mesostigmata: Macronyssidae)
populations among layer chicken flocks and local House Sparrows population
biology (Passeriformes: Passeridae). Journal of Medical Entomology 57,
1-9. https://doi.org/10.1093/jme/tjz136
Mendes, M.M., Mascarenhas, C.S., Sinkoc, A.L., Müller, G. 2014. Nasal
mites of Tyrannidae (Aves) in Brazil. Brazilian Journal of Biology
74(2), 480-482. https://doi.org/10.1590/1519-6984.12912
Mentz, M.B., Silva, G.L., Silva, C.E. 2015. Dermatitis caused by the
tropical fowl mite Ornithonyssus bursa (Berlese) (Acari: Macronyssidae):
a case report in humans. Revista da Sociedade de Medicina Tropical
48(6), 786-788. https://doi.org/10.1590/0037-8682-0170-2015
Mesquita-Sousa, D.,
Viegas-Melo, D., Martins, T. F., Monteiro, S.G., Faccini, J.L.H., Labruna,
M.B., Barros-Battesti, D.M., et al. 2020. An overview of
gamasoidosis caused by Ornithonyssus bursa (Mesostigmata: Macronyssidae)
in Brazil and new case records. International Journal of Acarology 46(7),
568-573. https://doi.org/10.1080/01647954.2020.1810119
Miller, W.V.,
Price, F.C. 1977. The avian mite, Ornithonyssus
sylviarum, on mammalian hosts with references to transmission to poultry. Journal
of Parasitology 63, 417.
Minagawa, F.H., Almeida, E.R.M., Souza, R.C.D., Santos, D.C.D., Haddad
Junior, V., Miot, H.A. 2024. Gamasoidosis (avian mite dermatitis)
outbreak in a student dormitory. Revista da Sociedade Brasileira de Medicina
Tropical 57, e01101-2024. https://doi.org/10.1590/0037-8682-0228-2024
Minnick, M.F., Anderson, B.E., Lima, A., Battisti, J.M., Lawyer, P.G.,
Birtles, R.J. 2014. Oroya Fever and Verruga Peruana: bartonelloses unique to
South America. PLoS Neglected Tropical Diseases 8(7), e2919. https://doi.org/10.1371/journal.pntd.0002919
Møller, A.P. 1990. Effects of parasitism by a haematophagous mite on
reproduction in the Barn Swallow. Ecology, 71, 2345-2357.
https://doi.org/10.2307/1938645
Moreno, J., Merino, S., Potti,
J., de León, A., Rodríguez, R. 1999. Maternal energy
expenditure does not change with flight costs or food availability in the pied
flycatcher: costs and benefits for nestlings. Behavioral Ecology and
Sociobiology 46, 244-251. https://doi.org/10.1007/s002650050616
Moreno, J., Merino, S., Martínez, J., Sanz, J.J., Arriero, E. 2002. Heterophil/lymphocyte ratios and heat-shock protein levels are
related to growth in nestling birds. Ecoscience 9, 434-439. http://dx.doi.org/10.1080/11956860.2002.11682731
Morrone, F., Mayworm, M.A.S.,
Tucci, E.C., Salatino, A., Guerreiro Filho, O. 2001. Ação acaricida de extratos
foliares de espécies de coffea (Rubiaceae) sobre Dermanyssus gallinae
(de geer, 1778) (Acari, Dermanyssidae). Arquivos do Instituto Biológico
68(2), 43-47. https://doi.org/10.1590/1808-842
1657v68n2p0432001
Moss, W.W. 1978. The
mite genus Dermanyssus: a survey with description of Dermanyssus
trochilinis, n. sp., and a revised key to the species (Acari: Mesostigmata:
Dermanyssidae). Journal of Medical Entomology 14, 627-640.
Mullen, G.R.,
O’Connor, B.M. 2009. Mites (Acari). En: Mullen, G.R., Durden, L.A. (Eds.), Medical
and Veterinary Entomology, 2nd ed., pp. 433-492.
Academic Press, San Diego, CA
Mullens, B.A., Kuney, D.R., Hinkle, N.C., Szijj, C.E. 2004. Producer attitudes and control practices for Northern Fowl Mites in
Southern California. Journal of Applied Poultry Research 13, 488-492. https://doi.org/10.1093/japr/13.3.488
Mullens, B.A., Owen, J.P., Kuney, D.R., Szijj, C.E., Klingler, K.A. 2009.
Temporal changes in distribution, prevalence and intensity of northern fowl
mite (Ornithonyssus sylviarum) parasitism in commercial caged laying
hens, with a comprehensive economic analysis of parasite impact. Veterinary
Parasitology 160(1-2), 116-133. https://doi.org/10.1016/j.vetpar.2008.10.076
Murillo,
A.C., Mullens, B.A. 2017. A review of the biology,
ecology, and control of the northern fowl mite, Ornithonyssus sylviarum
(Acari: Macronyssidae). Veterinary Parasitology 246, 30-37. https://doi.org/10.1016/j.vetpar.2017.09.002
Øines, Ø.,
Brännström, S. 2011. Molecular investigations of
cytochrome c oxidase subunit I (COI) and the internal transcribed spacer (ITS)
in the poultry red mite, Dermanyssus gallinae, in northern Europe and
implications for its transmission between laying poultry farms. Medical and
Veterinary Entomology 25, 402-412. https://doi.org/10.1111/j.1365-2915.2011.00958.x
Oliveira, M., 1972. Ocorrência de Dermanyssus gallinae no Rio Grande
do Sul. Revista de Medicina Veterinária 8(1), 67-70.
Oliveira, T.M., Teixeira, C.M.,
Araújo, I.L., Rezende, L.C., Cunha, L.M., Diniz, S.A., Silva, M.X. 2020.
Epidemiologia e avaliação de risco associado à presença de ácaros hematófagos
em galpões de granjas avícolas de postura. Arquivo Brasileiro De Med
Veterinária e Zootecnia 72, 2148–2156. https://doi.org/10.1590/1678-4162-11579
Owen, J.P., Delany, M.E., Cardona, C.J., Bickford, A.A., Mullens, B.A.
2009. Host inflammatory response governs fitness in an avian ectoparasite, the
northern fowl mite (Ornithonyssus sylviarum). International
Journal for Parasitology 39(7), 789-799. https://doi.org/10.1016/j.ijpara.2008.12.008
Oyarzún-Ruiz, P., Cárdenas,
G., Silva-de la Fuente, M.C., Martin, N., Mironov, S., Cicchino, A.C.,
Kinsella, J.M., et al. 2021. Parasitic fauna of the invasive
house sparrow (Passer domesticus) from Ñuble region, Chile: An example
of co-introduced parasites. Brazilian Journal of Veterinary Parasitology
30(3), e004221. https://doi.org/10.1590/S1984-29612021068
Oxilia, A., Luna, P.C., Debernardi,
M.E., González, V.M., Larralde, M. 2021. Lesiones en la piel causadas por
ácaros de palomas. Dermatología Argentina 27(4), 164-166. https://doi.org/10.47196/da.v27i4.2134
Pacejka, A.J., Gratton, C.M., Thompson, C.F. 1998. Do potentially virulent
mites affect house wren (Troglodytes aedon) reproductive success? Ecology
79(5), 1797-1806. https://doi.org/10.2307/176798
Parra-Henao, G., Alarcón
Pineda, E.P., López Valencia, G., Ramírez Monroy, D.M., Jaramillo Crespo, G.E.
2009. Detection of ectoparasites in wild birds evaluated in
Medellin (Colombia). Revista Colombiana de Ciencias Pecuarias 22,
642-647.
Paulsen, R.M.M., Mascarenhas, C.S., Müller, G., Brum, J.G.W. 2021. Rhinonyssus
rhinolethrum (Trouessart, 1895) (Mesostigmata: Rhinonyssidae) in Netta
peposaca (Vieillot, 1816) (Anseriformes: 898 Anatidae) from Southern
Brazil. Veterinary Parasitology: Regional Studies
and Reports 26, 100622. https://doi.org/10.1016/j.vprsr.2021.100622
Pavan, A.M., Evangelho-Silva, D.,
Costa-Corrêa, L.L., Juarez Ferla, N. 2022. Case report:
Parasitism of Ornithonyssus bursa (Macronyssidae) in humans in the
Taquari River Valley region, southern Brazil. Actualidades
Biológicas 44(117). http://dx.doi.org/10.17533/udea.acbi.v44n117a04
Pavićević, A., Pavlović, I.,
Kullić, S. 2021. Farmers' economic interest in Dermanyssus
gallinae control. Biotechnology in Animal Husbandry 37(3), 171-182. http://dx.doi.org/10.2298/BAH2103171P
Pereira, M.C., Oba, M.S.P., Schumaker, T.T.S. 1977. Ornithonyssus
sylviarum (Canestrini e Fanzago, 1877) (Mesostigmata: Macronyssidae) em Gallus
gallus domesticus (L.) no Estado de São Paulo, Brasil. Revista da
Faculdade de Medicina Veterinária e Zootecnia da Universidade de São Paulo
14(2), 243-251. https://doi.org/10.11606/issn.2318-3659.v14i2p243-251
Porto, C.C., dos Santos, L.S.,
Mascarenhas, C.S., dos Santos, C.C., Farias, N.A.R., Müller, G. 2022. Rhinonyssidae and Ereynetidae mites in Columba livia (Columbiformes:
Columbidae) in southern Brazil. Revista Mexicana de Biodiversidad
93, e933983-e933983. http://dx.doi.org/10.22201/ib.20078706e.2022.93.3983
Powlesland, R.G. 1977. Effects of the haematophagous mite Ornithonyssus
bursa on nestling starlings in New Zealand. New Zealand Journal of
Zoology 4, 85-94. https://doi.org/10.1080/03014223.1977.9517939
Proctor, H.,
Owens, I. 2000. Mites and birds: diversity,
parasitism and coevolution. Trends in Ecology and Evolution 15, 358-364.
Radovsky, F.J. 1969. Adaptive radiation in the parasitic Mesostigmata. Acarologia
11(3), 450-483.
Radovsky, F.J. 1994. The evolution of parasitism and the distribution of
some dermanyssoid mites (Mesostigmata) on vertebrate hosts. En: Houck, M.A.
(Ed.), Mites: Ecological and Evolutionary Analyses of Life-History Patterns,
pp. 186-217. Springer, Boston, MA. https://doi.org/10.1007/978-1-4615-2389-5_8
Radovsky, F.J. 1998. Description of the active stases and distribution of Pellonyssus
gorgasi Yunker and Radovsky, 1966 (Acari: Macronyssidae) of hummingbirds,
and its apparent use of flowers for host transfer. International Journal of Acarology 24,
99-106. https://doi.org/10.1080/01647959808684136
Reis, J. 1939. Alguns parasitos de Gallus gallus (L.) verificados
em São Paulo. Arquivos do Instituto Biológico 10,
147-153.
Reis, J., Reis, A.S., Nóbrega, P. 1934. Moléstias de aves observadas
em Sao Paulo. Arquivos do Instituto Biológico 5, 41-49.
Reshetnikov, P.T. 1967. The
mite Dermanyssus gallinae a vector of fowl spirochaetosis. Veterinariya
44(3), 48.
Rezende, L.D.C., Cunha, L.M.,
Teixeira, C.M., Oliveira, P.R.D., Martins, N.R.D.S. 2013. Mites
affecting hen egg production: Some considerations for Brazilian farms. Ciência
Rural 43(7), 1230-1237. https://doi.org/10.1590/S0103-84782013005000088
Rosa, A.E., Fletchmann,
C.H.W. 1981. Ácaros em ninhos de pardal (Passer domesticus L. 1758), em
São Paulo, Brasil. Ecossistema 6, 91-99.
Rosso, F., Rebellón-Sánchez, D.E.,
Llanos-Torres, J., Hurtado-Bermudez, L.J., Ayerbe, L., Suárez, J.H.,
Orozco-Echeverri, N., et al. G. 2023. Clinical
and microbiological characterization of Salmonella spp. isolates from
patients treated in a university hospital in South America between 2012-2021: a
cohort study. BMC Infectious Diseases 23, 625. https://doi.org/10.1186/s12879-023-08589-y
Roveda, R.J., Ringuelet,
R. 1947. Lista de los parásitos de los animales domésticos en la Argentina. Gaceta Veterinaria IX(43), 67-78.
Roy, L.,
Buronfosse, T. 2011. Using mitochondrial and
nuclear sequence data for disentangling population structure in complex pest
species: A case study with Dermanyssus gallinae. PLoS ONE 6(7),
e22305. https://doi.org/10.1371/journal.pone.0022305
Santillán, M.Á., Grande, J.M.,
Liébana, M.S., Martínez, P., Díaz, L.A., Bragagnolo, L.A., Solaro, C., et al.
2015. New hosts for the mite Ornithonyssus bursa in
Argentina. Medical and Veterinary Entomology 9, 1-5. https://doi.org/10.1111/mve.12129
Sáez-Ventura, Á.,
López-Montoya, A.J., Luna, Á., Romero-Vidal, P., Palma, A., Tella, J.L.,
Carrete, M., et al. 2022. Drivers of the ectoparasite
community and co-infection patterns in rural and urban Burrowing Owls. Biology 11(8), 1141. https://doi.org/10.3390/biology11081141
Schmidt, G.S., Abreu, P.G., Cunha, Jr. A., Feddern, V. 2025. Natural plant extracts control red mite (Dermanyssus gallinae)
on laying hen farms. Brazilian Journal of Poultry Science 27(1), 1-6. http://dx.doi.org/10.1590/1806-9061-2023-1877
Seijo, A., Picollo, M., Nicholson, W., Paddock, C. 2007. Rickettsial
spotted fever in the Paraná Delta. An emerging disease. Medicina (B. Aires)
67, 723-726.
Semenas,
L., Angaut Rocha, J. 1998. Un motivo poco
común de crisis de llanto en un recién nacido. Archivos Argentinos de
Pediatría 96, 131-133.
Serafini, P.S., Anjos, L.D.,
Arzua, M., Volpato, G., Vargas, E., Polletto, F. 2003. First
report of Ornithonyssus sylviarum (Acari: Macronyssidae) on black
vulture (Coragyps atratus) nestlings from Brazil. Revista
Brasileira de Parasitologia Veterinária 12, 92-93.
Sigognault
Flochlay, A., Thomas, E., Sparagano, O. 2017. Poultry red mite (Dermanyssus gallinae) infestation: A broad
impact parasitological disease that still remains a significant challenge for
the egg-laying industry in Europe. Parasites and Vectors 10, 4-9. https://doi.org/10.1186/s13071-017-2292-4
Sikes,
R.K., Chamberlain, R.W. 1954. Laboratory
observations on three species of bird mites. Journal of Parasitology 40,
691-697. https://doi.org/10.2307/3273713
Silva, D.E., Silva, G.L., Nascimento, J.M., Ferla, N.J. 2018a. Mite fauna
as sociated with bird nests in Southern Brazil. Systematic and Applied
Acarology 23(3), 426-440. https://doi.org/10.11158/saa.23.3.2
Silva, D., Scheer, S. Müller, G. 2018b. Nasal mites (Mesostigmata,
Rhinonyssidae) in Sternidae (Aves: Charadriiformes) on the southern coast of
Brazil. Brazilian Journal of Veterinary Parasitology 27, 109-111. http://dx.doi.org/10.1590/S1984-29612017070
Sinkoc, A.L., Brum, J.G.W. 2004. Ocorrência de Pelonyssus reedi (Zump &
Patterson, 1952) (Acari: Mesostigmata) em ninho de corruira Troglodytes
aedon (Passeriformes: Troglodytidae) em Pelotas, RS. Arquivos do
Instituto Biologico (Sao Paulo) 71, 377-378. https://doi.org/10.1590/1808-1657v71p3772004
Sinkoc, A.L., Brum, J.G.W., Muller, G. 2016. Ocorrência de Rhinonyssus
rhinolethrum (Trouessart, 1895) (Acarina: Rhinonyssidae) em marreca
caneleira Dendrocygna bicolor (Vieillot, 1816) e marreca piadeira Dendrocygna
viduata (Linnaeus, 1766) na região sul do Rio Grande do Sul, Brasil. Arquivos
do Instituto Biológico 83, e0782014. https://doi.org/10.1590/1808-1657000782014
Sioutas, G., Minoudi, S.,
Tiligada, K., Chliva, C., Triantafyllidis, A., Papadopoulos, E. 2021. Case of human infestation with Dermanyssus gallinae (poultry
red mite) from swallows (Hirundinidae). Pathogens 10(3), 299. https://doi.org/10.3390/pathogens10030299
Soares, N.M., Tucci, E.C., Guastalli, E.A.L., Yajima, H. 2008. Controle
da infestação por Ornithonyssus sylviarum (Canestrini e Fanzago, 1877)
(Acari: Macronyssidae) em poedeiras comerciais utilizando extrato de
Azadirachta indica. Revista Brasileira de Parasitologia Veterinária
17(4), 175-178. https://doi.org/10.1590/S1984-29612008000400001
Sparagano, O.A.E., Ho, J.
2020. Parasitic mite fauna in Asian poultry farming systems. Frontiers
in Veterinary Science 7, 400. https://doi.org/10.3389/fvets.2020.00400
Sparagano, O., Pavlićević, A., Murano, T., Camarda, A., Sahibi, H., Kilpinen,
O., Mul, M., et al. 2009. Prevalence and key figures for the poultry red mite Dermanyssus
gallinae infections in poultry farm systems. Experimental and Applied
Acarology 48, 3-10. https://doi.org/10.1007/978-90-481-2731-3_2
Sparagano, O.A.E., George, D.R., Harrington, D.W.J., Giangaspero, A. 2014.
Significance and control of the Poultry Red Mite, Dermanyssus gallinae. Annual
Review of Entomology 59, 447-466. https://doi.org/10.1146/annurev-ento-011613-162101
Stoehr, A.M., Nolan, P.M., Hill, G.E., McGraw, K.J. 2000. Nest mites (Pellonyssus
reedi) and the reproductive biology of the house finch (Carpodacus
mexicanus). Canadian Journal of Zoology 78(12), 2126-2133. https://doi.org/10.1139/z00-157
Szabó, K., Szalmás, A., Liker, A., Barta, Z. 2002. Effects of
haematophagous mites on nestling house sparrows (Passer domesticus). Acta
Parasitologica 47(4), 318-322.
Takatsu, J.C., Bassini-Silva, R., Spicer, G., Hingst-Zaher, E.,
Jacinavicius, F.D.C. 2021a. New records of avian nasal mites (Mesostigmata:
Rhinonyssidae) to Southeastern Brazil. Entomological Communications 3,
ec03040. https://doi.org/10.37486/2675-1305.ec03040
Takatsu, J.C., Bassini-Silva, R., de Moura, A.P., Batista, A.I., Dias,
G.F., Pereira, J.S., Dowling, A.P.G., et al. 2021b. Unusual association between
Ornithonyssus bursa (Berlese, 1888) (Mesostigmata: Macronyssidae) and Parabuteo
unicinctus (Temminck, 1824) (Accipitriformes: Accipitridae) in Paraíba
State, Brazil. Entomological Communications 3, ec03038. https://doi.org/10.37486/2675-1305.ec03038
Teixeira, C.M.,
Oliveira, T.M.D., Soriano-Araújo, A., Rezende,
L.D.C., Oliveira, P.R.D., Cunha, L.M., Martins, N.R.D.S. 2020. Ornithonyssus
sylviarum (Acari: Macronyssidae) parasitism among poultry farm workers in
Minas Gerais state, Brazil. Ciência Rural 50(7), e20190358. https://doi.org/10.1590/0103-8478cr20190358
Téllez, M.L., Sordo, C., Ruiz, A.,
Tucto, S., Manrique, A. 2008. Dermatosis por ácaros de palomas. Primer reporte
de la presencia de Ornithonyssus sylviarum en el Perú. Folia
Dermatologica Peru 19, 63-68.
Torres, E.C., Hernández,
J.F. 2018. Actividad acaricida de Bacillus thuringiensis sobre el ácaro
rojo de las aves, Dermanyssus gallinae. Revista Veterinaria
29(2), 128-132. https://doi.org/10.30972/vet.2923278
Tucci, E.C., Guimarães, J.H.,
Bruno, T.V., Gama, N.M.S.Q., Santos, A.M.M. 1998. Ocorrencia de ácaros
hematófagos em aviários de postura no estado de Sao Paulo. Revista
Brasileira de Parasitologia Veterinária 7, 71-78.
Valiente Moro, C., Chauve, C.,
Zenner, L. 2005. Vectorial role of some dermanyssoid mites (Acari,
Mesostigmata, Dermanyssoidea). Parasite 12, 99-109. https://doi.org/10.1051/parasite/2005122099
Vas, Z. 1935. Ectoparasitas de animaes
domesticos observados no estado de S. Paulo. Arquivos do Instituto Biológico
6(2), 29-33.
Villa, S.M., Le Bohec, C., Koop,
J.A., Proctor, H.C, Clayton, D.H. 2013. Diversity of feather
mites (Acari: Astigmata) on Darwin's finches. Journal of Parasitology
99(5), 756-62. https://doi.org/10.1645/12-112.1
Walter, D.E.,
Proctor, H. (Eds.). 2013. Chapter 11. Mites and
Biological Diversity. En: Mites: Ecology, Evolution & Behaviour: Life at a
Microscale, Second Edition, pp. 446-459. Springer, Dordrecht.
Villalobos-Moreno, A.,
Vera-Valdivieso, D.C., Hoyos-García, W., Valim, M.P., Arcila-Quiceno, V.H.
2020. Ectoparasites of Coragyps atratus (Bechstein, 1793)
(Accipitriformes: Cathartidae) on Bucaramanga, Santander, Colombia. Boletín
Científico. Centro de Museos. Museo de Historia Natural 24(2), 231-243. http://dx.doi.org/10.17151/bccm.2020.24.2.15
Wang, F.F., Wang, M., Xu, F.R., Liang, D.M., Pan, B.L. 2010. Survey of prevalence and control of ectoparasites in caged poultry
in China. Veterinary Record 167(24), 934-937. https://doi.org/10.1136/vr.c6212
Wilson, 1970. Acarina: Mesostigmata: Halarachnidae, Rhinonyssidae of South
Georgia, Heard and Kergueleni. Pacific Insects Monograph 23, 71-77.
Wambier,
C.G., Wambier, S.P. 2012. Gamasoidosis
illustrated – from the nest to dermoscopy. Anais Brasileiros de Dermatologia
87, 926-927. https://doi.org/10.1590/S0365-05962012000600021
Yazwinski, T.A., Tucker, C.A., Robins, J., Powell, J., Phillips, M., Johnson,
Z., Clark, D., et al. 2005. Effectiveness of various acaricides in the
treatment of naturally occurring Ornithonyssus sylviarum (Northern Fowl
Mite) infestations of chickens. Journal of Applied Poultry Research
14(2), 265-268. https://doi.org/10.1093/japr/14.2.265
Zhang, Z.-Q. 2011. Animal biodiversity: An outline of higher-level
classification and survey of taxonomic richness. Zootaxa 3148,
1-237. https://doi.org/10.11646/zootaxa.3703.1.1
![]() , María José
Saravia-Pietropaolo2
, María José
Saravia-Pietropaolo2 ![]() , Valeria Corbalán3
, Valeria Corbalán3 ![]() , Marcela Lareschi4
, Marcela Lareschi4 ![]()
