Introducción
Las garrapatas son ectoparásitos hematófagos que afectan a
gran variedad de hospedadores, incluidos mamíferos, aves, reptiles y anfibios
(e.g., Dudek et al. 2016; Duque-Amado y Megía-Palma 2024). Su
importancia se debe a su capacidad para transmitir una gran variedad de
patógenos productores de enfermedades tanto al ser humano como a una gran
variedad de vertebrados, por lo que suponen un problema en la salud pública y
en las explotaciones ganaderas (Hurtado y
Giraldo Rios 2019). En general, tanto la distribución geográfica como la
incidencia de las enfermedades transmitidas por garrapatas ha aumentado como
consecuencia de múltiples factores, entre los que se incluye el cambio
climático, así como factores ecológicos y sociales (de
la Fuente et al. 2023). En la actualidad se dispone de escasa información
sobre la presencia de garrapatas en ciertos grupos de hospedadores, así como de
su papel en la distribución de las garrapatas a escala geográfica en la
península ibérica. Este es el caso de los reptiles, que pueden ser hospedadores
ocasionales de distintas especies de garrapatas en la cuenca mediterránea (Megía-Palma et al. 2018; Mendoza-Roldan
et al. 2019). Concretamente, en España se desconoce en gran medida las
especies que los parasitan. Aportar información en esta dirección es
fundamental para la potencial aplicación de medidas de control de enfermedades
zoonóticas.
Las garrapatas son artrópodos que pertenecen a la Clase
Arachnida, Superorden Parasitiformes y Superfamilia Ixodoidea. Existen 3
familias: Ixodidae, que incluye 752 especies, Argasidae con 190 especies, y
Nuttalliellidae, compuesta por una sola especie (Tomassone
et al. 2017; Nava y Guglielmone 2023). La
familia Ixodidae (garrapatas duras) es la de mayor relevancia al representar el
80% de las especies de garrapatas y por la diversidad de importantes agentes
patógenos que pueden transmitir. Su ciclo biológico está compuesto por tres
estadíos tras la eclosión del huevo: larva, ninfa y adulto, pero cada especie
presenta particularidades en su ciclo de vida. En el caso de la familia
Ixodidae, los individuos solo se alimentan tres veces, una vez por estadío,
pudiendo permanecer prendidas desde uno o dos días hasta semanas durante las
alimentaciones dependiendo del estadío y de la especie. Las etapas inmaduras
(larvas y ninfas) normalmente se alimentan de sangre de pequeños hospedadores,
como roedores, aves y/o reptiles, mientras que los adultos se suelen alimentar
de la sangre de hospedadores grandes, incluyendo carnívoros y ungulados. Sin
embargo, algunas especies son altamente específicas para un tipo particular de
hospedador. Después de cada ingesta de sangre, los estadíos inmaduros mudan en
el suelo o sobre el propio hospedador (según la especie). Las hembras adultas
ingieren gran cantidad de sangre y, tras la cópula, se desprenden, caen al
suelo y hacen la puesta de hasta miles de huevos, que quedan entre la
vegetación en descomposición en sitios protegidos con alta humedad relativa, lo
que asegura su supervivencia (Estrada-Peña 2016).
Las especies de garrapatas que hay en un área determinada y la densidad de sus
poblaciones varían dependiendo de muchos factores: vegetación, presencia de
hospedadores adecuados, climatología, desarrollo de actividades humanas, y
transporte de ganado (Estrada-Peña et al. 2017).
La península ibérica es un área de transición geográfica y climática en la que
se han identificado hasta 40 especies de garrapatas, algunas comunes a
diferentes regiones de Europa, otras endémicas de la cuenca mediterránea, y
algunas especies habituales en África.
Los géneros de la familia Ixodidae presentes en España son: Ixodes,
Dermacentor, Haemaphysalis, Rhipicephalus e Hyalomma.
Ixodes ricinus (Linnaeus, 1758) es, desde el punto de vista sanitario,
la especie más importante en Europa. Su presencia se relaciona con una humedad
relativa en el suelo superior al 70%, por lo que su distribución está limitada
a ciertas áreas que cumplen estas condiciones, siendo más prevalente en las
regiones frescas y húmedas del norte peninsular (Estrada-Peña
2015), pero también presente en otras zonas de la Península (Mapa GARES, Ministerio de Sanidad). Esta especie de garrapata
tiene como especial característica la preferencia de alimentarse de la sangre
de reptiles durante sus estadíos inmaduros. No obstante, recientemente se ha
especulado sobre la coexistencia de esta especie con otra morfológicamente muy
similar, Ixodes inopinatus (Estrada-Peña et
al. 2014), en el sur de Europa y norte de África (Kahl
y Gray 2023). Es importante aportar datos fiables que permitan conocer con
mayor claridad el área de distribución y los requisitos climáticos de ambas
especies.
Otra garrapata de creciente interés sanitario es Hyalomma
lusitanicum (Koch, 1844), una especie mediterránea capaz de soportar las
altas temperaturas y baja humedad del verano (Estrada-Peña
2015). También son de interés Rhipicephalus sanguineus (Latreille,
1806), la garrapata marrón del perro, distribuida por toda la península, Dermacentor
marginatus (Sulzer, 1776) y Dermacentor reticulatus (Fabricius,
1794), en el centro sur y norte, respectivamente, y Haemaphysalis punctata
(Canestrini y Fanzago, 1878), una especie de garrapata que tolera diferentes
ambientes climáticos. Cada especie tiene su rango de hospedadores, necesidades
climáticas y capacidad vectorial. De hecho, las garrapatas pueden transmitir
una gran variedad de agentes: protozoos, rickettsias, espiroquetas, virus e
incluso nematodos, aunque el rango de patógenos transmitidos es muy variable
según la especie. Esto, unido a que están distribuidas por todo el mundo,
incluyendo la Antártida, y a que su abundancia y la incidencia de las
enfermedades que vectorizan se están incrementando en algunas regiones, les ha
convertido en uno de los problemas de salud pública y veterinaria de creciente
interés (Vucelja et al. 2023).
Las lagartijas y lagartos (familia Lacertidae) son
hospedadores ocasionales de garrapatas, pero existen pocos estudios sobre las
garrapatas que parasitan a los reptiles. Sin embargo, al igual que otros
pequeños vertebrados, los lacértidos son hospedadores idóneos para los estadíos
inmaduros de diferentes especies de garrapata (Tomassone
et al. 2017). Por ejemplo, en una investigación sobre el papel de los
lacértidos en el ciclo epidemiológico de los ixódidos en el Cáucaso y
territorios adyacentes, se encontraron 14 especies de garrapatas pertenecientes
a 5 géneros (Orlova et al. 2023), la mayoría de ellas
presentes en la península ibérica. Particularmente, I. ricinus y H.
punctata destacaron en dicho estudio por su amplia distribución y capacidad
para parasitar múltiples hospedadores. Los lacértidos se exponen a la
infestación por garrapatas al solaparse la preferencia de microambientes
húmedos de ambos taxones en aquellos hábitats con garrapatas. En los lacértidos
parasitados, la mayoría de las garrapatas se fijan en las bolsas nucales (en
las especies que las poseen), tímpano y axilas, localizaciones donde se ha
especulado con que pueden encontrar protección contra posibles daños cuando el
reptil se roza con la vegetación (Salvador et al. 1999).
Los reptiles parecen tener un papel
en el ciclo epidemiológico de las bacterias del género Borrelia
(particularmente Borrelia burgdorferi sensu lato), que a su vez son
transmitidas por garrapatas y causan la borreliosis de Lyme, una enfermedad
cuya incidencia ha ido aumentando en Europa en los últimos años (Vucelja et al. 2023). Borrelia burgdorferi s.l.
es un complejo bacteriano transmitido por garrapatas de la familia Ixodidae que
contiene 21 genoespecies identificadas, 8 de ellas presentes en Europa: B.
burgdorferi sensu stricto (s.s.), B. afzelii, B. garinii,
B. bissettiae, B. bavariensis, B. spielmanii, B.
lusitaniae y B. valaisiana, de las cuales las seis primeras causan
enfermedades en humanos (Vucelja et al. 2023; Dsouli et al. 2006). Las garrapatas del género Ixodes
son los principales vectores para la transmisión de diversas especies
patógenas de B. burgdorferi s.l., siendo I. ricinus el principal
vector en Europa. El genotipo B. lusitaniae se ha encontrado en Podarcis
muralis (Laurenti, 1768) en el centro de Italia (Amore
et al. 2007), en Psammodromus algirus (Linnaeus, 1758) en el norte
de África (Dsouli et al. 2006) y en Lacerta
viridis (Garsault, 1764) en Eslovaquia (Soualah-Alila
et al. 2015). Sus reservorios más frecuentes son los roedores
(especialmente el ratón de campo Apodemus sylvaticus (Linnaeus, 1758)) y
aves migratorias (Poupon et al. 2006). Esto ha
llevado a plantear que las aves podrían ser las responsables de la dispersión
geográfica de las garrapatas, y los lacértidos y roedores los responsables de
su perpetuación en ciclos endozoóticos (De Sousa et al.
2012). Borrelia lusitaniae no está incluida entre las genoespecies
de Borrelia que típicamente producen la borreliosis en humanos, pero se
ha aislado de un paciente con lesiones cutáneas inespecíficas y duraderas (Collares-Pereira et al. 2004). Además, los
lacértidos pueden ser un reservorio de especies patógenas de rickettsias (Rickettsia
monacensis y R. helvetica) (De Sousa et al.
2012; Tomassone et al. 2017), que se
transmiten a los humanos a través de las garrapatas. Finalmente, los lacértidos
también pueden actuar de reservorio para otros patógenos transmitidos por
garrapatas, como las bacterias de la familia Anaplasmataceae, que aparecen en
el lagarto Lacerta agilis (Linnaeus, 1758) en coinfección con B.
burgdorferi s.l. (Ekner et al. 2011).
A pesar de la reconocida
importancia de las garrapatas como vectores de enfermedades, existe poca
información sobre el papel de los reptiles tanto en el mantenimiento del ciclo
de la garrapata, su potencial como reservorios de agentes patógenos para el humano,
y los mecanismos de transmisión a los humanos. La principal dificultad estriba
en que las garrapatas que suelen parasitar a estos reptiles se encuentran en
estadíos inmaduros que, a diferencia de los adultos, son más complicados de
detectar, recolectarlos íntegramente e identificar. Este estudio tiene como
objetivo abordar algunos de los distintos problemas descritos, específicamente:
(1) La identificación de las especies/estadíos de garrapatas que infestan los
lacértidos de España. Para ello se han utilizado técnicas de identificación
morfológica y moleculares, haciendo especial énfasis en la detección de I.
inopinatus (Kahl y Gray 2023); (2) La
identificación de factores como el sexo de los hospedadores o variables
microclimáticas que puedan explicar la presencia e intensidad de infestación de
garrapatas en lacértidos ibéricos.
Material y métodos
Recogida y análisis de
muestras
Las garrapatas fueron recolectadas
en 83 de 442 lacértidos analizados, pertenecientes a 9 especies de la familia
Lacertidae durante los meses de máxima actividad de estos reptiles (desde marzo
a agosto, ambos incluidos) desde 2013 a 2021. Los individuos fueron capturados
mediante el uso de un nudo corredizo hecho con seda que se coloca en el extremo
de una vara de 1.5 m. Este método de captura es inocuo para los reptiles, que
fueron liberados inmediatamente tras la toma de muestras de garrapatas (e.g., Megía-Palma et al. 2024). En los individuos
capturados, se les midió la longitud hocico-cloaca con una regla (precisión: 1
mm). Las especies de hospedador, así como las regiones geográficas donde se
colectaron las garrapatas, fueron la Sierra de Guadarrama: Lacerta
schreiberi (Bedriaga, 1878), Podarcis guadarramae (Boscá, 1916), Timon
lepidus (Daudin, 1802), Podarcis muralis, Psammodromus algirus,
Iberolacerta cyreni (Müller y Hellmich, 1937); la submeseta sur: P.
algirus, Acanthodactylus erythrurus (Schinz, 1834); Pirineos: Zootoca
vivipara (Lichtenstein, 1823), P. muralis; Sierra Nevada: P
.algirus; Noroeste de Portugal: T. lepidus (Fig.
1). También se añadieron datos de una población de Gallotia galloti
(Oudart, 1839) de la isla de Tenerife (Islas Canarias) (Fig.
1). Las garrapatas fueron colectadas directamente del cuerpo del
hospedador y se conservaron en etanol al 70% y a 4 ºC.
Identificación
morfológica
La identificación de las garrapatas
se llevó a cabo en el laboratorio del Instituto Nacional de Investigación y
Tecnología Agraria y Alimentaria (INIA-CSIC) en Madrid. Para la visualización
de las garrapatas colectadas se utilizó un microscopio estereoscópico de campo
claro (Nikon SMZ25) y se identificaron a nivel de especie siguiendo Estrada-Peña et al. (2014, 2017). Para ello, se depositaron los ejemplares en
una placa de Petri, sujetas con material amoldable que permitía la colocación
adecuada de los ejemplares (Fig. 2).
Las especies I. ricinus e I.
inopinatus se distinguen por la longitud de las setas escutales y
aloscutales de sus ninfas. Por este motivo se midieron las setas de 199 ninfas
del género Ixodes con el programa NIS Elements D adaptado al
microscopio. Si las setas aloscutales (setas marginales dorsales (MD) 1-3) eran
sólo 2 a 3 veces más largas que las setas escutales, se identificaba como I.
ricinus (Estrada-Peña et al. 2014). Sin
embargo, si las setas aloscutales eran al menos 5 a 6 veces más largas que las
setas escutales se identificaba como I. inopinatus (Estrada-Peña et al. 2014; Fig.
2a). La visualización de las setas escutales dependía de la dirección
de la luz y de la posición de la garrapata. Debido a este problema era
necesario posicionarles varias veces en plastilina y trabajar con diferentes
planos de luz hasta que se logró visualizar las setas perfectamente (de manera
estandarizada) para poder medirlas.
La identificación de las larvas de
los ejemplares del género Ixodes es más complicada. Por un lado, las
estructuras están sin queratinizar y son más sensibles a las alteraciones.
Además, algunas de las piezas bucales, como el hipostoma y los palpos, estaban
dañadas. La mayoría de las claves de identificación no aportan datos sobre ese
estadío, pero Estrada-Peña et al. (2017) utiliza
los dientes del hipostoma para diferenciar la especie, por lo que sólo se
identificaron a nivel de género.
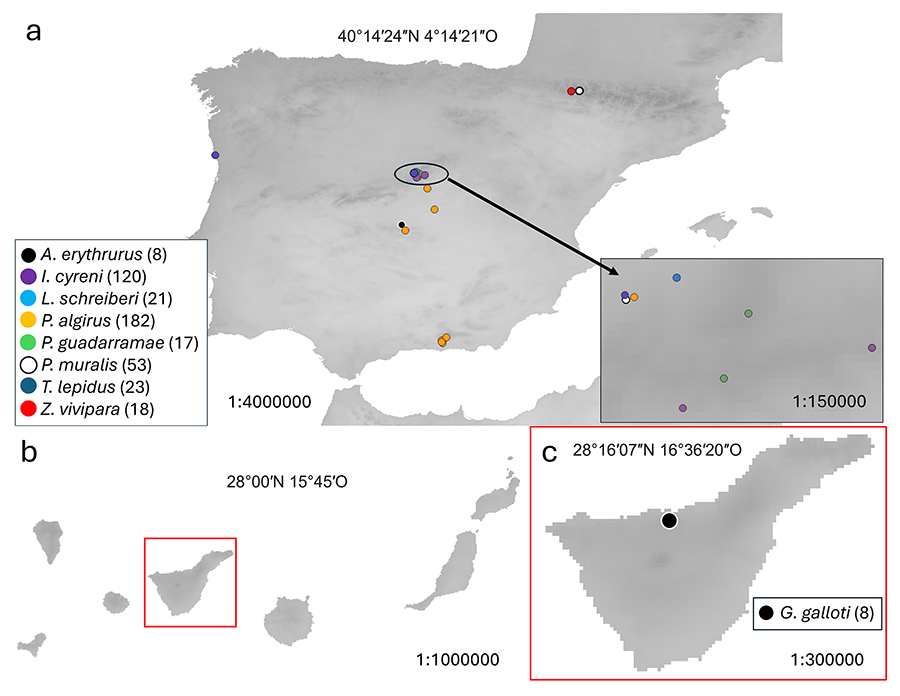
Figura 1. Puntos geográficos donde se investigó
la presencia de garrapatas sobre 9 especies de lacértido de los géneros Acanthodactylus,
Gallotia, Iberolacerta, Lacerta, Podarcis, Psammodromus,
Timon, y Zootoca. En paréntesis junto al género se muestra el
tamaño muestral. (a) Puntos muestreados en la península ibérica. En
todas las especies se encontró I. ricinus, salvo en A. erythrurus
donde se encontró H. lusitanicum. (b) En rojo se indica la
localización de Tenerife dentro del archipiélago de las Islas Canarias. (c)
Punto geográfico donde se encontraron garrapatas de la especie H. punctata
sobre la especie endémica de lacértido de Tenerife (G. galloti). En la
parte de arriba de cada mapa se muestra las coordenadas geográficas y en la
parte baja la escala a la que se representan.
Figure 1. Geographical points where the presence of ticks was investigated on
9 species of lizards of the genera Acanthodactylus, Gallotia, Iberolacerta,
Lacerta, Podarcis, Psammodromus, Timon, and Zootoca.
The sample size is shown in parentheses next to the genus. (a) Points sampled in the Iberian
Peninsula. In all species I. ricinus was found, except in A. erythrurus
where H. lusitanicum was found. (b) In red the location of Tenerife within the Canary Islands
archipelago is indicated. (c) Geographic point where ticks of the species H. punctata
were found on the endemic species of Tenerife lizard (G. galloti). At
the top of each map are shown the geographic coordinates and at the bottom the
scale at which they are represented.

Figura 2. (a) Vista dorsal sobre
plastilina de una posible ninfa de Ixodes inopinatus, con medición de
setas escutales aproximadamente 5 veces más largas que las setas aloscutales. (b)
Vista dorsal de una ninfa de Ixodes ricinus con medición de setas
escutales 2-3 veces más largas que las setas aloscutales.
Figure 2. (a) Dorsal view on plasticine of a
possible Ixodes inopinatus nymph, with scutal setae measuring
approximately 5 times longer than the aloscutal setae. (b) Dorsal view of an Ixodes ricinus
nymph with scutal setae measuring 2-3 times longer than the aloscutal setae.
Identificación molecular (PCR)
Por la dificultad para
identificar las muestras al microscopio, se realizó identificación molecular
por reacción en cadena de la polimerasa (PCR). Se extrajo ADN de 90 garrapatas
del género Ixodes (40 larvas y 50 ninfas). Para la ruptura y
homogeneización de los tejidos, se colocó una garrapata por cada pocillo en una
placa de 96 pocillos (Qiagen) que contenía 180 µl de agua de calidad PCR y 4-5
bolas de acero de 1.5 mm de diámetro. Para descartar contaminación por ADN
ambiental se utilizaron seis controles de extracción consistentes en pocillos
rellenos solo con reactivos que se procesaron en paralelo con las muestras a
analizar. Esta placa se introdujo 24 minutos en tandas de 6 minutos a 30 Hz
para lisar los tejidos (TyssueLyser II, Qiagen). Del homogeneizado se tomaron
120 µl de cada pocillo y se incubaron con proteinasa K durante 12 horas a 56
ºC. Finalmente, el ADN se extrajo en un sistema automático de extracción
Biosprint (Qiagen) con el kit DNeasy BS96 utilizando el protocolo de tejidos.
Se realizó una PCR utilizando el método previamente descrito
por Hornok et al. (2017). Se usaron los cebadores HCO2198 (5′-TAA ACT TCA GGG
TGA CCA AAA AAT CA-3′) y LCO1490 (5′-GGT CAA CAA ATC ATA AAG ATA TTG G-3′), que
amplifican un fragmento de aproximadamente 710 pb del gen citocromo c oxidasa 1
(cox 1). Complementariamente, se amplificó un fragmento de 460 pb del
gen mitocondrial 16S rRNA de la familia Ixodidae, con los cebadores
16S+1 (5′-CTG CTC AAT GAT TTT TTA AAT TGC TGT GG-3′) y 16S-1 (5′-CCG GTC TGA
ACT CAG ATC AAG T-3′) (Hornok et al. 2017). Los
productos amplificados se enviaron a secuenciar por ambos lados y las
secuencias generadas se analizaron con Bioedit Sequence Alignment Editor
v.7.2.6.1 (Hall 1999) y posteriormente se compararon
mediante la herramienta BLAST de GenBank (https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastn&BLAST_SPEC=GeoBlast&PAGE_TYPE=BlastSearch).
Variables microclimáticas
Para caracterizar el microclima
de las localidades donde se capturaron los lacértidos, se usó el paquete
'NicheMapR' en R (Kearney y Porter 2017). Se
extrajeron datos de temperatura del aire (ºC) y humedad (%) relativa a un
centímetro y un metro con respecto al suelo, así como del contenido de agua de
este (%). Estos datos fueron extraídos con una resolución espacial de 10
minutos de arco y una resolución temporal del mes y año en el que fueron
colectadas las garrapatas. Un estudio reciente validó el uso de esta resolución
espacial y temporal en dichas variables microclimáticas en lacértidos (Megía-Palma et al. 2024). Se promediaron los datos
de cada variable y se realizó un análisis de componentes principales que redujo
las cinco variables climáticas a un único factor (PC1 microclima) que explicó
el 73.42% de la varianza (Tabla 1).
Tabla 1. Análisis de
componentes principales de los datos microclimáticos de las localidades
muestreadas en el presente estudio. Un único componente principal (PC1) estuvo
altamente correlacionado con todas las variables climáticas y explicó más del
73% de la varianza observada originalmente.
Table 1. Principal component analysis of the microclimatic data from the
localities sampled in the present study. A single principal component (PC1) was
highly correlated with all climatic variables and explained more than 73% of
the variance originally observed.
Análisis estadísticos
Se comparó el PC1 microclima de las localidades donde los
lacértidos presentaron garrapatas del género Ixodes con aquellas donde
no mediante un análisis de la varianza en Statistica 12.0 (Statsoft Inc.,
Tulsa, Oklahoma, EE.UU.). Además, el número de garrapatas (transformado
mediante el logaritmo decimal del número de garrapatas + 1) de todos los
individuos con o sin garrapatas se incluyó como respuesta en un modelo general
lineal en R 4.4.1 (R Core Team 2024). En este
modelo, se comprobaron simultáneamente los efectos del sexo y especie de
hospedador, así como del mes de captura, el PC1 microclima y el tamaño corporal
promedio de los lacértidos de cada población hospedadora muestreada. Se
comprobó que la distribución residual del modelo se ajustase a una distribución
gaussiana mediante una prueba de Shapiro-Wilks del paquete ‘car’ de R (Fox y Weisberg 2019) y también se comprobaron la
kurtosis y sesgo residual mediante pruebas de Anscombe-Glynn y D’Agostino del
paquete ‘moments’ (Komsta y Novomestky 2022).
Cualquier otro modelo que consideró incluir interacciones (por ejemplo, especie
× sexo) tuvieron un coeficiente de Akaike corregido para tamaños de muestra
pequeños (AICc; Bedrick y Tsai 1994) mayor de dos
unidades con respecto al modelo sin interacciones, por lo que se descartaron.
En el caso de otras interacciones, como entre especie y mes, no fue factible
por tratarse de un muestreo por conveniencia, lo que imposibilitó que hubiese
datos para todos los meses en todas las especies. Además, se comprobó la
colinearidad del modelo mediante la valoración del factor de inflación de la
varianza (VIF) en el paquete ‘car’ (Fox y Weisberg
2019) resultando valores altos cuando en el modelo se incluía especie y el
promedio de la longitud corporal por población. Por este motivo, se compararon
dos modelos independientes que incluyeron alternativamente la especie y la
longitud corporal promedio, no resultando significativa la segunda y sí la
especie. Se decidió incluir ambos predictores en el modelo final presentado
porque el efecto de la especie no se vio anulado por el efecto redundante de la
longitud corporal y porque trabajos anteriores indican que la longitud corporal
puede ser un predictor importante de la intensidad parasitaria en lacértidos
(e.g., Drechsler et al. 2021). Se realizó una
prueba de razón de verosimilitud sobre el modelo para comprobar que difería
significativamente de un modelo nulo. Por último, se aplicó pruebas a
posteriori sobre aquellos factores con varios niveles (especie y mes) cuyos
efectos principales habían resultado significativos.
Resultados
Identificación morfológica de las garrapatas
Se recolectaron 401 garrapatas (172 larvas, 227 ninfas y 2
adultos: un macho y una hembra) de 3 géneros diferentes. El 95.51%
correspondieron al género Ixodes (211 ninfas y 172 larvas), el 3.99% (16
ninfas) a Haemaphysalis punctata, y el 0.50% (2 adultos) a Hyalomma
lusitanicum. Se encontraron garrapatas del género Ixodes en todas
las especies muestreadas, exceptuando A. erythrurus (en submeseta sur),
donde las garrapatas encontradas correspondieron con Hyalomma lusitanicum,
y G. galloti (en Tenerife) donde la especie encontrada correspondió con Haemaphysalis
punctata (Tabla 2).
Un total de 179 ninfas
cumplieron las medidas de las setas descritas para I. ricinus (Fig. 2b), pero en los 20 ejemplares restantes las
medidas presentaban valores intermedios a los descritos: las setas aloscutales
fueron más de 3, pero menos de 6 veces más largas que las escutales, por lo que
eran compatibles con la morfología descrita para I. inopinatus (Estrada-Peña et al. 2014). Del total de ninfas
examinadas, 12 no se pudieron identificar por su deteriorado estado de
conservación.
Tabla 2. Número y
porcentaje respecto al total de garrapatas identificadas por especie y estadío.
Table 2. Number and percentage with respect to the total number of ticks
identified by species and stage.
Identificación molecular
de las garrapatas
De las 90 muestras de garrapatas seleccionadas para su
análisis molecular, 10 produjeron un amplicón para el gen cox1 y 8
muestras para el gen 16S. El análisis de las secuencias parciales mostró
una similitud con Ixodes ricinus entre el 98.6% y el 100% para el gen cox1
y entre el 98.56% y el 100% para el gen 16S. En el resto de las muestras
no se obtuvo ninguna amplificación probablemente debido a que habían sufrido la
degradación del ADN ya que las muestras llevaban tiempo en alcohol desde su
recogida hasta el momento de análisis.
Prevalencia de I. ricinus por zona y
especie
El 54% (n = 21) de los individuos de lagarto verdinegro, L.
schreiberi, estaban parasitados por garrapatas del género Ixodes en
un robledal de la Sierra de Guadarrama en la provincia de Segovia a 1400 m de
altitud, siendo el hospedador analizado que mayor prevalencia de garrapatas
presentó. También en la Sierra de Guadarrama, aunque a varios kilómetros de
distancia y en un hábitat diferente, por encima de los 2000 m de altitud en la
vertiente madrileña, solo el 1% de los individuos de lagartija carpetana, I.
cyreni, presentaron garrapatas (n = 100). Otras dos localidades cercanas
donde se muestreó I. cyreni (Bola del Mundo y La Najarra, n = 20)
presentaron 0% de prevalencia. Por otro lado, la lagartija de Guadarrama, P.
guadarramae, y la lagartija roquera, P. muralis, fueron capturadas
compartiendo los mismos tocones y rocas en un pinar de la provincia de Segovia
y presentaron prevalencias dispares, de 26% (n = 7) y 3% (n = 25),
respectivamente. A dos kilómetros de distancia, se encontró un 40% de
prevalencia en el lagarto ocelado, T. lepidus (n = 13) y, sin embargo,
otra población de T. lepidus muestreada a nivel del mar en un hábitat
rocoso en la costa noroccidental de Portugal no presentó garrapatas (n = 10).
Del mismo modo, otra población de P. guadarramae muestreada a 1400 m de
altitud en Madrid (n = 10), en un hábitat similar al muestreado en la vertiente
segoviana, tampoco presentó garrapatas. Otro caso notorio es el de Z.
vivipara y P. muralis que fueron capturadas a unos 1800 m de altitud
y una a escasos metros de separación en el Pirineo Oscense; la primera especie
tuvo una prevalencia de Ixodes del 29% (n = 18), mientras que P.
muralis del 3.5% (n = 28). En este sentido, la prevalencia en P. muralis
fue muy similar en Pirineos y en la Sierra de Guadarrama donde fue del 3% (n =
25). Sin embargo, la prevalencia de garrapatas sobre P. algirus en un
robledal a 1100 m de altitud en submeseta sur fue el doble (31%) que la
prevalencia observada (15%) para esta misma especie en una colina a 1430 m de
altitud y parcialmente cubierta por robles en la provincia de Segovia en la
Sierra de Guadarrama. La prevalencia para P. algirus en Sierra Nevada,
en la provincia de Granada, varió no linealmente con la altitud en las 6
altitudes muestreadas: a 300 m (n = 31) y 2200 m (n = 6) la prevalencia fue del
0%, mientras que, a 700 m, 1200 m, 1700 m, y 2400 m las prevalencias fueron del
3.45% (n = 29), 4.76% (n = 21), 11.43% (n = 35) y 3.85% (n = 26),
respectivamente.
Efectos del microclima, sexo, fenología y especie
de lacértido sobre la intensidad de garrapatas
El componente principal de
microclima generado (PC1 microclima) estuvo asociado significativa y
positivamente con las dos variables de temperatura, y significativa y
negativamente con el contenido de agua del suelo, y las dos variables de
humedad relativa (Tabla 1). El análisis de la
varianza que comparó el PC1 microclima de las localidades donde se encontraron
garrapatas sobre los lacértidos con el de aquellas donde no tuvieron garrapatas
indicó que las localidades con valores positivos de prevalencia fueron significativamente
más frías y húmedas (F1, 181 = 17.72, P < 0.001) (Fig. 3a). La intensidad de parasitación por
garrapatas del género Ixodes fue parcialmente explicada por el PC1
microclima: donde más garrapatas tenían los lacértidos fue en aquellas
localidades donde el microclima fue más cálido y seco (Tabla
3; Fig. 3b). Además, los machos tuvieron
significativamente más garrapatas que las hembras (Tabla 4;
Fig. 4a) y también hubo un efecto significativo
del mes y la especie hospedadora (Tabla 3).
Particularmente, junio y julio destacaron por ser los meses donde generalmente
encontramos un mayor número de garrapatas sobre los hospedadores (Tabla A1 del Anexo), mientras que L.
schreiberi y P. muralis tuvieron un mayor número de garrapatas que
el resto de especies y Z. vivipara la que menos (Figs.
4b y 4c; Tabla A2
del Anexo).
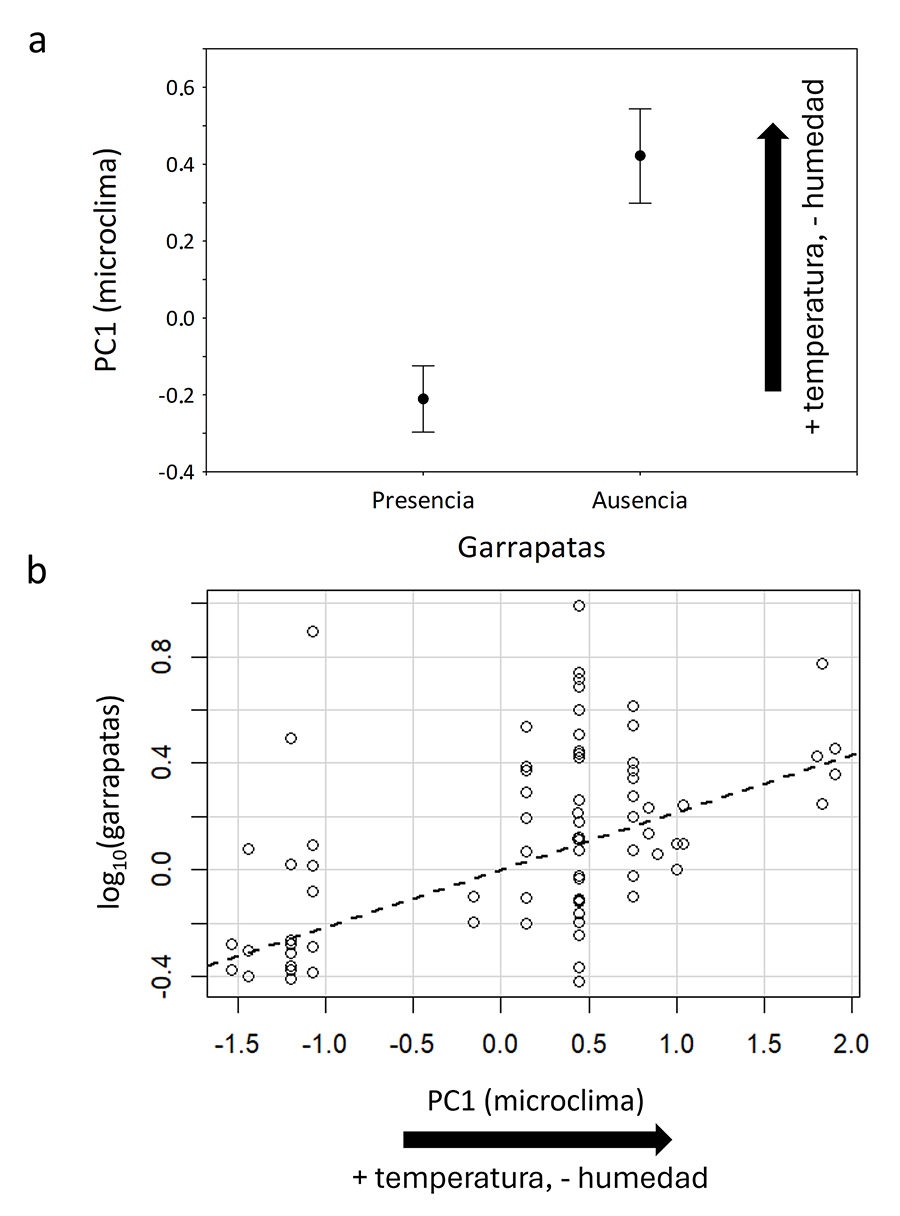
Figura 3. (a) Los puntos de muestreo
donde los lagartos y lagartijas presentaron garrapatas del género Ixodes
fueron más fríos y húmedos que aquellos otros donde no estuvieron infestados. (b)
Sin embargo, el número de garrapatas por hospedador fue mayor en aquellos
lugares que fueron más calientes y secos, de acuerdo con un modelo general
lineal presentado en la Tabla 3. En (b) se
representan los valores residuales del número de garrapatas corregido por los
efectos del mes, sexo y especie del hospedador, y la longitud corporal promedio
para cada población muestreada.
Figure 3. (a)
Sampling points where lizards presented ticks of the genus Ixodes were
colder and wetter than those where they were not infested. (b) However,
the number of ticks per host was higher in those places that were warmer and
drier, according to a general linear model presented in Table
3. In (b) the residual values of tick number corrected for the
effects of month, sex and host species, and mean body length for each sampled
population are plotted.
Tabla 3. Resultados
del modelo general lineal para explicar la variación observada en la intensidad
de garrapatas del género Ixodes sobre lagartos y lagartijas en la
muestra. SC = suma de cuadrados, g.l. = grados de libertad, F = estadístico de
Fisher. Los efectos significativos con P < 0.05 se marcan en negrita.
Table 3. Results of the general linear model to explain the variation
observed in the intensity of ticks of the genus Ixodes on lizards in the
sample. SC = sum of squares, d.f. = degrees of freedom, F = Fisher's statistic.
Significant effects with P < 0.05 are marked in bold.
Tabla 4. Número de
garrapatas del género Ixodes (N = 413) según el sexo y especie de
hospedador. Para la realización de esta tabla solo se han utilizado datos de
abundancia (= individuos infestados) para calcular la media y desviación
estándar.
Table 4. Number of ticks of the genus Ixodes (N = 413) according to
sex and host species. For the preparation of this table, only data of abundance
(= infested individuals) were used to calculate the mean and standard
deviation.
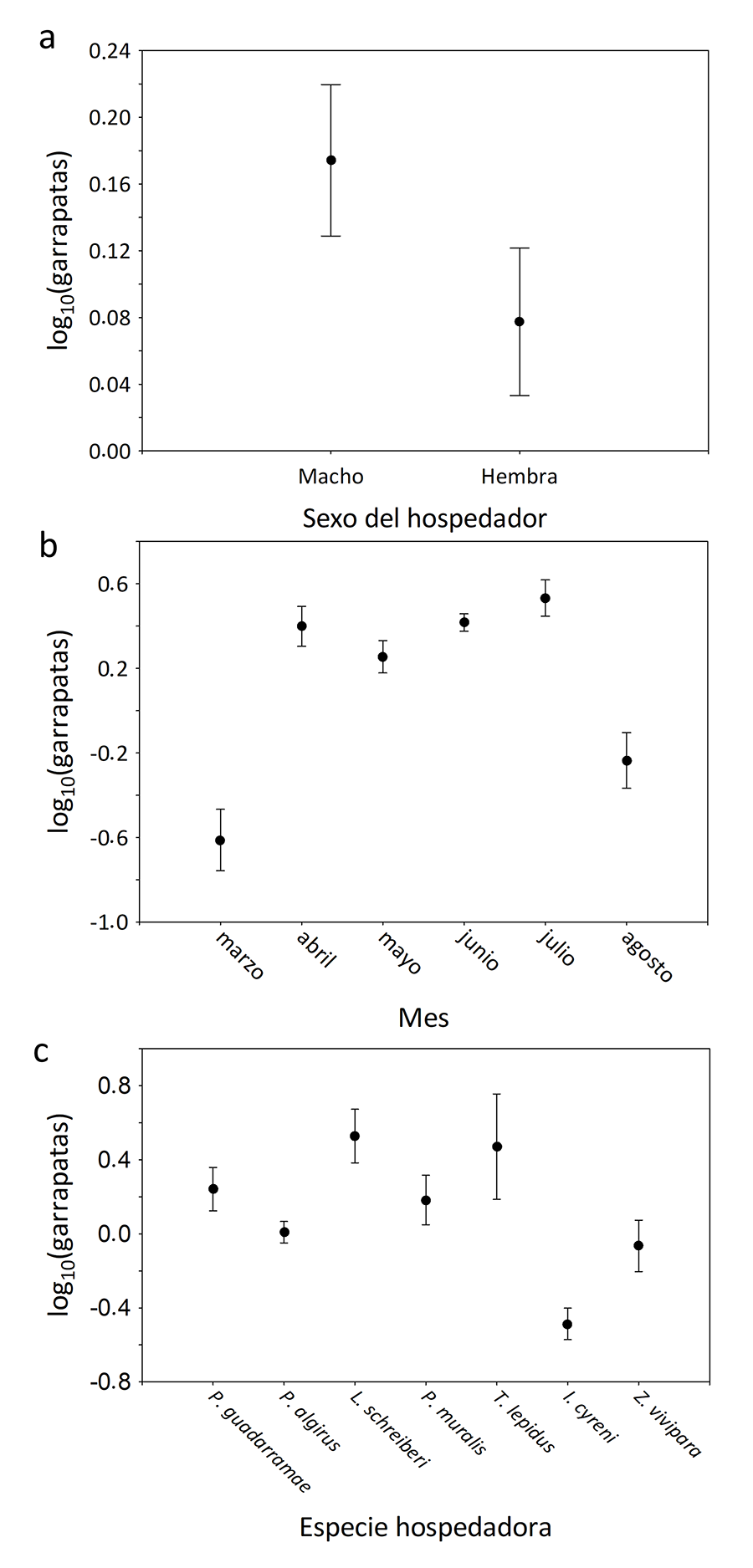
Figura 4. (a) Los machos tuvieron un
número significativamente mayor de garrapatas del género Ixodes. (b)
Efecto del mes de muestreo. (c) Efecto de la especie hospedadora.
Figure 4. (a)
Males had significantly higher numbers of ticks of the genus Ixodes. (b)
Effect of month of sampling. (c) Effect of host species.
Discusión
El 95.5% de las garrapatas encontradas en lacértidos
ibéricos y analizadas en el presente estudio pertenecieron al género Ixodes.
De ese 95.5%, el 83.8% fueron compatibles morfológicamente con I. ricinus,
el 6.8% no pudieron identificarse por especie, y el 9.4% restante se
consideraron compatibles morfológicamente con I. inopinatus. Sin
embargo, según los marcadores moleculares utilizados, nuestros resultados no
apoyaron la presencia de I. inopinatus en lacértidos ibéricos. Además,
desde su descripción en España en base a caracteres morfológicos y
secuenciación parcial del ADN ribosómico (Estrada-Peña
et al. 2014), la validez de esta especie ha sido puesta en duda (Velez et al. 2023; Daněk et al. 2024).
Por ejemplo, Hrazdilova et al. (2023) utilizaron
genomas mitocondriales completos de garrapatas colectadas en Alemania e
identificadas morfológicamente como I. inopinatus; concluyeron que estas
son genéticamente indistinguibles de I. ricinus. Asimismo, indicaron que
ni la identificación morfológica ni los genes mitocondriales permiten
diferenciar de manera efectiva estas dos presuntas especies. Además, otros
estudios también han analizado marcadores nucleares y mitocondriales de
garrapatas identificadas como I. ricinus e I. inopinatus evidenciándose
una posible hibridación entre ambas morfoespecies (Daněk
et al. 2024).
Los resultados del presente estudio complementan lo descrito
por Estrada-Peña (2015), quien afirmó que en
España existen poblaciones importantes de I. ricinus, particularmente
en la cornisa Cantábrica, en partes del Pirineo, y en algunas sierras del
centro del país, como las de La Rioja y norte de Extremadura. Nuestro estudio
aporta datos sobre la presencia del género Ixodes en el sureste
peninsular, en Sierra Nevada. Ixodes ricinus es altamente predominante
en lacértidos, aunque también destacamos que su presencia en lacértidos no es
siempre frecuente y depende de las condiciones ambientales (Dsouli et al. 2006; Soualah-Alila
et al. 2015). Las regiones geográficas en las que se encontraron I.
ricinus sobre los reptiles representan hábitats favorables para esta
especie porque son lugares donde el suelo puede permanecer húmedo durante el
día (Kahl y Gray 2023; Vucelja
et al. 2023). En este sentido, las garrapatas encontradas, en particular,
sobre la lagartija colirroja, no fueron de este género, quizás porque A.
erythrurus tiene preferencias por medios secos, arenosos y altamente
expuestos donde pueden alcanzar temperaturas corporales relativamente elevadas
(Carretero y Llorente 1995; Drechsler et al. 2021), lo que dificultaría la
presencia de garrapatas del género Ixodes. La identificación de dos
adultos de H. lusitanicum en A. erythrurus es destacable, ya que
normalmente parasitan a ungulados domésticos y silvestres (Valcárcel et al. 2023). Además, las lagartijas y
lagartos normalmente son parasitados por estadíos inmaduros (Tomassone et al. 2017). En este mismo sentido, las
garrapatas H. punctata encontradas sobre G. galloti en Tenerife
típicamente infestan ganado, ratones y conejos (Melendreras-Fernández 2019) y no sería un
parásito habitual de reptiles. De hecho, datos no mostrados revelan la ausencia
de garrapatas sobre G. galloti en 45 puntos en La Palma y Tenerife,
donde este lagarto es endémico (Megía-Palma, obs. pers.), solo habiéndose
encontrado lagartos infestados en la localidad que aquí se comunica. En un
reciente estudio (Garrido-Bautista et al. 2025,
en este monográfico) también se observaron varios P. algirus con ninfas
y larvas de Hyalomma, en localidades en el norte de África. Lo cual
sugiere que en otros contextos geográficos diferentes a la península ibérica
algunas especies de lacértidos puedan ser hospedadores más frecuentes de Hyalomma.
En el presente estudio se analizaron factores que determinan
la prevalencia e intensidad de infestación de Ixodes, porque el resto de
las especies identificadas se encontraron solo de forma puntual. Conocer la
dinámica de las relaciones entre el hospedador y el parásito es complejo porque
influyen muchos factores (Peralbo-Moreno et al.
2022). De hecho, las diferencias observadas en la intensidad de infestación
por garrapatas del género Ixodes sobre las especies hospedadoras
investigadas pudieron explicarse por (i) la especie de hospedador, (ii) el mes
de toma de muestras, (iii) el sexo del hospedador, y (iv) el clima. La especie
de lacértido que, presentando garrapatas del género Ixodes, tuvo un
número menor de ellas por individuo fue Z. vivipara, mientras que L.
schreiberi y P. muralis destacaron por ser las que más. Esto apunta
a la mayor susceptibilidad de algunas especies de lacértidos a la infestación
por garrapatas del género Ixodes, interpretación que está apoyada por el
hecho de que algunas especies de lagartija fueron capturadas a escasos metros
unas de otras y, tanto la prevalencia como el número de garrapatas, fueron
diferentes. Aun así, incluso dentro de una misma especie de lacértido, la
prevalencia e intensidad de garrapatas puede variar geográficamente,
presumiblemente como consecuencia del efecto del clima sobre la presencia y abundancia
de garrapatas en el medio.
También es un factor influyente la época del año, habiéndose
descrito las parasitaciones más elevadas por estadíos inmaduros de I.
ricinus en lacértidos al final de la temporada de reproducción, típicamente
en el mes de julio (Huyghe et al. 2010), lo que
corroboran nuestros datos por ser junio y julio los meses con mayores
intensidades de infestación después de corregir por el factor hospedador. Esto
podría estar relacionado con el ciclo biológico de I. ricinus y la
variación fenológica de su abundancia en el ambiente (Bauwens
et al. 1983), aunque dicha fenología puede variar localmente (Peralbo-Moreno et al. 2024). Además, la mayor
actividad de los lacértidos ocurre de abril a septiembre y geográficamente
concurre con la de Ixodes, en las que la humedad y temperatura tienen un
papel determinante en la distribución y abundancia de las ninfas en el ambiente
(Ruiz-Fons et al. 2012).
El hecho de que los machos de lacértido tuvieran mayores
intensidades de infestación concuerdan con trabajos anteriores (Václav et al. 2007; pero ver también Tomassone et al. 2017) y podría deberse a que su
mayor actividad reproductora a partir de finales de abril (Salvador et al. 1996) implica una mayor demanda de
energía de los machos durante este periodo y también que lo machos tienen
generalmente un mayor área de campeo (Perry y
Garland 2002), lo que los expone a más encuentros con las garrapatas. En
este sentido, la mayor actividad de desplazamiento de los machos se ha
relacionado con una mayor exposición a las garrapatas en lacértidos (Olsson et al. 2000; Wieczorek
et al. 2020). Además, el mantenimiento de elevadas cargas de garrapatas
durante los meses posteriores a la temporada de emparejamientos podría
relacionarse con un aumento de los desplazamientos asociados a una mayor
actividad termorreguladora para compensar el estrés térmico (Megía-Palma et al. 2022) y/o a un mantenimiento de
niveles altos hormonales relacionados con la reproducción (e.g., testosterona)
(Olsson et al. 2000). Nuestros datos indican sin
embargo que en agosto el número de garrapatas descendería, lo que podría
relacionarse con una menor abundancia de Ixodes en el ambiente durante
este mes (Bauwens et al. 1983).
En cuanto al componente climático, los puntos geográficos
donde encontramos garrapatas del género Ixodes sobre los lacértidos
fueron más húmedos y fríos que aquellos donde no tuvieron estas garrapatas. Sin
embargo, al analizar la intensidad de garrapatas en todos los puntos
muestreados, encontramos una relación positiva con la temperatura y negativa
con la humedad y contenido de agua del suelo. Así, dentro de los lugares donde
los lacértidos presentaron infestaciones por Ixodes, aquellos que fueron
más calientes y secos favorecieron la presencia de un mayor número de
garrapatas sobre los lacértidos. Las posibles causas de esta relación son
inciertas. Estudios anteriores encontraron que las diferencias en la carga de
garrapatas en poblaciones diferentes de la misma especie están explicadas por
rasgos de los propios hospedadores individuales, como el tamaño y condición
corporal, y el grado de agregación y de conectividad de los distintos grupos de
hospedadores en la población (Bauwens et al. 1983; Václav et al. 2007; Godfrey et
al. 2009; Dudek et al. 2016; Ferreira et al. 2023). Sin embargo, nuestros datos
también dan relevancia a factores ambientales y climáticos en consonancia con
resultados anteriores que indican que la distribución de I. ricinus está
influida por factores ambientales (Estrada-Peña et
al. 2014). Por ejemplo, trabajos anteriores muestran que los hospedadores
de I. ricinus pueden variar según la región geográfica y el tipo de
hábitat (Wu et al. 2019; Kahl y
Gray 2023) y que la abundancia en el ambiente de estos ectoparásitos es
mayor en zonas con presencia de ganado y ungulados silvestres y una mayor
cobertura vegetal (que a su vez correlaciona con las condiciones
microclimáticas).
En conclusión, los lagartos y lagartijas en la península
ibérica son hospedadores válidos para las garrapatas. Los estadíos inmaduros de
I. ricinus son claramente los más frecuentes, si bien se han observado
puntualmente parasitaciones por adultos de H. lusitanicum en A.
erythrurus y ninfas de H. punctata en G. galloti. Aunque
morfológicamente algunos ejemplares fueron compatibles con I. inopinatus,
el análisis molecular de genes mitocondriales confirmó su mayor similitud con I.
ricinus. Estos resultados concuerdan con los últimos estudios que confirman
la dificultad de diferenciación entre ambas especies. Nuestros resultados
indicaron que el sexo y especie del hospedador, así como el mes de captura, y
variables microclimáticas, pueden explicar la variación observada en la
intensidad de infestación por Ixodes ricinus en lacértidos ibéricos.
Contribución de los autores
Conceptualización, concepción y diseño de los análisis:
Candela Hernández, Rodrigo Megía-Palma, Ángeles Sonia Olmeda; Recopilación de
datos: Rodrigo Megía-Palma, Patrick S. Fitze, Senda Reguera; Obtención de
financiación y administración del proyecto: Félix Valcárcel, Gregorio
Moreno-Rueda; Análisis de los datos: Candela Hernández, Rodrigo Megía-Palma; Redacción
del manuscrito: Candela Hernández, Rodrigo Megía-Palma; Metodología: Rodrigo
Megía-Palma, Ángeles Sonia Olmeda, Candela Hernández Rojas, María Sánchez,
Raquel Martín Hernández; Revisión crítica, edición y aprobación final del
manuscrito para su publicación: Candela Hernández, Rodrigo Megía-Palma, Senda
Reguera, Patrick S. Fitze, Gregorio Moreno-Rueda, Ángeles Sonia Olmeda, Félix
Valcárcel.
Disponibilidad de los datos
Los datos empleados para este estudio se encuentran
disponibles en: https://data.mendeley.com/datasets/62r6yjxtwc/1
Financiación, permisos requeridos, potenciales
conflictos de interés y agradecimientos
Los
autores/as declaran no tener ningún conflicto de intereses.
Esta investigación ha sido cofinanciada con: proyecto GARES
(fondos EU Next Generation), Villamagna SA, y grupo ESGARIBER (SOCEPA). El
Ministerio de Economía y Competitividad y el Fondo Europeo de Desarrollo
Regional (MINECO/FEDER) aportaron fondos con los proyectos: CGL2012-32459
(PSF), y CGL-2014-55969-P a GM-R. Igualmente el Ministerio de Educación,
Cultura y Deporte financión la beca predoctoral (2010- 2014) de RM-P
(BES-2010-038427). Los datos de garrapatas se colectaron bajo los permisos de
captura de lagartijas con los siguientes códigos: 10/033298.9/13,
10/373043.9/12, 10/380311.9/12, 10/315072.9/11, 10/040449.9/13, 2012/272,
372/2013-VS (FAU13_038), DGMEN/SEN/avp_13_025_aut, Biod/MLCE-68564,
EP/CYL/101/2013, EP/SG/625/2011, EP/SG/213/2013, SGYB/EF/FJRH Re-9H/13,
INAGA/5000201/24/2013/04434, CSVZ5-4ZBJN-02QA1-DYREG, EHV/24/2010/105-106,
LCE/mp24/2012/426, 500201/24/2013/5692(1098), 2013/025426(74/CS/13). Esto
incluyó administraciones como la Dirección General de Gestión del Medio Natural
(Junta de Andalucía), y al Instituto da Conservação da Natureza e das Florestas
de Portugal (ICNF; 733/2020/CAPT), entre otras correspondientes a los códigos
que se indican.
Referencias
Amore, G., Tomassone, L., Grego, E., Ragagli, C., Bertolotti, L., Nebbia,
P., Rosati, S., et al. 2007. Borrelia lusitaniae in immature Ixodes
ricinus (Acari: Ixodidae) feeding on common wall lizards in Tuscany,
central Italy. Journal of Medical Entomology 44(2), 303–307. https://doi.org/10.1093/jmedent/44.2.303
Bauwens, D., Strijbosch, H., Stumpel, A.H.P. 1983. The lizards Lacerta
agilis and L. vivipara as hosts to larvae and nymphs of the tick Ixodes
ricinus. Ecography 6(1), 32–40. https://doi.org/10.1111/j.1600-
0587.1983.tb01062.x
Bedrick, E.J.,
Tsai, C.L. 1994. Model selection for multivariate
regression in small samples. Biometrics 50:226-231. https://doi.org/10.2307/2533213
Carretero, M.A., Llorente,
G.A. 1995. Thermal and temporal patterns of two Mediterranean
Lacertidae. Scientia herpetologica 1995, 213-223.
Collares-Pereira, M.,
Couceiro, S., Franca, I., Kurtenbach, K., Schäfer, S.M., Vitorino, L.,
Gonçalves, L., et al. 2004. First isolation of Borrelia
lusitaniae from a human patient. Journal of Clinical Microbiology 42(3),
1316–1318. https://doi.org/10.1128/JCM.42.3.1316-1318.2004
Daněk, O., Hrbatová, A., Volfová, K., Ševčíková, S., Lesiczka, P.,
Nováková, M., Ghodrati, S., et al. 2024. Italian peninsula as a hybridization
zone of Ixodes inopinatus and I. ricinus and the prevalence of
tick-borne pathogens in I. inopinatus, I. ricinus, and their
hybrids. Parasites and Vectors 17(1), 1–12. https://doi.org/10.1186/s13071-024-06271-z
de la Fuente, J., Estrada-Peña,
A., Rafael, M., Almazán, C., Bermúdez, S., Abdelbaset, A.E., Kasaija, P.D., et
al. 2023. Perception of ticks and tick-borne diseases
worldwide. Pathogens 12(10), 1258. https://doi.org/10.3390/pathogens12101258
De Sousa, R., de Carvalho, I.L.,
Santos, A.S., Bernardes, C., Milhano, N., Jesus, J., Menezes, D., et al. 2012. Role of the lizard Teira dugesii as a potential host for Ixodes
ricinus tick-borne pathogens. Applied and Environmental Microbiology
78(10), 3767–3769. https://doi.org/10.1128/AEM.07945-11
Drechsler, R.M., Belliure, J., Megía-Palma, R. 2021. Phenological and
intrinsic predictors of mite and haemacoccidian infection dynamics in a
Mediterranean community of lizards. Parasitology 148(11), 1328- 1338.
https://doi.org/10.1017/S0031182021000858
Dsouli, N., Younsi-Kabachii, H., Postic, D., Nouira, S., Gern, L.,
Bouattour, A. 2006. Reservoir role of lizard Psammodromus algirus in
transmission cycle of Borrelia burgdorferi sensu lato (Spirochaetaceae)
in Tunisia. Journal of Medical Entomology 43(4), 737–742. https://doi.org/10.1603/0022- 2585(2006)43[737: RROLPA]2.0.CO;2
Dudek, K., Skórka, P., Sajkowska, Z.A., Ekner-Grzyb, A., Dudek, M.,
Tryjanowski, P. 2016. Distribution pattern and number of ticks on lizards. Ticks
and Tick-Borne Diseases 7(1), 172–179. https://doi.org/10.1016/j.ttbdis.2015.10.014
Duque Amado, C.,
Megía-Palma, R. 2024. The Mesoamerican giant toad Rhinella
horribilis as bioindicator of vegetation degradation in a tropical forest. Basic
& Applied Herpetology 38, 77–89. https://doi.org/10.11160/bah.273
Ekner, A., Dudek, K., Sajkowska, Z., Majláthová, V., Majláth, I.,
Tryjanowski, P. 2011. Anaplasmataceae and Borrelia burgdorferi sensu lato in
the sand lizard Lacerta agilis and co-infection of these bacteria in
hosted Ixodes ricinus ticks. Parasites and Vectors 4(1), 182.
https://doi.org/10.1186/1756-3305-4-182
Estrada-Peña, A. 2015. Orden
Ixodida: Las garrapatas. Revista IDE@-SEA, 13, 30–36.
Estrada-Peña, A. 2016. Ticks as Vectors. Encyclopedia of Parasitology, 34(1),
2729–2729. https://doi.org/10.1007/978-3-662-43978-4_3182
Estrada-Peña, A., Nava, S., Petney, T. 2014. Description
of all the stages of Ixodes inopinatus n. sp. (Acari: Ixodidae). Ticks
and Tick-Borne Diseases 5(6), 734–743. https://doi.org/10.1016/j.ttbdis.2014.05.003
Estrada-Peña, A., Mihalca,
A.D., Petney, T.N. 2017. Ticks of Europe and North Africa:
A guide to species identification. Springer
International Publishing AG. https://doi.org/10.1007/978-3-319-63760-0
Ferreira, A.I., Damas-Moreira, I., Marshall, K.L.A., Perera, A., Harris,
D.J. 2023. What influences the prevalence and intensity of haemoparasites and
ectoparasites in an insular lizard? Animals 13(4), 723. https://doi.org/10.3390/ani13040723
Fox, J.,
Weisberg, S. 2019. An R Companion to Applied
Regression, Third edition. Sage, Thousand Oaks CA, USA. https://socialsciences.mcmaster.ca/jfox/Books/Companion/
Garrido-Bautista, J.,
Moreno-Rueda, G., Zamora-Camacho, F.J., Comas, M., Laghzaoui, E.M., Carretero,
M.A., Rocha A.D., et al. 2025. Geographic variation in tick
parasitism and impact on immune physiology of the lizard Psammodromus
algirus across its distribution range. Ecosistemas 34(2) 2931,
https://doi.org/10.7818/ECOS.2931
Godfrey, S.S., Bull, C.M., James, R., Murray, K. 2009. Network structure
and parasite transmission in a group living lizard, the gidgee skink, Egernia
stokesii. Behavioral Ecology and Sociobiology 63, 1045- 1056. https://doi.org/10.1007/s00265-009-0730-9
Hall, T.A. 1999. BioEdit: a user-friendly biological sequence alignment
editor and analysis program for Windows 95/98/NT. Nucleic Acids Symposium
Series 41:95-98
Hornok, S., Sándor, A.D., Beck, R., Farkas, R., Beati, L., Kontschán, J.,
Takács, N., et al. 2017. Contributions to the phylogeny of Ixodes (Pholeoixodes)
canisuga, I. (Ph.) kaiseri, I. (Ph.) hexagonus
and a simple pictorial key for the identification of their females. Parasites
and Vectors 10(1), 545. https://doi.org/10.1186/s13071-017-2424-x
Hrazdilova, K., Danek, O., Hrbatova, A., Cervena, B., Noskova, E., Adamik, P.,
Votypka, J., et al. 2023. Genetic analysis challenges the presence of Ixodes
inopinatus in Central Europe: development of a multiplex PCR to distinguish
I. inopinatus from I. ricinus. Parasites and Vectors
16(1), 354. https://doi.org/10.1186/s13071-023-05971-2
Hurtado, O.J.B.,
Giraldo-Ríos, C. 2019. Economic and health impact of the
ticks in production animals. In: Abubakar, M., Perera, P.K., (eds.), Ticks
and Tick-Borne Pathogens, pp. 1–19. IntechOpen, London, UK.
Huyghe, K., Van Oystaeyen, A., Pasmans, F., Tadić, Z., Vanhooydonck, B.,
Van Damme, R. 2010. Seasonal changes in parasite load and a cellular immune
response in a colour polymorphic lizard. Oecologia 163, 867-874.
https://doi.org/10.1007/s00442-010-1646-9
Kahl, O., Gray, J.S. 2023. The biology of Ixodes ricinus with emphasis on its ecology. Ticks
and Tick- Borne Diseases 14(2), 102114. https://doi.org/10.1016/j.ttbdis.2022.102114
Kearney, M.R.,
Porter, W.P. 2017. NicheMapR—an R package for
biophysical modelling: the microclimate model. Ecography 40, 664-674.
https://doi.org/10.1111/ecog.02360
Komsta, L.,
Novomestky, F. 2022. moments: Moments, Cumulants,
Skewness, Kurtosis and Related Tests. R package version 0.14.1. https://CRAN.R-project.org/package=moments
Ministerio de Sanidad. Mapa
Gares. Plan Nacional de prevención, Vigilancia y control de Enfermedades
Transmitidas por Vectores. Gobierno de España. Madrid, España. [Fecha de
consulta: 03/2025] https://www.sanidad.gob.es/areas/alertasEmergenciasSanitarias/preparacionRespuesta/Plan_Vectores.htm
Megía-Palma, R., Martínez, J.,
Merino, S. 2018. Manipulation of parasite load induces
significant changes in the structural-based throat color of male Iberian green
lizards. Current Zoology 64(3), 293- 302. https://doi.org/10.1093/cz/zox036
Megía-Palma, R., Barja, I., Barrientos, R. 2022. Fecal glucocorticoid
metabolites and ectoparasites as biomarkers of heat stress close to roads in a
Mediterranean lizard. Science of the Total Environment 802, 149919. https://doi.org/10.1016/j.scitotenv.2021.149919
Megía‐Palma, R., Cuervo, J.J., Fitze, P.S., Martínez,
J., Jiménez‐Robles, O.,
De la Riva, I., Reguera, S., et al. 2024. Do sexual
differences in life strategies make male lizards more susceptible to parasite
infection? Journal of Animal Ecology 93(9), 1338-1350. https://doi.org/10.1111/1365-2656.14154
Melendreras-Fernández, B. 2019. Enfermedades víricas transmitidas por garrapatas
en Canarias: ¿sería posible la transmisión en Canarias del Crimea-Congo? Trabajo
de fin de máster en Diagnostico e Investigación de Enfermedades tropicales. Universidad
de La Laguna. http://riull.ull.es/xmlui/handle/915/14811
Mendoza-Roldan, J.A.,
Colella, V., Lia, R.P., Nguyen, V.L., Barros-Battesti, D.M., Iatta, R., Dantas-
Torres, F., et al. 2019. Borrelia burgdorferi (sensu lato) in ectoparasites and reptiles in southern Italy.
Parasites & Vectors 12, 35. https://doi.org/10.1186/s13071-019-3286-1
Nava, S., Guglielmone,
A.A. 2023. Ixodidae. En: Claps, L.E., Roig-Juñent, S., Morrone, J.J. (eds.), Biodiversidad
de Artrópodos Argentinos, Vol. 5, pp. 296-306. Facultad de Ciencias
Naturales e Instituto Miguel Lillo, Universidad Nacional de Tucumán, Argentina.
http://hdl.handle.net/11336/252130
Olsson, M., Wapstra, E., Madsen, T., Silverin, B. 2000. Testosterone,
ticks and travels: a test of the immunocompetence-handicap hypothesis in
free-ranging male sand lizards. Proceedings of the Royal Society of London. Series
B: Biological Sciences 267(1459), 2339-2343. https://doi.org/10.1098/rspb.2000.1289
Orlova, M.V., Doronin, I.V., Doronina, M.A., Anisimov, N.V. 2023. A review
of ixodid ticks (Acari: Ixodidae) associated with Lacerta spp.
(Reptilia: Lacertidae) from the Caucasus and adjacent territory. Diversity 15(10), 1026. https://doi.org/10.3390/d15091026
Peralbo-Moreno, A.,
Baz-Flores, S., Cuadrado-Matías, R., Barroso, P., Triguero-Ocaña, R.,
Jiménez-Ruiz, S., et al. 2022. Environmental factors driving
fine-scale ixodid tick abundance patterns. Science of the Total Environment
853, 158633. https://doi.org/10.1016/j.scitotenv.2022.158633
Peralbo-Moreno, A., Espí,
A., Barandika, J.F., García-Pérez, A.L., Acevedo, P., Ruiz-Fons, F. 2024. Spatiotemporal dynamics of Ixodes ricinus abundance in
northern Spain. Ticks and Tick-borne Diseases 15(6), 102373. https://doi.org/10.1016/j.ttbdis.2024.102373
Perry, G.,
Garland Jr, T. 2002. Lizard home ranges revisited:
effects of sex, body size, diet, habitat, and phylogeny. Ecology 83(7),
1870-1885. https://doi.org/10.1890/0012-9658(2002)083[1870:LHRREO]2.0.CO;2
Poupon, M., Lommano, E., Humair, P., Douet, V., Rais, O., Schaad, M.,
Jenni, L., et al. 2006. Prevalence of Borrelia burgdorferi sensu lato in
ticks collected from migratory birds in Switzerland. Applied and
Environmental Microbiology 72. https://doi.org/10.1128/AEM.72.1.976-979.2006
R Core Team 2024. R: A Language and Environment for Statistical Computing. R
Foundation for Statistical Computing, Vienna, Austria. https://www.R-project.org/
Ruiz-Fons, F., Fernández-de-Mera,
I.G., Acevedo, P., Gortázar, C., de la Fuente, J. 2012. Factors
driving the abundance of Ixodes ricinus ticks and the prevalence of
zoonotic I. ricinus-borne pathogens in natural foci. Applied
and Environmental Microbiology 78(8), 2669–2676. https://doi.org/10.1128/AEM.06564-11
Salvador, A., Veiga, J.P.,
Martin, J., Lopez, P., Abelenda, M., Puerta, M. 1996. The cost
of producing a sexual signal: testosterone increases the susceptibility of male
lizards to ectoparasitic infestation. Behavioral Ecology 7(2), 145–150.
https://doi.org/10.1093/beheco/7.2.145
Salvador, A., Veiga, J.P.,
Civantos, E. 1999. Do skin pockets of lizards reduce the
deleterious effects of ectoparasites? An experimental study with Psammodromus
algirus. Herpetologica 55(1), 1–7. http://www.jstor.org/stable/3893063
Soualah-Alila, H., Bouslama, Z., Amr, Z., Bani Hani, R. 2015. Tick infestations
(Acari: Ixodidae) on three lizard species from Seraidi (Annaba District),
northeastern Algeria. Experimental and Applied Acarology 67(1), 159–163.
https://doi.org/10.1007/s10493-015-9932-1
Tomassone, L., Ceballos, L.A., Ragagli, C., Martello, E., De Sousa, R.,
Stella, M.C., Mannelli, A. 2017. Importance of common wall lizards in the
transmission dynamics of tick-borne pathogens in the Northern Apennine
Mountains, Italy. Microbial Ecology 74(4), 961–968. https://doi.org/10.1007/s00248-017-0994-y
Václav, R., Prokop, P., Fekiač, V. 2007. Expression of breeding
coloration in European green lizards (Lacerta viridis): variation with
morphology and tick infestation. Canadian Journal of Zoology 85(12), 1199-1206. https://doi.org/10.1139/Z07-102
Valcárcel, F., Elhachimi, L., Vilá, M., Tomassone, L., Sánchez, M., Selles,
S.M., Kouidri, M., et al. 2023. Emerging Hyalomma lusitanicum: From
identification to vectorial role and integrated control. Medical and
Veterinary Entomology 37(3), 425–459. https://doi.org/10.1111/mve.12660
Velez, R., Meeûs, T.D., Beati, L., Younsi, H., Zhioua, E., Antunes, S.,
Domingos, A., et al. 2023. Development and testing of microsatellite loci for
the study of population genetics of Ixodes ricinus Linnaeus, 1758 and Ixodes
inopinatus Estrada-Peña, Nava & Petney, 2014 (Acari: Ixodidae) in the
western Mediterranean region. Acarologia 63(2): 356-372. https://doi.org/10.24349/bvem-4h49
Vucelja, M., Krčmar, S., Habuš, J., Perko, V.M., Boljfetić, M., Bjedov,
L., Margaletić, J. 2023. Altitudinal distribution, seasonal dynamics and Borrelia
burgdorferi Sensu lato infections in hard ticks (Acari: Ixodidae) in
different forest communities in inland Croatia. Sustainability
(Switzerland), 15(6): 4862. https://doi.org/10.3390/su15064862
Wieczorek, M., Rektor, R., Najbar, B., Morelli, F. 2020. Tick parasitism is
associated with home range area in the sand lizard, Lacerta agilis. Amphibia
Reptilia 41(4), 479–488. https://doi.org/10.1163/15685381-bja10018
Wu, Q., Richard, M., Rutschmann, A., Miles, D.B., Clobert, J. 2019.
Environmental variation mediates the prevalence and co-occurrence of parasites
in the common lizard, Zootoca vivipara. BMC
ecology 19, 1-11. https://doi.org/10.1186/s12898-019-0259-3
Anexo / Appendix
Table A1. Resultado del análisis a posteriori de Bonferroni
resultante de los efectos principales del mes que explican la variación en la
intensidad de parasitación por garrapatas en lacértidos ibéricos.
Table A1. Results of a Bonferroni’s post-hoc analysis resulting from the
main effects of the month that explain the variation in the intensity of tick
parasitism in Iberian lacertids.
Tabla A2. Resultado
del análisis a posteriori de Bonferroni resultante de los efectos principales
de la especie de hospedador que explican la variación en la intensidad de
parasitación por garrapatas en lacértidos ibéricos.
Table A2. Results of a Bonferroni’s post-hoc analysis resulting from the main
effects of the host species that explain the variation in the intensity of tick
parasitism in Iberian lacertids.
![]() ,
Ángeles Sonia Olmeda1,2
,
Ángeles Sonia Olmeda1,2 ![]() , Félix Valcárcel2,3
, Félix Valcárcel2,3 ![]() , María Sánchez2
, María Sánchez2 ![]() , Patrick S. Fitze4
, Patrick S. Fitze4 ![]() , Senda Reguera5
, Senda Reguera5 ![]() , Gregorio
Moreno-Rueda6
, Gregorio
Moreno-Rueda6 ![]() , Raquel Martín-Hernández7
, Raquel Martín-Hernández7 ![]() ,
Rodrigo Megía-Palma8
,
Rodrigo Megía-Palma8 ![]()



