El seguimiento de la introducción de especies exóticas
presenta problemas relacionados con, por ejemplo, la falta de taxónomos
expertos que puedan identificarlas tempranamente, o la dificultad en rastrear
el tráfico a nivel internacional (Simberloff 2014).
No obstante, trazar un seguimiento de las especies introducidas mediante la jardinería
es bastante factible, ya que son las autoridades locales las que deciden qué
especies se cultivan en los jardines públicos, apoyándose en las directrices de
los planes urbanísticos, así como en expertos botánicos, técnicos paisajistas,
proveedores locales y, ocasionalmente, la población. Es bien sabido que la
cultura de cada región juega un papel importante en la toma de decisiones, al
establecerse vínculos entre la población y las especies vegetales con las que
históricamente se ha relacionado (p. ej., Heinrich et
al. 1998 en México; Redzic 2007 en Bosnia y
Herzegovina; o Arriaza et al. 2004 y Gras et al. 2019 en España).
Debido a esto, en los últimos años, estudiar cuáles son las
cualidades de las especies que las hacen atractivas para ser cultivadas en
nuestros jardines públicos está tomando relevancia (véase Thuiller et al. 2006; Ruiz-Hernández
et al. 2021). Estudios recientes prueban que la población urbana aprecia
más en sus parques a las especies ornamentales con rasgos relacionados con la
estética y la fenología (Kendal et al. 2012; Aronson et al. 2016; Kato et al.
2017; Wang et al. 2019; Mendes
et al. 2024). Además, la capacidad de proveer servicios estéticos y
culturales en los parques urbanos también se ha convertido en una de las
principales razones para la introducción deliberada de especies exóticas ornamentales
(Vaz et al. 2018). Por ejemplo, los ciudadanos
británicos muestran una clara predilección por las plantas exóticas, coloridas,
que no producen muchos residuos y que atraen a los insectos. Además, los
ciudadanos también se sienten atraídos hacia lo que consideraban poco común o
estructuralmente complejo (Hoyle et al. 2017a). Goodness (2018) llegó a las mismas conclusiones llevando
a cabo un estudio similar en Ciudad del Cabo, Sudáfrica; con la excepción de
que la ciudadanía posee una mayor conciencia sobre la importancia de preservar
las especies nativas. No obstante, pese a la cantidad de literatura científica
basada mayoritariamente en cuestionarios que describen preferencias sobre
rasgos vegetales, existe una carencia de estudios que investiguen si hay
diferencias entre la relación de los rasgos estéticos con el origen y el
potencial invasor de las especies.
Nuestro estudio analiza la composición vegetal leñosa y su
origen en los principales parques urbanos de España peninsular, con el objetivo
de describir los rasgos estéticos de las especies más representativas. Además,
hemos investigado si existen diferencias entre estos rasgos, el origen y el
grado de invasión de las especies exóticas en los espacios naturales.
1. ¿Cuáles
son las especies ornamentales leñosas y familias más cultivadas en los parques
urbanos de la España peninsular?
2. ¿Cuál es
la proporción de especies exóticas y, de estas, cuáles se encuentran
establecidas o son invasoras en el medio natural?
3. ¿Qué
caracteres foliares, florales, de los frutos, corteza y copa de los árboles
puedan explicar la elección de plantas ornamentales?
4. ¿Hay
diferencias en estos rasgos según el origen y el grado de invasión de las
plantas ornamentales leñosas exóticas?
Se recopilaron inventarios de especies vegetales leñosas de
59 parques y jardines públicos urbanos presentes en 27 localidades repartidas
por todo el territorio peninsular español (Fig. 1).
Los datos se tomaron del repositorio en línea “Vivir los parques”
(www.vivirlosparques.es; último acceso: 14 Feb 2024) creado por la “Asociación
Española de Parques y Jardines Públicos” (AEPJP 2019).
Este repositorio proporciona la información más actualizada sobre inventarios
vegetales en los parques urbanos españoles. Nuestro
estudio supone una actualización y ampliación de los resultados de Bayón et al. (2021) mediante la actualización de los
parques disponibles, los inventarios de especies en cada uno de ellos y la toma
de datos sobre rasgos en los repositorios consultados.
De todas las especies presentes en los repositorios, se
seleccionaron solo aquellas que presentan un crecimiento secundario leñoso
aéreo (i.e., árboles, arbustos, cactus y palmeras). Las especies herbáceas,
rizomatosas y tuberculosas se excluyeron porque su cultivo puede variar
drásticamente de unos años a otros. Para armonizar y actualizar la nomenclatura
de los taxones a nivel de especie se utilizaron las herramientas en línea
“World Flora Online” (WFO 2024; último acceso: 2 Mar 2024)
y “Catalogue of Life” (Bánki et al. 2024; último
acceso: 2 Mar 2024). Luego, los taxones infraespecíficos se estandarizaron al
nivel taxonómico de especie (p. ej., Pyrus calleryana var.
graciliflora pasó a ser Pyrus calleryana). Se descartaron los
taxones supra-específicos, indeterminados e híbridos (p. ej., Abies sp.,
Pinus spp. o Citrus × aurantium). La aplicación de estos filtros
resultó en la reducción de los 635 taxones obtenidos inicialmente, hasta un
total de 541 especies leñosas pertenecientes a 91 familias. Por último, se
acotó la selección de especies de análisis a aquellas presentes en un mínimo de
dos parques; así, nuestro estudio se centra en 342 especies leñosas. Este
filtro facilitó obtener una base de datos representativa de la flora ornamental
y sus rasgos a nivel peninsular.
Para cada especie seleccionada, se comprobó su región de
procedencia y se le asignó una categoría de origen y grado de invasión
siguiendo la terminología propuesta por Richardson et
al. (2000):
Se seleccionaron 11 rasgos
estéticos categóricos (2 de hojas, 3 de flores, 3 de frutos, 1 de semillas, 1
de copas y 2 de cortezas) de cada una de las especies de estudio. En la Tabla 1 se muestran los rasgos, sus categorías y el
número de especies de estudio en cada categoría.
|
Rasgo
|
Categoría
|
|
Origen
|
Nativas (68), Exóticas no establecidas
(164), Exóticas establecidas (97) y Exóticas invasoras (13)
|
|
Forma
de la hoja
|
Ovada
(59), Elíptica (51), Lanceolada (44), Acicular (31), Palmada (24), Linear
(23), Oblonga (20), Escama (17), Obovada (12), Costapalmada (12), Cordada
(9), Lobada (5), Trifoliada (5), Romboidal (4), Orbicular (3), Digitada (2),
en Abanico (2), Deltoidea (2), Flabelada (1) y Variable (16)
|
|
Tipo
de hoja
|
Simple
(257), Pinnada (77), Bipinnada (7) y Variable (1)
|
|
Color
de la unidad sexual
|
Blanco
(102), Amarillo (90), Verde (37), Rojo (32), Marrón (19), Rosa (14), Morado
(12), Naranja (6), Azul (3) y Variable (27)
|
|
Forma
de la unidad sexual
|
Amento
(62), Panícula (61), Racimo (38), Corimbo (35), Actinomorfa (20), Espádice
(18), Umbela (16), Globosa (14), Glomérulos (9), Cónica (9), Espiga (8),
Fascículo (8), Capítulo (4), Dicasio compuesto (4), Sicono (4), Umbela
compuesta (4), Pseudoracimo (3), Cima helicoidal (2), Tirso (2), Policasio
(2), Dicasio (1) y Variable (18)
|
|
Tipo
de unidad sexual
|
Inflorescencia
racimosa (127), Inflorescencia compuesta (67), Estróbilo (61), Inflorescencia
cimosa (47), Flor solitaria (20), Inflorescencia especializada (4) y Variable
(16)
|
|
Color
del fruto
|
Marrón
(138), Rojo (50), Negro (39), Amarillo (26), Morado (25), Verde (22), Naranja
(15), Blanco (10), Azul (7), Gris (2) y Rosa (2) y Variable (6)
|
|
Forma
del fruto
|
Drupa
(86), Baya (55), Cápsula (50), Samara (26), Cono cilíndrico (23), Nuez (24),
Cono globoso (20), Vaina (19), Aquenio (6), Gálbulo (5), Pomo (5), Folículo
(4), Siconio (4), Polidrupa (4), Esquizocarpo (2), Plurifolículo (3), Arilo
(3), Esporófilo (2) y Balausta (1)
|
|
Tipo
de fruto
|
Carnoso
(141), Seco dehiscente (68), Seco indehiscente (62), Cono (43), Fruto
múltiple (11), Cono modificado (8), Infrutescencia (7) y Esporangio*
(2)
|
|
Tipo
de unidad de dispersión
|
Semilla
(244), Fruto (63), Segmento del fruto (28), Infrutescencia (2) y Variable (5)
|
|
Forma
de la copa
|
Redondeada
(140), Cónica (57), Arbustiva (51), Extendida en fuente (42), Columnar (16),
Trepadora (15), Cónica inversa (8), Irregular (7) y Pendular (6)
|
|
Textura
de la corteza
|
Surcos
(142), Suave (75), Descamada en fibras (41), Lenticelas (27), Descamada en
parches (8) y Otros (49),
|
|
Color
de la corteza
|
Marrón
(146), Gris (140), Roja (13), Verde (12), Blanco (9), Negro (1), Morado (1),
Amarillo (1) y Variable (19)
|
|
* Un esporangio no es un fruto, pero se incluye en esta categoría
por ser la estructura que forma las diásporas.
|
Estos rasgos estaban relacionados con el color, la forma y
la textura de diversas partes de las plantas, y la información sobre ellos se
solicitó al repositorio TRY-Plant Trait Database (Kattge
et al. 2020). En TRY se encontró información para el 40 % de los datos
solicitados, de forma que el resto se consultó en herramientas digitales (Material Suplementario.
Lista S1) de acuerdo con la siguiente jerarquía:
1º Descripción
de los tipos originales.
2º Descripciones
taxonómicas actualizadas publicadas en la literatura científica.
3º Descripciones
de paratipos o neotipos preservados en herbarios virtuales universitarios o
estatales.
4º Claves de
identificación dicotómica.
5º Descripciones
botánicas en Floras digitales que no hacen referencia directa a un espécimen
preservado.
6º Información
disponible en viveros en-línea.
Tras conseguir información
sobre todos los rasgos, se simplificó y armonizó la nomenclatura de las
categorías de cada rasgo como sigue. Se descartó la terminología relacionada
con tonalidades o colores intermedios (p. ej., “pardo” o “amarillo claro” pasaron
a ser “marrón” y “amarillo”), y se desecharon nombres minoritarios dados a
formas de flores y hojas, y se aproximaron a formas similares y más comunes (p.
ej., “ovo-elíptica” o “cuneada” se renombraron como “ovada” y “obovada”,
respectivamente). También se incluyeron dos categorías nuevas: la categoría
“variable” se refiere a aquellos rasgos de especies que presentan un espectro
amplio de caracteres igualmente representados, o bien para los casos en los que
no se encontró información clara sobre cuál de los caracteres es el
predominante. Por otro lado, la categoría “otro”, presente solo en la variable
“Textura de la corteza”, se utiliza para designar a especies cuyas cortezas no
presentan un patrón claro o pueden presentan varios patrones a la vez, pero este
patrón no varía sustancialmente entre individuos como sí ocurre con la
categoría “variable”.
Análisis de datos
El análisis estadístico se llevó a cabo en la versión 4.2.2
de R (R Core Team 2022).
Primero, se hizo una exploración y clasificación de los
datos utilizando el paquete “dplyr” (Wickham et al. 2023),
que dispone de herramientas muy útiles de ordenación de datos y estadística
descriptiva. De este modo, se ordenaron las especies según su familia y origen;
y se exploraron la abundancia y variabilidad de los valores de cada rasgo.
Posteriormente, para cada variable, se crearon dos tablas de
contingencia incluyendo la variable “origen” y la frecuencia de los rasgos. En
una tabla se agrupó la variable “origen” en “nativas” y “exóticas”. En la otra
tabla se incluyeron solo las especies exóticas, con el objetivo de comparar las
distintas categorías (no establecidas, naturalizadas e invasoras) entre ellas.
Luego se aplicó una prueba de chi-cuadrado de Pearson (χ²) a cada tabla y
variable para analizar las diferencias dentro de cada variable. La tabla de
contingencia se creó utilizando la colección de paquetes “tidyverse” (Wickham et al. 2019), y el χ² se llevó a cabo
utilizando la función “chisq.test()” disponible en la versión base de R.
Finalmente, se analizaron los residuos estandarizados de los
test χ² con el objetivo de ver la dirección y la fuerza de las diferencias
entre categorías para cada clase de origen. Se consideraron significativos
todos los resultados del test χ² asociados a un p-valor < 0.05,
notado «*»; o los residuos estándar > |1.96|. También se consideraron dos
índices de significancia superiores en p-valor < 0.01 o residuos
estándar > |2.58| (notados «**») y p-valor < 0.001 o residuos
estándar > |3.29| (notados «***»).
Resultados
Composición de especies
En los parques urbanos analizados se han encontrado un total
de 342 especies leñosas pertenecientes a 183 géneros y 66 familias. Cada
especie está presente en una media de 10 ± 8.64 (media ± desv. est.) parques.
En concreto, 227 (66.4 %) especies están presentes en 10 parques o menos, 71
(20.8 %) especies están presentes en el rango de 10 a 20 parques, y 43 (12.6 %)
especies están cultivadas en 20 parques o más. Las especies más cultivadas son Cupressus
sempervirens (Cupressaceae, naturalizada), plantada en 43 (72.9 %) parques;
Robinia pseudoacacia (Fabaceae, invasora), presente en 35 (59.3 %); y Cedrus
atlantica (Pinaceae, naturalizada), Cedrus deodara (Pinaceae,
naturalizada), Celtis australis (Cannabaceae, naturalizada) y Styphnolobium
japonicum (Fabaceae, exótica no establecida), presentes en 34 (57.6 %).
En cuanto a la división taxonómica, hemos encontrado 281
especies de angiospermas y 61 especies de gimnospermas. Entre las angiospermas,
263 especies tienen forma de árbol o arbusto y 18 especies tienen forma de
palmera. Las familias más comunes son Rosaceae, representada por 40 especies (11.7
%); y Arecaceae, representada por 34 especies (9.94 %). Por debajo, las
familias Cupressaceae y Pinaceae cuentan con 21 y 20 especies respectivamente (6.14
% y 5.85 %), y las 227 especies restantes pertenecen a 62 familias con menos de
20 representantes por familia (<5 %).
En cuanto al origen, hemos encontrado 68 especies nativas (19.9
%) y 274 especies exóticas (80.1 %). Entre las exóticas, 164 especies (47.9 %)
no se encuentran establecidas en el medio natural, 97 especies (28.4 %) están
naturalizadas y 13 (3.8 %) son invasoras. Las especies catalogadas como
invasoras son Acacia dealbata (Fabaceae), Acer negundo (Sapindaceae),
Ailanthus altissima (Simaroubaceae), Buddleja davidii (Scrophulariaceae),
Elaeagnus angustifolia (Elaeagnaceae), Eriobotrya japonica (Rosaceae),
Eucalyptus camaldulensis (Myrtaceae), Eucalyptus globulus
(Myrtaceae), Gleditsia triacanthos (Fabaceae), Lonicera japonica
(Caprifoliaceae), Parkinsonia aculeata (Fabaceae), Robinia
pseudoacacia (Fabaceae) y Schinus molle (Anacardiaceae).
Rasgos estéticos
La Tabla 2
muestra los resultados para el test estadístico χ² entre los rasgos y el origen
y grado de invasión de las especies. En el material suplementario (Tabla
S2), se incluye la dirección del efecto para cada carácter en los rasgos
que muestran diferencias.
Tabla 2. Resultados
del test χ² llevado a cabo entre cada rasgo y el origen y grado de invasión de
las exóticas. Las diferencias significativas se
muestran en negrita. *: p-valor < 0.05, **: p-valor <
0.01, ***: p-valor < 0.001.
Table 2. Results for the χ² test performed between each trait and the origin
and the invasion status of the species. Significant
differences are shown in bold. *: p-value < 0.05, **: p-value < 0.01, ***: p-value < 0.001.
Hojas
En las clasificaciones según el tipo y forma de las hojas (Fig. 2), hemos encontrado que la mayoría de especies
tienen hojas simples con formas muy distintas, siendo las más comunes las hojas
ovadas, elípticas y lanceoladas. La hiedra virgen (Parthenocissus
tricuspidata), una planta naturalizada trepadora, es la única
especie con tipo de hoja “variable”, pues tiene hojas compuestas pero el número
de divisiones de la hoja no es fijo entre individuos.
La forma y el tipo de hoja no difiere entre especies nativas
y exóticas (Fig. 2A, B). No obstante, sí hay
diferencias dentro de las especies exóticas (Fig. 2C, D):
entre las especies exóticas no establecidas no se han encontrado diferencias
según el tipo de hoja, pero sí presentan una menor frecuencia de hojas con
forma de escama que las especies naturalizadas e invasoras. Las especies
naturalizadas tampoco muestran diferencias con respecto al tipo de hoja, pero
sí se han encontrado más especies con hojas con forma de escama y ovada; en
cambio, presentan menos hojas lineares. Por último, las especies invasoras
presentan diferencias en el tipo de hoja, englobando casi a la totalidad de
especies con hoja bipinnada y también mostrando más hojas de forma linear y
variable que el resto; en cambio, presentan menos hojas de tipo simple.
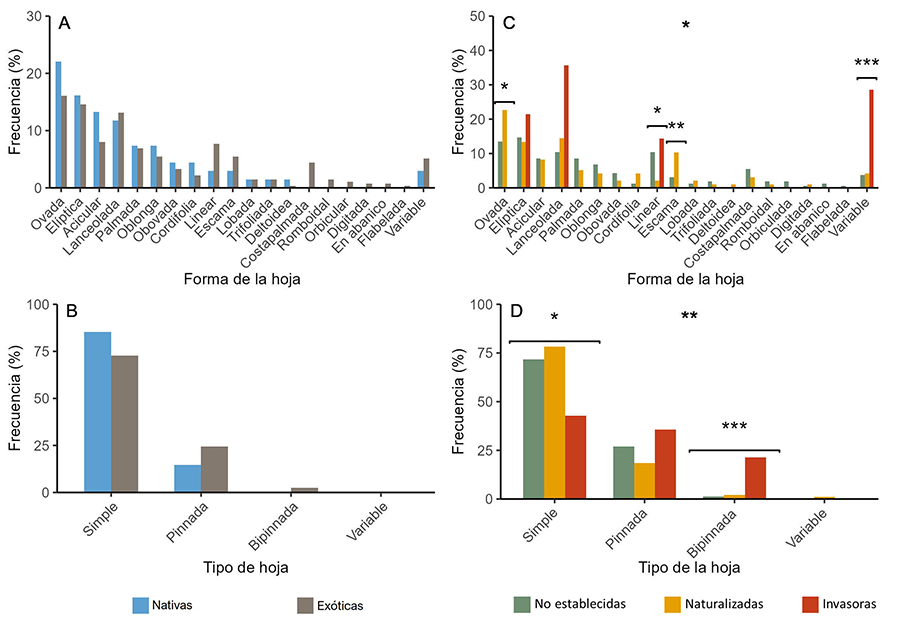
Figura 2. Frecuencia (%) de aparición de cada
categoría para los rasgos Forma y Tipo de la hoja, según el origen (A-B)
y el grado de invasión (C-D). Nótese que los ejes Y pueden mostrarse en
escalas distintas. Las diferencias significativas se notan con asteriscos. *: p-valor
< 0.05 o residuos estándar > |1.96|, **: p-valor < 0.01 o
residuos estándar > |2.58|, ***: p-valor < 0.001 o residuos
estándar > |3,29|.
Figure 2. Frequency (%) of occurrence of each category for leaf Shape and
Type traits, according to origin (A-B) and invasion status (C-D). Please note that Y axis might be shown in different scales.
Significant differences are marked with asterisks. *: p-value < 0.05 or standardized
residuals > |1.96|, **: p-value < 0.01 or standardized residuals > |2.58|, ***: p-value < 0.001 or standardized
residuals > |3.29|.
Unidades sexuales
La mayoría de especies agrupan sus flores en inflorescencias
racimosas o compuestas que se muestran en forma de panículas, racimos o
corimbos de color blanco, amarillo o verde. Las especies con flores solitarias
son minoritarias, y siempre se trata de flores de simetría actinomorfa. Las
unidades sexuales de tipo estróbilo siempre muestran forma de amento, de color
predominantemente marrón. En cuanto a la categoría “variable”, si se refiere al
tipo de unidad sexual, generalmente hace referencia a plantas Angiospermas
dioicas en las que cada sexo presenta un tipo distinto de flores; y si se
refiere al color, puede tratarse tanto de flores policromadas (p. ej., el
castaño de Indias –Aesculus hippocastanum–, con flores blanco-rosadas) o
bien de flores en las que el color cambia durante o tras la polinización (p. ej.,
el género Betula, con flores inicialmente verdes que se tornan rojas o
amarronadas tras la polinización).
No hay distinción ni en el color ni en el tipo de la unidad
sexual entre especies nativas y exóticas, ni tampoco según el grado de
invasión. La forma de la unidad sexual (Fig. 3A, C),
por su parte, si presenta diferencias entre nativas y exóticas. Las especies
nativas presentan unidades sexuales agrupadas principalmente en inflorescencias
con formas de umbela compuesta y glomérulos, y en menor medida en forma de
amento.
Las especies exóticas exhiben unidades sexuales en forma de
espádice. No hemos encontrado diferencias para la forma de la unidad sexual
según el grado de invasión.
Frutos y unidades dispersivas
Las especies leñosas analizadas tienen generalmente frutos
carnosos en forma de drupa o baya; seguidos por los frutos secos (dehiscentes e
indehiscentes), mayoritariamente con forma de cápsula o sámara. Los estróbilos
femeninos de las gimnospermas tienen forma de conos cilíndricos o globosos.
En cuanto al color, en su mayoría encontramos frutos
marrones, rojos o negros. Los frutos de color variable generalmente pertenecen
a especies de interés agrícola como el manzano europeo (Malus domestica),
de la cual se cultivan muchas variedades con frutos de colores muy diversos.
Ni el tipo de fruto ni su color difieren según el origen y
grado de invasión de las especies. En cambio, la forma del fruto sí es
distinguible entre especies nativas y exóticas (Fig. 3C):
las especies nativas tienen frutos con forma de nuez, y, en menor medida, de
pomo; mientras que las especies exóticas muestran una alta frecuencia de
estróbilos (conos) con forma globosa. No se encontraron diferencias para la
forma del fruto entre especies exóticas.
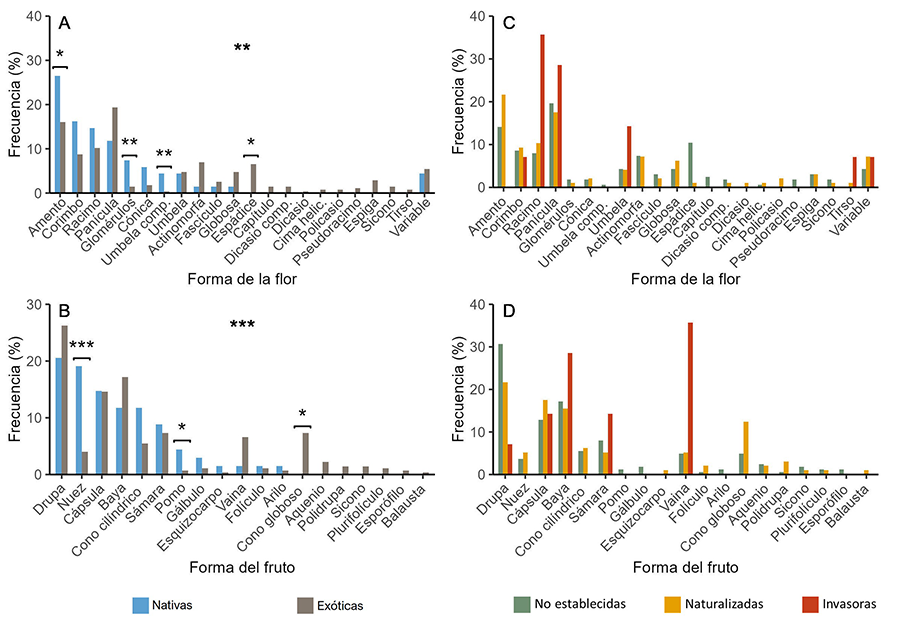
Figura 3. Frecuencia (%) de aparición de cada
categoría para los rasgos Forma de la unidad sexual y Forma del fruto, según el
origen (A-B) y el grado de invasión (C-D). Nótese que los ejes Y
pueden mostrarse en escalas distintas. La notación sobre la significancia es la
misma que en la Figura 2.
Figure 3. Frequency (%) of occurrence of each category for the sexual unit
Shape and fruit Shape traits, according to origin (A-B) and invasion status (C-D). Please note that Y axis might be shown in different scales. Significant
differences notation is the same as in Figure 2.
Con respecto a las unidades dedicadas a la dispersión, la
mayoría de especies dispersan su descendencia en semillas. Las especies con
unidades dispersivas variables presentan unos tipos u otros en base al método
de dispersión. El tipo de unidad dispersiva no está asociada ni al origen ni al
grado de invasión.
Copas y cortezas
En su mayoría, las especies muestran copas redondeadas
asimilables a esferas, cónicas, o en fuente como en las palmeras. Las copas de
las especies nativas (Fig. 4A, C) son más
frecuentemente de formas irregulares; mientras que las de las especies exóticas
muestran copas caedizas en fuente. El tipo de copa no difiere entre especies
exóticas.
Por lo general, las cortezas con surcos, seguidas por las
cortezas suaves son las más comunes. Las especies nativas (Fig.
4B) presentan cortezas con surcos pronunciados por acumulación de
súber, mientras que las exóticas tienen cortezas más heterogéneas (categoría “otros”),
con una mayor diversidad de patrones. Entre las exóticas (Fig.
4D), volvemos a encontrar este patrón entre especies no establecidas y
naturalizadas: las no establecidas presentan frecuentemente cortezas de textura
heterogénea y menos cortezas con surcos; mientras que las naturalizadas
presentan más cortezas con surcos y menos cortezas heterogéneas.
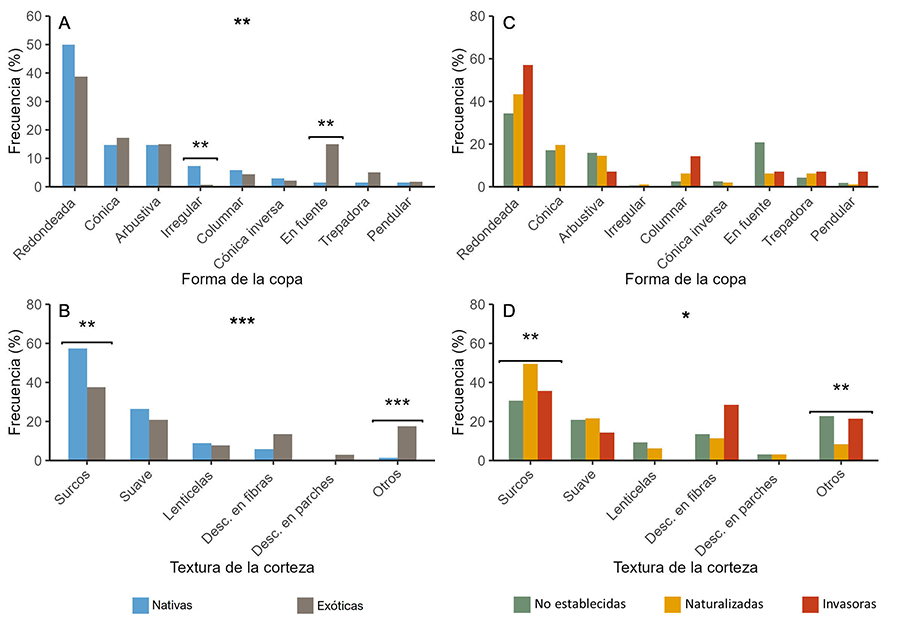
Figura 4. Frecuencia (%) de aparición de cada
categoría para los rasgos Forma de la copa y Textura de la corteza, según el
origen (A-B) y el grado de invasión (C-D). Nótese que los ejes Y
pueden mostrarse en escalas distintas. La notación sobre la significancia es la
misma que en la Figura 2.
Figure 4. Frequency (%) of occurrence of each category for the traits canopy
Shape and bark Texture, according to origin (A-B) and invasion status (C-D). Please note that Y axis might be
shown in different scales. Significant differences notation is the same
as in Figure 2.
En cuanto al color de la corteza, mayoritariamente
encontramos cortezas marrones o grises, seguidas por cortezas de color
variable, que normalmente varían entre estos dos colores más comunes según la
etapa de la vida del individuo. No hay una distinción clara en el color de la
corteza según el origen y grado de invasión de la especie.
Discusión
Aunque la investigación sobre las actividades humanas que
facilitan e impulsan las invasiones biológicas ha aumentado considerablemente
en las últimas décadas, existen pocos estudios que aporten luz sobre la
relación entre la introducción de especies exóticas y cuestiones socioculturales
(Hulme et al. 2023). Nuestro estudio supone un
acercamiento a esta cuestión por medio del análisis del nexo entre los rasgos
estéticos de plantas leñosas ornamentales típicamente preferidas por la
población (Aronson et al. 2016; Goodness
2018).
Los resultados de nuestra investigación muestran que la
composición de especies leñosas de los parques en España presenta algunas
similitudes a la de los países europeos con clima mediterráneo, pero es
distinta a los países centroeuropeos y nórdicos. En los países mediterráneos
como España, Italia, Grecia o Turquía, las peculiaridades del clima, las
características del suelo o los lazos culturales han permitido y favorecido el
cultivo de palmeras con bajas necesidades hídricas, además de determinadas especies
como la Acacia del Japón (Styphnolobium japonicum, exótica no
establecida), las del género Pinus o Cupressus, o las de la
familia Rosaceae (p. ej., Heywood 2017; Çoban et al. 2020; Bartoli et al.
2022). En cambio, en el norte de Europa, la alta continentalidad, una mayor
frecuencia de precipitaciones y el frío hacen desaparecer los cultivos de
palmeras y especies tropicales y subtropicales, que son reemplazadas por
coníferas y especies caducifolias, como las de los géneros Acer y Tilia
(p. ej., Szwagrzyk y Gazda 2007; Sjöman et al. 2012). Es importante también destacar que
en los parques de España hay un mayor número de especies exóticas que en otros
países europeos.
Entre especies nativas y exóticas, encontramos una
distinción clara según la forma de sus órganos y la textura de sus cortezas. Las
especies nativas están representadas por géneros emblemáticos de la flora
nativa mediterránea, de los cuales se cultivan muchos taxones emparentados con
rasgos similares. Por ejemplo, los géneros Viburnum y Quercus
están compuestos mayoritariamente por especies nativas, con 4 especies nativas
de 5 totales en el primer caso, y 9 de 12 en el segundo. En cuanto a sus
rasgos, el género Viburnum es el único que presenta inflorescencias en
umbela compuesta; mientras que el género Quercus es un gran
representante de los frutos en forma de nuez y las cortezas con surcos
pronunciados, debido posiblemente a una fuerte suberización. También
encontramos especies nativas aromáticas muy emblemáticas como el enebro (género
Juniperus), con estróbilos de formas similares a pequeños glomérulos.
Las especies exóticas, por su parte, incluyen grupos
taxonómicos representados únicamente por especies exóticas que aportan rasgos
exclusivos. Un ejemplo claro son las palmeras, con 48 especies exóticas y solo
una especie nativa (el palmito, Chamaerops humilis). Las palmeras poseen
inflorescencias en espádice y copas extendidas en fuente, que son casi
inexistentes en especies que no sean palmeras y, por tanto, entre las especies
nativas.
El grupo de las coníferas también presenta diferencias
interesantes entre especies nativas y exóticas. En ambos casos, se cultivan
géneros muy emblemáticos que, a su vez, contienen muchas especies. Sin embargo,
la mayoría de las coníferas nativas pertenecen a la familia Pinaceae, que
poseen conos masculinos en forma de amentos y conos femeninos de forma
cilíndrica, además de hojas aciculares. En cambio, las coníferas exóticas están
representadas por la familia Cupressaceae, que muestra una heterogeneidad de
formas de conos masculinos, conos femeninos de forma globosa y hojas en forma
de escama.
Para la división según el grado de invasión, encontramos que
las especies naturalizadas tienen rasgos muy similares a las especies nativas,
mientras que las que no consiguen establecerse tienen rasgos distintos. El
rasgo “corteza con surcos”, muy presente en especies nativas y naturalizadas,
está muy poco representado en exóticas no establecidas. Especies exóticas que
comparten características con especies nativas son por ejemplo el pino de
Monterrey (Pinus radiata) y el roble rojo americano (Quercus rubra).
Muchos árboles frutales exóticos y de interés comercial como el caqui (Diospyros
kaki) o el ciruelo de jardín (Prunus cerasifera) también
tienen caracteres similares a las especies nativas, como cortezas con surcos o
frutos en forma de pomo. Estos árboles han logrado establecerse en comunidades
naturales, lo que posiblemente ha sido facilitado por su amplio cultivo.
En cuanto a las especies invasoras, se distinguen del resto
de especies exóticas en el tipo y la forma de sus hojas, y en ambos casos, las
diferencias pueden explicarse por la relación de la morfología foliar con el
área específica foliar. La morfología foliar es un rasgo activamente
seleccionado en la planificación del arbolado urbano porque está asociado a
servicios ecosistémicos importantes como la provisión de sombra y la captación
de CO2 (Reich et al. 1999; Millward y Sabir 2010). Las plantas ornamentales
invasoras poseen una mayor frecuencia de hojas bipinnadas y una menor
frecuencia de hojas simples. Esta mayor división de las hojas concuerda con una
mayor área foliar. Muchas plantas invasoras poseen una elevada área específica
foliar lo cual les ofrece una mayor capacidad fotosintética (Grotkopp y Rejmánek 2007).
Dos de las tres especies invasoras con hojas bipinnadas son
especies de acacias: la mimosa (Acacia dealbata) y la acacia de tres
espinas (Gleditsia triacanthos). Las invasiones de las acacias en
ecosistemas mediterráneos han sido ampliamente estudiadas y sus impactos son
bien conocidos. Las acacias alteran las condiciones bioquímicas y estructurales
del suelo, y sus invasiones no solo pueden estar relacionadas con el tipo o
forma de sus hojas, sino que también con su capacidad de fijar N (Souza-Alonso et al. 2017).
Según la forma de las hojas, existe además una asociación
entre la forma linear y la forma variable. Las hojas lineares, como las del
árbol del paraíso (Elaeagnus angustifolia), suelen presentar bajos
valores de área específica foliar, que les confiere menor capacidad de
transpiración y captación de recursos fotosintéticos, pero también previene una
excesiva pérdida de agua y protege contra la herbivoría, lo que las hace más resistentes
a las perturbaciones (Wright et al. 2017). Las hojas
de forma variable, en concreto, pertenecen al eucalipto rojo (Eucalyptus
camaldulensis), al eucalipto blanco (Eucalyptus globulus), al
arbusto de las mariposas (Buddleja davidii) y al negundo (Acer
negundo). Estas especies comparten una heterofilia similar: en individuos
juveniles, las hojas tienen forma ovada; mientras que, en los adultos, las
hojas se estrechan y toman una forma lanceolada o similar. Así, estas especies
poseen una estrategia de economía foliar apta para las necesidades del individuo
durante todo el ciclo vital.
Por último, no hemos encontrado diferencias según el grado
de invasión para los rasgos de las coníferas. En nuestros resultados, las
coníferas naturalizadas destacan por su pertenencia a géneros ampliamente
cultivados como Cupressus o Thuja, pero no por sus rasgos
estéticos. En esta línea, muchos estudios relacionan la capacidad
invasora de las coníferas con los rasgos ecológicos que comparten, como la
dispersión por anemocoria, la alta capacidad de regeneración tras
perturbaciones o el establecimiento de redes micorrícicas a nivel poblacional (Richardson y Rejmánek 2004; Farjon 2018; Fanal 2021), rasgos
que no hemos analizado como de interés estético.
Nuestros resultados están respaldados por la bibliografía al
respecto, que demuestra que la población europea considera que las especias
exóticas aportan rasgos estéticos novedosos y complejidad a los ecosistemas
urbanos (Hoyle et al. 2017a,
2017b; Patoilo-Teixeira et al. 2022).
Además, diversos estudios en ecología demuestran que las especies exóticas con
rasgos similares a los de las especies nativas tienen una mayor facilidad para
establecerse en comunidades naturales (Van Kleunen et
al. 2010; Divísek et al. 2018).
Sin embargo, en nuestro estudio no hemos encontrado
diferencias para los rasgos relacionados el color de los órganos. Es bien
conocido que el color de los órganos sexuales y los frutos son rasgos estéticos
importantes para la población (Kaufman y Lohr 2004;
Peschardt y Stigsdotter 2013; Hoyle et al. 2017a, 2017b; Goodness 2018). El color también es importante para la
atracción de polinizadores y dispersores, que son organismos clave en la
reproducción de las especies (Castro-Urgal y
Traveset 2016; Ornal y Keasar 2020; Geert 2021). La imposibilidad de diferenciar el origen y
grado de invasión a partir del color puede deberse a la sobrerrepresentación de
algunas categorías que son comunes entre grupos de origen y grado de invasión.
Por ejemplo, los frutos de color marrón representan el 40 % del total de frutos
y son compartidos entre muchos taxones, mientras que la mayoría de los otros
colores tienen una representación inferior al 10 % y pertenecen a grupos de
origen o grado de invasión concretos.
Conclusiones
Nuestro estudio evidencia que algunos rasgos estéticos
pueden influir en las preferencias por la introducción de especies exóticas.
Además, algunas de estas especies que consiguen naturalizarse también se
distinguen por sus rasgos, mientras que las especies invasoras solo pueden
distinguirse por el tipo y la forma de sus hojas. Muchas especies invasoras con
rasgos poco comunes pertenecen a grupos taxonómicos exóticos, que además poseen
asociados otros rasgos funcionales que favorecen su invasión, como es el caso
comentado de las acacias. Para obtener un conocimiento más profundo de los
factores que influyen en la invasión, son necesarios estudios que establezcan
un nexo entre los rasgos estéticos, importantes para la introducción de
especies exóticas; y los rasgos funcionales, cruciales para su establecimiento (Thuiller 2006; Drenovsky 2012).
Estos estudios pueden ser de enorme utilidad para realizar análisis de riesgo
de invasión de especies potencialmente invasoras puesto que la probabilidad de
que una especie sea invasora depende de que sea introducida, de que tenga
capacidad para establecerse y que pueda ocasionar impactos (Cano-Barbacil et al. 2023). Abogamos
por más estudios que identifiquen los rasgos de las especies ornamentales y
exploren su relación con el origen de las especies, así como su posible papel
en el paso a través de los distintos estadios de invasión.
Contribución de los autores
M. Vilà: Concepción del estudio, supervisión, adaptación y
revisión de la metodología, redacción, revisión y edición del texto. R.
Morón-López: toma y curación de datos, adaptación de la metodología, análisis
formal, redacción y edición del texto.
Disponibilidad de datos
En el Material
Suplementario (https://doi.org/10.7818/ECOS.2900MS) se aporta un conjunto de datos que incluye: 1) la
lista de especies analizadas en este estudio, su familia y su origen (Tabla S1);
2) la lista de recursos consultados para la recopilación de datos sobre rasgos
estéticos (Lista S1); 3) los resultados del test χ² llevado a cabo entre
cada rasgo y el origen y grado de invasión de las especies estudiadas (Tabla
S2), y 4) las frecuencias relativas de los caracteres analizados para todos
los rasgos (Figura S1).
La base de datos de especies y sus rasgos, así como la de
presencia de especies en los parques están disponibles en https://doi.org/10.5281/zenodo.15045669
Financiación, permisos requeridos, potenciales
conflictos de interés y agradecimientos
Esta investigación ha estado financiada por el proyecto
RADIOPOPO (PID2021-122690OB-I00) financiada por
MCIN/AEI/10.13039/501100011033/FEDER, UE. Agradecemos al repositorio TRY (Ref.
31914) y sus colaboradores por proporcionar parte de la información necesaria
para la toma de datos de este estudio; así como a Álvaro Bayón por la ayuda en
la concepción de la metodología. Agradecemos el trabajo riguroso del revisor
que comentó un primer borrador de este manuscrito.
Los autores/as declaran no tener ningún conflicto de
intereses.
Referencias
Aronson,
M.F.J., Nilon, C.H., Lepczyk, C.A., Parker, T.S., Warren, P.S., Cilliers, S.S.,
Goddard, M.A., et al. 2016. Hierarchical filters determine
community assembly of urban species pools. Ecology 97(11):2952–2963. https://doi.org/10.1002/ecy.1535
Arriaza, M., Cañas-Ortega, J.F.,
Cañas-Madueño, J.A., Ruiz-Aviles, P. 2004. Assessing the
visual quality of rural landscapes. Landscape and Urban Planning
69(1):115-125. https://doi.org/10.1016/j.landurbplan.2003.10.029
Asociación Española de
Parques y Jardines Públicos 2019. Vivir los Parques [used February 14,
2024]. Disponible en: http://www.vivirlosparques.es
Bánki, O., Roskov, Y., Döring, M.,
Ower, G., Hernández-Robles, D.R., Plata-Corredor, C.A., Stjernegaard-Jeppesen,
T., et al. 2024. Catalogue of life (Version 2024-02-22) [used March 2, 2024]. Catalogue
of Life Secretariat, Amsterdam, Netherlands. Available
at: https://www.catalogueoflife.org/
Bartoli, F., Savo, V., Caneva, G. 2022. Biodiversity
of urban Street trees in Italian cities: a comparative analysis. Plant
Biosystems 156(3):649-662. https://doi.org/10.1080/11263504.2021.1906347
Bayón, A., Vilà, M. 2019. Horizon scanning to identify invasion risk of ornamental
plants marketed in Spain. NeoBiota 52:47-86. https://doi.org/10.3897/neobiota.52.32113
Bayón, A., Godoy, O., Maurel, N.,
van Kleunen, M., Vilà, M. 2021. Proportion of non-native
plants in urban parks correlates with climate, socioeconomic factors and plant
traits. Urban Forestry & Urban Greening 63:127215. https://doi.org/10.1016/j.ufug.2021.127215
Breuste, J., Schnellinger, J., Qureshi, S., Faggi, A. 2013. Urban Ecosystem
Services on the Local Level: Urban Green Spaces as Providers. Ekológia
32(3):290-304. https://doi.org/10.2478/eko-2013-0026
Cano-Barbacil, C., Carrete,
M., Castro-Díez, P., Delibes-Mateos, M., Jaques, J.A., López-Darias, M.,
Nogales, M., et al. 2023. Identification of potential invasive
alien species in Spain through horizon scanning. Journal of Environmental
Management 345: 118696. https://doi.org/10.1016/j.jenvman.2023.118696
Castro-Urgal,
R., Traveset, A. 2016. Contrasting
Partners’ Traits of Generalized and Specialized Species in Flower-Visitation
Networks. PLoS ONE 11(3):e0150824. https://doi.org/10.1371/journal.pone.0150824
Castroviejo, S. 2012. Flora
Ibérica. Real Jardín Botánico, CSIC, Madrid.
Caughlin, T.T., Clark, M., Jochems, L.W., Kolarik, N., Zaiats, A., Hall, C.,
Winiarski, J.M., et al. 2023. Socio-ecological interactions promote outbreaks
of a harmful invasive plant in an urban landscape. Ecological Solutions and
Evidence 4(2): e12247. https://doi.org/10.1002/2688-8319.12247
Chiesura, A. 2004. The role of urban parks for the sustainable city. Landscape
and Urban Planning 68(1):129-138. https://doi.org/10.1016/j.landurbplan.2003.08.003
Çoban, S., Doganay Yener, S., Bayraktar, S. 2020. Woody plant composition
and diversity of urban green spaces in Istanbul, Turkey. Plant Biosystems
155(1):83-91. https://doi.org/10.1080/11263504.2020.1727980
Diagne, C., Leroy, B., Vaissière, A.C., Gozlan, R.E., Roiz, D., Jarić, I.,
Salles, J.M., et al. 2021. High and rising economic costs of biological
invasions worldwide. Nature 592: 571-576. https://doi.org/10.1038/s41586-021-03405-6
Divísek, J., Chytrý, M., Beckage, B., Gotelli, N.J., Lososová, Z., Pysek,
P., Richardson, D.M., et al. 2018. Similarity of introduced plant species to
native ones facilitates naturalization, but differences enhance invasion
success. Nature Communications 9:4631. https://doi.org/10.1038/s41467-018-06995-4
Drenovsky, R.E., Grewell, B.J., D’Antonio, C.M., Funk, J.L., James, J.J.,
Molinari, N., Parker, I.M., et al. 2012. A Functional Trait Perspective on
Plant Invasion. Annals of Botany 110(1):141-153. https://doi.org/10.1093/aob/mcs100
European Commission: Directorate-General for Environment. July 13, 2017. Commission
implementing regulation (EU) 2017/1263 of 12 July 2017 updating the list of
invasive alien species of Union concern established by Implementing Regulation
(EU) 2016/1141 pursuant to Regulation (EU) No 1143/2014 of the European
Parliament and of the Council. Official Journal of the European Union,
L. 182/37. http://data.europa.eu/eli/reg_impl/2017/1263/oj
European Commission: Directorate-General for Environment 2020a. EU Biodiversitry
Strategy for 2030: Bringing Nature Back into our Lives (COM/2020/380
final). European Commission. Brussels. Belgium. https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=celex:52020DC0380
European Commission: Directorate-General for Environment 2020b. Invasive Alien
Species of Union Concern. Version 2020, Publications Office. https://data.europa.eu/doi/10.2779/791940
Fanal, A., Mahy, G., Fayolle, A., Monty, A. 2021. Arboreta reveal the
invasive potential of several conifer species in the temperate forests of
western Europe. NeoBiota 64:23-42. https://doi.org/10.3897/neobiota.64.56027
Farjon, A. 2018. Conifers of the World. Kew Bulletin 73:8. https://doi.org/10.1007/S12225-018-9738-5
Geary, R.S., Wheeler, B., Lovell, R., Jepson, R., Hunter, R., Rodgers, S.
2021. A call to action: Improving urban green spaces to reduce health
inequalities exacerbated by COVID-19. Preventive Medicine 145:106425. https://doi.org/10.1016/j.ypmed.2021.106425
Geert, Y. 2021. The role of plant functional traits in organising
plant-pollinator interactions. [Doctoral Dissertation]. Charles University,
Czech Republic. http://hdl.handle.net/20.500.11956/125303
Goodness, J. 2018. Urban landscaping choices and people’s selection of plant
traits in Cape Town, South Africa. Environmental Science & Policy
85:182-192. https://doi.org/10.1016/j.envsci.2018.02.010
Gras, A., Serrasoles, G., Vallès, J., Garnatje, T. 2019. Traditional knowledge in semi-rural close to industrial areas:
Ethnobotanical studies in western Gironès (Catalonia, Iberian Peninsula). Journal
of Erthnobiology and Ethnomedicine 15(1):19. https://doi.org/10.1186/s13002-019-0295-2
Grotkopp,
E., Rejmánek, M. 2007. High seedling relative
growth rate and specific leaf area are traits of invasive species:
Phylogenetically independent contrasts of woody angiosperms. American
Journal of Botany 94(4):526-532. https://doi.org/10.3732/ajb.94.4.526
Hall, D.M., Camilo, G.R.,Tonietto, R.K., Ollerton, J., Ahrne K.,
Arduser, M., Ascher, J.S., et al. 2016. The city as a refuge for insect
pollinators. Conservation Biology 31(1):24-29. https://doi.org/10.1111/cobi.12840
Haubrock, P.J., Turbelin, J., Cuthbert, R.N., Novoa, A., Taylor, N.G.,
Angulo, E., Ballesteros-Mejua, L., et al. 2021. Economic costs of invasive
alien species across Europe. NeoBiota 67:153-190. https://doi.org/10.3897/neobiota.67.58196
Heinrich, M., Ankli, A., Frei, B., Weimann, C., Sticher, O. 1998. Medicinal
plants in Mexico: Healers’ consensus and cultural importance. Social Science
and Medicine 47(11):1859-1871. https://doi.org/10.1016/S0177-9536(98)00181-6
Heywood, V.H. 2017. The nature and composition of urban plant diversity in
the Mediterranean. Flora Mediterranea 27:195-220. https://doi.org/10.7320/FlMedit27.195
Hoyle, H., Hitchmough, J., Jorgensen, A. 2017a. Attractive,
climate-adapted and sustainable? Public perception of non-native planting in
the designed urban landscape. Landscape and Urban Planning 164:49-63. https://doi.org/10/1016/j.landurbplan.2017.03.009
Hoyle, H., Hitchmough, J., Jorgensen, A. 2017b. All about the ‘wow
factor’? The relationships between aesthetics, restorative effect and perceived
biodiversity in designed urban planting. Landscape and Urban Planning 164:109-123.
https://doi.org/10.1016/j.landurbplan.2017.03.011
Hulme, P.E. 2006. Beyond control: wider implications for the management
of biological invasions. Journal of Applied Ecology 43(5):835-847. https://doi.org/10.1111/j.1365-2664.2006.01227.x
Hulme, P.E. 2014. Invasive species challenge the global response to
emerging diseases. Trends in Parasitology 30(4):267-270. https://doi.org/10.1016/j.pt.2014.03.005
Hulme, P.E., Ikeda, T., Vandvik, V.,
Blanchard, R., Camacho-Cervantes, M., Herrera, I., Koyama, A., et al. 2023. Drivers affecting biological Invasions. In: Roy, E.H., Pauchard, A.,
Stoett, P. & Renard Truong, T. (eds.), Thematic Assessment Report on
Invasive Alien Species and their Control of the Intergovernmental
Science-Policy Platform on Biodiversity and Ecosystem Services, Chapter 3.
IPBES Secretariat, Bonn, Germany. https://doi.org/10.5281/zenodo.7430727
Hussner, A., Stiers, I., Verhofstad, M.J.J.M., Bakker, E.S., Grutters,
B.M.C., Haury, J., van Valkenburg, J.L.C.H., et al. 2017. Management and
control of methods of invasive alien freshwater aquatic plants: A review. Aquatic
Botany 136: 112-137. https://doi.org/10.1016/j.aquabot.2016.08.002
IPBES 2019. Global assessment report of the Intergovernmental Science-Policy
Platform on Biodiversity and Ecosystem Services, Brondízio, E.S., Settele, J.,
Díaz, S., Ngo, H.T. (eds). IPBES secretariat, Bonn, Germany. 1144 pages. ISBN:
978-3-947851-20-1. https://files.ipbes.net/ipbes-web-prod-public-files/inline/files/ipbes_global_assessment_report_summary_for_policymakers.pdf
IUCN 2000. IUCN Guidelines for the Prevention of Biodiversity Loss
Caused by Alien Species. IUCN Species Survival Commission (SSC): Invasive
Species Specialist Group, Auckland, New Zealand. Available at: https://portals.iucn.org/library/node/12413
Kato, S., Hishiyama, K., Darmadi, A., Suprapta, D. 2017. Changing roles of traditional small urban green spaces (Telajakan)
in Bali, Indonesia. Open Journal of Ecology 7:1-11.
Kattge, J., Bönisch, G., Díaz, S., Lavorel, S., Prentice, I.C., Leadley,
P., Tautenhahn, S., et al. 2020. TRY plant trait database – enhanced coverage
and open access. Global Change Biology 26(1):119-188. https://doi.org/10.1111/gcb.14904
Kaufman, A.J.,
Lohr, V.I. 2004. Does plant color affect emotional
and physiological responses to landscapes? Acta Horticulturae
639:229–233. https://doi.org/10.17660/ActaHortic.2004.639.29
Keller, R.P., Geist, J., Jeschke, J.M., Kühn, I. 2011. Invasive species in
Europe: ecology, status, and policy. Environmental Sciences Europe
23:23. https://doi.org/10.1186/2190-4715-23-23
Kendal, D., Williams, K.J., Williams, N.S. 2012. Plants traits link
people’s plant preferences to the composition of their gardens. Landscape
and Urban Planning 105(1-2):34-42. https://doi.org/10.1016/j.landurbplan.2011.11.023
Lee, A.C., Jordan, H.C., Horsley, J. 2015. Value of urban green spaces
in promoting healthy living and wellbeing: prospects for planning. Risk
Management and Healthcare Policy 8:131-137. https://doi.org/10.2147/RMHP.S61654
Mendes, P., Goyette, J.O., Cottet, M., Cimon-Morin, J., Pellerin, S.,
Poulin, M. 2024. The aesthetic value of natural vegetation remnants, city parks
and vacant lost: The role of ecosystem features and observer characteristics. Urban
Forestry & Urban Greening 98: 128388. https://doi.org/10.1016/j.ufug.2024.128388
Millward,
A.A., Sabir, S. 2010. Structure of a forested urban
park: Implications for strategic management. Journal of Environmental
Management 91(11):2215-2224. https://doi.org/10.1016/j.jenvman.2010.06.006
MITECO 2023. Order TED/339/2023, of April 7, 2023, modifying the annex of
the Royal Decree 630/2013, of August 2, 2013, regulating the Spanish Catalog on
Invasive Exotic Species. Ministerio para la Transición Ecológica y el
Reto Demográfico. BOE 83, de 7 de abril de 2023, pp. 50910-50915. https://www.boe.es/eli/es/o/2023/03/30/ted339
Ornal, A., Keasar, T. 2020. Floral Complexity Traits as Predictor of Plant-Bee Interactions in a
Mediterranean Pollination Web. Plants 9(11):1432. https://doi.org/10.3390/plants9111432
Padullés-Cubino, J., Borowy, D., Knapp, S., Lososová, Z., Ricotta, C., Siebert, S.,
Cavender-Bares, J., et al. 2021. Contrasting Impacts of Cultivated Exotics on
the Functional Diversity of Domestic Gardens in Three Regions with Different
Aridity. Ecosystems
24:875-890. https://doi.org/10.1007/s10021-020-00556-x
Patoilo-Teixeira, C., Oliveira-Fernandez, C., Ryan, R., Ahern, J. 2022. Attitudes and preferences towards plants in urban green spaces:
Implications for the design and management of Novel Urban Ecosystems. Journal
of Environmental Management 314:115103. https://doi.org/10.1016/j.jenvman.2022.115103
Peschardt,
K., Stigsdotte, U. 2013. Associations between park
characteristics and perceives restorativeness of small public urban green
spaces. Landscape and Urban Planning 122:26:39. https://doi.org/10.1016/j.landurbplan.2012.12.013
Pyke, S. 2013. Notes on xenophytes detected in Catalonia, Spain. Collectanea
Botanica 32:83-86. https://doi.org/10.3989/collectbot.2013.v32.007
Pysek, P., Hulme, P.E., Simberloff, D., Bacher, S., Blackburn, T.M.,
Carlton, J.T., Dawson, W., et al. 2020. Scientists’ warning on invasive alien
species. Biological Reviews 95(6):1511-1534. https://doi.org/10.1111/brv.12627
R Core Team 2022. R: A language and environment for statistical computing. R
Foundation for Statistical Computing. Disponible en: https://www.r-project.org
Redzic, S. 2007. The ecological aspect of ethnobotany and
ethnopharmacology of population in Bosnia and Herzegovina. Collegium
Antropologicum 31(3):869-890.
Reich, P.B., Ellsworth, D.S., Walters, M.B., Vose, J.M., Gresham, C.
Volin, J.C., Bowman, W.D. 1999. Generality of leaf trait relationships: a test
across six biomes. Ecology 80(6):1955-1969. https://doi.org/10.1890/0012-9658(1999)085[1955:GOLTRA]2.0.CO;2
Richardson,
D.M., Rejmánek, M. 2004. Conifers as invasive
aliens: a global survey and predictive framework. Diversity and
Distributions 10(5-6):321-331. https://doi.org/10.1111/j.1366-9516.2004.0096.x
Richardson, D.M., Pysek, P., Rejmánek, M., Barbour, M.G., Panetta, F.D., West,
C.J. 2000. Naturalization and invasion of alien plants: concepts and
definitions. Diversity and Distributions 6(2):93-107. https://doi.org/10.1046/j.1472-4642.2000.00083.x
Rout, T., Moore, J., Possingham, H., McCarthy, M. 2011. Allocating
biosecurity resources between preventing, detecting, and eradicating island
invasions. Ecological Economics 71: 54-62. https://doi.org/10.1016/J.ECOLECON.2011.09.009
Ruiz-Hernández, V., Joubert, L., Rodríguez-Gómez, A., Artuso, S., Pattrick, J.G.,
Gómez, P.A., Eckerstorfer, S. 2021. Humans Share More Preferences for Floral
Phenotypes with Pollinators Than With Pests. Frontiers in Plant Science
12:647347. https://doi.org/10.3389/fpls.2021.647347
Sánchez-Gullón,
E., Verloove, F. 2015. New record of interesting
xenophytes in the Iberian Peninsula. V. Lazaroa 36:43-50. https://doi.org/10.5209/rev_LAZA.2015.v36.48752
Sánchez-Gullón, E.,
Verloove, F. 2016. New record of interesting xenophytes in
the Iberian Peninsula: VI. Folia Botanica Extremadurensis
10:52-59.
Sanz-Elorza, M.,
Sobrino-Vesperinas, E., Dana-Sánchez, E.D. 2004. Atlas de las plantas
alóctonas invasoras en España. Organismo Autónomo de Parques y Jardines,
Madrid. ISBN: 84-8014-575-7
Seebens, H., Blackburn, T.M.,
Dyer, E.E., Genovesi, P., Hulme, P.E., Jeschke, J.M., Pagad, S., et al. 2017. No saturation in the accumulation of alien species worldwide. Nature
communications 8:14435. https://doi.org/10.1038/ncomms14435
Simberloff, D. 2014. Biological Invasions: What’s worth fighting and what can
be won? Ecological Engineering 65:112-121. https://doi.org/10.1016/j.ecoleng.2013.08.004
Sjöman, H., Östberg, J., Bühler, O. 2012. Diversity and distribution of
the urban tree population in ten major Nordic cities. Urban Forestry
& Urban Greening 11:31-39. https://doi.org/10.1016/j.ufug.2011.09.004
Souza-Alonso, P., Rodríguez,
J., González, L., Lorenzo, P. 2017. Here to stay. Recent
advances and perspectives about Acacia invasion in Mediterranean areas. Annals
of Forest Science 74:55. https://doi.org/10.1007/s13595-017-0651-0
Szwagrzyk,
J., Gazda, A. 2007. Above-ground standing biomass
and tree species diversity in natural stands of Central Europe. Journal of
Vegetation Science 18:555-562.
Thuiller, W., Richardson, D.M., Rouget, M., Procheş, Ş., Wilson, J.R.U.
2006. Interactions between Environment, Species Traits, and Human Uses Describe
Patterns of Plant Invasions. Ecology 87(7):1755-1769. https://doi.org/10.1890/0012-9658(2006)87[1755:IBESTA]2.0.CO;2
Tzoulas, K., Korpela, K., Venn, S., Yli-Pelkonen, V., Kazmierczak, A.,
Niemela, J., James, P. 2007. Promoting ecosystem and human health in urban
areas using Green Infrastructure: A literature review. Landscape and Urban
Planning 81:167-178. https://doi.org/10.1016/j.landurbplan.2007.02.001
Ugolini, F., Massetti, L., Calaza-Martínez, P., Cariñanos, P., Dobbs, C.,
Krajter-Ostoic, S., Marin, A.M., et al. 2020. Effects of the COVID-19 pandemic
on the use and perceptions of urban green space: An international exploratory
study. Urban Forestry and Urban Greening 56:126888. https://doi.org/10.1016/j.ufug.2020.126888
Valdés, B. 2015. Xenophytes in the Doñana territory (SW Spain). Flora
Mediterranea 25:55-64. https://doi.org/10.7320/FlMedit25SI.055
Van Kleunen, M., Weber, E., Fischer, M. 2010. A meta-analysis of trait
differences between invasive and non-invasive plant species. Ecology Letters 13:235–245. https://doi.org/10.1111/j.1461-0248.2009.01418.x
Van Kleunen, M., Essl, F., Pergl, J., Brundu, G., Carboni, M., Dullinger, S.
Early, R., et al. 2018. The changing role of ornamental horticulture in alien
plant invasions. Biological Reviews 93(3):1421-1437. https://doi.org/10.1111/brv.12402
Vargas-Hernández, J.G., Pallagst, K., Zdunek-Wielgolaska, J. 2023. Urban Green
Spaces as a Component of an Ecosystem. In: Dhiman, S. (ed.), Sustainable
Development and Environmental Stewardship. Springer,
Cham, Switzerland. https://doi.org/10.1007/978-3-031-28885-2_8
Vaz, A.S., Castro-Díez, P., Godoy, O., Alonso, A., Vilà, M., Saldaña,
A., Marchante, H., et al. 2018. An indicator-based
approach to analyse the effects of non-native tree species on multiple cultural
ecosystem services. Ecological Indicators 85: 48-56. https://doi.org/10.1016/j.ecolind.2017.10.009
Verloove, F. 2006. New records of interesting xenophytes in Spain. Lazaroa
26, 141-148. https://revistas.ucm.es/index.php/LAZA/article/view/LAZA0505110141A
Verloove, F.,
Sánchez-Gullón, E. 2008. New records of interesting
xenophytes in the Iberian Peninsula. Acta Botanica Malacitana 33:147-167.
https://doi.org/10.24310/abm.v33i0.6978
Verloove,
F., Sánchez-Gullón, E. 2012. New records of interesting
vascular plants (mainly xenophytes) in the Iberian Peninsula: II. Flora
Mediterranea 22:5-25. https://doi.org/10.7320/FlMedit22.005
Wang, R., Zhao, J., Meitner, M.J., Hu, Y., Xu, X. 2019. Characteristics
of urban green spaces in relation to aesthetic preference and stress recovery.
Urban Forestry & Urban Greening 41: 6-13. https://doi.org/10.1016/j.ufug.2019.03.005
WFO 2024. World Flora Online [used March 2, 2024]. Available at: https://www.worldfloraonline.org/
Wickham, H., Averick, M., Bryan, J., Chang, W., D’Agostino-McGowan, L.,
François, R., Grolemund, G., et al. 2019. Welcome to the tidyverse. Journal
of Open Source Software 4(43):1686. https://doi.org/10.21105/joss.01686
Wickham, H., François, R., Henry, L., Müller, K., Vaughan, D. 2023. dplyr:
A Grammar of Data Manipulation. R package version 1.1.4. Available at: https://dplyr.tidyverse.org/
Wright, I.J., Dong, N., Mairie, V., Prentice, I.C., Westoby, M., Dían, S.,
Gallagher, R.V., et al. 2017. Global climatic drivers of leaf size. Science
357(6354):917-921. https://doi.org/10.1126/science.aal4760
![]() Montserrat Vilà1,2
Montserrat Vilà1,2 ![]()