Introducción
Las garrapatas y los parásitos de la malaria aviar son ectoparásitos
y endoparásitos respectivamente, que pueden tener importantes efectos en la
salud, comportamiento, supervivencia y éxito reproductor de las aves (Marzal et al. 2005; Heylen
y Matthysen 2008; Bustillo-de la Rosa et
al. 2022). Las garrapatas se encuentran entre los ectoparásitos más
generalizados que afectan a las aves, causándoles daños físicos directos y
generando consecuencias directas como anemia, irritación de la piel y una mayor
susceptibilidad a infecciones secundarias, lo que en conjunto puede conducir a
un menor éxito reproductor y supervivencia (Merino y
Møller 2010). Además, las garrapatas pueden actuar como vectores de
diversos patógenos, como bacterias (e.g., Anaplasma spp. Rickettisia
spp., Coxiella burnetii), virus (e.g., el virus de la encefalitis
transmitida por garrapatas) y protozoos (e.g., Babesia spp., Theileria
spp.) (Palomar et al. 2012; Sparagano
et al. 2015), siendo alguno de estos patógenos zoonóticos (Ogden et al. 2008). Asimismo, el patrón de distribución
de las garrapatas se está expandiendo (Simon et al. 2014;
Ogden et al. 2021), por lo que las garrapatas suponen
una amenaza potencial tanto para la fauna silvestre, como para la salud humana.
Investigaciones previas han demostrado que la prevalencia de garrapatas en las
poblaciones de aves varía ampliamente en función de las condiciones ambientales
y las características del hospedador (Loss et al. 2016;
Brinkerhoff et al. 2019). Por ejemplo, ciertas
especies de aves son más propensas a las infestaciones por garrapatas debido a
factores como la selección del lugar de nidificación, el comportamiento de
búsqueda de alimento y el tipo de hábitat (Ghosh et al.
2006; Keve et al. 2022). Además, se ha demostrado
que la infestación por garrapatas y malaria puede variar en función del ciclo
vital de la especie de ave (por ejemplo, migratoria o residente) (Waldenström et al. 2002; Ogden
et al. 2008). Por lo tanto, la investigación sobre la identificación,
prevalencia y distribución de las infestaciones por garrapatas en aves, así
como la posible detección de malaria aviar presente en garrapatas, es crucial
para comprender el estado de salud y de conservación de las poblaciones de aves
(Norte et al. 2013), la epidemiología de las
enfermedades transmitidas por vectores, identificar las zonas de alto riesgo y
aplicar estrategias de gestión eficaces (Estrada-Peña
et al. 2013).
La malaria aviar, causada por parásitos protozoarios de los
géneros Plasmodium y Haemoproteus (orden Haemosporida), es una
preocupación importante para el estado de salud de las poblaciones de aves (Valkiūnas 2005). Estos parásitos son transmitidos por
insectos hematófagos (orden Diptera), como mosquitos (Atkinson
2008) principalmente de la familia Culicidae (Santiago-Alarcon
et al. 2012; Valkiūnas e Iezhova 2018) o
moscas (familias Hippoboscidae y Ceratopogonidae) (Santiago-Alarcon
et al. 2012). La malaria aviar provoca una serie de efectos patológicos que
van desde signos clínicos discretos o leves hasta una morbilidad grave y
mortalidad (Valkiūnas 2005). Se ha determinado que
la prevalencia de la malaria aviar en las poblaciones de aves alcanza casi el
20% en todo el mundo (Yan et al. 2024) y está influida
por el clima, el hábitat, la abundancia de vectores y la susceptibilidad
específica de las especies de aves (Bensch et al. 2009;
LaPointe et al. 2012). Estudiar la posible
presencia de malaria aviar ayuda a comprender la dinámica de la enfermedad y a
desarrollar estrategias para mitigar su impacto en las poblaciones de aves
susceptibles a la misma (Atkinson y LaPointe
2009). Este conocimiento no sólo es fundamental para la conservación de las
aves, sino también para comprender procesos ecológicos más amplios y la
interconexión de las especies dentro de sus hábitats.
El cambio climático y las alteraciones del medio ambiente a
lo largo del tiempo han sido identificadas como causas clave de la expansión de
parásitos debido, entre otras cosas, a la variación fenológica no sólo de los
parásitos (es decir, vectores como garrapatas y mosquitos, o patógenos
transmitidos por ellos), sino también de sus hospedadores (Merino y Møller 2010). Por tanto, es de gran
importancia considerar el papel de los hospedadores potenciales (como por
ejemplo ungulados u otras especies asociadas al ganado doméstico) en la
infestación por garrapatas. No obstante, la interacción entre el ganado
doméstico y la fauna silvestre es un área de investigación ecológica compleja.
Un aspecto significativo de esta interacción es la influencia de los rebaños de
ovejas en la probabilidad de infestaciones parasitarias, actuando, por ejemplo,
como reservorios de garrapatas (Springer et al. 2020;
Defaye et al. 2022). Se sabe que las ovejas albergan
diversas especies de garrapatas, lo que, combinado con sus patrones de
movimiento y pastoreo, puede contribuir a la dispersión de las garrapatas por
distintos hábitats (Estrada-Peña et al. 2013) y,
por tanto, a la infestación de aves y otros animales silvestres (Ogden et al. 2008). Esto puede ocasionar una mayor
prevalencia de enfermedades transmitidas por garrapatas en las poblaciones de
aves de zonas con mayor presencia de ganado, afectando a su salud y estado
físico (Heylen y Matthysen 2008). Además, los
rebaños de ovejas pueden llegar a influir en infecciones de la fauna silvestre,
como la malaria aviar, actuando como atrayentes de insectos vectores, por
ejemplo, por la presencia de puntos de agua para el ganado, los cuales pueden
actuar como reservorio de mosquitos (González-Quevedo
et al. 2014; Ferraguti et al. 2018). El
pastoreo de ovejas puede provocar también una reducción de la cubierta vegetal,
la compactación del suelo y la modificación de las especies vegetales,
dependiendo de la intensidad del pastoreo (Centeri 2022).
Ferraguti et al (2018) demostraron cómo la
cercanía de cuerpos de agua, riqueza de especies de vertebrados, dinámicas
poblacionales e insectos vectores, como los mosquitos, y la composición y
estructura del hábitat, pueden repercutir en la dinámica de transmisión de la
malaria aviar y otros patógenos. Por lo tanto, comprender la posible influencia
del ganado en la infestación parasitaria de las aves es crucial para
proporcionar medidas específicas para la conservación de la fauna silvestre y
la gestión ganadera. Sin embargo, nuestros conocimientos actuales sobre la
relación entre pastoreo por rebaños de ovejas y la infestación parasitaria de
las aves son bastante limitados.
En este estudio, mediante la integración de muestreos de
campo, diagnósticos moleculares y análisis ecológicos, pretendemos mejorar
nuestra comprensión sobre infecciones parasitarias en aves esteparias, la
variación de la prevalencia de dichas infecciones entre especies simpátricas y
si presentan alguna asociación con la intensidad de pastoreo por ganado
doméstico. Una mejor comprensión de la probabilidad de presencia de garrapatas
y de potencial infección por malaria aviar en aves esteparias, junto con los
factores que influyen en estos riesgos, puede contribuir al conocimiento de la
salud aviar y a la conservación de la biodiversidad en los ecosistemas
esteparios, globalmente amenazados. En concreto, los objetivos de este estudio
fueron: (1) identificar las especies de garrapatas y patógenos presentes en
estas en seis especies simpátricas de paseriformes esteparios; (2) determinar
la prevalencia de infestación por garrapatas y probabilidad de infección por
malaria aviar en este grupo de aves; y (3) evaluar la posible influencia del
pastoreo por rebaños de ovejas en la prevalencia de garrapatas y malaria en las
especies estudiadas. Examinamos la potencial variación en la prevalencia de
garrapatas entre las especies estudiadas, y predecimos una mayor prevalencia de
garrapatas e infección por malaria aviar en zonas con mayor presencia de
rebaños ovinos.
Metodología
Área de estudio y procedimiento de muestreo
Este estudio se llevó a cabo entre los años 2017 y 2021, en
las Zonas de Especial Protección para las Aves (ZEPA) de Altos de Barahona y
Páramo de Layna (provincia de Soria, centro de España, Fig.
1). Se trata de extensiones llanas de estepa natural a gran altitud
(1100−1200 msnm), dominadas por arbustos basófilos continentales (Zurdo et al. 2021) con presencia de cultivos y árboles
dispersos. El clima es mediterráneo continental (Aranbarri
et al. 2015). En estas zonas la actividad de pastoreo por rebaños ovinos ha
estado históricamente presente y continúa siendo una actividad relevante (Gómez-Catasús et al. 2023).
Este estudio se centra en seis paseriformes esteparios
simpátricos durante la época de cría (Barrero et al.
2023a; 2024): alondra ricotí (Chersophilus
duponti), alondra común (Alauda arvensis), terrera común (Calandrella
brachydactyla), collalba gris (Oenanthe oenanthe), collalba rubia (Oenanthe
hispanica) y bisbita campestre (Anthus campestris). Estas especies
fueron seleccionadas como modelo de estudio porque coexisten y comparten
características ecológicas, lo que facilita su comparación. Por ejemplo, todas
son insectívoras y anidan en el suelo (Barrero et al.
2023b; Zurdo et al. 2023).
Las aves fueron
capturadas en el marco de un estudio a largo plazo sobre la ecología de estas
especies. Se emplearon cepos malla cebados con gusanos de la harina (Tenebrio
molitor), junto con la reproducción en altavoces de grabaciones específicas
de cada para atraer a los individuos. Se capturaron un total de 614 individuos,
cubriendo la mayor parte de la zona de estudio (Fig. 1). Las capturas y la manipulación de los individuos fueron realizadas
por anilladores expertos, con el fin de reducir al máximo el tiempo de
manipulación y evitar cualquier posible estrés de los individuos. Una vez
capturados, todos los individuos fueron anillados con anillas de metal para
evitar muestreos en recapturas. Además, se obtuvo la localización de cada
captura mediante un GPS. El protocolo seguido para llevar a cabo las capturas y
el manejo se realizó bajo permisos de las autoridades españolas y fue aprobado
por el Comité Ético Local de Experimentación Animal de la Universidad Autónoma
de Madrid (CEI80-1468-A229).
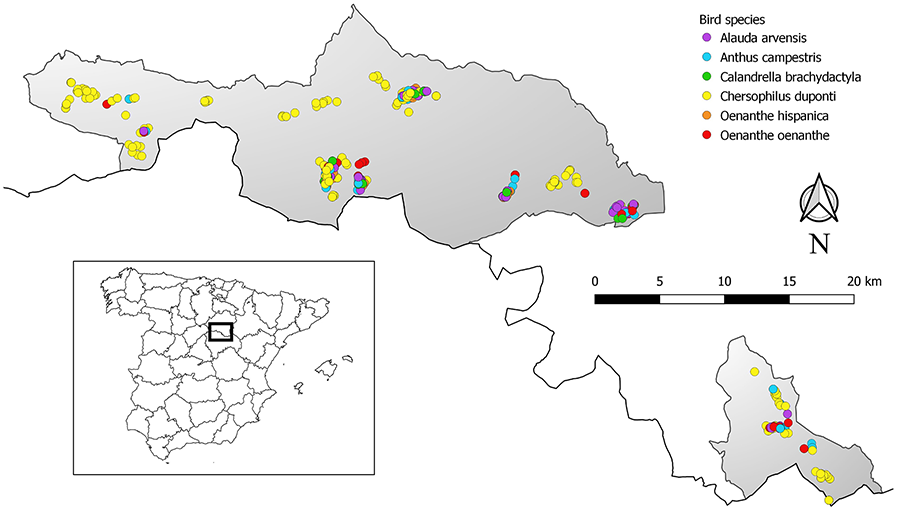
Figura 1. Localización del área de estudio en
el sur de la provincia de Soria (rectángulo negro dentro de España), indicando
los puntos donde se capturaron individuos de diferentes especies de aves
esteparias (puntos de color). En gris se muestran las Zonas de Especial
Protección para las Aves (ZEPA) de la Red Natura 2000 de la Unión Europea (más
al norte, Altos de Barahona, y más al sur, Páramo de Layna).
Figure 1. Location of the study area in southern Soria province (black
rectangle within Spain), indicating points where individuals of different
steppe bird species were trapped (colour dots). Special Protection Areas (SPAs)
of the European Union’s Natura 2000 Network are shown in grey (further north,
‘Altos de Barahona’, and further south, ‘Páramo de Layna’).
Tras la obtención de medidas morfológicas y muestras
biológicas para otros estudios asociados (ver por ejemplo Bustillo-de la Rosa et al. 2022; Zurdo et al. 2023), buscamos la presencia de garrapatas
en cada individuo. Para ello, contamos el número de garrapatas (si estaban
presentes) en cada ejemplar capturado y recogimos algunas muestras (una media
de 5-6 garrapatas para aquellos individuos con alta infestación, y su totalidad
cuando presentaban baja infestación) para ser procesadas posteriormente. Las
garrapatas muestreadas se introdujeron en tubos Eppendorf y se almacenaron a
-80 °C hasta su posterior análisis molecular. Las aves fueron liberadas
inmediatamente en el lugar donde habían sido capturadas.
Procedimientos de laboratorio
Las garrapatas fueron inicialmente identificadas y
posteriormente procesadas en el laboratorio del Instituto de Investigación en
Recursos Cinegéticos (IREC-CSIC, UCLM, JCCM). Se utilizaron claves taxonómicas
específicas proporcionadas por Estrada-Peña et al.
(2018) para identificar morfológicamente la especie de garrapata, el sexo y
su estado de desarrollo (larva, ninfa, adulto).
La extracción de los ácidos nucleicos (ADN y ARN) de cada
garrapata se realizó utilizando Tri Reagent® (Sigma-Aldrich, Burlington, MA,
EE.UU.) siguiendo las instrucciones del fabricante. Brevemente, las garrapatas
se cortaron en dos mitades longitudinales utilizando una hoja de bisturí
desechable, extrayendo su contenido y utilizándolo para la extracción de los
ácidos nucleicos. La concentración, calidad y pureza de ARN y ADN se
comprobaron con un espectrofotómetro NanoDrop One® (ThermoScientific, Waltham, MA,
EE.UU.) y se almacenaron a -80 ºC hasta su posterior análisis.
La detección de patógenos
presentes en garrapatas se llevó a cabo mediante la amplificación por reacción
en cadena de la polimerasa (PCR) de varios fragmentos de genes, mediante PCR
convencionales para Rickettsia sp. (16S rRNA); Anaplasmataceae,
incluyendo Anaplasma sp. y Ehrlichia sp. (16S rRNA); PCR anidada
para Haemosporida, incluyendo Plasmodium sp. y Haemoproteus sp.
(gen citocromo-b); PCR en tiempo real para el gen de inserción IS1111a
específico de Coxiella burnetii; y RT-PCR en tiempo real para
Flavivirus (extremo N-terminal del dominio ARN polimerasa dependiente de ARN).
Estos análisis se realizaron para determinar el potencial papel de las
garrapatas como vector de enfermedades y como proxy de la presencia de
infección por malaria aviar en las aves infestadas. Todos los primers y las
condiciones de PCR utilizadas en este estudio se muestran en la Tabla A1 del Anexo.
Las garrapatas se
analizaron individualmente para todos los patógenos, excepto para Haemosporida.
En este caso, se realizó una PCR anidada analizando las muestras en grupos
(pools) de tres garrapatas con el fin de reducir costes. Posteriormente, se
analizaron individualmente las garrapatas que componían cualquier pool
positivo. Los análisis mediante PCR convencional y PCR anidada se realizaron en
un termociclador S1000 Touch (Bio-Rad, Hercules, CA, EE.UU.) utilizando el kit
de PCR Master Mix (Promega Corporation, Madison, WI, EE.UU.). Los análisis
mediante PCR en tiempo real y RT-PCR en tiempo real se realizaron en
termociclador CFX96 Touch (Bio-Rad) utilizando el kit SsoAdvanced Universal
Probes Supermix (Bio-Rad) y el iTaq Universal SYBR Green One-Step RT-qPCR
(Bio-Rad), respectivamente. En todas las PCR llevadas a cabo se utilizó ADN o
ARN del patógeno estudiado como control positivo y agua libre de nucleasas como
control negativo. Los productos de las PCR convencionales se visualizaron por
electroforesis en geles de agarosa al 1.5% utilizando GelRed® Nucleic Acid Gel
Stain (Biotium, Fremont, CA, EE.UU.). Los amplicones se purificaron con
QIAquick PCR Purification Kit (Qiagen, Hilden, Alemania) y fueron enviados a
secuenciar a una empresa comercial (Secugen S.L., Madrid, España). Para evaluar
el nivel de similitud de las secuencias obtenidas con las depositadas en la
base de datos GenBank (http://blast.ncbi.nlm.nih.gov/), se utilizó el
análisis BLAST (NCBI’s Basic Local Alingment Search Tool). Además, las
secuencias parciales de Ehrlichia spp., Anaplasma spp. y Plasmodium
relictum obtenidas de garrapatas en este estudio se depositaron en la base
de datos GenBank (números de acceso: PQ656542, PQ656543, PQ671638, PQ671639,
PQ671640 y PQ671641).
Análisis estadísticos
Se calculó la
prevalencia de infestación por garrapatas, definida como el número de
individuos de cada especie de ave con presencia de garrapatas en relación con
el número total de capturas por especie, considerando conjuntamente machos,
hembras y pollos. Además, se estimó el número de parásitos por individuo
infestado (intensidad media), de acuerdo con Bush et al.
(1997). Del mismo modo, estimamos la probabilidad de infección por
parásitos de malaria aviar por especie (número de individuos infestados por
garrapata en las que se detectó presencia de malaria aviar) basándonos en los
análisis moleculares realizados sobre garrapatas. Como se ha indicado
anteriormente, la presencia de malaria aviar en las garrapatas se utilizó como
indicador de la potencial infección por malaria de las aves identificadas como
hospedadoras de garrapatas, por lo que la probabilidad de infección por malaria
aviar se estimó teniendo en cuenta únicamente los individuos portadores de
garrapatas.
Para estudiar la influencia
potencial del ganado en la probabilidad de infestación de garrapatas en aves,
utilizamos la Función de Densidad de Kernel (KDF) para estimar la intensidad de
uso del suelo por los rebaños de ovejas utilizando puntos de movimiento
recogidos por transmisores GPS, los cuales fueron incorporados en ovejas
durante el período de cría de aves (abril-junio de 2018 y 2019; Fig. 2). KDF es una representación espacial de la
distribución de frecuencia relativa de puntos, donde las áreas con más puntos
muestran valores de probabilidad más altos (Worton 1989).
Todos los rebaños de ovejas del área de estudio (n = 5) fueron equipados con
collares GPS, que consistían en un dispositivo GPS CatLog2 y una batería de
litio recargable de 9000 mAh protegida por un tubo de PVC (proporcionado por
Perthold Engineering LLC; www.mr-lee.com).
Se colocó un collar GPS por rebaño y se programó para obtener una localización
cada 30 min. Una descripción detallada de los datos GPS y del procedimiento de
limpieza de los datos se puede ver en Gómez-Catasús
et al. (2023).
La intensidad ganadera se estimó utilizando un factor de
suavizado de 900 y un tamaño de celda de 50×50 m. Además, se asignó el número
de ovejas por rebaño como factor de ponderación para cada ubicación GPS y
fecha. Consideramos la intensidad ganadera durante el período de cría (es
decir, abril-junio de los años 2018 y 2019) como un proxy del papel
potencial de las ovejas como reservorio de garrapatas en el rango de tiempo en
el que todas las especies estudiadas pueden encontrarse juntas.
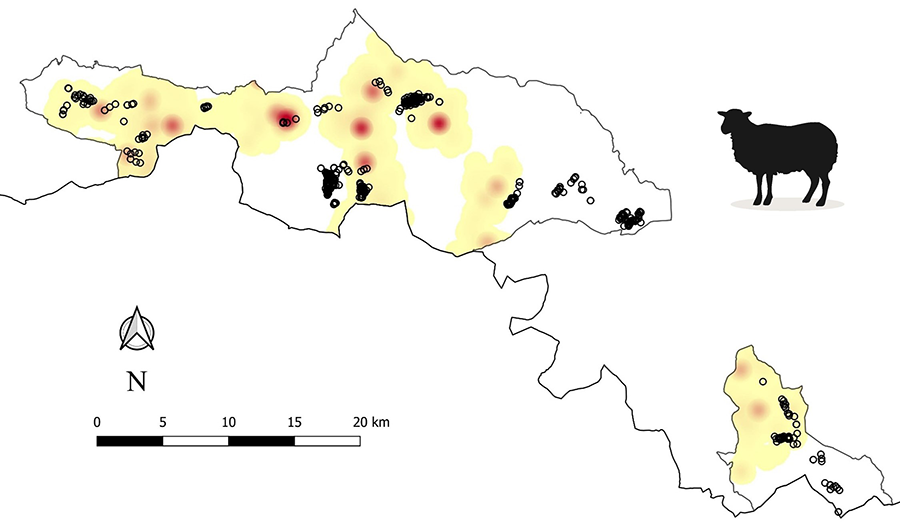
Figura 2. Densidad ganadera en la zona de
estudio durante la época de cría, estimada mediante una función de densidad de
Kernel (KDF) utilizando localizaciones GPS. Las zonas de baja intensidad se
muestran en amarillo, las de alta intensidad en rojo, mientras que las zonas
blancas indican ausencia de pastoreo. Los puntos muestran la ubicación de las
capturas de aves.
Figure 2. Livestock density at the study area during the breeding season,
estimated by a Kernel Density Function (KDF) using GPS locations. Low intensity
areas are shown in yellow, high intensity areas in red, while white areas
indicate no grazing. Dots show the location of bird captures.
Utilizamos la función glmer del software R (versión
3.6.1; R Core Team 2019) para ejecutar una regresión
logística binaria de efectos mixtos con el fin de abordar si la prevalencia de
garrapatas variaba entre especies. En primer lugar, utilizamos la
presencia/ausencia de garrapatas (1/0 respectivamente) como variable de respuesta,
y la especie de ave como factor fijo para determinar las diferencias
interespecíficas en la probabilidad de presencia de garrapatas. Como la mayoría
de las especies estudiadas (todas, excepto la alondra ricotí) son migratorias,
incluimos el mes de captura como variable aleatoria para tener en cuenta el
posible sesgo debido al momento de llegada de cada especie a la zona de
estudio. En segundo lugar, utilizamos una regresión logística binaria de
efectos mixtos para evaluar la posible influencia de la intensidad del pastoreo
en la probabilidad de presencia de garrapatas. En este caso, calculamos la
intensidad de pastoreo como el valor medio de KDF en un buffer de 50 metros
alrededor de cada punto de captura y lo utilizamos como variable explicativa,
manteniendo la presencia/ausencia de garrapatas (1/0 respectivamente) como
variable respuesta. En este análisis incluimos la especie de ave como variable
aleatoria. Se repitieron ambos tipos de análisis, pero utilizando como variable
de respuesta la presencia o ausencia de infección por malaria aviar. Los
análisis de la posible influencia de la intensidad ganadera en la probabilidad
de infestación por garrapatas y malaria aviar se realizaron considerando
únicamente los datos de 2018 y 2019, ya que es el periodo en el que se
controlaron los rebaños de ovejas. Los predictores continuos fueron
z-estandarizados (media = 0 y desviación estándar = 1).
Resultados
De 2017 a 2021 se capturaron un total de 614 aves en la zona
de estudio. De ellos, 141 individuos fueron identificados como hospedadores de
garrapatas (112 alondras ricotí, 11 alondras comunes, 5 terreras comunes, 1
collalba gris, 1 collalba rubia y 11 bisbitas campestres). Todas las garrapatas
extraídas de las aves se identificaron como Haemaphysalis punctata. La
mayoría de ellas mostraban un estadio de ninfa, con un solo macho adulto y dos
larvas. Los análisis moleculares mostraron la presencia de distintos patógenos
(Anaplasma spp., Ehrlichia spp. y Plasmodium relictum) en
garrapatas de varias especies de aves (Tabla 1).
Tabla 1. Resumen de
los resultados de PCR (nº positivos/nº analizados) para patógenos analizados en
las garrapatas Haemaphysalis punctata obtenidos de aves capturadas en
Soria entre 2017 y 2021.
Table 1. Summary of the PCR results (no. positives/no. analysed) for
pathogens analysed in ticks Haemaphysalis punctata removed from birds
captured in Soria between 2017 and 2021.
La probabilidad de presencia de
garrapatas fue significativamente mayor en la alondra ricotí en comparación con
el resto de las especies (χ2 = 90.01, df = 5, P < 0.001) (Fig. 3), sin variación significativa entre las demás
especies. El 46.3% de los individuos capturados de alondra ricotí tuvieron
garrapatas, mostrando el mayor valor de infestación, seguida del bisbita
campestre (14.5%). La presencia de garrapatas en las otras dos alondras y en
ambas collalbas fue inferior al 9% (Tabla 2). Por
otro lado, la malaria aviar (considerada por la presencia de Plasmodium
relictum) fue la infección más común detectada. No obstante, sólo estaba
presente en garrapatas de dos especies, la alondra ricotí y la collalba rubia,
con tasas de prevalencia del 21.6% y el 100% (aunque en sólo dos garrapatas),
respectivamente (Tabla 2). Anaplasma spp. y
Ehrlichia spp. sólo se detectaron en garrapatas procedentes de la alondra
ricotí (Tabla 1).
Con respecto a la secuenciación
molecular, 5 de las 17 muestras positivas a la PCR convencional anidada para la
detección de Haemosporida pudieron ser secuenciadas, mostrando una homología
entre 97.50% y 100% con otras secuencias de Plasmodium relictum aisladas
de diferentes aves (Japón, LC230047.1; Austria, MK652233.1). Las
secuencias de nucleótidos de Ehrlichia spp. y Anaplasma spp.
mostraron homologías de 99.66% con una secuencia obtenida de una garrapata
(Belice, ON107291.1) y de 100% aislada de un murciélago (Brasil, PP109409.1),
respectivamente.
Tabla 2. Número de
aves (machos, hembras y pollos) por especie capturados en Soria entre 2017 y
2021 y distribución de Haemaphysalis punctata según las especies de
aves. También se muestra el porcentaje de detección de malaria aviar en las
garrapatas analizadas (número y proporción de individuos con garrapatas
positivas a malaria).
Table 2. Number of birds (males, females and chicks) per species captured in
Soria between 2017 and 2021 and distribution ofHaemaphysalis punctata according to the birds species. Percentage of avian malaria detected in ticks analyzed (number
and proportion of individuals with ticks. positive to avian malaria) is also
shown.
La prevalencia de garrapatas no varió significativamente en
función de la intensidad ganadera (χ2 = 0.29; df = 1; P = 0.59). La
prevalencia de la malaria aviar obtenida a partir del análisis molecular de la
sangre de garrapatas no varió significativamente entre especies (χ2
= 0; df = 5; P = 1). La probabilidad de estar infectado por malaria aviar no
varió significativamente en función de la intensidad de pastoreo (χ2
= 1.11; df = 1; P = 0.29).
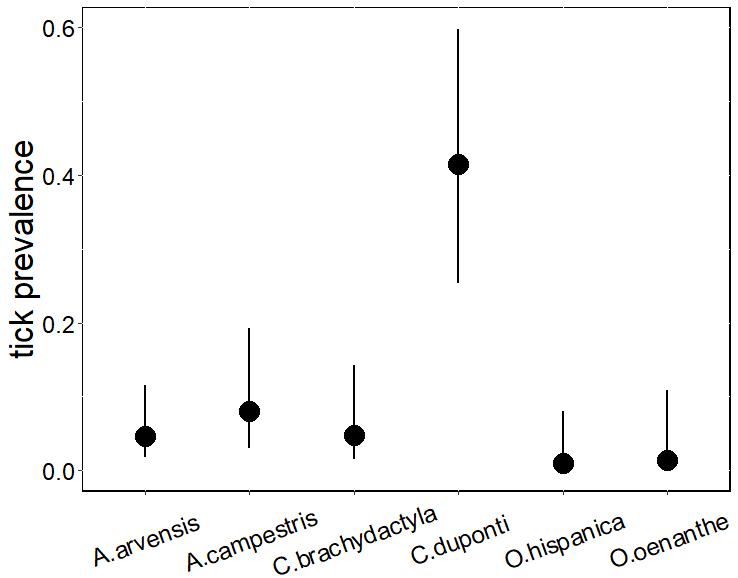
Figura 3.
Media predicha e intervalo de confianza (IC) al 95% para la prevalencia de
garrapatas en diferentes especies de aves esteparias en Soria (España) obtenida
a partir de una regresión logística mixta (glmer) de la variación de la
prevalencia de garrapatas frente a la especie, utilizando el mes de captura
como variable aleatoria.
Figure 3.
Predicted mean and 95%-CI for tick prevalence on different steppe bird species
in Soria (Spain) obtained from the mixed-effect binary logistic regression (glmer)
of tick prevalence variation against the species, using the month of capture as
a random variable.
Discusión
En este estudio
proporcionamos una de las primeras descripciones de la prevalencia de
garrapatas y malaria aviar en especies simpátricas de aves esteparias, uno de
los grupos de vertebrados más amenazados de Europa (Agencia Europea de Medio Ambiente 2015).
Encontramos garrapatas en todas las especies monitorizadas, aunque su
prevalencia varió mucho entre especies, con una prevalencia de garrapatas
significativamente mayor en la especie más amenazada y con más individuos
muestreados, la alondra ricotí. La infección por malaria aviar sólo se detectó
en dos de las especies estudiadas, la alondra ricotí y la collalba rubia.
También se evaluó el posible papel del ganado doméstico como reservorio de la
infestación parasitaria de las aves y como atrayente de otros insectos vectores
portadores de malaria. Sin embargo, el pastoreo de ovejas no parece estar
relacionado con la prevalencia de infestación por garrapatas, ni con la
presencia de malaria aviar hallada en nuestro estudio.
Todas las garrapatas
identificadas pertenecían a la especie Haemaphysalis punctata, la cual
ha sido descrita como una especie con una amplia distribución en la región
paleártica y común en estadio inmaduro en paseriformes (Pfäffle
et al. 2018; Keve et al. 2022). Aunque todas las
especies fueron identificadas como hospedadoras de esta especie de garrapata,
su prevalencia varió significativamente entre ellas. La alondra ricotí mostró
la prevalencia más alta, debido potencialmente a diferencias biológicas y de comportamiento
con respecto a las otras especies, que no mostraron diferencias significativas
entre ellas en la prevalencia de garrapatas. Aunque todas las especies
observadas nidifican en el suelo (Cramp y Simmons
1980; Barrero et al. 2023b), la alondra ricotí es
la única residente. Su carácter residente, junto con su alta especificidad de
hábitat (Seoane et al. 2006; Gómez-Catasús et al. 2019), podría explicar la
mayor presencia de garrapatas debido a la exposición durante todo el año a la
potencial infestación (Hornok et al. 2014) como
segundos hospedadores de ninfas o adultos (Klaus et al.
2016), los cuales se alimentan principalmente de ungulados (en este caso,
ovejas) (Pfäffle et al. 2018).
Los resultados sobre
presencia de patógenos detectados en garrapatas (Anaplasma spp., Ehrlichia
spp. y Plasmodium relictum) nos indican que las aves infestadas podrían
estar actuando como reservorio de estos (Hornok et al.
2014; Defaye et al. 2023). Por un lado, la
presencia de Anaplasma spp. o Ehrlichia spp., patógenos
transmitidos por garrapatas, podría asociarse a su conocido papel como vectores
de estos patógenos (Hasle 2013), no garantizando que las
especies de aves estén infectadas. Por otro lado, la detección en las
garrapatas analizadas de Plasmodium relictum, parásito de la malaria
aviar con una distribución mundial (Beadell et al. 2006;
Ferraguti et al. 2023) y cuya vía de transmisión
es por mosquitos, podría estar indicando que las aves hospedadoras de dichas
garrapatas han sido parasitadas por otros vectores portadores de malaria.
Nuestros resultados deben interpretarse con cautela debido al reducido número
de muestras analizadas para algunas especies y a la falta de muestras de aves
no infestadas por garrapatas en nuestros análisis. No obstante, la prevalencia
de malaria aviar en las garrapatas extraídas de alondra ricotí, la única
especie con un gran número de individuos analizados (112 aves), alcanzó un
21.6%, un valor muy similar a la prevalencia media de malaria aviar estimada en
todo el mundo (Yan et al. 2024). Estos resultados
muestran cómo las garrapatas podrían utilizarse como proxy para evaluar,
de forma no invasiva, la presencia potencial de agentes de enfermedades
infecciosas que pueden encontrarse en el torrente sanguíneo. Aunque se han
encontrado algunos individuos infectados por malaria aviar, aquí no podemos
concluir sobre su patogenicidad (Marzal 2012). Su
impacto potencial sobre la salud y el estado físico de los individuos, o la
ausencia de impacto, parece estar relacionado con el grado de infección (es
decir, la tasa de parasitemia), la condición de los individuos o la inmunidad
adaptativa de la especie (Matson y Beadell 2010;
Granthon y Williams 2017; Bustillo-de la Rosa et al. 2022; Muriel et al. 2023). Así pues, deberían llevarse a cabo
más estudios centrados en el estudio del impacto potencial de la malaria aviar
en las aves silvestres, especialmente en el caso de las especies amenazadas.
Aunque esperábamos
encontrar una relación entre la presencia de ganado ovino y las tasas de
prevalencia de garrapatas y malaria aviar, no obtuvimos ninguna influencia
significativa de la intensidad de pastoreo. No obstante, estos resultados deben
considerarse con cautela, pues los datos sobre el pastoreo se limitaron a dos
temporadas reproductoras, lo que redujo drásticamente el tamaño de la muestra
disponible para este análisis, pudiendo subestimar el papel potencial del
ganado como reservorio de garrapatas y atrayente de insectos. Es necesario
seguir investigando con un mayor número de especies de aves (migratorias y
residentes) en lugares con un régimen de pastoreo variable para dilucidar si el
ganado doméstico tiene potencial para influir en la infestación parasitaria de
las aves.
Nuestro estudio aporta
los primeros datos sobre la infestación por garrapatas y su potencial papel
indicador de infección por malaria aviar en paseriformes esteparios. Tomamos
muestras de un gran número de aves y descubrimos que casi una cuarta parte de los
individuos estaban infestados por garrapatas. Nuestros análisis también
mostraron que la tasa de prevalencia de garrapatas variaba entre las especies,
con una mayor tasa de infestación en la especie más amenazada, la alondra
ricotí. A diferencia de la infestación por garrapatas, el porcentaje de aves
infectadas por malaria aviar fue bajo y, probablemente debido al escaso tamaño
de la muestra, no encontramos ninguna relación significativa entre la infección
por malaria aviar y otros factores, como la variación de su prevalencia entre
especies. Aunque descubrimos que ni la infestación por garrapatas ni por
malaria aviar estaban asociadas a la presión del pastoreo ovino, futuras
investigaciones deberían abarcar una escala temporal mayor con el fin de evaluar
la posible relación entre la infestación de aves y la fauna doméstica. Del
mismo modo, sería deseable que futuros estudios que analicen la infestación de
garrapatas y malaria aviar en aves consideren individuos infestados e
individuos control (sin ectoparásitos). De esta forma se podría demostrar de
forma directa el uso de garrapatas como indicadores de infección en sus
hospedadores, o el potencial impacto que puede tener la infección por malaria
aviar sobre su sistema inmunitario (por ejemplo, relación heterófilo/linfocito
como indicador de estrés fisiológico; Bustillo-de
la Rosa et al. 2022), condición física o tasa de supervivencia, para
mejorar nuestro conocimiento actual sobre su impacto en la dinámica poblacional
de las aves.
Contribución de los autores
Daniel Bustillo-de la Rosa: Conceptualización del estudio;
tratamiento de datos; análisis; investigación; metodología; redacción del
borrador original, revisión y edición. Adrián Barrero: apoyo en la
investigación, redacción, revisión y edición del manuscrito. Julia
Gómez-Catasús: apoyo en la investigación, redacción, revisión y edición del
manuscrito. Margarita Reverter: apoyo en la investigación, redacción, revisión
y edición del manuscrito. Julia Zurdo: apoyo en la investigación, redacción,
revisión y edición del manuscrito. Cristian Pérez-Granados: apoyo en la
investigación, redacción, revisión y edición del manuscrito. Marta
Sánchez-Sánchez: apoyo en la investigación, redacción, revisión y edición del
manuscrito; contribución igual en metodología. Isabel G. Fernández-De-Mera:
apoyo en la investigación, redacción, revisión y edición del manuscrito. Ursula
Höfle: apoyo en la investigación, redacción, revisión y edición del manuscrito.
Manuel B. Morales: apoyo en la investigación, redacción, revisión y edición del
manuscrito. Juan Traba: Conceptualización del estudio; tratamiento de datos;
análisis; investigación; metodología; redacción del borrador original; apoyo en
la revisión y edición; Supervisión; Obtención de financiación.
Todos los autores han
leído y aceptado la versión publicada del manuscrito.
Disponibilidad de datos
Los datos empleados para este estudio se encuentran
disponibles en Figshare: https://figshare.com/articles/dataset/
Datos_Garrapatas_Ecosistemas_csv/28352375?file=52154420
Financiación, permisos requeridos, potenciales
conflictos de interés y agradecimientos
Este estudio fue
parcialmente financiado por la Agencia Española de Cooperación Internacional
(AECI; C/3868/05), y los proyectos LIFE Ricotí (LIFE15-NAT-ES-000802) y LIFE
Connect Ricotí (LIFE20-NAT-ES-000133), apoyados por la Comisión Europea. La
investigación también ha sido parcialmente apoyada por el Ministerio de Ciencia
e Innovación español con la subvención ERTA-2017-0003-C02-01, y por la
subvención 2022-GRIN-34227 financiada por la UCLM y FEDER. El Instituto de
Investigación en Recursos Cinegéticos, IREC (CSIC-UCLM-JCCM), proporcionó el
laboratorio para el análisis de ADN. Esta es una contribución a la Red
REMEDINAL-TE (ES2018-EMT-4338).
Los autores/as declaran no tener ningún
conflicto de intereses.
Referencias
Aranbarri,
J., González-Sampériz, P., Iriarte, E., Moreno, A., Rojo-Guerra, M.,
Peña-Chocarro, L., Valero-Garcés, B., et al. 2015. Human–landscape
interactions in the Conquezuela–Ambrona Valley (Soria, continental Iberia):
from the early Neolithic land use to the origin of the current oak woodland. Palaeogeogr.,
Palaeoclimatol., Palaeoecol 436, 41–57. https://doi.org/10.1016/j.palaeo.2015.06.030
Atkinson, C.T. 2008. Avian Malaria. In: Atkinson, C.T., Thomas, N.J.,Hunter, D.B. (eds.),
Parasitic Diseases of Wild Birds, pp. 35-53. John Wiley &
Sons, Inc. https://doi.org/10.1002/9780813804620.ch3
Atkinson,
C.T., LaPointe, D.A. 2009. Introduced avian
diseases, climate change, and the future of Hawaiian honeycreepers. Journal
of avian medicine and surgery 23(1), 53–63. https://doi.org/10.1647/2008-059.1
Barrero, A., Gómez-Catasús, J., Traba, J., Ovaskainen, O. 2023a. Co-occurrence
patterns in a steppe bird community: insights into the role of dominance and
competition. Oikos e09780. https://doi.org/10.1111/oik.09780
Barrero, A., Cortés Caballero, B.,
Reverter, M., Gómez-Catasús, J., Bustillo-de la Rosa, D., Zurdo, J.,
Pérez-Granados, C., et al. 2023b. Nest features and nesting
niche segregation in five Iberian steppe passerine. Ardeola 70(2):
201-224. https://doi.org/10.13157/arla.70.2.2023.ra4
Barrero, A., Tarjuelo, R., Traba, J. 2024 Increased
Density of Conspecifics Caused Niche Contraction in a Multispecific Passerine
Assemblage. Ecology 105: e4296. https://doi.org/10.1002/ecy.4296
Beadell, J.S., Ishtiaq, F., Covas, R., Melo, M., Warren, B.H., Atkinson,
C.T., Bensch, S., et al. 2006. Global phylogeographic limits of Hawaii's avian
malaria. Proceedings of the Royal Society B: Biological Sciences
273(1604), 2935–2944. https://doi.org/10.1098/rspb.2006.3671
Bensch, S., Stjernman, M., Hasselquist, D., Örjan, Ö., Hannson, B.,
Westerdahl, H., Pinheiro, R.T. 2000. Host specificity in avian blood parasites:
a study of Plasmodium and Haemoproteus mitochondrial DNA amplified from
birds. Proceedings of the Royal Society of London. Series B: Biological
Sciences 267(1452), 1583-1589. https://doi.org/10.1098/rspb.2000.1181
Bensch, S., Hellgren, O.,
Pérez-Tris, J. 2009. MalAvi: a public database of malaria
parasites and related haemosporidians in avian hosts based on mitochondrial
cytochrome b lineages. Molecular Ecology Resources 9(5), 1353-1358. https://doi.org/10.1111/j.1755-0998.2009.02692.x
Brinkerhoff, R.J., Dang, L., Streby, H.M., Gimpel, M. 2019. Life history
characteristics of birds influence patterns of tick parasitism. Infection
Ecology & Epidemiology 9(1), 1547096. https://doi.org/10.1080/20008686.2018.1547096
Bush, A.O.,
Lafferty, K.D., Lotz, J.M., Shostak, A.W. 1997. Parasitology Meets Ecology on Its Own Terms: Margolis
et al. Revisited. The Journal
of parasitology 83(4), 575–583.
https://doi.org/10.2307/3284227
Bustillo-de la Rosa, D.,
Calero-Riestra, M., Pérez-Granados, C., Mereu, S., Morales, M.B., Traba, J.,
López-Iborra, G., et al. 2022. Leukocyte profile variation in
Dupont’s Lark (Chersophilus duponti) in Spain and Morocco. Journal of Ornithology 163, 539-551. https://doi.org/10.1007/s10336-021-01958-x
Centeri, C. 2022. Effects of grazing on water erosion, compaction and
infiltration on grasslands. Hydrology 9(2), 34. https://doi.org/10.3390/hydrology9020034
Cramp, S.,
Simmons, K.E.l. 1980. Birds of the Western
Palearctic (vol. 2). Oxford University Press. Oxford, UK.
Defaye, B., Moutailler, S., Pasqualini, V., Quilichini, Y. 2022.
Distribution of tick-borne pathogens in domestic animals and their ticks in the
countries of the Mediterranean basin between 2000 and 2021: A systematic
review. Microorganisms 10(6), 1236. https://doi.org/10.3390/microorganisms10061236
Defaye, B., Moutailler, S., Vollot, B., Galon, C., Gonzalez, G.,
Moraes, R.A., Leoncini, A.S., et al. 2023. Detection of Pathogens and Ticks on
Sedentary and Migratory Birds in Two Corsican Wetlands (France, Mediterranean
Area). Microorganisms 11(4), 869. https://doi.org/10.3390/microorganisms11040869
Estrada-Peña, A., Venzal, J.M., Sanchez, A.C. 2013. The
role of habitat fragmentation on the evolutionary history of tick-borne
pathogens. Frontiers in Cellular and Infection Microbiology, 3, 27. https://doi.org/10.3389/fcimb.2013.00029
Estrada-Peña, A., Mihalca, A.D., Petney, T.N. (Eds.). 2018. Ticks of Europe and North Africa: a
guide to species identification. Springer International Publishing AG. https://doi.org/10.1111/mve.12410
European Environment Agency 2015. State of nature in
the EU. Results from reporting under the nature directives 2007–2012. European Environment Agency, Technical
Report No. 2/2015.
Ferraguti, M., Martínez‐de la Puente, J., Bensch, S., Roiz, D., Ruiz, S., Viana, D. S.,
Soriguer, R.D., et al. 2018. Ecological determinants of avian malaria infections: an
integrative analysis at landscape, mosquito and vertebrate community
levels. Journal of
Animal Ecology, 87(3),
727-740. https://doi.org/10.1111/1365-2656.12805
Ferraguti, M., Magallanes, S.,
Jiménez-Peñuela, J., Martínez-de la Puente, J., Garcia-Longoria, L., Figuerola,
J., Muriel, J., et al. 2023. Environmental, geographical and
time-related impacts on avian malaria infections in native and introduced
populations of house sparrows (Passer domesticus), a globally invasive
species. Global Ecology and Biogeography 32, 809–823. https://doi.org/10.1111/geb.13651
Ghosh, S., Bansal, G.C., Gupta, S.C., et al. 2006. Status of tick distribution in Bangladesh, India and Pakistan. Parasitology
Research 99(1), 1-14. https://doi.org/10.1007/s00436-007-0684-7
Gómez-Catasús, J., Garza, V.,
Morales, M.B., Traba, J. 2019. Hierarchical habitat-use by an
endangered steppe bird in fragmented landscapes is associated with large
connected patches and high food availability. Scientific Reports
9(1), 19010. https://doi.org/10.1038/s41598-019-55467-2
Gómez-Catasús, J., Reverter,
M., Bustillo-de la Rosa, D., Barrero, A., Pérez-Granados, C., Zurdo, J., Traba,
J. 2023. Moderate sheep grazing increases arthropod biomass
and habitat use by steppe birds. Agriculture, Ecosystems & Environment
354, 108556. https://doi.org/10.1016/j.agee.2023.108556
González‐Quevedo, C., Davies, R.G.,
Richardson, D.S. 2014. Predictors of malaria infection in a wild bird population: landscape‐level
analyses reveal climatic and anthropogenic factors. Journal of animal
ecology 83(5), 1091-1102. https://doi.org/10.1111/1365-2656.12214
Granthon, C., Williams, D.A. 2017. Avian malaria,
body condition, and blood parameters in four species of songbirds. The
Wilson Journal of Ornithology 129(3), 492-508. https://doi.org/10.1676/16-060.1
Hasle, G. 2013. Transport of ixodid ticks and tick-borne pathogens by
migratory birds. Frontiers in cellular and infection microbiology 3, 48.
https://doi.org/10.3389/fcimb.2013.00048
Heylen, D.,
Matthysen, E. 2008. Effect of tick parasitism on
the health status of a passerine bird. Functional Ecology 22. 1099 -
1107. https://doi.org/10.1111/j.1365-2435.2008.01463.x
Hornok, S., Kováts, D., Csörgő, T., Meli, M.L., Gönczi, E.,
Hadnagy, Z., Takács, N., et al. 2014. Birds as potential reservoirs of
tick-borne pathogens: first evidence of bacteraemia with Rickettsia helvetica. Parasites
& vectors 7, 1-7. https://doi.org/10.1186/1756-3305-7-128
Keve, G., Sándor, A.D., Hornok, S. 2022. Hard
ticks (Acari: Ixodidae) associated with birds in Europe: Review of literature
data. Frontiers in Veterinary Science 9, 928756. https://doi.org/10.3389/fvets.2022.928756
Klaus, C., Gethmann, J., Hoffmann, B., Ziegler, U., Heller, M., Beer, M.
2016. Tick infestation in birds and prevalence of pathogens in ticks collected
from different places in Germany. Parasitology research,115(7),
2729-2740. https://doi.org/10.1007/s00436-016-5022-5
LaPointe, D.A., Atkinson, C.T., Samuel, M.D. 2012. Ecology and conservation
biology of avian malaria. Annals of the New York Academy of Sciences
1249(1), 211-226. https://doi.org/10.1111/j.1749-6632.2011.06431.x
Loss, S.R., Noden, B.H., Hamer, G.L., Hamer, S.A. 2016. A quantitative
synthesis of the role of birds in carrying ticks and tick-borne pathogens in
North America. Oecologia 182, 947-959. https://doi.org/10.1007/s00442-016-3731-1
Matson, K.D., Beadell, J.S. 2010. Infection,
immunity, and island adaptation in birds. The biogeography of
host–parasite interactions 217.
Marzal, A. 2012. Recent advances in studies on avian malaria parasites. Malaria
parasites, 30, 135-158. https://doi.org/10.5772/33730
Marzal, A., de Lope, F., Navarro,
C., Møller, A.P. 2005. Malarial parasites decrease
reproductive success: an experimental study in a passerine bird. Oecologia
142(4), 541–545. https://doi.org/10.1007/s00442-004-1757-2
Merino, S., Møller, A.P.
2010. Host-parasite interactions and climate change. Effects
of climate change on birds 15, 213-226.
Moureau, G., Temmam, S., Gonzalez, J.P., Charrel, R.N., Grard, G., De
Lamballerie, X. 2007. A real-time RT-PCR method for the
universal detection and identification of flaviviruses. Vector-Borne
and Zoonotic Diseases 7(4), 467-478. https://doi.org/10.1089/vbz.2007.0206
Muriel, J., Garcia-Longoria, L., Magallanes, S., Ortiz, J.A.,
Marzal, A. 2023. Avian malaria, haematocrit, and body condition in invasive
wetland passerines settled in southwestern Spain. Avian Research 14, 100081. https://doi.org/10.1016/j.avrs.2023.100081
Norte, A.C., Lobato, D.N.C., Braga,
E.M., Antonini, Y., Lacorte, G., Gonçalves, M., Lopes de Carvalho, I., et al.
2013. Do ticks and Borrelia burgdorferi sl constitute a
burden to birds? Parasitology research 112, 1903-1912. https://doi.org/10.1007/s00436-013-3343-1
Ogden, N.H., Lindsay, L.R., Hanincová, K., Barker, Barker, I.K.,
Bigras-Poulin, M., Charron, D.F., Heagy, A., et al. 2008. Role of migratory
birds in introduction and range expansion of Ixodes scapularis ticks and
of Borrelia burgdorferi and Anaplasma phagocytophilum in Canada. Applied
and Environmental Microbiology 74(6), 1780-1790. https://doi.org/10.1128/AEM.01982-07
Ogden, N.H., Ben Beard, C., Ginsberg, H.S., Tsao, J.I. 2021. Possible
effects of climate change on ixodid ticks and the pathogens they transmit:
Predictions and observations. Journal of Medical Entomology 58(4),
1536-1545. https://doi.org/10.1093/jme/tjaa220
Palomar, A.M., Santibáñez, P., Mazuelas, D., Roncero, L., Santibáñez, S.,
Portillo, A., Oteo, J.A. 2012. Role of birds in dispersal of etiologic agents
of tick-borne zoonoses, Spain, 2009. Emerging infectious diseases 18(7),
1188. https://doi.org/10.3201/eid1807.111777
Pfäffle, M.P., Santos-Silva, M.M., Jaenson, T.G.T., Vatansever, Z., Petney,
T.N. 2018. Haemaphysalis punctate, Canestrini. Ticks of Europe and North Africa: A Guide to Species
Identification 237. https://doi.org/10.1007/978-3-319-63760-0_46
R Core Team 2019. R: A language and environment for statistical computing, version 3.6.1. R Foundation for Statistical
Computing, Vienna, Austria. URL https://www.R-project.org/
Santiago‐Alarcon, D., Palinauskas, V.,
Schaefer, H.M. 2012. Diptera vectors of avian Haemosporidian parasites:
untangling parasite life cycles and their taxonomy. Biological Reviews 87(4), 928-964. https://doi.org/10.1111/j.1469-185X.2012.00234.x
Seoane, J., Justribo, J.H., García,
F., Retamar, J., Rabadan, C., Atienza, J.C. 2006. Habitat-suitability
modelling to assess the effects of land-use changes on Dupont’s lark Chersophilus
duponti: a case study in the Layna Important Bird Area. Biological
Conservation 128(2), 241-252. https://doi.org/10.1016/j.biocon.2005.09.032
Simon, J.A., Marrotte, R.R., Desrosiers, N., Fiset, J., Gaitan, J.,
Gonzalez, A., Koffi, J.K., et al 2014. Climate change and habitat fragmentation
drive the occurrence of Borrelia burgdorferi, the agent of Lyme disease,
at the northeastern limit of its distribution. Evolutionary
Applications 7(7), 750-764.
https://doi.org/10.1111/eva.12165
Sparagano, O., George, D., Giangaspero, A., Špitalská, E. 2015.
Arthropods and associated arthropod-borne diseases transmitted by migrating
birds. The case of ticks and tick-borne pathogens. Veterinary parasitology
213(1-2), 61-66. https://doi.org/10.1016/j.vetpar.2015.08.028
Springer, A., Glass, A., Topp, A.K., Strube, C. 2020. Zoonotic tick-borne
pathogens in temperate and cold regions of Europe—a review on the prevalence in
domestic animals. Frontiers in veterinary science 7, 604910. https://doi.org/10.3389/fvets.2020.604910
Stuen, S., Nevland, S., Moum, T. 2003. Fatal cases of tick-borne fever
(TBF) in sheep caused by several 16S rRNA gene variants of Anaplasma
phagocytophilum. Annals of the New York Academy of Sciences 990(1),
433-434. https://doi.org/10.1111/j.1749-6632.2003.tb07407.x
Tilburg, J.J., Melchers, W.J., Pettersson, A.M., Rossen, J.W., Hermans,
M.H., van Hannen, E.J., Nabuurs-Franssen, M.H., et al. 2010. Interlaboratory
evaluation of different extraction and real-time PCR methods for detection of Coxiella
burnetii DNA in serum. Journal of clinical microbiology 48(11),
3923-3927. https://doi.org/10.1128/JCM.01006-10
Valkiūnas, G. 2005. Avian Malaria Parasites and Other Haemosporidia. CRC
Press. https://doi.org/10.1201/9780203643792
Valkiūnas,
G., Iezhova, T.A. 2018. Keys to the avian malaria
parasites. Malaria Journal 17, 1-24. https://doi.org/10.1186/s12936-018-2359-5
Waldenström, J., Bensch, S., Kiboi, S., Hasselquist, D., Ottosson, U. 2002.
Cross‐species infection of blood parasites between resident and migratory
songbirds in Africa. Molecular ecology 11(8), 1545-1554. https://doi.org/10.1046/j.1365-294X.2002.01523.x
Waldenström, J., Bensch, S., Hasselquist, D., Östman, Ö. 2004. A new nested
polymerase chain reaction method very efficient in detecting Plasmodium and
Haemoproteus infections from avian blood. Journal of Parasitology 90(1),
191-194. https://doi.org/10.1645/GE-3221RN
Weisburg, W.G., Dobson, M.E., Samuel, J.E., Dasch, G.A., Mallavia, L.P.,
Baca, O., Mandelco, L., et al. 1989. Phylogenetic diversity of the
Rickettsiae. Journal of bacteriology 171(8), 4202-4206. https://doi.org/10.1128/jb.171.8.4202-4206.1989
Worton, B.J. 1989. Kernel methods for estimating the utilization
distribution in home-range studies. Ecology 70 (1), 164–168. https://doi.org/10.2307/1938423
Yan, W.L., Sun, H.T., Zhao, Y.C., Hou, X.W., Zhang, M., Zhao, Q.,
Elsheikha, H.M., et al. 2024. Global prevalence of Plasmodium infection in wild
birds: A systematic review and meta-analysis. Research in Veterinary Science
105136. https://doi.org/10.1016/j.rvsc.2024.105136
Zurdo, J., Baonza, J., Traba, J. 2021. New
insights on plant communities and flora of the southern páramos of the Iberian
range (Spain). Phytocoenologia 50, 371–382. https://doi.org/10.1127/phyto/2021/0381
Zurdo, J., Barrero, A., da Silva,
L.P., Bustillo-de la Rosa, D., Gómez-Catasús, J., Morales, M.B., Traba, J., et
al. 2023. Dietary niche overlap and resource partitioning
among six steppe passerines of Central Spain using DNA metabarcoding. Ibis
165, 905–923. https://doi.org/10.1111/ibi.13188
![]() , Marta Sánchez-Sánchez3
, Marta Sánchez-Sánchez3 ![]() , Isabel G. Fernández-De-Mera3
, Isabel G. Fernández-De-Mera3 ![]() , Úrsula Höfle3
, Úrsula Höfle3 ![]() ,
Adrián Barrero1,2
,
Adrián Barrero1,2 ![]() , Julia
Gómez-Catasús1,2
, Julia
Gómez-Catasús1,2 ![]() , Margarita Reverter1,2
, Margarita Reverter1,2 ![]() ,
Julia Zurdo1,2
,
Julia Zurdo1,2 ![]() , Cristian Pérez-Granados4
, Cristian Pérez-Granados4 ![]() ,
Manuel B. Morales1,2
,
Manuel B. Morales1,2 ![]() , Juan Traba1,2,*
, Juan Traba1,2,* ![]()


