Introducción
Las especies del género Anolis, son comúnmente
conocidos como lagartos del nuevo mundo, debido a su distribución de origen
neotropical, son lagartijas de hábitos diurnos, que utilizan una gran variedad
de hábitats (Roughgarden 1995; Lee 2000; Losos 2009; Pough et al. 2016). Generalmente son de hábitos
arborícolas, ocupando diferentes alturas de perchas para forrajeo, refugio y
actividades de cortejo durante la etapa reproductiva (García-Rentería et al. 2006); las especies
de este género son usadas como modelos de estudios ecológicos, debido a su gran
diversidad y altas densidades poblacionales (Losos 1994;
Irschick et al. 1997).
En México, el género Anolis está representado por 58
especies (Ramírez-Bautista et al. 2023),
dentro de las cuales se encuentra Anolis barkeri (Schmidt 1939), una
especie endémica de México, de hábitos semiacuático, que habita a lo largo de
arroyos que presentan afloramientos rocosos (Robinson
1962; Kennedy 1965; Johnson
et al. 2017). Dentro de los estudios sobre la historia natural de la
especie, se encuentran los de Birt et al. (2001),
donde aportan datos sobre el tamaño poblacional, morfología, proporción de
sexos, dieta y reproducción en una población en los Tuxtlas, Veracruz, México;
así mismo Ramírez-Bautista y
Arizmendi (2004) actualizan la información sobre su biología y ecología,
incorporando datos de distribución, hábitat, etología, conservación y factores
de riesgo.
Anolis barkeri se distribuye en los estados de
Veracruz, Chiapas, Oaxaca y Tabasco (Ramírez-Bautista
y Arizmendi 2004); siendo la última entidad la que presenta una
distribución más aislada geográficamente y de la cual se desconoce su estado
poblacional. La especie se encuentra categorizada por la IUCN en estado
vulnerable (VU) (Flores-Villela et al. 2007)
y por la NOM 059 SEMARNAT-2010 como sujeta a protección especial (Pr) (SERMANAT 2010), debido a que sus poblaciones podrían
encontrarse amenazadas por factores antropogénicos como la tala de árboles
maderables y el desmonte de selvas para la agricultura. A pesar de las amenazas
que enfrenta la especie, son pocos los estudios que evalúan algunos de sus
parámetros poblacionales y los cuales datan de casi dos décadas (Robinson 1962; Kennedy 1965;
Birt et al. 2001). Por lo anteriormente expuesto,
el objetivo de la presente investigación fue determinar la estructura
poblacional y el uso del microhábitat de A. barkeri en una selva
tropical del sureste de México. Nuestras hipótesis son: a) de acuerdo con
estudios previos y a la biología de la especie se espera una baja abundancia de
A. barkeri; b) debido a la homogeneidad del hábitat y a los
afloramientos rocosos a lo largo del arroyo, la distribución de la población
será uniforme con una densidad baja; c) debido al apropiado grado de
conservación del sitio de estudio donde se encuentra la población permite que
ésta se mantenga estable, por lo tanto, las clases etarias estarían conformadas
de un mayor número de crías que juveniles y adultos; d) de acuerdo a la historia
natural y la biología descrita para el género Anolis, en particular para
las especies tropicales, se espera que la proporción de sexos sea equitativa; y
e) debido a que el sustrato más abundante es roca y este le proporciona rutas
de escape y sitios de forrajeo, se espera que el microhábitat más utilizado sea
roca en el estrato bajo.
Materiales y métodos
Área de
estudio
El estudio se realizó sobre un arroyo ubicado en el Ejido
Villa de Guadalupe, dentro del complejo Ecoturístico Agua Selva en el municipio
de Huimanguillo, Tabasco, México (17°21’38.23” N y 93°36’30.97” O), donde se
encuentran relictos de vegetación selvática, en la cual sobresalen especies
como cedro (Cedrela odorata L.), ceiba (Ceiba pentandra (L.)
Gaerth.), bojón (Cordia alliodora (Ruiz & Pav.) Oken), palo mulato (Burseras
simaruba (L.) Sarg.), palo amarillo (Terminalia amazonia (J.F.Gmel.)
Exell), orquídeas y begonias, algunas de éstas en peligro de extinción (Palma-López et al. 2007; 2011; Rodríguez-Ocaña
y Banda-Izeta 2016). El
clima es cálido húmedo con lluvias todo el año (Af), con un rango de
temperatura que oscila entre los 22 y 28 °C, la precipitación va de 2000 a 3500
mm anuales, con abundantes lluvias en verano (INEGI 2017).
Trabajo
de campo
Se establecieron 10 transectos sobre
un arroyo apartados de los senderos utilizados en los recorridos turísticos,
los cuales tuvieron 100 m de largo por 15 m de ancho, con una separación de 25
m entre ellos y recorridos en un solo sentido para asegurar la independencia de
los datos (Ríos-Rodas et al. 2020). Se
realizaron muestreos mensuales de septiembre 2017 a agosto 2018, estableciendo
dos días efectivos de recorridos diurnos de 09:00 a 15:00 h y nocturnos de
18:00 a 00.00 h, debido a que la especie presenta actividad durante el día,
pero se puede encontrar perchando en la noche entre las rocas; alcanzando un
esfuerzo de muestreo de 1210 h/hombres (Altamirano-Álvarez
et al. 2016). Debido a las condiciones meteorológicas adversas y la
complejidad del terreno en el sitio de estudio, enero fue el único mes que no
fue muestreado. Los individuos fueron registrados
mediante el método de encuentros visuales (VES) propuesto por Angulo et al. (2006) y Altamirano-Álvarez et al. (2016). Con el
objetivo de determinar el tamaño poblacional se realizaron marcajes mediante el
método de ectomización de falanges a los individuos capturados de septiembre a
diciembre 2017 y de febrero a abril 2018, sumando siete meses de marcajes
efectivos; para disminuir los efectos del método de marcaje se modificó la
numeración propuesta por Donnelly et al. (1994) y Cruz
(2012), asignándola de
la siguiente manera: extremidades anteriores y posteriores izquierda, las
unidades, extremidad anterior derecha las decenas y extremidad posterior
derecha las centenas (Fig. 1). Inmediatamente después del corte se aplicó Cloruro de
benzalconio (Mertodol tintura ®) para evitar posibles infecciones. Para
identificar las clases etarias se utilizaron las medidas morfométricas
propuestas por Birt et al. (2001) y Meyer (1968a): largo hocico-cloaca
(LHC) y largo cola (LC) en las siguientes categorías de edades, crías (LHC ≤20
mm, LC ≤50 mm), juveniles (LCH: 40-59 mm, LC ≥55 mm) y adultos (LHC> 60 mm,
LC≥ 70 mm), y el sexo de los individuos se determinó con la presencia/ausencia
del abanico gular en los machos, mientras que las hembras, carecen de éste. Los
individuos fueron liberados en el sitio de captura después de ser medidos y
ectomizados. Para conocer el uso del microhábitat, se registró el sustrato y el
estrato ocupado por los individuos visualizados y capturados de A. barkeri (Muñoz-Guerrero et al. 2007): entendiéndose
como sustrato el sitio donde se encuentra el individuo (hoja, hojarasca, rama,
roca, suelo y tronco); y estrato como la altura de percha, donde se emplearon
las siguientes categorías: suelo (0 cm), bajo (<49 cm), medio (50-149 cm) y
alto (>150 cm a 2 m) (Heyer
et al. 1994).
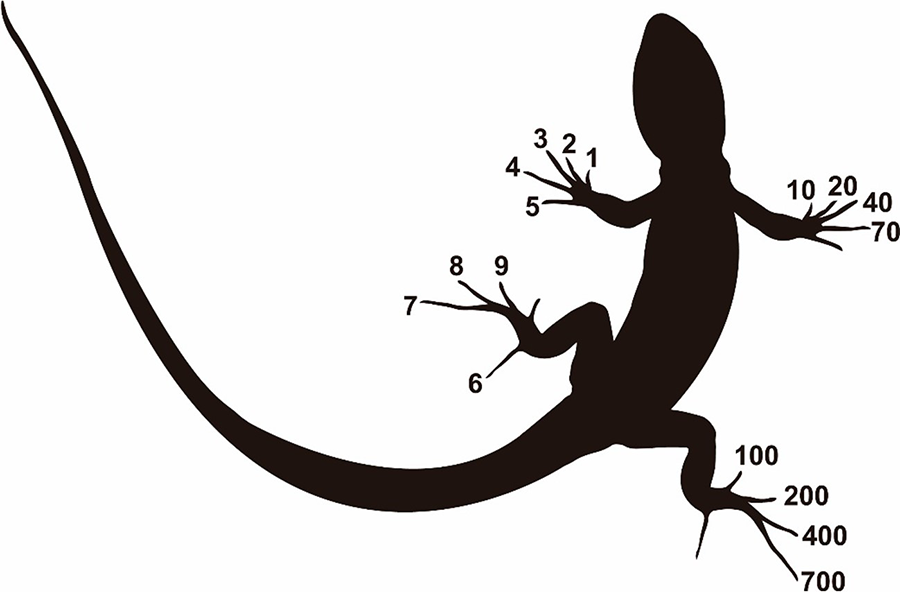
Figura 1. Código de ectomización de falanges en
Anolis barkeri tomado y modificado de la numeración propuesta por Donnelly et al. (1994) y Cruz (2012).
Figure
1. Phalangeal ectomation code in Anolis barkeri taken and modified from
the numbering proposed by Donnelly et al. (1994) and Cruz (2012).
Análisis de datos
La proporción de sexos de A. barkeri se estimó dividiendo
el número de machos entre el número de hembras (Morláns
2004). El tamaño
poblacional se calculó con el programa MARK (Cooch y
White 2019), utilizando los datos de captura-recaptura de acuerdo a la
metodología de Jolly-Seber (Arnason y Mills 1981)
y la parametrización de POPAN (Arnason y Mills
1981), el cual permite identificar la supervivencia, el reclutamiento y la
abundancia de las lagartijas bajo el supuesto de una población abierta; dónde:
P1: representa la probabilidad de captura en ocasión 1, φ1: representa la
probabilidad de supervivencia entre cada ocasión de muestreo i y i + 1 y b1: la
probabilidad de que un organismo de la población ingrese a la población entre
las ocasiones i e i +1 y sobreviva a la siguiente ocasión del muestreo 1+1, b1
también es conocido como PENT (probabilidades de entrada). Se utilizaron
constantes (.) y variables (t) esto con el fin de realizar diferentes modelos y
posteriormente, se seleccionó a través del criterio de información de Akaike
(AICC), el modelo que registró el menor valor (Cooch y White 2019). Se determinó la distribución espacial utilizando la relación
varianza/media, donde valores mayores a uno indican una distribución agregada,
valores menores a uno una distribución uniforme e igual a uno aleatoria (Morláns 2004). Se calculó la densidad poblacional con
la fórmula D=n/s, donde n es el número de animales avistados y
capturados, y s es la superficie (Mandujano 2011), posteriormente se estimó la presencia
de un individuo por m2 a través de la siguiente formula 1/D. Por
último, para comparar tanto el uso de sustratos y estratos se realizaron
utilizando la frecuencia de usos y avistamientos a través de la prueba no
paramétrica Kruskal-Wallis (Kruskal y Wallis 1952),
donde se utilizó como variable de respuesta la abundancia y como variable
independiente los sustratos y estratos respectivamente, seguida de una prueba
post-hoc para identificar las diferencias estadísticamente significativas (Ríos-Rodas et al. 2023), esto con ayuda del
programa estadístico Statgraphics Centurion 18 versión 18.1.13 (Statgraphics Technologies 2022).
Resultados
Durante el periodo de muestreo se avistaron un total de 204
individuos, de los cuales 110 fueron adultos, 62 juveniles y 32 crías, con una
proporción de sexo ligeramente sesgada a favor de las hembras (machos: 75,
hembras: 80; sex ratio = 0.93). Los meses que presentaron la mayor abundancia
fueron octubre y mayo, con 34 y 29 individuos, respectivamente, mientras que la
menor abundancia se registró en diciembre y abril (Fig. 2).
Se marcaron un total de 78 individuos, de los cuales 11
fueron recapturados, uno de ellos en tres ocasiones y diez en dos, mismos que fueron recapturados en meses seguidos a lo
largo del muestreo. Con los organismos marcados, se calculó el tamaño de la
población, dando como resultado 135 individuos, la probabilidad de
supervivencia fue del 22% entre cada tiempo del muestreo y la probabilidad de
recaptura de 57% Tabla 1. La
población de A. barkeri mostró una distribución espacial agregada (5.25),
con una densidad total de un individuo por cada 71.8 m2. De los
cuatro estratos utilizados por A. barkeri, el estrato bajo registró la
mayor abundancia, con 125 de 204 individuos lo que representa el 61.27 % de los
avistamientos, seguido del estrato medio con 49 individuos, el estrato alto con
16 y el suelo con 14. El estrato bajo mostró diferencias estadísticamente
significativas (KW = 21.16, p < 0.001) con
respecto a los demás estratos (Fig. 3). Se
identificaron un total de seis sustratos o microhábitats: hoja, hojarasca,
rama, roca, suelo y tronco, siendo roca el microhábitat mayormente utilizado
por 158 individuos de 204, lo que representa el 77.45 % de los avistamientos,
seguido de rama con 23, tronco con 13, hojarasca y suelo, con cuatro cada uno y
hoja con dos. El sustrato roca mostró diferencias estadísticamente
significativas (KW = 35.89, p < 0.001) con
respecto a los demás sustratos (Fig. 4).
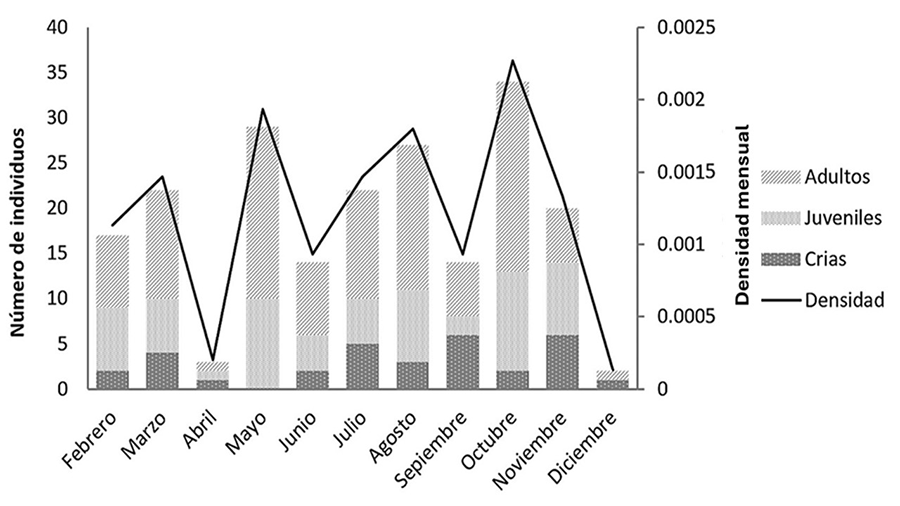
Figura 2. Abundancia y densidad registrada para
Anolis barkeri durante el periodo de muestreo.
Figure 2. Abundance and density recorded for Anolis
barkeri during the sampling period.
Tabla 1. Parametrización
de la población de Anolis barkeri.
Table 1.
Population parameterization of Anolis barkeri.
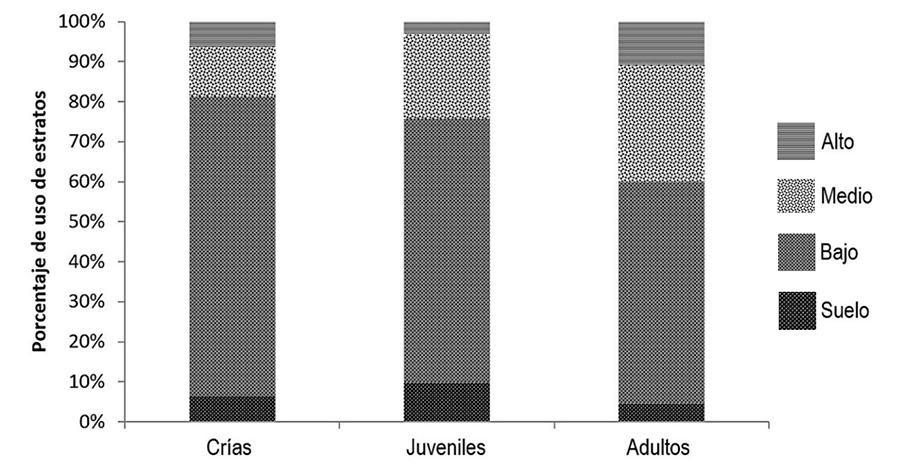
Figura 3. Uso de estrato por clases etarias de Anolis
barkeri. Suelo (0 cm), bajo (<49 cm), medio (50-149 cm) y alto (>150
cm a 2 m).
Figure 3. Stratum use by age classes of Anolis
barkeri. Soil (0 cm), low (<49 cm), medium
(50-149 cm) and high (>150 cm at 2 m).

Figura 4. Usos de sustratos por clases etarias
de Anolis barkeri.
Figure 4. Substrate use by age classes of Anolis
barkeri.
Discusión
La abundancia registrada para A. barkeri en el ejido
Villa de Guadalupe, es similar a los resultados obtenidos por Meyer (1968b), quien registró en 1964 y 1966, 300 y 200
individuos, respectivamente. Los datos del tamaño poblacional difieren a lo
reportado por Birt et al. (2001), quienes
registraron un menor tamaño poblacional con 42 organismos. Esta diferencia en
el tamaño de la población la atribuyen a una alta densidad de Basiliscus
vittatus Wiegmann, 1828, siendo este un posible depredador de la especie,
aunado a la falta de agua en el sitio y a la escaza cobertura vegetal;
particularidades que no están presentes en nuestro sitio de estudio, ya que se
caracteriza por tener un flujo de agua constante gran parte del año, abundante
cobertura vegetal y una baja abundancia de B. vittatus (Gutiérrez-Suárez et al. 2022). A través de estos estudios y nuestros resultados podemos
inferir sobre la necesidad de agua y cobertura vegetal abundante para que las
poblaciones de A. barkeri prosperen a lo largo del tiempo. Si bien, no
se realizó el estudio en los sitios donde previamente se conocía la presencia
de esta especie, podemos mencionar que aún existen sitios como el de Villa de
Guadalupe donde estas poblaciones han encontrado una estabilidad en ambientes
que, aunque son utilizados como recreación, no son impactados de manera
drásticas por las actividades humanas.
La densidad poblacional registrada en el presente estudio es
similar a lo descrito por Meyer (1968a); en 1962
registró un A. barkeri cada 40 m², en 1964 un anolis cada 52 m² y en
1966 un anolis cada 75 m². Así mismo, Campbell (1973)
obtuvo densidades similares para otras especies semiacuáticas (A. poecilopus
Coper 1862 y A. lionotus Cope 1861) de un anolis cada 45 m² en
temporada de seca; sin embargo, en temporada de lluvia, se registró un
individuo cada 10 m²; las diferencias en la densidad poblacional son atribuidas
a factores como: la dinámica de la productividad en el ecosistema, la concentración
de individuos en las perchas y la variación del campo visual (García y Siliceo-Cantero 2019). La
distribución espacial de la población de A. barkeri coincide con lo
descrito por Velazco (2016) para A. lucius Duméril
y Bibron, 1837, la cual es atribuida a la preferencia que tiene por el sustrato
rocoso a pesar de no ser riparia. La distribución de la especie en estudio
puede estar influenciada también por la interacción intraespecífica, corrientes
de agua, disponibilidad de los recursos alimentarios y alteración del hábitat,
factores que pueden afectar la abundancia, la densidad y el tamaño poblacional
(Meyer 1968b; Santos
y Tellería 2006; Altamirano-Álvarez et
al. 2015; González-Espinosa
y Manríquez-Morán 2018).
La proporción de las clases etarias identificadas en el
estudio difieren a lo registrado por Velazco (2016)
en otras especies de anolis, reportando que más del 90 % de los individuos
registrados de A. angusticeps Hallowell, 1856, A. homolechis
(Cope 1864), A. lucius, A. porcatus Gray 1840, y A. sagrei
Duméril y Bibron 1837, fueron adultos y el resto juveniles. En el presente
estudio se registraron adultos, juveniles y crías, el 15.7 % de la abundancia
total fueron crías, estas diferencias pueden deberse a la asociación de A.
barkeri con el arroyo, en contraste con las especies antes mencionadas que
son de hábitos terrestres y arborícolas, lo que aumenta el área de
desplazamiento de los individuos, aunado al tamaño de las crías y estructura
del hábitat que dificulta la detección de dicha clase etaria. El valor de supervivencia de A. barkeri
muestra indicios de una población depredada activamente. Sin
embargo, esta depredación podría estar compensada por la proporción de sexos,
como lo sugieren Márquez et al. (2009) para A.
aquaticus Taylor 1956, donde al igual que nuestro estudio la proporción fue
de 1:1. En cuanto al uso de microhábitat por A. barkeri, nuestros datos
concuerdan a lo reportado por Robinson (1962), Kennedy (1965), y Birt et al.
(2001), quienes mencionan para otras poblaciones de A. barkeri una
preferencia por los estratos bajos y medios, los cuales se encuentran cercanos
a corrientes de agua, que les proporciona medio de escape y mayor protección
contra sus depredadores (Campbell
1973). Los
avistamientos de los individuos con mayor frecuencia en los microhábitats roca
y rama, son similares a los observados en otras especies como A. aquaticus,
A. lionotus, A. poecilopus y A. purpuronectes (Campbell 1973; Eifler y Eifler 2010; Muñoz et al. 2015; Gray et al. 2016), ya que son los microhábitats más
abundantes en los ecosistemas donde se distribuyen. Las tres clases etarias
identificadas en el estudio usaron con mayor frecuencia los estratos bajos y el
microhábitat roca, datos que coinciden con lo reportado por Birt et al. (2001) para otra población de A
barkeri; el uso de roca como el sustrato con mayor ocurrencia de individuos
respecto a otros sustratos, podría deberse a que en los sitios abiertos penetra
mayor cantidad de radiación solar que es captada por este sustrato y que a su
vez es trasmitida a los individuos a través de la conducción durante su
comportamiento de termorregulación, lo que les permite mantener una temperatura
corporal idónea, además de requerir un menor costo energético debido a que no
necesitan buscar sitios de asoleo fuera de su territorio (Kennedy 1965; Altamirano-Álvarez
et al. 2016; Velazco 2016). La población de A.
barkeri estudiada presenta características particulares con respecto a
otras especies del género Anolis, es una especie endémica de México,
riparia, de talla corporal mayor al promedio de otras especies del género,
amenazada por la destrucción de su hábitat por actividades antropogénicas,
aunado a que la especie ha recibido
poca atención y, por lo tanto, aún no existe una
cartografía completa de su distribución que permita conservar hábitats naturales no antropizados para su conservación.
Conclusiones
Los resultados de este estudio y las fuentes bibliográficas
consultadas muestran que la abundancia de A. barkeri es baja de manera
natural. Otro atributo poblacional que destacar en la especie, es la
distribución espacial agregada debido a los hábitos riparios
donde se encuentra un mayor número de microhábitats que son utilizados como
sitios de protección y de escape a sus depredadores; lo que las hace
vulnerables a los cambios antrópicos que se puedan presentar en el sitio de
estudio. Resultado que difiere en el tipo de
distribución espacial esperado, siendo la única predicción que no se cumplió de
las hipótesis planteadas. Pese a ser una especie endémica del sureste de
México, se desconoce gran parte de su historia natural, por lo que es
importante continuar con estudios relacionados al estado actual de sus
poblaciones en los diferentes sitios de distribución, así como datos más
precisos acerca de su alimentación, ciclo de vida y comportamiento que sienten
las bases para su manejo y conservación, contrarrestando los impactos negativos
del deterioro de la cobertura vegetal y disminución de los niveles de agua
ocasionados por el cambio de uso de suelo y los efectos del cambio climático
global.
Disponibilidad de los datos
Los datos utilizados en este estudio forman parte de un
proyecto de investigación y, debido a restricciones institucionales y de
confidencialidad, no pueden ser compartidos públicamente en este momento; sin
embargo, los datos pueden ser proporcionados bajo solicitud. El autor de
correspondencia tiene acceso a los datos y podrá brindar información
complementaria en la medida de lo posible.
Contribución de los autores
Jenny del Carmen Estrada-Montiel: Investigación, Análisis
formal, Redacción, borrador inicial — María del Rosario Barragán-Vázquez:
Investigación, Recursos, Redacción — José del Carmen Gerónimo-Torres:
Conceptualización, Análisis formal, Metodología, Redacción — Liliana Ríos-Rodas:
Investigación, Análisis formal, Redacción, Recursos — Marco Antonio
Torrez-Pérez — Metodología, Redacción.
Financiación, permisos requeridos, potenciales
conflictos de interés y agradecimientos
Se agradece el apoyo brindado para la realización de esta
investigación a la Secretaría de Investigación, Posgrado y Vinculación de la
Universidad Juárez Autónoma de Tabasco, a través del proyecto interno
“Diversidad de reptiles en la Sierra de Huimanguillo, Tabasco”, con la clave
294. Así como, a José María Gutiérrez Suárez y Débora Olvera por el acompañamiento
en campo.
Los autores/as declaran no tener ningún conflicto de intereses.
Referencias
Altamirano-Álvarez, T.A., Keer-García, K., Soriano-Sarabia,
M. 2015. Distribución y uso de microhábitats de Sceloporus grammicus Wiegmann
(Sauria: Phrynosomatidae) en la F.E.S. Iztacala. Revista de Zoología 26:
11-19.
Altamirano-Álvarez,
T.A., Soriano-Sarabia, M., López, J.F. (eds.) 2016. Ecología de anfibios y
reptiles: Métodos y técnicas para su estudio. Editorial
FES-Iztacala. UNAM, Ciudad de México.
Angulo,
A., Rueda-Almonacid, J.V., Rodríguez-Mahecha, J.V., La Marca, E. (eds.) 2006. Técnicas
de inventario y monitoreo para los anfibios y reptiles de la región tropical
andina. Conservación Internacional. Serie Manuales para la Conservación
Nº 2. Unidad de Conservación de Especies del Centro de Biodiversidad de los
Andes (CBC) de Conservación Internacional. Bogotá, Colombia.
Arnason, A.N., Mills, K.H. 1981. Bias and loss of
precision due to tag loss in Jolly-Seber estimates for mark-recapture
experiments. Canadian Journal of Fisheries and Aquatic Science 38:
1077-1095. https://doi.org/10.1139/f81-148
Birt, R.A., Powell, R., Greene, B.D. 2001. Natural history of Anolis barkeri: A semiaquatic lizard from
southern Mexico. Journal of
Herpetology 35(1):
161-166. https://doi.org/10.2307/1566043
Campbell, H.W.
1973. Ecological observations on Anolis lionotus
and Anolis poecilopus (Reptilia, Sauria) in Panama. American Museum
Novitates 2516: 1-29.
Cooch, E.G.,
White, G.C. 2019. Program MARK, A gentle
introduction. Available at: http://www.phidot.org/software/mark/docs/book/. [Used on 21-01-2019]
Cruz, D.S. 2012. Aspectos de la
biología de la lagartija Xantusia Sanchezi. Tesis de doctorado, Facultad de
Ciencias Biológicas. Universidad Autónoma de Nuevo León, San Nicolás de los
Garza, México.
Donnelly, M.A., Guyer, C., Juterbock, J.E., Alford, R.A. 1994. Techniques for marking amphibians En: Heyer W.R., Donnelly, M.A.,
McDiarmid, R.W., Hakey, L.A.C., Foster, M.S. (Eds.) Measuring and monitoring
biological diversity: standard methods for amphibians, pp. 227-284.
Smithsonian Institution Press. Washington, DC. USA.
Eifler,
D.A., Eifler, M.A. 2010. Use of habitat by the
semiaquatic lizard, Norops aquaticus. The Southwestern Naturalist 55(3):
466-470. https://doi.org/10.1894/PAS-19.1
Flores-Villela, O., López-Luna, M.A.,
Calderón-Mandujano, R. 2007. Anolis barkeri. The IUCN red list
of threatened species 2007: e.T64186A12745198. https://dx.doi.org/10.2305/IUCN.UK.2007.RLTS.T64186A12745198.en [Accessed on 06-02-2022]
Fox, J., Bouchet-Valat, M., Muñoz-Márquez, M., Andronic, L., Ash, M.,
Boye, T., Calza, S., et al. 2013. Package ‘rcmdr’, version 2.6-2. https://cran.r-project.org/web/packages/Rcmdr/index.html [Accessed on 10-02-2023]
García, A.,
Siliceo-Cantero, H.H. 2019. Huracán Jova: efecto de un fenómeno
metereológico severo sobre lagartijas insulares en el occidente de México. Revista
Mexicana de Biodiversidad 90:1-13. https://doi.org/10.22201/ib.20078706e.2019.90.2880
García-Rentería, U.,
Rengífo-Mosquera, J.T., Moreno-Mosquera, F., Jiménez-Ortega, M. 2006.
Diversidad de lagartos (Squamata: Lacertilia) en el sotobosque de cuatro
localidades asociadas a la cuenca del rio Cabí, Chocó, Colombia. Revista
Institucional Universidad Tecnológica del Chocó 25: 47-55.
González-Espinosa,
J.E., Manríquez-Morán, N.L. 2018. Preferencia de sustrato de los
lacertilios diurnos del valle Zapotitlán Salinas, Puebla. Revista Mexicana de Biodiversidad
89(2): 471-478. https://doi.org/10.22201/ib.20078706e.2018.2.2337
Gray, L., Meza-Lázaro, R., Poe,
S., Nieto-Montes de Oca, A. 2016. A new species of semiaquatic
Anolis (Squamata: Dactyloidae) from Oaxaca and Veracruz, Mexico. Herpetological Journal 26: 253-262.
Gutiérrez-Suárez, J.M., Ríos-Rodas, L.,
Gerónimo-Torres, J. del C., Barragán-Vázquez,
M del R. 2022. Diversidad y estado de conservación de reptiles
asociados a dos ecosistemas ribereños del municipio de Huimanguillo, Tabasco,
México. Tropical and Subtropical
Agroecosystems 25(1): 1-15. http://dx.doi.org/10.56369/tsaes.3894
Heyer, W.R., Donnelly, M.A., McDiarmid,
R.W., Hayek, L.C., Foster, M.S. (Eds.) 1994. Measuring,
and monitoring biological diversity, standard methods for amphibians. Smithsonian Institution Press. Washington, DC. USA.
INEGI 2017. Anuario
Estadístico y Geográfico de Tabasco. Instituto Nacional de Estadística y
Geografía. Aguascalientes, México. Disponible en: https://www.datatur.sectur.gob.mx/ITxEF_Docs/TAB_ANUARIO_PDF.pdf
Irschick, D.J., Vitt, L.J.,
Losos, J.B. 1997. A comparison of evolutionary radiations in
mainland and caribbean Anolis lizards. Ecology
78(7): 2191-2203. https://doi.org/10.2307/2265955
Johnson, D.J., Wilson, L.D.,
Mata-Silva, V., García-Padilla, E., DeSantis, D.L. 2017. The
endemic herpetofauna of Mexico: organisms of global significance in severe
peril. Mesoamerican Herpetology 4(3):
544-620.
Kennedy, J.P. 1965. Observations on the distribution and ecology of
Barker’s anole, Anolis barkeri Schmidt (Iguanidae). Zoologica 50(1):
41-43. https://doi.org/10.5962/p.203266
Kruskal, W.H., Wallis, W.A. 1952. Use of ranks in one-criterion variance
analysis. Journal of the American Statistical Association 47: 583–621. https://doi.org/10.2307/2280779
Lee, J.C. 2000. A Field guide to the amphibians and reptiles of the Maya
World: The lowlands of Mexico northern Guatemala, and Belize. Comstock
Publishing Associates. New York, USA.
Losos, J.B. 1994. Integrative approaches to evolutionary ecology: anolis
lizards as model systems. Annual Review of Ecology and Systematics
25:467-493. https://doi.org/10.1146/annurev.es.25.110194.002343
Losos, J.B. 2009. Lizards
in an evolutionary tree: ecology and adaptive radiation of anoles. University of California Press. California, USA. https://doi.org/10.1525/california/9780520255913.001.0001
Mandujano, S.R. 2011.
Conceptos generales de ecología poblacional en el manejo de fauna silvestre. En:
Gallina, T.S., López, G.C. (Eds.). Manual de técnicas para el estudio de la
fauna, pp. 37-60. Universidad Autónoma de Querétaro, Santiago de Querétaro,
Qro., México e Instituto de Ecología, A.C. INECOL. Veracruz, México.
Márquez, B.C., Márquez,
R.L., Rea, P.S., Márquez, R.J. 2009. Demografía de la población de Anolis
aquaticus (Sauria Polychrotidae) de la quebrada La Palma, Puriscal, Costa
Rica. Revista Ecuatoriana de Medicina y Ciencias Bilógicas 30(1-2): 67-77.
https://doi.org/10.26807/remcb.v30i1-2.75
Meyer, J.R. 1968a. Distribution and variation of the mexican lizard, Anolis
barkeri Schmidt (Iguanidae), with Redescription of the Species. Copeia
1: 89-95. https://doi.org/10.2307/1441554
Meyer, J.R. 1968b. The ecological significance of feeding behavior in the
Mexican lizard Anolis barkeri. Bulletin of the Southern California
Academy of Sciences 67(4): 255-262. https://doi.org/10.3160/0038-3872-67.4.255
Morláns, M.C. 2004. Introducción
a la ecología de poblaciones, área ecología. Editorial Científica
Universitaria. Universidad Nacional de Catamarca. Catamarca, Argentina.
Muñoz-Guerrero, J.,
Serrano, V.H., Ramírez-Padilla, M.P. 2007. Uso de microhábitat, dieta y tiempo
de actividad en cuatro especies simpátricas de ranas hílidas neotropicales
(Anura: Hylidae). Caldasia
29(2): 413-425.
Muñoz, M.M., Crandell, K.E., Campbell-Staton, S.C., Fenstermacher, K.,
Frank, H.K., Middlesworth, P.V., Sasa, M., et al. 2015. Multiple paths to aquatic specialisation in four species of Central
American Anolis lizards. Journal of Natural History 49(27-28) 1717-1730.
https://doi.org/10.1080/00222933.2015.1005714
Palma-López, D.J., Cisneros-Dominguez, J., Moreno-Caliz, E., Rincón-Ramírez,
J.A. (Eds.), 2007. Suelos de Tabasco: Su Uso y Manejo Sustentable.
Colegio De Postgraduados-ISPROTAB-Fundación Produce Tabasco. Villahermosa,
Tabasco.
Palma-López, D.J.,
Vázquez-Navarrete, C.J., Mata-Zayas, E.E., López-Castañeda, A.,
Morales-Garduza, M.A., Chablé-Pascual, R., Contreras-Hernández, J., et al. (Eds.),
2011. Zonificación de ecosistemas y agroecosistemas susceptibles de recibir
pagos por servicios ambientales en la Chontalpa, Tabasco. Colegio De
Postgraduados Campus Tabasco, Secretaría de Recursos Naturales y Protección
Ambiental. Villahermosa, Tabasco, México.
Pough, F., Andrews, R., Crum, M., Savitzky A., Wells K., Brandely, M.
(Eds.), 2016. Herpetology. Sinauer Associates Inc, Sunderland, Massachusetts,
USA. https://doi.org/10.1093/hesc/9781605352336.001.0001
Ramírez-Bautista,
A., Arizmendi, M.C. 2004. Anolis barkeri. Sistemática e historia natural
de algunos anfibios y reptiles de México. Facultad de Estudios Superiores
Iztacala, Unidad de Biología, Tecnología y Prototipos (UBIPRO), Universidad
Nacional Autónoma de México. Bases de datos SNIB-CONABIO. Proyecto W013.
México. Disponible en: http://www.conabio.gob.mx/conocimiento/ise/fichasnom/Anolisbarkeri00.pdf
Ramírez-Bautista, A., Torres-Hernández, A.,
Cruz-Elizalde, R., Berriozabal-Islas, C., Hernández-Salinas, U., Wilson, L.D.,
Johnson, J.D., et al. 2023. An updated list of the Mexican
herpetofauna: with a summary of historical and contemporary studies. Zookeys 1166: 287-306. https://doi.org/10.3897/zookeys.1166.86986
Ríos-Rodas, L., Zenteno-Ruíz, C.E., Pérez-de la
Cruz, M., Arriaga-Weiss, S.L., Jiménez-Pérez, N. del C., Bustos-Zagal, M.G.
2020. Anfibios riparios en dos ecosistemas tropicales del sureste de México. Ecosistemas 29(3): 1-7. https://doi.org/10.7818/ECOS.2098
Ríos-Rodas, L.,
Zenteno-Ruiz, C.E., Gerónimo-Torres, J.D.C., Jiménez-Pérez, N.D.C.,
Bustos-Zagal, M.G., Pérez-De la Cruz, M. 2023. Uso de microhábitats y
diversidad de presas consumidas por Craugastor berkenbuschii (Anura:
Craugastoridae) en México. Acta Biológica Colombiana 28(1): 39-48. http://dx.doi.org/10.15446/abc.v28n1.95266
Robinson, D.C. 1962. Notes
on the lizard Anolis barkeri Schmidt. Copeia 3: 640-642. https://doi.org/10.2307/1441193
Rodríguez-Ocaña,
L., Banda-Izeta, H. 2016. El ecoturismo en Agua
Selva Tabasco, México: medios de promoción. International
Journal of Scientific Managment Tourism 2(3):
291-306.
Roughgarden,
J. 1995. Anolis lizards of the Caribbean:
Ecology, Evolution and Plate Tectonics. Oxford University Press. New York, USA. https://doi.org/10.1093/oso/9780195067316.001.0001
Santos, T., Tellería, J.L.
2006. Pérdida y fragmentación del hábitat: Efecto sobre la conservación de
las especies. Ecosistemas 15(2): 3-12. Recuperado de https://www.revistaecosistemas.net/index.php/ecosistemas/article/view/180
SEMARNAT 2010. Norma Oficial
Mexicana NOM-059-SEMARNAT-2010, Protección ambiental-Especies nativas de México
de flora y fauna silvestres-Categorías de riesgo y especificaciones para su
inclusión, exclusión o cambio-Lista de especies en riesgo. Diario Oficial de
la Federación del Jueves 30 de diciembre de 2010, 2ª sección.
Disponible en: https://www.profepa.gob.mx/innovaportal/file/435/1/nom_059_semarnat_2010.pdf
Actualizado en DOF 14/11/2019. https://www.dof.gob.mx/nota_to_doc.php?codnota=5578807
Statgraphics
Technologies, Inc. 2022. Statgraphics Centurion 18
(versión 18.1.16) [Software]. Recuperado de https://www.statgraphics.com/download18
Velazco, P.K. 2016. Segregación
estructural, climática y temporal de cinco especies simpátricas de Anolis
(Sauria: Dactyloidae) en Boca de Canasí, Cuba. Poeyana 502: 49-54.
![]() , María del Rosario Barragán-Vázquez1
, María del Rosario Barragán-Vázquez1 ![]() , José del Carmen Gerónimo-Torres2
, José del Carmen Gerónimo-Torres2 ![]() , Liliana Ríos-Rodas3,*
, Liliana Ríos-Rodas3,* ![]() , Marco Antonio Torrez-Pérez6
, Marco Antonio Torrez-Pérez6 ![]()


