Introducción
La pérdida y fragmentación del hábitat es una de las mayores
amenazas para la biodiversidad a escala global (Sala
2000; Jaureguiberry et al. 2022). El
desarrollo humano ha generado el aumento acelerado de infraestructuras lineales
de transporte a nivel mundial (de aquí en adelante ILT; como carreteras, vías
férreas y canales), con una previsión creciente hasta 2050 (Meijer et al. 2018). Las ILT generan una
degradación, pérdida y fragmentación del hábitat inmediata (Barrientos et al. 2019), restringiendo el acceso
a terrenos anteriormente disponibles y generando una antropización intensa en
las zonas circundantes (van der Ree et al. 2015).
Esta fragmentación se traduce en discontinuidades en los hábitats naturales que
se transforman en un conjunto de fragmentos desconectados entre sí, con cambios
tanto en composición de especies como en estructura que amenaza la
supervivencia de numerosos vertebrados, además de poner en riesgo el
funcionamiento y la provisión de servicios de los ecosistemas (Liu et al. 2018; Biswas et
al. 2023). Respecto a los atropellos de fauna, algunos estudios muestran
que las colisiones con vehículos tienen un patrón estacional dependiente de los
patrones de movimiento de las especies (Arca-Rubio
et al. 2023), aunque hay una falta de conocimiento acerca de los impactos
de las colisiones sobre la viabilidad de las poblaciones en los diferentes
grupos faunísticos (Barrientos et al. 2021).
El efecto barrera de las ILT es especialmente dañino para
especies amenazadas o con capacidad de dispersión limitada (Colino-Rabanal y Lizana 2012; Weigand et al. 2019). La pérdida y fragmentación de
hábitat producida por las ILT pueden llevar al aislamiento de poblaciones de
especies en zonas protegidas (Sánchez-Fernández
et al. 2022), reduciendo el tamaño poblacional y aumentando la probabilidad
de extinción local (Barrientos et al. 2021; Jiménez-Franco et al. 2022). La fragmentación
del hábitat también reduce la diversidad genética, generando endogamia en
poblaciones pequeñas (Balkenhol y Waits 2009; Holderegger y Di Giulio 2010; Rivera‐Ortíz
et al. 2015).
Los diferentes impactos que generan las carreteras hacen
necesario acometer medidas que permitan restablecer la conectividad del
paisaje, definida como “la capacidad de un paisaje para facilitar el
movimiento de individuos y el flujo genético entre áreas de buen hábitat” (Taylor et al. 1993). La mitigación de los impactos
en carreteras a escala local pasa, por un lado, por establecer vallas o
cerramientos físicos o virtuales (ej. barrera de ultrasonidos) para evitar
colisiones y atropellos (Glista et al. 2009; Botting et al. 2023), y por otro, por fomentar la
conectividad del hábitat entre ambos lados de las carreteras con la instalación
de estructuras que permitan la movilidad de vertebrados, llamadas de forma
general “pasos de fauna” (van der Grift et al.
2013). Actualmente, existen diferentes tipos de pasos de fauna que incluyen
tanto pasos subterráneos (ej. túneles de anfibios, tuberías de mesomamíferos,
parte inferior de viaductos y servidumbres subterráneas) como pasos superiores
(ej. puentes elevados, de cuerda o de troncos, terreno natural sobre un túnel; Van der Ree et al. 2015). Es por ello, que las
medidas de mitigación para fomentar la conectividad del paisaje es un aspecto para
considerar en la planificación y proyección de las ILT, y en especial en los
espacios naturales protegidos.
Sin embargo, cuando se construye o amplía una carretera, no
siempre se realizan estudios sobre la afección a la conectividad de las
poblaciones animales y en los proyectos apenas se incluyen pasos de fauna
específicamente diseñados para mitigar el efecto barrera, especialmente en las
ILT más antiguas (Van der Ree et al. 2015). A
falta de pasos de fauna específicos, existen ciertas infraestructuras que
pueden actuar como tal (ej. túneles, viaductos, servidumbres, etc.; Warnock-Juteau et al. 2022). Entre ellas,
destacan por su abundancia las estructuras de drenaje transversal de carreteras
(de aquí en adelante “drenajes”), diseñadas para evacuar el agua durante
episodios de lluvia. Estos drenajes podrían tener una funcionalidad parcial
como pasos de fauna para algunas especies de vertebrados (Young et al. 2023) pero ha sido evaluada en un menor
número de estudios, aumentando éstos en número y relevancia en los últimos años
(Yanes et al. 1995; Clevenger
et al. 2001; Mata et al. 2008; Brunen et al. 2020; Chen et
al. 2021). La funcionalidad de estos drenajes, además de por sus
características constructivas y el hábitat adyacente, puede variar por las
características individuales de cada especie, como el tamaño corporal y
capacidad de desplazamiento. Los estudios existentes hasta la fecha muestran
que los drenajes son utilizados por carnívoros, lagomorfos y pequeños mamíferos
(Rodriguez et al. 1996), incluyendo también
ungulados (Ng et al. 2004) y especies de limitado
movimiento como reptiles (Rodriguez et al. 1996;
Jones et al. 2022). En este sentido, la
herpetofauna es uno de los grupos con menor movilidad y capacidad de dispersión
lo que los hace más vulnerables a la fragmentación del hábitat (Keinath et al. 2017; Inman et
al. 2023; Caballero-Díaz 2024) y los
atropellos (Colino-Rabanal y Lizana 2012; Rytwinski y Fahrig 2012). En este contexto, resulta
de especial interés evaluar la funcionalidad de estas estructuras para especies
amenazadas de movilidad limitada en carreteras que atraviesan espacios
naturales protegidos. De esta forma, será posible determinar las necesidades de
conectividad de cada especie en el marco de la Red Natura 2000, identificando
estrategias de gestión que complementen la conectividad que puedan generar
dichos drenajes, a través de la adaptación de los drenajes existentes y el
establecimiento de nuevos pasos de fauna específicos (Ministerio
de Agricultura, Alimentación y Medio Ambiente 2015).
La evaluación de la conectividad paisajística de vertebrados
terrestres se ha realizado principalmente en mamíferos (Martinig y Bélanger‐Smith 2016), utilizando técnicas
tradicionales como captura de huellas en marmolina o radioseguimiento (Rodriguez et al. 1996; Ng
et al. 2004), y otras de desarrollo reciente como seguimiento con GPS (Harju et al. 2024) y cámaras de fototrampeo (Young et al. 2023). Para analizar la conectividad, el
uso de cámaras de fototrampeo es una de las metodologías más sensibles
disponibles en la actualidad, especialmente en hábitats cerrados (Wearn y Glover-Kapfer 2019). Es una técnica que
además de no invasiva, es bastante fiable para identificar especies conspicuas
o de hábitos nocturnos (Jumeau et al. 2017).
El objetivo general de este trabajo es evaluar la
funcionalidad de los drenajes de carretera como pasos de fauna en una Zona de
Especial Conservación (ZEC) que alberga endemismos ibéricos y especies
amenazadas. Para ello, se instalaron 8 cámaras trampa durante un año completo
(2023-2024) en 8 drenajes en el tramo de la carretera autonómica A-1205 que
divide al ZEC Sierras de Almagrera, de Los Pinos y El Aguilón (ES6110012), que
presenta un hábitat de matorral mediterráneo de elevada calidad. Los objetivos
específicos de este trabajo son: 1) identificar qué especies de vertebrados
utilizan los drenajes de las carreteras en un espacio protegido y amenazado; 2)
analizar los patrones espaciales y temporales (estacional y patrones diarios)
de los eventos de paso de las diferentes especies de vertebrados, prestando
especial atención a especies amenazadas. En base a lo
observado en estudios previos (Clevenger et
al. 2001; Mata et al. 2008; Denneboom et al. 2021), hipotetizamos que
existirán diferencias significativas en la frecuencia de uso de los drenajes
entre especies, favoreciendo el paso de mamíferos de mediano tamaño, pero
pudiendo ser una barrera (e incluso una trampa) para reptiles amenazados de
pequeño tamaño y poca capacidad de dispersión (Lovich
et al. 2011), como la tortuga mora (Graciá y
Giménez 2015; Graciá et al. 2020a). Además,
dada su similitud constructiva y cercanía (todos situados en 1-2 km de
distancia y 7 de 8 son tubos de drenaje idénticos), no se esperan grandes
diferencias en los patrones espaciales de paso entre especies. De hecho, se
espera que especies similares en tamaño o movilidad compartan los drenajes más
de lo esperable por azar. Finalmente, esperamos encontrar diferencias en el
patrón estacional y diario, especialmente entre los animales ectotermos y
endotermos (Mata et al. 2008; Denneboom et al. 2021). Así, aunque se prevé una
mayor actividad para la fauna general en primavera, se espera que las
diferencias entre estaciones sean mucho más acusadas en reptiles que en otros
grupos faunísticos.
Materiales y métodos
Área de estudio
El área de estudio se encuentra
en la carretera provincial A-1205 (km 4-6, Pulpí, Almería, España; Fig. 1). Pese a solo tener un carril por sentido, la
carretera soporta un tránsito de hasta 5000 vehículos diarios (Junta de
Andalucía 2019) ya que conecta la
autopista AP7, las localidades de Pulpí, Pilar de Jaravía y núcleos costeros
como San Juan de los Terreros o Pozo del Esparto. En su trazado cruza las
Sierras de Almagrera, de Los Pinos y El Aguilón. Esta ZEC de la Red Natura 2000
cuyo uso del suelo es natural (ausencia de uso agrícola o urbano) presenta un
clima mediterráneo semiárido en el que los periodos de sequía y calor son muy
prolongados en el tiempo, especialmente en periodos estivales, siendo la
precipitación media anual cercana a los 250 mm, la temperatura media de 17.7ºC
y el índice de insolación >3000 horas anuales, valores de los más altos de
Europa (Junta
de Andalucía 2015). Este clima
condiciona una vegetación de matorral eminentemente xerófila o con alta
resistencia a la aridez, idéntica a ambos lados de la carretera, y siendo
abundantes especies como Salsola oppositifolia, Thymelaea hirsuta, Retama
sphaerocarpa, Stipa tenacissima, Asparagus horridus, Taraxacum officinale,
Sedum sediforme, Lavandula stoechas, Marrubium vulgare, Rhamnus lycioides,
Artemisia herba-alba, Artemisia barrelieri, Rosmarinus officinalis, Anthyllis
cytisoides, Pistacia lentiscus o Thymus vulgaris.
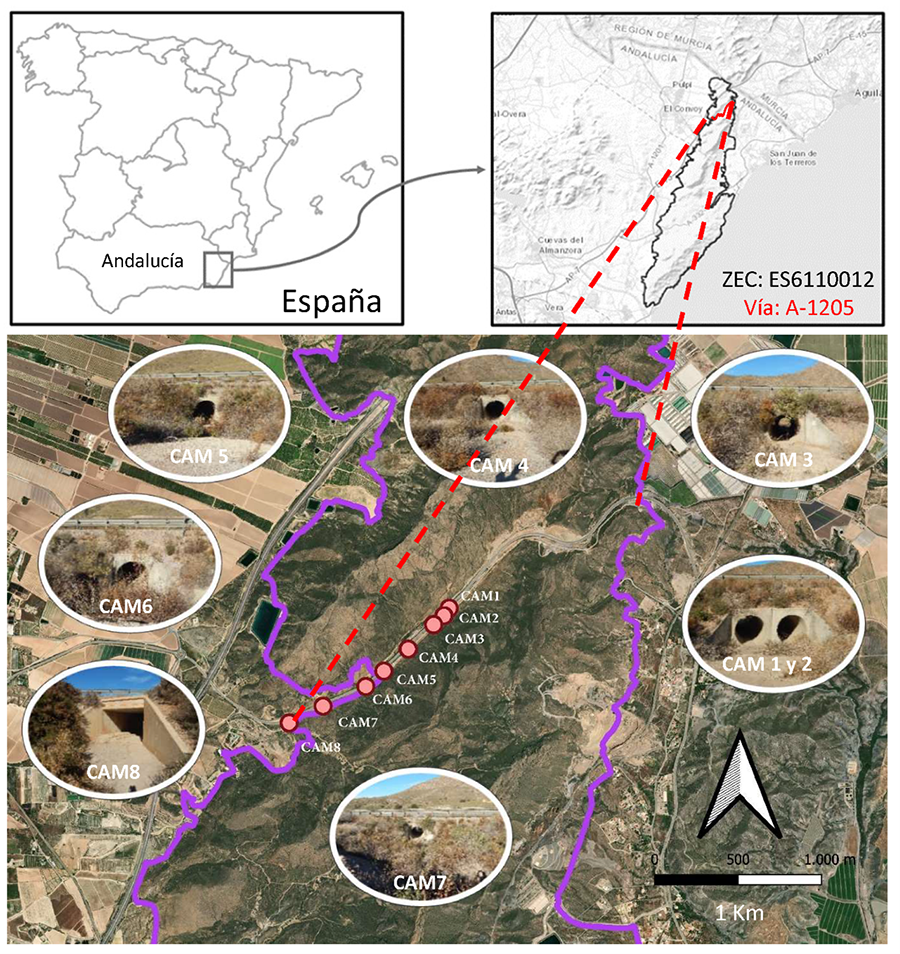
Figura 1. Área de estudio y detalle de los 8
drenajes en los que se instalaron cámaras de fototrampeo en la carretera A-1205
en el tramo que intersecciona con la ZEC Sierras Almagrera, de los Pinos y el
Aguilón (ES6110012).
Figure 1.
Study area and details of the 8 drainages where cameras traps were installed on
the A-1205 road in the section which intersects with the ZEC Sierras Almagrera,
de los Pinos y el Aguilón (ES6110012).
Puntos
de muestreo y procesado de imágenes
En esta carretera
A-1205 se realizó primeramente una identificación y caracterización de 8 obras
de drenaje y de su entorno (Fig. 1; Mora 2024). Estas estructuras se encuentran a una
distancia media entre ellos de 466 m (±285 m SD), siendo 7 de ellas tubos de
drenaje (CAM1-CAM7) de similares características constructivas (hormigón; sin
pendiente; diámetro=1.8 m; longitud <20 m) y de hábitat (uso del suelo
natural, distancia los parches de vegetación más cercanos < 5 metros; Anexo I.a). El drenaje restante (CAM8) se sitúa en
el mismo hábitat y es un paso inferior de 20.7 metros de longitud, sin
pendiente, con sustrato de tierra y diámetro de 4.3 metros (Anexo
I.a). A continuación, se anclaron cámaras de fototrampeo en el techo,
en el punto central de cada uno de los 8 pasos (Anexo
I.b). Las cámaras contaban con sensores de detección de movimiento
(modelo Browning Dark Ops PRO DCL; 26 Mpx), fueron configuradas en modo
alta sensibilidad y estuvieron grabando de forma continua durante un año
completo (21 de junio de 2023 al 1 de julio de 2024) tanto de día como de noche
(equipada con luz infrarroja).
Se registraron un total de 9996
imágenes en las 8 cámaras, que fueron revisadas una a una, de las cuales 4756
contenían animales (Fig. 2). En una segunda fase,
quedaron 4094 imágenes tras la eliminación de todas las especies de
invertebrados, quirópteros y aves, excepto Alectoris rufa, un ave de
movilidad eminentemente terrestre (Nadal et al. 2018)
presa clave en los ecosistemas mediterráneos (Casas y
García 2022) que se encuentra en declive por pérdida de hábitat (Delibes-Mateos et al. 2012). En la última
fase de filtrado, eliminamos todas aquellas fotos de individuos repetidos que
no constituyen eventos de paso distintos. Para que se consideraran eventos de
paso diferentes tenían que darse varias condiciones: un mínimo de 2 minutos entre
imagen e imagen de la misma especie; que entre ambas imágenes haya alguna en la
que ya no se visualiza a la especie, y que no se detecte un comportamiento
errático en la secuencia de imágenes disponibles sino una dirección clara e
inequívoca de cruce, por lo que si un individuo era identificado con un
comportamiento errático ante la cámara, solo se consideraba un cruce aunque se
cumplieran el resto de requisitos. Tras el filtrado de especies y la
identificación de los eventos de paso únicos (en adelante detecciones), nos
quedamos con 3157 detecciones de cruce de 19 especies de vertebrados en las 8
cámaras monitoreadas durante la duración del estudio (Anexos
I.c y I.d).

Figura 2. Ejemplo de
imágenes de fauna captadas por las cámaras de fototrampeo: Oryctolagus
cuniculus (1), Testudo graeca (2), Vulpes vulpes (3), Capra
pyrenaica (4), Martes foina (5), Felis silvestris (6), Meles
meles (7), Genetta genetta (8), Rattus rattus (9), Felis
catus (10), Timon nevadensis (11), Alectoris rufa (12), Zamenis
scalaris (13), Mus spretus (14), Canis lupus familiaris (15)
y Eliomys quercinus (16).
Figure 2.
Example of species photographs taken by camera traps in the studied drainages: Oryctolagus cuniculus (1), Testudo graeca (2), Vulpes vulpes (3), Capra pyrenaica (4), Martes foina (5), Felis silvestris (6), Meles meles (7), Genetta genetta (8), Rattus rattus (9), Felis catus (10), Timon nevadensis (11), Alectoris rufa (12), Zamenis scalaris (13), Mus spretus (14), Canis lupus familiaris (15) y Eliomys quercinus (16).
Análisis de datos
Se
realizaron correlaciones de Spearman entre las detecciones de cada especie para
determinar si hay especies que comparten los drenajes más o menos
frecuentemente que lo esperable por azar. A continuación, se realizó un
análisis de ordenación NMDS (Non-Metric Multidimensional Scaling), para
representar gráficamente los drenajes, en función de la similitud (utilizando
la distancia de Bray-Curtis) de las especies que atraviesan los mismos e
identificando si hay especies que están determinando la ordenación obtenida.
Complementariamente, para evaluar si existían especies que cruzaban drenajes
concretos más frecuentemente de lo esperado por azar, se realizó un Modelo
Lineal Generalizado (GLM) que evalúa la relación entre la frecuencia de paso
(variable respuesta) con las variables explicativas Especie y Drenaje (y su
interacción). Aunque se hizo una caracterización de todos los drenajes (Anexo I.a), dada su escasa variabilidad
constructiva y el bajo tamaño muestral, no se pudo testar la influencia de
variables constructivas concretas en el patrón observado de las detecciones de
paso.
Finalmente,
para evaluar el patrón temporal, se testaron las relaciones entre las
detecciones mensuales y el efecto interactivo del tipo de especie, la estación
del año y el periodo del día a través de modelos mixtos lineales generalizados
(GLMM). Consideramos como factores fijos la especie, la estación del año y el
periodo del día (día/noche), mientras que el drenaje fue considerado como un
factor aleatorio. Se utilizó el Criterio de Información de Akaike (AIC) para la
selección del mejor modelo y el R2marginal (R2m)
para la bondad del ajuste dada por los factores fijos del modelo. Las
asunciones de los modelos fueron analizadas visualmente: normalidad y
homocedasticidad de los residuos. Estos análisis fueron realizados utilizando
los paquetes estadísticos y de visualización car (Fox
y Weisber 2019), lme4 (Bates et al. 2015),
vegan (Dixon 2003), ggplot2 (Wickham 2016) del software libre R (R Core Team 2024).
Para
los análisis se eliminaron los registros de la cámara 8, puesto que fue robada
en marzo (grabó desde junio a principios de marzo), y se mantuvieron todas las
imágenes de las 7 cámaras restantes (CAM1-CAM7) durante un año completo de
grabación (julio 2023- junio 2024) obteniendo datos comparables de un conjunto
final de 2812 detecciones (ver Anexos I.e y
I.h) para ver la distribución de las
detecciones por especie, drenaje, estación del año y momento del día).
Resultados
En
este estudio fueron identificadas un total de 26 especies de vertebrados,
incluyendo mamíferos (Apodemus sylvaticus, Canis lupus familiaris, Capra
pyrenaica, Eliomys quercinus, Felis catus, Felis silvestris, Genetta genetta,
Martes foina, Meles meles, Mus spretus, Oryctolagus cuniculus, Rattus rattus,
Sus scrofa, Vulpes vulpes), aves (A. rufa, Cecropis daurica, Chloris
chloris, Galerida cristata, Passer domesticus, Phoenicurus ochruros, Turdus
merula, Upupa epops) y reptiles (Hemorrhois hippocrepis, T. graeca,
Timon nevadensis, Zamenis scalaris).
Tras
el filtrado de especies, nos quedamos con 19 especies de vertebrados con
movilidad terrestre en las 8 cámaras monitoreadas (ver ejemplos de especies en la
Figura 2 y resumen de especies por drenaje en Anexo I.c). El número de especies objetivo
registrado en cada drenaje varió entre 10 (CAM1) y 14 (CAM2, CAM3 y CAM7)
especies. La especie con un mayor número de detecciones fue O. cuniculus
(1731; 54.1% de las detecciones), seguido de R. rattus (592; 18.5%) y V.
vulpes (235; 7.31%). El número de detecciones medio por drenaje fue de
395±195 (SD) variando entre 156 (CAM1) y 668 (CAM2). Hubo un mayor número de
detecciones nocturnas (1907; 60%) que diurnas (1250; 40%), con diferencias
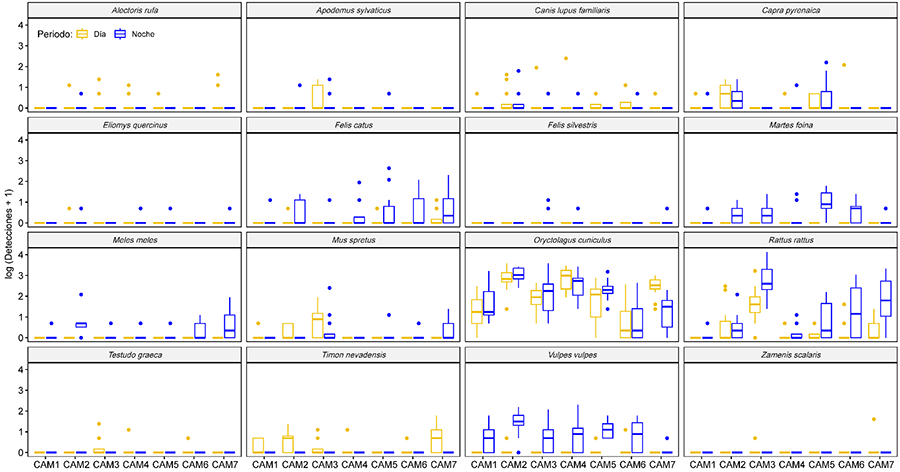
marcadas en los patrones de actividad diaria entre las distintas especies (Fig. 3). Las especies que cruzaron casi siempre de
día fueron los reptiles Z. scalaris (100% de detecciones diurnas), T.
nevadensis (93%) y T. graeca (73%) y aves como A. rufa (98%),
mientras que mesomamíferos como F. silvestris (100%), M. foina
(100%), M. meles (97.7%) y V. vulpes (98%), o roedores como E.quercinus
(86%) y R. rattus (81%) cruzaron casi siempre de noche. Respecto a los
animales domésticos, los perros (C. lupus familiaris) cruzaron
eminentemente de día (75%) mientras los gatos ferales (F. catus) lo
hicieron de noche (90%). Otros mamíferos como C. pyrenaica, O.
cuniculus y M. spretus cruzaron indistintamente de día y de noche
(~50%).
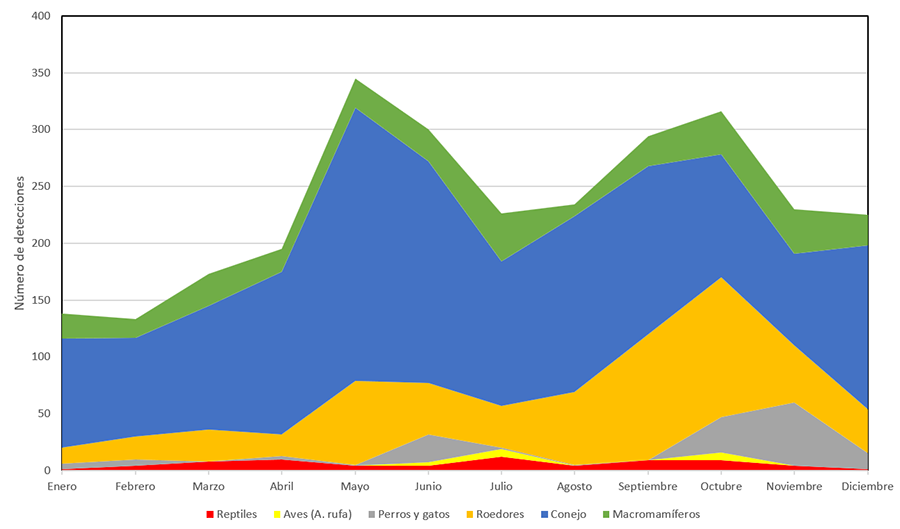
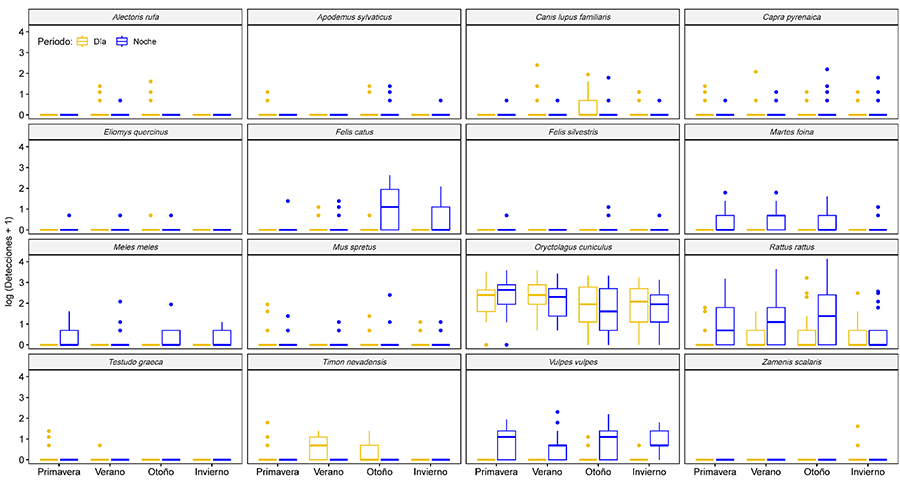
Respecto
al patrón estacional (Tabla 1; Anexos I.d y I.h),
mayo-junio y septiembre-octubre fueron los meses en los que se detectó un mayor
tránsito de vertebrados (~300 detecciones/mes), mientras que, durante los meses
de enero y febrero, las detecciones descendieron a la mitad (<150
detecciones). Existe una mayor actividad primaveral que es especialmente
evidente en el caso del conejo y los reptiles, y otro pico de actividad otoñal,
en el que destacan los roedores (especialmente la rata común o negra) y
animales domésticos asilvestrados (especialmente los gatos ferales en otoño).
Respecto
a la especie más amenazada del área de estudio, T. graeca ha sido
registrada 11 veces utilizando 5 de los 8 drenajes monitoreados, no existiendo
una selección de drenaje evidente (Tabla 2). Según
el sensor de temperatura de la cámara de fototrampeo, el rango de temperaturas
en los que se ha detectado tránsito de tortuga mora oscila entre los 15ºC (5 de
marzo a las 15:24) y los 32ºC (12 de julio a las 11:37). El movimiento
estacional detectado se inicia a principios de marzo, siendo este mes el de
mayor número de cruces detectados (5 de 11) y todos en las horas centrales del
día (13:43-15:30) con una temperatura máxima de detección de 21ºC. La actividad
parece prolongarse a un nivel bajo (1-2 detecciones) hasta septiembre con la
excepción de agosto en los que no se detectó el uso de los drenajes (Tabla 2). Desde final de junio a septiembre parece
observarse una preferencia nocturna para cruzar estos drenajes (3 detecciones
entre las 23:00-05:00), oscilando la temperatura entre 22ºC y 32ºC en el
momento de la detección.
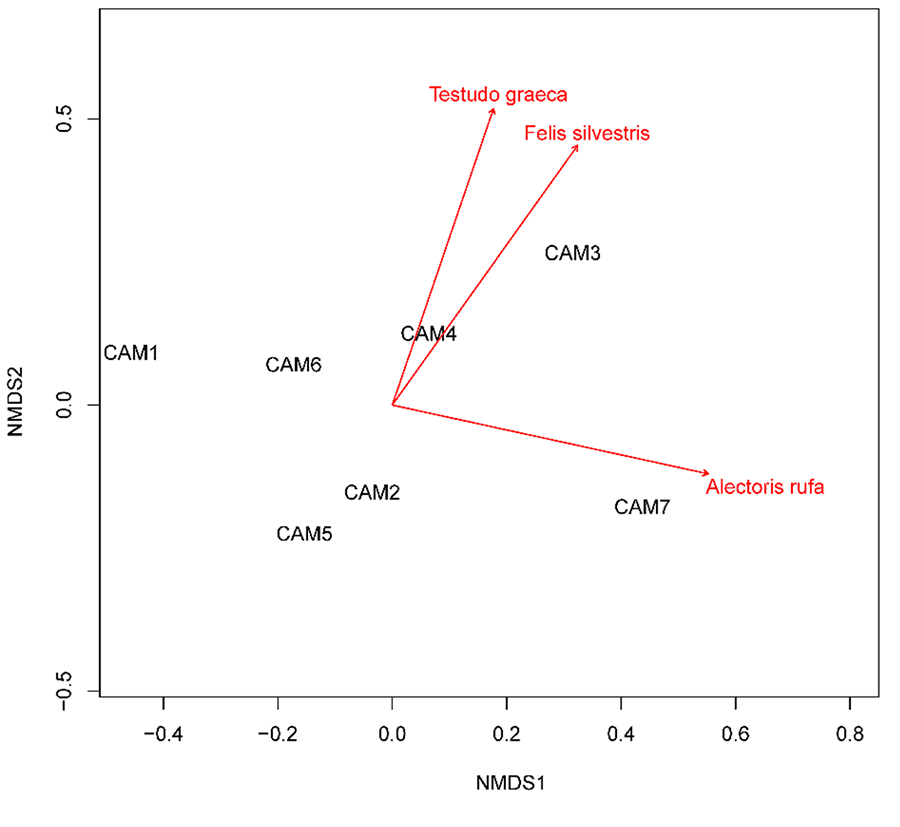
Prácticamente
todas las correlaciones significativas encontradas (p<0.05) entre las
distintas especies fueron de coeficiente positivo (Tabla 3).
Se encontraron correlaciones positivas fuertes entre el tránsito de perros,
jabalíes y zorros (r>0.75). De manera similar, las detecciones de
micromamíferos como R. rattus y M. spretus y de reptiles como Z.
scalaris estuvieron positivamente correlacionados entre ellos (r>0.72).
El tránsito de F. silvestris estuvo correlacionado con el de A. rufa
y T. graeca (r=0.87). Además, el NMDS (estrés=0.065; Anexo II.a) mostró que estas tres especies fueron
las únicas significativas (p<0.05) en la ordenación de los drenajes
según sus frecuencias de paso.
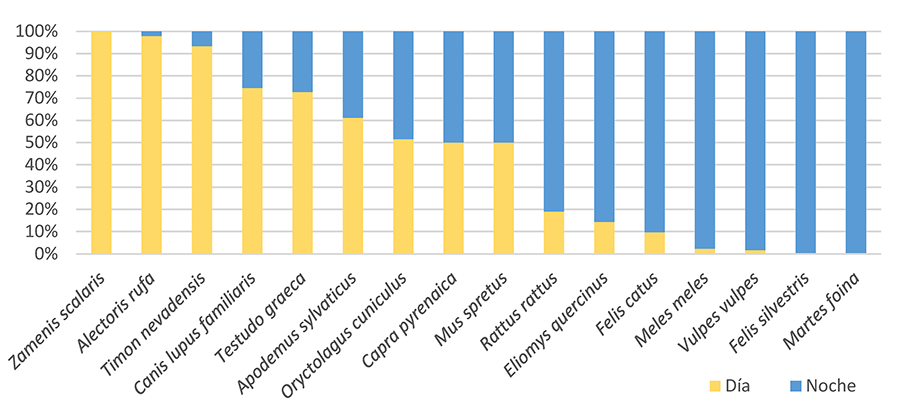
Figura 3. Porcentaje de eventos de paso
detectados durante el día y la noche para las especies con más de 5 detecciones
en el área de estudio.
Figure 3.
Percentage of detections during daylight and night for the species with more
than 5 detections in the study area.
Tabla 1.
Número de detecciones por estación del año de las especies más relevantes
en el área de estudio en las cámaras que grabaron durante un año completo
(CAM1-CAM7).
Table 1.
Number of detections per season of the most significant species in the camera
traps recording during the whole year (CAM1-CAM7).
Tabla 2. Detalle de
las detecciones de paso de tortuga mora (Testudo graeca). *La
cámara 8 fue robada en marzo de 2024.
Table
2. Detail of detection of the spur-thighed tortoise
(Testudo graeca) in the road culverts. CAM8 was stolen on March 2024.
Tabla 3.
Resultados de las correlaciones (r) entre las detecciones de paso de las
distintas especies. Solo se muestran aquellas especies que mostraron alguna
correlación significativa. Las correlaciones significativas se muestran en
negrita. **p<0.01; *p<0.05.
Table 3. Ccorrelations (r) between
the detection of the different species. Only those species that showed a
significant correlation are shown. Significant correlations are shown in bold.
**p<0.01; *p<0.05.
Los
resultados del GLM muestran que la variable Especie fue la única que resultó
significativa (p-valor<0.001; R2=0.64), mostrando O.
cuniculus, R. rattus, V. vulpes y F. catus una frecuencia de
paso significativamente mayor que el resto de especies (Anexo
II.b). Ninguno de los drenajes ni la interacción con Especie resultó
significativa. El modelo GLMM más explicativo y con menor AIC (R2m=0.55;
AIC=3747; Anexo II.c) fue el que incluyó la
interacción entre Especie, Estación del año y Periodo del día (Anexo II.d), lo que indica que existen especies
cuya frecuencia de paso es significativamente mayor en algunas estaciones y
momento del día como F. catus, M. foina y R. rattus que
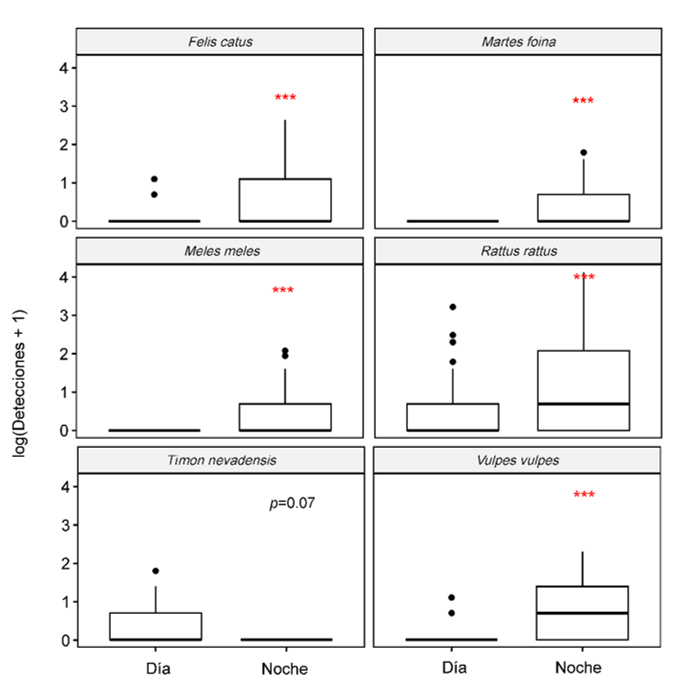
son detectadas más frecuentemente durante las noches de verano y/o otoño (Fig. 4; Anexo I.h).
La interacción entre especie y periodo fue significativa (p<0.001), y
los modelos mixtos que solo incluyeron la interacción entre Especie y Periodo
del día fueron el mejor segundo modelo (R2m=0.52; AIC=3787).
Todas las especies que mostraron interacciones significativas (Anexo II.e) mostraron movimientos nocturnos (F.
catus, M. foina, M. meles, R. rattus y V. vulpes). De manera similar, la
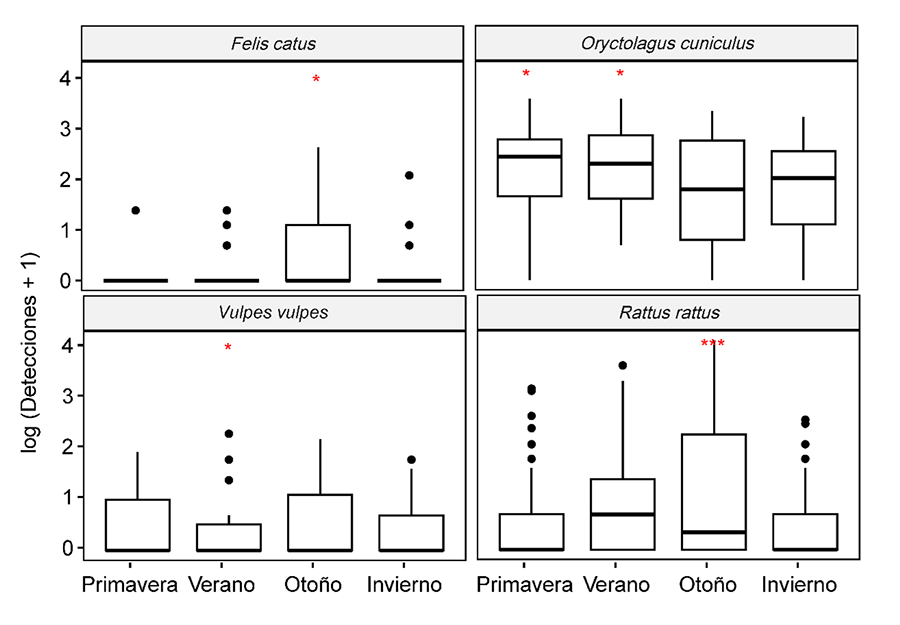
interacción entre especie y estación del año también resultó significativa y
constituyó el tercer mejor modelo (R2m=0.50; AIC=4038; Anexo II.f). En otoño hubo un número
significativamente mayor de detecciones de R. rattus y F. catus, y
en primavera y verano de O. cuniculus. En verano, el tránsito de V.
vulpes fue significativamente menor que en otras estaciones del año.
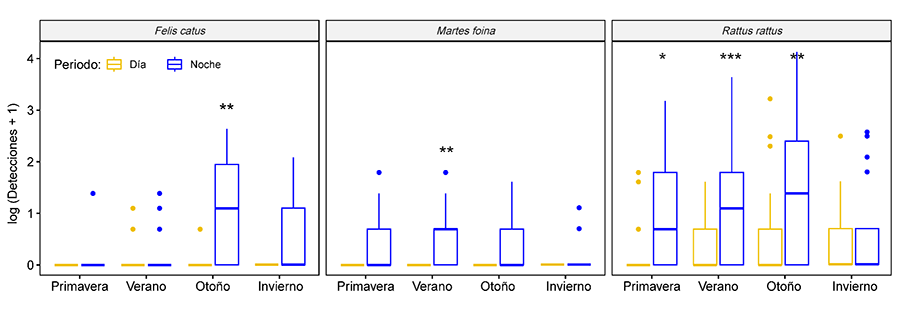
Figura 4. Diagrama de cajas mostrando las
interacciones significativas entre Especie, Estación del año y Periodo del día
(día o noche). La línea horizontal en negrita representa la mediana, la caja
delimita el rango intercuartílico y las líneas de bigotes se extienden hasta
los máximos y mínimos observados, excepto para los valores atípicos
simbolizados por puntos. También se proporcionan los p valores según los GLMM ***p-valor<0.001;
**p<0.01; *p<0.05.
Figure 4.
Boxplot showing the significant interactions between Species, Season and Period
of the day (daylight or night). The bold horizontal line represents the median,
the box delimits the interquartile range and the whisker lines extend to the
observed maxima and minima, except for outliers symbolised by dots. The
p-values according to GLMM also provided ***p-value<0.001; **p<0.01;
*p<0.05.
Discusión
El
monitoreo anual de diferentes drenajes de carreteras muestra que pueden
facilitar la conectividad poblacional de algunos vertebrados terrestres,
incluyendo especies amenazadas y existiendo diferentes patrones temporales y de
uso en función de la especie. Los resultados apuntan a que los drenajes, si
están bien diseñados, pueden tener cierta importancia en la conectividad del
hábitat y mitigar parcialmente la fragmentación generada por las ILT, tal y
como se ha demostrado en estudios previos con marmolina en vías férreas
españolas (Rodriguez et al. 1996), o con
cámaras de fototrampeo en Estados Unidos (Young et al.
2023). No obstante, su funcionalidad probablemente sea menor que la de los
pasos de fauna diseñados para tal fin (Soanes et al.
2013; Brunen et al. 2020; Denneboom et al. 2021), estando siempre
condicionados por el tamaño de la carretera y la longitud de los mismos (a
menor longitud, mayor funcionalidad; Yanes et al. 1995;
Chen et al. 2021).
El
monitoreo de drenajes de carreteras a través de cámaras de fototrampeo puede
ofrecer información valiosa, contribuyendo a actualizar los rangos de
distribución de diferentes especies de interés para la conservación y la
gestión. El total de especies de vertebrados observados ha sido de 26, siendo
19 ellas de movilidad terrestre, entre las que destacan mamíferos de interés (C. pyrenaica, E. quercinus, F. silvestris, G.
genetta, M. foina, M. meles, M. spretus, O. cuniculus), reptiles (H. hippocrepis,
T. graeca, T. nevadensis, Z. scalaris) y aves con baja capacidad
de vuelo (A. rufa). Por tanto, estas infraestructuras pueden ser
relevantes para la conservación de fauna en áreas semiáridas como el sureste
Ibérico, y los servicios ecosistémicos asociados, como la dispersión de
semillas (Acosta-Rojas et al. 2019). Como
contrapartida, se ha detectado el paso de especies domésticas como perros y
gatos ferales, especies que pueden tener efectos negativos sobre la
conservación de otros vertebrados (Twardek et al.
2017). Dada la ubicuidad de estas especies, un aspecto positivo de que
estén usando los drenajes, es la potencial contribución de estas
infraestructuras en la reducción del número de accidentes con vehículos. Por
ejemplo, en 2022 se registraron 3155 siniestros causados por perros en España,
suponiendo el 76% de los causados por fauna doméstica y casi el 10% del total (DGT 2022).
Existe una alta variabilidad en la
frecuencia de paso según la especie, observándose que hay algunas especies como
el conejo (O. cuniculus), la rata negra (R. rattus), el zorro
rojo (V. vulpes) y los gatos ferales (F. catus) que fueron
significativamente más detectadas que el resto. De hecho, la especie más
frecuentemente detectada cruzando los drenajes ha sido el conejo (>50% de
todas las detecciones de paso), dada su alta movilidad y la idoneidad del
hábitat en esta zona de Andalucía (Delibes-Mateos
et al. 2010), siendo además una presa clave en la red trófica de los
ecosistemas mediterráneos (Delibes-Mateos et
al. 2007, 2008). Según el Atlas de los
Mamíferos de España, la rata negra y el zorro rojo han sido oficialmente
detectadas previamente en localidades cercanas al área de estudio en la
provincia de Almería, pero no en la misma cuadrícula UTM 10x10 km (Palomo et al. 2007). De hecho, Almería es la
provincia del sureste ibérico donde el zorro rojo tiene una menor área de
distribución reconocida (Palomo et al. 2007). La
detección recurrente de gatos ferales en una ZEC, alejados de núcleos de
población habitados, supone una amenaza para numerosas especies, especialmente
aves y pequeños mamíferos en áreas mediterráneas (Mori
et al. 2019). Las especies de movilidad limitada como los pequeños
mamíferos y reptiles tendieron a utilizar los mismos drenajes. No se puede
descartar una influencia de las características constructivas, aspecto que no
ha sido testado en este estudio dado el bajo tamaño muestral y la similitud de
los drenajes estudiados. De hecho, distintos diseños de pasos de fauna y
drenajes pueden diferir en funcionalidad según los requerimientos de las
especies presentes (D'Amico
et al. 2015).
En cuanto al patrón diario, exceptuando
los reptiles y las aves, la mayor parte de mamíferos detectados fueron especies
de hábitos nocturnos que cruzaron los drenajes de noche (ej. M. foina, M.
meles y V. vulpes), reflejando los patrones generales de actividad
usuales de estas especies. Aunque no se detectó ningún mamífero de hábitos
exclusivamente diurnos, sí que se identificaron especies que cruzaron tanto de
día como de noche (C. pyrenaica, O. cuniculus y M. spretus).
Respecto al patrón estacional, el final de la primavera e inicio del verano,
así como principios de otoño fueron los momentos en los que se detectó un mayor
tránsito de vertebrados. La alta actividad otoñal es evidente en un depredador
como el gato doméstico y una de sus principales presas, la rata negra. La
primavera suele implicar un mayor movimiento de los individuos y especialmente
de animales ectotermos como los reptiles (Anadón et
al. 2012) y de otros mamíferos como el conejo, dado el incremento de
actividad biológica en general, y de la reproducción en particular (Ferreira 2012). En concreto,
el conejo es una de las presas principales del zorro rojo (Fernández de Simon et al. 2015), y al igual
que en estudios previos, hemos detectado diferencias significativas entre los
patrones de actividad de ambas especies (Penteriani
et al. 2013), detectando un mayor tránsito de conejos en verano, época que
coincide con una menor detección de zorro rojo.
Aunque la mayor parte de las especies
tienen un estatus internacional de conservación catalogado como de preocupación
menor, se han detectado especies vulnerables (tortuga mora, UICN 2023a; y lirón careto, UICN 2023b) y
casi amenazadas (perdiz roja, UICN 2023c) por la
Unión Internacional de Conservación de la Naturaleza (UICN). Esto concuerda con
lo detectado en otras áreas de clima mediterráneo donde se ha detectado el uso
de drenajes por parte de mamíferos con interés de conservación (Ng et al. 2004). Los drenajes de carretera y,
especialmente los pasos de fauna, pueden ser fundamentales para endemismos
ibéricos con tendencias poblacionales decrecientes como el lagarto bético (T.
nevadensis) y otros en expansión como la cabra montés (C. pyrenaica),
ya que disminuyen el riesgo de atropello y se facilita el crecimiento
poblacional y la dispersión de las especies (Denneboom
et al. 2021). Cabe destacar que la utilización de drenajes como pasos de
fauna por parte de C. pyrenaica, que sepamos, no ha sido documentado
hasta ahora en la bibliografía científica. De hecho, a nivel mundial, apenas
hay evidencias de ungulados cruzando tubos de drenaje (Ng
et al. 2004). La detección recurrente de gato montés (F. silvestris),
una especie que presenta bajas densidades y sobre la que se tienen pocos datos
fiables (Gil-Sánchez et al. 2020), pueden
suponer datos valiosos para su gestión y la del territorio. Dados sus
requisitos de hábitat para su dispersión y sensibilidad a la fragmentación, se
considera una especie representativa para la consecución de una Infraestructura
Verde efectiva a nivel nacional (Ecoperfiles; MITECO
2023). El lirón careto, aunque no parece tener amenazas graves, ha sufrido
un acusado descenso poblacional en los últimos años en España (Palomo et al. 2007). Por tanto, el monitoreo con
cámaras trampa en pasos de fauna o drenajes en ILTs puede aportar datos que
ayuden a determinar variaciones demográficas de especies de interés a escala
local.
El
vertebrado terrestre más amenazado detectado en el área de estudio fue la
tortuga mora (T. graeca), catalogada “en Peligro de Extinción” según el
Catálogo Andaluz de Especies Amenazadas (Junta
de Andalucía 2012) incluida en la Lista Roja de la UICN como vulnerable (Baillie y Groombridge 1996), como estrictamente
protegida en la Convención de Berna (Anexo II; Consejo de Europa 1979) y la Convención sobre el Comercio
Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES 2013). Esta especie de distribución restringida y
movimiento limitado ha sido registrada 11 veces cruzando los drenajes, lo que
supone la primera evidencia de uso de pasos de fauna u obras de drenaje en una
ILT en el conjunto de su área de distribución. Además, existen escasos estudios
hasta la fecha, que evidencien el uso de drenajes como pasos de fauna por parte
de reptiles (Jones et al. 2022; Harju et al. 2024). De hecho, en tortugas de tierra
solo tenemos constancia del uso aislado por parte de un individuo de tortuga
del desierto de Mojave (Gopherus agassizii; Harju
et al. 2024). Hasta la fecha, el comportamiento observado en las carreteras
anchas es evitar cruzarlas (Paterson et al. 2019),
a pesar de tener un movimiento cercano a las mismas y no variar su selección de
hábitat (Weigand et al. 2019). Estudios previos
mediante radio-seguimiento y control de huellas con marmolina realizados en
poblaciones cercanas con densidades similares a las de nuestro trabajo no
detectaron ninguna evidencia de paso (Anadón et al.
2009; Botella et al. 2008). La pérdida y
fragmentación del hábitat es la principal amenaza para la tortuga mora (Graciá et al. 2020a). Nuestros resultados permiten
plantear la posibilidad de que estas infraestructuras de paso puedan contribuir
parcialmente a corregir la pérdida de conectividad entre poblaciones ocasionada
por las ILT, aunque es necesario realizar estudios específicos que incluyan
distintos tipos de drenajes con distintas características constructivas para
obtener conclusiones robustas. Todas las detecciones fueron de adultos y 5 de
las 11 ocurrieron en marzo en las horas centrales del día (mayor insolación y
temperatura), un mes clave para la reproducción de la especie, en el que
especialmente los machos están más activos tras la hibernación recorriendo
mayores distancias en busca de hembras (Graciá et
al. 2020b; Jiménez-Franco et al. 2020).
Se detectaron cruces esporádicos todos los meses desde marzo a septiembre
(salvo agosto-estivación), no detectándose movimiento durante los meses de
hibernación, por lo que el uso de drenajes refleja el patrón estacional de
actividad de la especie (Anadón et al. 2012).
La
construcción de pasos de fauna parece insuficiente en las carreteras españolas.
Aunque los drenajes de carreteras que incorporen ciertas características en su
diseño pueden incrementar parcialmente la conectividad de las poblaciones de
distintas especies de vertebrados (Chen et al. 2021),
futuros estudios deben de alcanzar una mayor representatividad espacial,
evaluando un mayor número de tipologías de drenaje (pasos inferiores, tubos,
marcos, etc.) que atraviesen ILT de diferente magnitud y uso (autovías, tren de
alta velocidad, carreteras nacionales, regionales y comarcales) y en un mayor
número de ZEC y diversidad de hábitats, para poder extraer conclusiones
generalizables (Denneboom et al. 2021). Pese a
los recientes avances en la sensibilidad de las cámaras de fototrampeo que han
redundado en un aumento de la fiabilidad y eficacia de la detección de especies
de pequeño tamaño, incluidos reptiles, anfibios y mamíferos, el uso de una sola
cámara puede infradetectar el paso de pequeños mamíferos (Jumeau et al. 2017). Por el contrario, aunque no
podemos garantizar que alguno de los eventos de paso fuera en realidad un cruce
abortado, dada la metodología utilizada y los patrones de movimiento observados
de las distintas especies, estos parecen mínimos entre el total de cruces
detectados. En cualquier caso, dada la limitada longitud de los drenajes
(cruzan una carretera regional de un carril en cada sentido) y los resultados
obtenidos, el uso de una cámara en el punto central del paso durante un año
completo de grabación puede ofrecer un indicador representativo del uso de los
pasos de fauna. Estos estudios suelen limitarse a poco
más de un mes (Kays et al. 2020), mientras que
éste suple el bajo tamaño muestral y las limitaciones en el número de cámaras
con una amplia representatividad temporal.
Finalmente,
de manera general y a tenor de los resultados, el incremento de la densidad de
drenajes podría disminuir la mortalidad de especies vulnerables, casi
amenazadas o en peligro de extinción y aumentar la conectividad de las
poblaciones. Sin embargo, su eficacia dependerá en gran medida del diseño,
características y ubicación de cada uno de ellos, tanto en la red de carreteras
como en la matriz espacial que conforma el paisaje a una escala regional (Brunen et al. 2020; Young
et al. 2023). Además, un correcto diseño de los drenajes para permitir el
tránsito de fauna debería ir acompañado de un vallado perimetral o cerramiento
de la vía que evite el cruce en superficie y un potencial atropello,
conduciendo a los individuos hacia los pasos de fauna o drenajes existentes (Crawford et al. 2018; Boyle
et al. 2021). Es importante llevar a cabo estudios complementarios para
ampliar la comprensión de las necesidades particulares de los drenajes y
aumentar su permeabilidad para especies amenazadas, de movimiento limitado o
con distribución restringida, y poder establecer así medidas de gestión que
favorezcan la conectividad paisajística de especies como la tortuga mora (Jiménez-Franco et al. 2022). La construcción
y adecuación de pasos de fauna que logren ser funcionales para esta especie,
también lo deberían ser para el resto de la comunidad de vertebrados terrestres
en el sureste Ibérico, un aspecto que debería ser tenido en cuenta en la estrategia
de Infraestructura Verde en España (Ministerio de
Agricultura, Alimentación y Medio Ambiente 2015; MITECO
2021). La restauración de las zonas colindantes, su revegetación con
especies autóctonas en las entradas para atraer individuos, la renaturalización
del suelo (evitar materiales corrugados), la reducción de escalones o
instalación de rampas para disminuir la pendiente, pueden ser medidas que
aumenten el uso de los drenajes por parte de la fauna, especialmente aquella
con una capacidad de movimiento limitada como la tortuga mora (Ministerio de Agricultura, Alimentación y Medio Ambiente
2015).
Conclusiones
Actualmente
existe una evidente falta de pasos de fauna que reduzcan la fragmentación del
territorio causada por las carreteras, y aumenten la conectividad de las
poblaciones de vertebrados terrestres. De manera complementaria, los drenajes
de carreteras pueden actuar parcialmente como pasos de fauna para los
vertebrados terrestres pero su funcionalidad como tal ha sido menos estudiada. En
este estudio, se han detectado un total de 19 especies de vertebrados
terrestres en los 8 drenajes monitoreados durante un año en la provincia de
Almería, incluyendo endemismos ibéricos como la cabra montés (C. pyrenaica)
o el lagarto bético (T. nevadensis), así como otras especies de interés
para la conservación o la conectividad paisajística como diversos mamíferos (gato montés, lirón careto) y reptiles (tortuga
mora). Además, mamíferos abundantes en el área de estudio como el conejo (O.
cuniculus), la rata negra (R. rattus) o el zorro rojo (V. vulpes)
fueron las especies que más los han utilizado.
El
patrón temporal general muestra que el tránsito de vertebrados fue mayor
durante mayo-junio y septiembre-octubre. Los mamíferos tuvieron preferencia por
el uso nocturno de los drenajes, mientras que animales ectotermos como los
reptiles fueron captados cruzando casi siempre durante el día. Las limitaciones
del estudio impidieron la detección de un patrón espacial claro, por lo que es
necesario aumentar el tamaño muestral y la representatividad espacial y
constructiva. Para ello, el fototrampeo es una metodología no invasiva que se
ha demostrado efectiva para la detección de especies esquivas y de pequeño
tamaño.
Como
gran novedad, hemos conseguido registros fotográficos mediante el uso de
cámaras de fototrampeo de tortuga mora (T. graeca), un reptil
amenazado de distribución mundial restringida, cruzando un drenaje de carretera
o paso de fauna, algo que no se había conseguido previamente. Los pasos o
drenajes que permiten el tránsito de tortuga mora, una especie de limitado
movimiento y capacidad de dispersión limitada, podrían garantizar el de otras
muchas especies de vertebrados en el sureste ibérico.
Finalmente,
aunque hayamos detectado que los drenajes de carreteras puedan fomentar la
conectividad de hábitats naturales presentes en un paisaje mediterráneo, esto
no implica que sean equivalentes en funcionamiento y prestaciones a pasos de
fauna específicamente diseñados para tal fin en las ILT.
Contribución de autores
Conceptualización: AG, MVJF, DB; Curado
de datos: RM, GS, CA, NP, MVJF, DB; Análisis formal: DB, MVJF; Financiación:
AG, MVJF; Escritura – borrador original: DB, MVJF, RM; Escritura – revisión y
edición: DB, MVJF, AG, NP.
Disponibilidad de datos
Los datos recogidos por las cámaras de
fototrampeo se encuentran disponibles en el Anexo III
de este documento, donde se muestran el número de detecciones diurnas y
nocturnas por cámara y mes de las distintas especies objetivo.
Financiación, permisos requeridos, potenciales
conflictos de interés y agradecimientos
Estos
datos han sido obtenidos en el marco del proyecto “Trabajos de
diagnóstico del estado de conservación de la tortuga mora y bases para su
recuperación en la provincia de Almería. Trabajos previos a la
redacción del proyecto de medidas compensatorias para la tortuga mora,
derivadas de la ejecución del corredor mediterráneo de alta velocidad. Tramo:
Murcia‐Almería.”
financiado por ADIF Alta Velocidad. Otras fuentes de financiación fueron la
Generalitat Valenciana (Proyecto de Investigación de Grupos Emergentes
CIGE/2021/157) y un contrato postdoctoral “Juan de la Cierva-Incorporación”
(referencia IJC2019-039145-I; MCIN/AEI/ 10.13039/501100011033) de MVJF.
Agradecer a Francisco Botella-Robles, Juan Manuel Pérez-García y María Isabel
García de la Fuente por su asesoramiento y ayuda en la instalación de cámaras
trampa. La instalación de las cámaras y grabación fue autorizada por la
Dirección General de Política Forestal y Biodiversidad de la Junta de Andalucía
(Ref. 2023620000001858). Agradecer a la empresa Biocyma por su participación en
el monitoreo y a los técnicos de la Junta de Andalucía por su colaboración y
ayuda. Finalmente, agradecer la desinteresada labor de revisores y editores por
su crítica constructiva y su contribución a mejorar la calidad del manuscrito.
Los
autores/as declaran no tener ningún conflicto de intereses.
Referencias
Acosta-Rojas, D.C.,
Jiménez-Franco, M.V., Zapata-Pérez, V.M., De la Rúa, P., Martínez-López, V.
2019. An integrative approach
to discern the seed dispersal role of frugivorous guilds in a Mediterranean
semiarid priority habitat. PeerJ 7, e7609. https://doi.org/10.7717/peerj.7609
Anadón, J.D., Giménez, A., Ballestar, R., Pérez, I. 2009. Evaluation of local ecological knowledge as
a method for collecting extensive data on animal abundance. Conservation
Biology 23, 617–625. https://doi.org/10.1111/j.1523-1739.2008.01145.x
Anadón, J.D., Wiegand, T., Giménez, A. 2012. Individual‐based movement models reveals sex‐biased effects of landscape fragmentation
on animal movement. Ecosphere 3(7), 1-32. https://doi.org/10.1890/ES11-00237.1
Arca-Rubio, J.,
Moreno-Rueda, G., Ortega, Z. 2023. The distribution of
vertebrate roadkill varies by season, surrounding environment, and animal
class. European Journal of Wildlife Research 69(3), 42. https://doi.org/10.1007/s10344-023-01669-z
Baillie, J., Groombridge, B. 1996. 1996 IUCN Red List of Threatened
Animals. International Union for Conservation of Nature, Gland, Switzerland
and Cambridge, United Kingdom.
Balkenhol, N., Waits, L.P. 2009. Molecular road ecology: exploring the
potential of genetics for investigating transportation impacts on
wildlife. Molecular Ecology 18(20), 4151-4164. https://doi.org/10.1111/j.1365-294X.2009.04322.x
Barrientos, R., Ascensão, F., Beja, P., Pereira, H.M., Borda-de-Água, L. 2019.
Railway ecology vs. road ecology: similarities and
differences. European Journal of Wildlife Research 65, 1-9. https://doi.org/10.1007/s10344-018-1248-0
Barrientos, R., Ascensão, F., D’Amico, M., Grilo, C., Pereira, H.M. 2021. The lost road: Do transportation networks imperil wildlife
population persistence?. Perspectives in Ecology and Conservation 19(4),
411-416. https://doi.org/10.1016/j.pecon.2021.07.004
Bates, D., Mächler, M., Bolker, B., Walker, S. 2015. Fitting linear
mixed-effects models using the lme4 package in R. Journal of
Statistical Software, 67, 1-48. https://doi.org/10.18637/jss.v067.i01
Biswas, G., Sengupta, A., Alfaisal, F.M., Alam, S., Alharbi, R.S., Jeon,
B.H. 2023. Evaluating the effects of landscape
fragmentation on ecosystem services: A three-decade perspective. Ecological
Informatics 77, 102283. https://doi.org/10.1016/j.ecoinf.2023.102283
Botella, F., Giménez, A.,
Bordonado, S., Sempere, R.A. 2008. Plan de Seguimiento de los pasos de fauna
y drenajes en la autopista Cartagena-Vera. Universidad Miguel Hernández de
Elche, Elche, Alicante, España.
Botting, I., Ascensão, F.,
Navarro, L.M., Paniw, M., Tablado, Z., Román, J., et al. 2023. The road to success and the fences to be crossed: considering
multiple infrastructure in landscape connectivity modelling. Wildlife Biology e01187. https://doi.org/10.1002/wlb3.01187
Boyle, S.P., Keevil, M.G., Litzgus, J.D., Tyerman, D., Lesbarrères, D.
2021. Road-effect mitigation promotes connectivity and
reduces mortality at the population-level. Biological Conservation 261,
109230. https://doi.org/10.1016/j.biocon.2021.109230
Brunen, B., Daguet, C., Jaeger, J.A. 2020. What attributes are relevant
for drainage culverts to serve as efficient road crossing structures for
mammals?. Journal of Environmental Management 268, 110423. https://doi.org/10.1016/j.jenvman.2020.110423
Caballero-Díaz, C., Rodríguez, C., Oñorbe, M., García, F.J., Cabezas-Díaz, S.,
López, C., et al. 2024. Atropellos de anfibios y reptiles en las
carreteras españolas: primeros resultados del Proyecto SAFE. Boletín de la
Asociación Herpetológica Española 35, 60-70.
Casas, F., García, J.T.
2022. The Future of the Red-legged Partridge: Science,
Hunting and Conservation (Vol. 6). Springer
Nature. https://doi.org/10.1007/978-3-030-96341-5
Chen, H.L., Posthumus, E.E., Koprowski,
J.L. 2021. Potential of small culverts as wildlife passages on forest
roads. Sustainability 13(13), 7224. https://doi.org/10.3390/su13137224
CITES. 2013. Convention on International Trade in Endangered Species of Wild
Fauna and Flora. CITES Secretariat, Geneve, Switzerland.
Clevenger, A.P., Chruszcz, B., Gunson, K. 2001. Drainage culverts as habitat
linkages and factors affecting passage by mammals. Journal of Applied
Ecology 38(6), 1340-1349. https://doi.org/10.1046/j.0021-8901.2001.00678.x
Colino-Rabanal, V.J., Lizana, M. 2012. Herpetofauna and roads: a review. Basic
and Applied Herpetology 26, 5-31. https://doi.org/10.11160/bah.12008
Consejo de Europa. 1979. Convention on the
Conservation of European Wildlife and Natural Habitats. Berne,
Switzerland.
Crawford, B.A., Moore, C.T., Norton, T.M., Maerz, J.C. 2018. Integrated
analysis for population estimation, management impact evaluation, and
decision-making for a declining species. Biological
Conservation 222, 33-43. https://doi.org/10.1016/j.biocon.2018.03.023
D'Amico, M., Clevenger, A.P., Román, J., Revilla, E. 2015. General versus
specific surveys: Estimating the suitability of different road‐crossing structures for small mammals. The Journal
of Wildlife Management 79(5), 854-860. https://doi.org/10.1002/jwmg.900
Delibes-Mateos, M., Redpath, S.M., Angulo, E., Ferreras, P.,
Villafuerte, R. 2007. Rabbits as a keystone species in southern Europe. Biological
Conservation 137(1), 149-156. https://doi.org/10.1016/j.biocon.2007.01.024
Delibes‐Mateos, M., Delibes, M., Ferreras, P., Villafuerte, R. 2008.
Key role of European rabbits
in the conservation of the Western Mediterranean basin hotspot. Conservation Biology 22(5), 1106-1117. https://doi.org/10.1111/j.1523-1739.2008.00993.x
Delibes-Mateos, M., Farfán, M.Á., Olivero, J., Vargas, J.M. 2010. Land-use changes as a critical factor for
long-term wild rabbit conservation in the Iberian Peninsula. Environmental Conservation 37(2), 169-176. https://doi.org/10.1017/S0376892910000214
Delibes-Mateos, M., Farfán,
M.Á., Olivero, J., Vargas, J.M. 2012. Impact of land-use changes on red-legged partridge conservation in the
Iberian Peninsula. Environmental Conservation 39(4), 337-346. https://doi.org/10.1017/S0376892912000100
Denneboom, D., Bar-Massada, A., Shwartz, A. 2021. Factors affecting usage of
crossing structures by wildlife–A systematic review and meta-analysis. Science of the Total Environment 777, 146061. https://doi.org/10.1016/j.scitotenv.2021.146061
DGT. 2022. Siniestralidad vial con implicación de
animales. Observatorio Nacional de Seguridad Vial, Madrid, España. Acceso: https://www.dgt.es/export/sites/web-DGT/.galleries/downloads/dgt-en-cifras/24h/Informe_Implicacion_animales_version-web.pdf
Dixon, P. 2003.
VEGAN, a package of R functions for community ecology. Journal of vegetation science 14(6), 927-930. https://doi.org/10.1111/j.1654-1103.2003.tb02228.x
Fernández de Simon, J.,
Díaz-Ruiz, F., Rodríguez-de la Cruz, M., Delibes-Mateos, M., Villafuerte, R.,
Ferreras, P. 2015. Can
widespread generalist predators affect keystone prey? A case study with red
foxes and European rabbits in their native range. Population ecology 57,
591-599. https://doi.org/10.1007/s10144-015-0510-5
Ferreira, C. 2012.
European rabbit research in the Iberian Peninsula: state of the art and future
perspectives. European Journal of Wildlife Research 58(6),
885-895. https://doi.org/10.1007/s10344-012-0664-9
Fox, J., Weisberg, S. 2019. An R Companion to Applied
Regression, Third edition. Sage, Thousand Oaks, California, USA.
Gil-Sánchez, J.M., Barea-Azcón, J.M., Jaramillo, J.,
Herrera-Sánchez, F.J., Jiménez, J., Virgós, E. 2020. Fragmentation and low
density as major conservation challenges for the southernmost populations of
the European wildcat. PLoS One 15(1), e0227708. https://doi.org/10.1371/journal.pone.0227708
Glista, D.J., DeVault, T.L., DeWoody, J.A. 2009. A
review of mitigation measures for reducing wildlife mortality on
roadways. Landscape and urban planning 91(1), 1-7. https://doi.org/10.1016/j.landurbplan.2008.11.001
Graciá, E., Giménez, A. 2015. La tortuga
mora (Testudo graeca) en la península ibérica y en las islas Baleares. Boletín
de la Asociación Herpetológica Española 26(2), 28-35.
Graciá, E., Rodríguez-Caro,
R.C., Martínez-Silvestre, A., Pérez-Ibarra, I. Amahjour, R. Aranda, C., et al.
2020a. From troubles to
solutions: conservation of Mediterranean tortoises under global change. Basic
and Applied Herpetology 34, 5-16. https://doi.org/10.11160/bah.196
Graciá, E., Rodríguez-Caro, R.C., Sanz-Aguilar, A., Anadón, J.D., Botella, F., García-García, A.L.,
et al. 2020b. Assessment of the key evolutionary traits that prevent
extinctions in human-altered habitats using a spatially explicit
individual-based model. Ecological Modelling 415, 108823. https://doi.org/10.1016/j.ecolmodel.2019.108823
Harju, S., Cambrin, S., Berg, J. 2024. Indirect impacts of a highway on
movement behavioral states of a threatened tortoise and implications for
landscape connectivity. Scientific Reports 14(1), 716. https://doi.org/10.1038/s41598-024-51378-z
Holderegger, R., Di Giulio, M. 2010. The genetic effects of roads: a review of
empirical evidence. Basic and Applied Ecology 11(6), 522-531. https://doi.org/10.1016/j.baae.2010.06.006
Inman, R.D., Esque, T.C., Nussear, K.E. 2023. Dispersal
limitations increase vulnerability under climate change for reptiles and
amphibians in the southwestern United States. The Journal of Wildlife
Management 87(1), e22317. https://doi.org/10.1002/jwmg.22317
Jaureguiberry, P., Titeux, N., Wiemers, M., Bowler, D.E., Coscieme, L., Golden,
A.S., et al. 2022. The direct drivers of recent global anthropogenic
biodiversity loss. Science advances 8(45), eabm9982. https://doi.org/10.1126/sciadv.abm9982
Jiménez‐Franco, M. V., Giménez, A., Rodríguez‐Caro, R. C., Sanz‐Aguilar, A., Botella,
F., Anadón, J. D., et al. 2020. Sperm
storage reduces the strength of the mate‐finding Allee effect. Ecology and
Evolution 10(4), 1938-1948. https://doi.org/10.1002/ece3.6019
Jiménez-Franco, M.V., Graciá, E., Rodríguez-Caro, R.C., Anadón, J.D., Wiegand, T.,
Botella, F., Giménez, A. 2022. Problems seeded in the past: lagged effects of
historical land-use changes can cause an extinction debt in long-lived species
due to movement limitation. Landscape Ecology 37(5), 1331-1346. https://doi.org/10.1007/s10980-021-01388-3
Jones, M.D., Marshall, B.M., Smith, S.N., Crane, M., Silva, I.,
Artchawakom, T., et al. 2022. How do King Cobras move across a major highway?
Unintentional wildlife crossing structures may facilitate movement. Ecology
and Evolution 12(3), e8691. https://doi.org/10.1002/ece3.8691
Jumeau, J., Petrod, L., Handrich, Y. 2017. A comparison of camera trap and
permanent recording video camera efficiency in wildlife underpasses. Ecology and evolution 7(18), 7399-7407. https://doi.org/10.1002/ece3.3149
Junta de
Andalucía. 2012. Decreto 23/2012, de 14 de febrero, por el que se
regula la conservación y el uso sostenible de la flora y fauna silvestres y sus
hábitats. Boletín Oficial de la Junta de Andalucía, Sevilla, España.
Junta de Andalucía. 2015.
Plan de Gestión de la Zona Especial de Conservación Sierras Almagrera, de
Los Pinos y El Aguilón (ES6110012). Consejería de Sostenibilidad, Medio
Ambiente y Economía Azul, Sevilla, España.
Junta de Andalucía. 2019.
Plan de aforos de la red autonómica de carreteras de Andalucía. Provincia de
Almería. Consejería de fomento, Infraestructuras y Ordenación del
Territorio, Sevilla, España.
Kays, R., Arbogast, B.S., Baker‐Whatton, M., Beirne, C., Boone,
H.M., Bowler, M., et al. 2020. An empirical evaluation of camera trap study
design: How many, how long and when?. Methods in Ecology and Evolution 11(6),
700-713. https://doi.org/10.1111/2041-210X.13370
Keinath, D.A., Doak, D.F., Hodges, K.E., Prugh, L.R., Fagan, W.,
Sekercioglu, C.H., et al. 2017. A global analysis of traits predicting species
sensitivity to habitat fragmentation. Global Ecology and Biogeography 26(1),
115-127. https://doi.org/10.1111/geb.12509
Liu, J., Wilson, M., Hu, G., Liu, J., Wu, J., Yu, M. 2018. How does
habitat fragmentation affect the biodiversity and ecosystem functioning
relationship?. Landscape Ecology 33, 341-352. https://doi.org/10.1007/s10980-018-0620-5
Lovich, J.E., Ennen, J.R., Madrak, S., Grover, B. 2011. Turtles and
culverts, and alternative energy development: An unreported but potentially
significant mortality threat to the Desert Tortoise (Gopherus agassizii). Chelonian
Conservation and Biology 10(1), 124-129. https://doi.org/10.2744/CCB-0864.1
Martinig, A.R., Bélanger‐Smith, K.
2016. Factors influencing the discovery and use of wildlife passages for small
fauna. Journal of Applied Ecology 53(3), 825-836. https://doi.org/10.1111/1365-2664.12616
Mata, C., Hervás, I., Herranz, J.,
Suárez, F., Malo, J.E. 2008. Are motorway wildlife passages worth building?
Vertebrate use of road-crossing structures on a Spanish motorway. Journal
of Environmental Management 88(3), 407-415. https://doi.org/10.1016/j.jenvman.2007.03.014
Meijer, J.R., Huijbregts, M.A., Schotten, K.C., Schipper, A.M. 2018. Global
patterns of current and future road infrastructure. Environmental
Research Letters 13(6), 064006. https://doi.org/10.1088/1748-9326/aabd42
Ministerio de Agricultura,
Alimentación y Medio Ambiente. 2015. Prescripciones técnicas para el
diseño de pasos de fauna y vallados perimetrales (segunda edición, revisada y
ampliada). Documentos para la reducción de la fragmentación de hábitats
causada por infraestructuras de transportes, número 1. Ministerio de
Agricultura, Alimentación y Medio Ambiente, Madrid, España.
MITECO. 2021. Estrategia
Nacional de la Infraestructura Verde y de la Conectividad y la Restauración
Ecológicas. Gobierno de España. Ministerio para la Transición Ecológica y
el Reto Demográfico, Madrid, España.
MITECO. 2023. Análisis
demostrativo de conectividad ecológica de ecoperfiles de especies en la
península ibérica. Gobierno de España. Ministerio para la Transición Ecológica
y el Reto Demográfico, Madrid, España
Mora, R. 2024. Evaluación de la
efectividad de pasos de fauna para la conectividad de poblaciones de
vertebrados. Trabajo Fin de Grado. Universidad Miguel Hernández de Elche,
Elche, España.
Mori, E., Menchetti, M.,
Camporesi, A., Cavigioli, L., Tabarelli de Fatis, K., Girardello, M. 2019. License to kill? Domestic cats affect a wide range of native fauna
in a highly biodiverse Mediterranean country. Frontiers in Ecology and
Evolution 7, 477. https://doi.org/10.3389/fevo.2019.00477
Nadal, J., Ponz, C., Margalida, A. 2018. Body proportions for the
facilitation of walking, running and flying: the case of partridges. BMC
Evolutionary Biology 18, 1-9. https://doi.org/10.1186/s12862-018-1295-x
Ng, S.J., Dole, J.W., Sauvajot, R.M., Riley, S.P., Valone, T.J. 2004.
Use of highway undercrossings by wildlife in southern California. Biological
conservation 115(3), 499-507. https://doi.org/10.1016/S0006-3207(03)00166-6
Palomo, L.J., Gisbert, J.,
Blanco, J.C. 2007. Atlas y libro rojo de los mamíferos terrestres de
España. Organismo Autónomo de Parques Nacionales, Madrid, España.
Paterson, J.E., Baxter‐Gilbert, J., Beaudry, F.,
Carstairs, S., Chow‐Fraser,
P., Edge, C.B., et al. 2019. Road avoidance and its energetic
consequences for reptiles. Ecology and Evolution 9(17),
9794-9803. https://doi.org/10.1002/ece3.5515
Penteriani, V., Kuparinen, A., del Mar Delgado, M., Palomares,
F., López-Bao, J.V., Fedriani, J.M., et al. 2013. Responses of a top and a meso predator and their prey
to moon phases. Oecologia 173, 753-766. https://doi.org/10.1007/s00442-013-2651-6
R Core Team 2024. R: A language and environment for statistical computing.
Version 4.3. 1. R foundation for statistical computing, Vienna, Austria. https://www.r-project.org/
Rivera‐Ortíz, F.A., Aguilar, R.,
Arizmendi, M.D.C., Quesada, M., Oyama, K. 2015. Habitat
fragmentation and genetic variability of tetrapod populations. Animal
Conservation 18(3), 249-258. https://doi.org/10.1111/acv.12165
Rodriguez, A., Crema, G.,
Delibes, M. 1996. Use of non-wildlife passages across a high
speed railway by terrestrial vertebrates. Journal of Applied Ecology 33,
1527-1540. https://doi.org/10.2307/2404791
Rytwinski, T., Fahrig, L. 2012. Do species life history traits explain
population responses to roads? A meta-analysis. Biological conservation 147(1),
87-98. https://doi.org/10.1016/j.biocon.2011.11.023
Sala, O.E., Stuart -Chapin, F., Armesto, J.J., Berlow, E., Bloomfield,
J., Dirzo, R., et al. 2000. Global biodiversity scenarios for the year 2100. Science
287(5459), 1770-1774. https://doi.org/10.1126/science.287.5459.1770
Sánchez-Fernández,
M., Barrigón Morillas, J.M., Montes González, D., de Sanjosé Blasco, J.J. 2022.
Impact of roads on environmental protected areas: analysis and
comparison of metrics for assessing habitat fragmentation. Land 11(10),
1843. https://doi.org/10.3390/land11101843
Soanes, K., Lobo, M.C., Vesk, P.A., McCarthy,
M.A., Moore, J.L., Van Der Ree, R. 2013. Movement re-established but not
restored: inferring the effectiveness of road-crossing mitigation for a gliding
mammal by monitoring use. Biological Conservation 159,
434-441. https://doi.org/10.1016/j.biocon.2012.10.016
Taylor, P.D., Fahrig, L., Henein, K., Merriam, G. 1993. Connectivity is a
vital element of landscape structure. Oikos 68(3), 571-573. https://doi.org/10.2307/3544927
Twardek, W.M., Peiman, K.S., Gallagher, A.J., Cooke, S.J. 2017. Fido,
Fluffy, and wildlife conservation: The environmental consequences of
domesticated animals. Environmental Reviews 25(4),
381-395. https://doi.org/10.1139/er-2016-0111
UICN 2023a. Testudo graeca,
En: La Lista Roja de Especies Amenazadas de la UICN. Versión 2022-1.
Obtenido de: https://www.iucnredlist.org/es/species/21646/9305693
UICN 2023b. Eliomys quercinus.
En: La Lista Roja de Especies Amenazadas de la UICN. Versión 2022-1.
Obtenido de: https://www.iucnredlist.org/es/species/7618/3139783
UICN 2023c. Alectoris rufa.
En: La Lista Roja de Especies Amenazadas de la UICN. Versión 2022-1.
Obtenido de: https://www.iucnredlist.org/es/species/22678711/166184840
van der Grift, E.A., van
der Ree, R., Fahrig, L., Findlay, S., Houlahan, J., Jaeger, J.A.G., Klar, N.,
Madriñan, L.F., Olson, L., 2013. Evaluating the effectiveness
of road mitigation measures. Biodiversity and Conservation 22, 425–448. https://doi.org/10.1007/s10531-012-0421-0
van der Ree, R., Smith, D.J., Grilo, C. 2015. Handbook
of road ecology. John Wiley Sons, Chichester, West
Sussex, United Kingdom. https://doi.org/10.1002/9781118568170
Warnock-Juteau, K., Bolduc, V., LoScerbo, D., Anderson, M., Daguet,
C., Jaeger, J.A. 2022. Co-use of existing crossing structures along roads by
wildlife and humans: Wishful thinking?. Nature Conservation 47, 235-270. https://doi.org/10.3897/natureconservation.47.73060
Wearn, O.R.,
Glover-Kapfer, P. 2019. Snap happy: camera traps are an effective sampling tool
when compared with alternative methods. Royal Society Open Science 6(3),
181748. https://doi.org/10.1098/rsos.181748
Weigand, N.M., Wagner, R.B., Tonra, C.M., Popescu, V.D. 2019. Proximity to
highways has limited influence on space use and physiology of terrestrial
testudines. European Journal of Wildlife Research 65(5), 80. https://doi.org/10.1007/s10344-019-1315-1
Wickham, H. 2016. ggplot2. Elegant Graphics for Data Analysis.
Springer Nature, Cham, Switzerland. https://doi.org/10.1007/978-3-319-24277-4_9
Yanes,
M., Velasco, J.M., Suárez, F. 1995. Permeability of roads and
railways to vertebrates: the importance of culverts. Biological
Conservation 71(3), 217-222. https://doi.org/10.1016/0006-3207(94)00028-O
Young, G., King, R., Allen, B.L. 2023. Where do wildlife cross the road?
Experimental evaluation reveals fauna preferences for multiple types of
crossing structures. Global Ecology and
Conservation 46, e02570. https://doi.org/10.1016/j.gecco.2023.e02570
Anexo I. Características básicas de los
drenajes de carretera y su uso como pasos de fauna / Annex
I. Basic characteristics of road culverts and their use as wildlife crossings
Anexo I.a.
Características constructivas (tipo, diámetro, longitud, índice de
apertura=longitud/sección, cobertura de matorral y distancia al refugio de
vegetación más cercano) y número de especies (Spp) y detecciones (Detec) de los
distintos drenajes estudiados. Formato de las coordenadas: WGS84. *La cámara 8
fue robada en marzo de 2024 y no fue considerada en los análisis estadísticos.
Anexo I.a. Constructive
characteristics (type, diameter, length, openness index=length/section, shrub
cover, and distance to the nearest vegetation patch) and number of species
(Spp) and detections (Detec) of the different road culverts. Coordinate format:
WGS84. *Camera 8 was stolen in March 2024 and was not considered in the
statistical analyses.
Anexo I.b. Cámara
tipo de fototrampeo Browning Dark Ops PRO DCL instalada en las obras de drenaje
de la carretera A1205.
Anexo I.b. Browning
Dark Ops PRO DCL was the photo-trap camera model installed at the A1205 road culverts.

Anexo I.c. Detecciones
de paso totales durante todo el periodo de grabación por drenaje de las
especies objetivo. *La cámara 8 fue robada en marzo de 2024.
Anexo I.c. Total wildlife crossings events of target species detected by road
culvert during the recording period. *The camera 8 was stolen in March
2024.
Anexo
I.d. Detecciones de paso totales durante todo el periodo de grabación
por drenaje y mes. *La cámara 8 fue robada en marzo de 2024.
Anexo I.d. Total
wildlife crossings events detected by road culvert and month during the
recording period. *Camera 8 was stolen in March 2024.
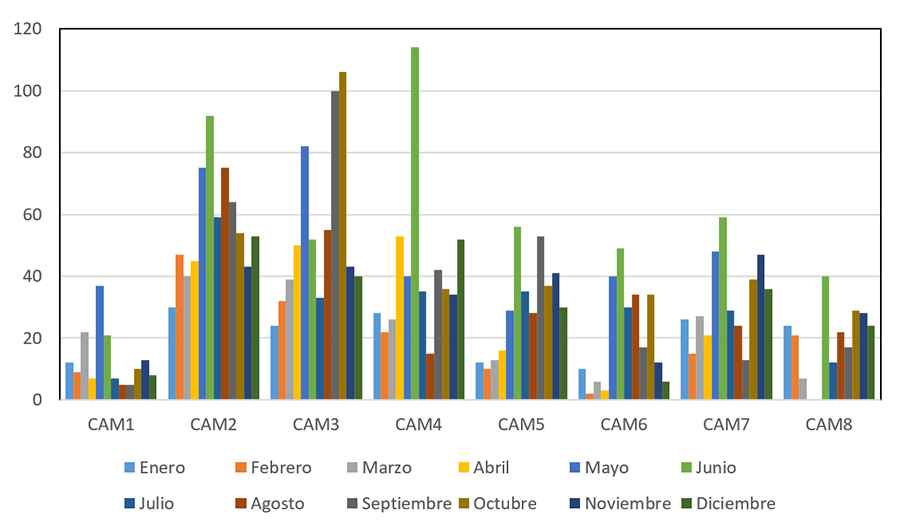
Anexo I.e. Número
de detecciones de cada especie por mes (julio 2023-junio 2024) en el área de
estudio (CAM1-CAM7).
Anexo I.e. Wildlife
crossing events detected per target species and month (July 2023-June 2024) in
the study area (CAM1-CAM7).
Anexo
I.f. Número de detecciones por mes (julio 2023-junio 2024) en el
área de estudio (CAM1-CAM7).
Anexo I.f. Wildlife crossing events detected per month (July 2023-June 2024)
in the study area (CAM1-CAM7).
Anexo I.g.
Distribución de las detecciones de paso por drenaje (CAM1-7) y momento del día
(día/noche) para las especies con >5 registros.
Anexo I.g. Distribution of wildlife crossing events
detected per road culvert (CAM1-7) and time of day (day/night) for species with
>5 records.
Anexo
I.h. Distribución de las detecciones de paso por estación del año y
momento del día (día/noche) para las especies con >5 registros.
Anexo I.h. Distribution of wildlife crossing events detected per road culvert
(CAM1-7) and season for species with >5 records.
Anexo II.
Resultados de los análisis estadísticos realizados / Annex
II. Results of the statistical analyses performed
Anexo II.a. Resultados
de la significación de especies en la ordenación (NMDS) de los drenajes en
función de las especies que los cruzan (distancia Bray-Curtis). En el gráfico
se muestran las especies que resultaron significativas en el NMDS. **p-<0.01; *p<0.05; .p<0.1.
Anexo
II.a. Results of species significance in the
ordenation (NMDS) of road culverts according to the species detected crossing
them (Bray-Curtis distance). The graph shows the species that were significant
in the NMDS. **p-value<0.01; *p<0.05; .p<0.1.
Anexo II.b.
Coeficientes y significación del GLM relacionando las especies con las
detecciones de paso. ***p-valor<0.001;
**p<0.01; *p<0.05; .p<0.1.
Anexo II.b.
Coefficients and significance of GLM relating species to crossing events. ***p-value<0.001;
**p<0.01; *p<0.05; .p<0.1.
Anexo
II.c. Resumen de los resultados de los modelos GLMM testados
ordenados por el AIC. Se muestra la R2 marginal (R2m)
que corresponde con los efectos fijos (variables testadas: especie, estación y
periodo) y la R2 condicional (R2c) que
corresponde a los efectos fijos y aleatorios (variables testadas más identidad
del drenaje).
Anexo
II.c. Summary of the results of the GLMM models
ranked by AIC. We show marginal R2 (R2m), corresponding to fixed effects (tested variables: species,
season and day period), and the conditional R2 (R2c), corresponding to the fixed and random effects (tested variables
plus drainage identity).
Anexo
II.d. Coeficientes y significación del mejor modelo GLMM. ***p-valor<0.001.
Anexo
II.d. Coefficients and significance of the best
GLMM model. ***p-value<0.001.
Anexo II.e. Diagrama
de cajas mostrando las interacciones significativas entre Especie y Periodo del
día (día o noche). La línea horizontal en negrita representa la mediana, la
caja delimita el rango intercuartílico y las líneas de bigotes se extienden
hasta los máximos y mínimos observados, excepto para los valores atípicos
simbolizados por puntos. También se proporcionan los p valores según los GLMM.
***p-valor<0.001.
Anexo
II.e. Boxplots showing the significant
interactions between species and time of day (day or night). The median is
denoted by the bold horizontal line, the box delimits the interquartile range,
and the whisker lines extend to the observed maxima and minima, except for the
outliers symbolized by points. P-values are also shown ***p-value
<0.001.
Anexo II.f. Diagrama
de cajas mostrando las interacciones significativas entre Especie y Estaciones
del año. La línea horizontal en negrita representa la mediana, la caja delimita
el rango intercuartílico y las líneas de bigotes se extienden hasta los máximos
y mínimos observados, excepto para los valores atípicos simbolizados por
puntos. También se proporcionan los p valores según los GLMM. ***p-valor<0.001;
*p<0.05.
Anexo
II.f. Boxplots showing the significant interactions
between species and season. The median is denoted by the bold horizontal line,
the box delimits the interquartile range, and the whisker lines extend to the
observed maxima and minima, except for the outliers symbolized by points. P-values
are also shown ***p-value <0.001; *p<0.5.
Anexo III.
Número de detecciones diurnas y nocturnas por cámara y mes de las distintas
especies objetivo. / Annex III. Number of day and night wildlife crossing
events detected per camera and month of the different target species
![]() , Ramón Mora2
, Ramón Mora2 ![]() , Goodwill Estal1
, Goodwill Estal1 ![]() , Nuria
Pujante1
, Nuria
Pujante1 ![]() , Carolina Audisio2
, Carolina Audisio2 ![]() , Andrés Giménez1,2
, Andrés Giménez1,2 ![]() , María Victoria Jiménez-Franco1
, María Victoria Jiménez-Franco1 ![]()











