Introducción
En la península ibérica, la ausencia general de grandes
carnívoros como el oso pardo (Ursus arctos), el lobo (Canis lupus
signatus) o el lince ibérico (Lynx pardinus), especialmente en zonas
degradadas, ha provocado un aumento de las poblaciones de mesocarnívoros (Monterroso et al. 2015; Jiménez et al. 2017, 2019;
Burgos et al. 2023). Los mesocarnívoros son
carnívoros de talla intermedia (< 15 kg) que se encuentran más abajo en la
cadena trófica y que pueden llegar a ejercer de depredadores apicales en
ecosistemas carentes de grandes depredadores, siendo incapaz, sin embargo, de
controlar la población de otros carnívoros (Roemer
et al. 2009).Esto puede provocar un aumento de densidad poblacional por
encima de lo habitual, al no existir dicha presión ejercida por los grandes
depredadores que regule sus poblaciones, en un proceso conocido como
“mesopredator release” (Soulé et al. 1988; Buskirk 1999; Prugh et al.
2009). El aumento de densidad de los mesocarnívoros va a suponer mayores
dificultades en la coexistencia, especialmente entre especies de nichos
similares. Normalmente, esta coexistencia está mediada por la diferenciación
espacial, temporal o trófica de las especies implicadas (Hardin
1960). Sin embargo, cuando nos referimos a hábitats de dimensiones
reducidas y con comunidades muy diversas, la diferenciación espacial es menos
probable debido a que el espacio es limitado. En consecuencia, la
diferenciación de nicho debería estar más relacionada con el ámbito trófico y
temporal (Lucherini et al. 2009; Di Bitetti et al. 2009).
La diferenciación en el
nicho temporal va a reflejarse principalmente en las diferencias entre los
patrones de actividad. Estos, definidos como “secuencias adaptativas de rutinas
diarias”, han sido modelados a lo largo de la evolución (Halle y
Stenseth 2000), siendo regulados
principalmente por ritmos circadianos endógenos (Kronfeld-Schor
y Dayan 2003). Sin embargo,
estos patrones también son susceptibles de sufrir pequeños cambios debido a
factores externos, aportándoles cierta plasticidad (Zielinski 1986; Monterroso et al. 2013). Esta plasticidad permite a los depredadores
adaptarse a las variaciones de las condiciones del hábitat, permitiéndoles, por
ejemplo, solapar su actividad con la de sus potenciales presas (Brown et al. 2001; O’Connell et al. 2006; Foster et al. 2013; Azevedo et al. 2018), aunque eso conlleve coincidir temporalmente
con otros depredadores. De esta forma, el
ritmo de actividad de un depredador es el resultado de un compromiso entre un
beneficio y un coste. Por un lado, los depredadores tratan de maximizar su
actividad durante periodos de alta disponibilidad de presas y, por otro, evitan
el riesgo de conflicto fruto de encuentros interespecíficos con competidores (Halle y
Stenseth 2000; Santos et al. 2019).
Existen muchos factores externos que pueden influir en los
patrones de actividad de las especies, como puede ser la presencia de otros
depredadores (Garrote y Pérez de Ayala 2019),
la presencia humana (Carter et al. 2015), o
factores abióticos como la temperatura (Kronfeld-Schor y Dayan 2003) o la
duración del día (Bennie et al. 2014), entre
otros. En esta línea, la disponibilidad de recursos puede ser un factor clave
para determinar los patrones temporales de actividad de los depredadores (Zhao et al. 2020). Los recursos disponibles en el
hábitat, ya sea agua, alimento o refugio, varían a lo largo del año y las
especies van a tener que adaptarse a su disponibilidad en cada una de las
estaciones (Penido et al. 2017). Por tanto, la
especialización trófica y la disponibilidad de presas serán factores
determinantes en esta plasticidad en la actividad. Las especies que muestren
preferencia por un tipo de presa concreto deberán presentar un mayor
solapamiento con la actividad de estas que una especie más generalista, que
puede explotar otro tipo de recursos tróficos y no necesitará ajustar tan
estrechamente su actividad a la de sus presas (Monterroso
et al. 2013; Burgos et al. 2023).
Aunque existen numerosos estudios sobre la actividad de los
mesocarnívoros en la península ibérica (Barrull et
al. 2013; Monterroso et al. 2014; Vilella et al. 2020; Burgos
et al. 2023), aún quedan algunas cuestiones que explorar, especialmente en
áreas humanizadas donde los remanentes de hábitats naturales pueden suponer
auténticos refugios para algunas especies. En este sentido, los bosques de
ribera son uno de los hábitats más importantes para los mesocarnívoros,
especialmente en contextos agrícolas intensivos (Virgós
2001). Estos hábitats riparios suelen presentar una estructura lineal
adyacente a sistemas acuáticos interiores (Malanson
1993; Naiman et al. 2010) y poseen un gran
valor ecológico, ya que además de presentar una elevada biodiversidad (Sabo et al. 2005; Matos et
al. 2009), cumplen funciones fundamentales actuando como corredores entre
parches forestales (Hilty y Merenlender 2004),
como proveedores de alimento (Matos et al. 2009),
refugio (Virgós 2001) y sitios de descanso (Santos-Reis et al. 2005). Además, el efecto
amortiguador del río en el microclima generado en torno a ellos supone un
factor fundamental para especies termófilas como la gineta (Virgós 2001; Camps 2017).
Por tanto, estos hábitats riparios son óptimos para los mesocarnívoros, ya que
van a satisfacer las necesidades fundamentales para su supervivencia, y puede
ser especialmente importante en contextos de matrices agrarias o altamente
humanizadas (Virgós 2001; Santos et al. 2016).
En
este estudio evaluamos la coexistencia de la gineta y el zorro en un bosque de
ribera inmerso en un área altamente humanizada mediante el análisis de sus
patrones de actividad y los de sus potenciales presas utilizando el
fototrampeo. Nuestro objetivo es
demostrar que la mayor especificidad trófica de la gineta por los
micromamíferos y la mayor plasticidad ecológica del zorro permitirán su
coexistencia en el área de estudio mediante la modificación de sus patrones de
actividad en las distintas estaciones del año. De forma secundaria, buscamos
definir la riqueza de la comunidad de carnívoros silvestres de la zona, que
deberá ser elevada dada su condición de refugio en un entorno altamente
modificado por la acción humana. Con todo esto, pretendemos aportar más
información sobre alguno de los mecanismos de coexistencia dentro de las
comunidades de mesocarnívoros mediante la diferenciación de sus patrones de
actividad y la preferencia por sus potenciales presas a lo largo del año.
Materiales y Métodos
Área de estudio
El área de estudio fue un bosque de ribera adyacente a un
tramo de 12 km del río Tormes a su paso por la provincia de Salamanca, en una
zona agrícola intensiva de regadío (40º58´N,5º28´W) (Fig.
1). La altitud media de este tramo es de 790 msnm. El clima es
mediterráneo, con inviernos fríos y veranos calurosos. La temperatura media
anual es de 12.5ºC, con rangos de temperatura entre los -8ºC y los 40.5ºC. La
precipitación media anual es de 400 mm (Agencia Estatal de Meteorología,
estación Salamanca Aeropuerto, 2022). La vegetación del bosque de ribera está
compuesta principalmente por especies de porte arbóreo como álamos (Populus
sp.), fresnos (Fraxinus angustifolia), sauces (Salix sp.),
alisos (Alnus glutinosa), y otras especies arbustivas entre las que
destacan zarzamoras (Rubus sp.), rosales silvestres (Rosa sp.) y
majuelos (Crataegus monogyna). El contexto circundante es una matriz
agrícola intensiva de regadío (Fig. 1), siendo el
cultivo principal el maíz (Zea mays).
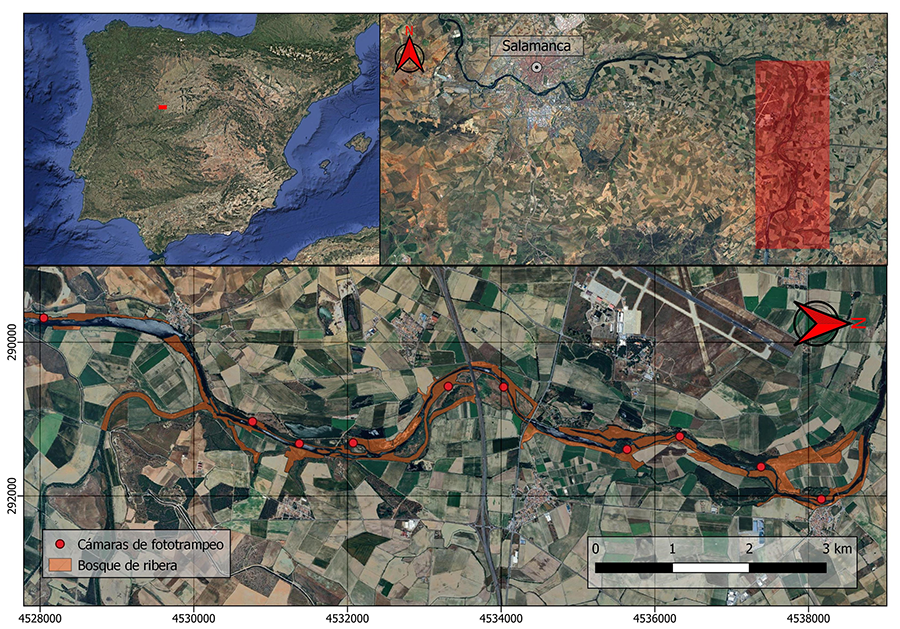
Figura 1. Mapa del
área de estudio al oeste de la provincia de Salamanca (España). Cada punto rojo representa una estación de muestreo.
Figure 1. Map
of the study area in the west of the province of Salamanca (Spain). Each
red dot represents a sampling station.
Muestreo
El estudio tuvo una duración de 320 días, entre mayo de 2021
y marzo de 2022, logrando así obtener información de las cuatro estaciones del
año (primavera, verano, otoño e invierno). Para conocer los ritmos circadianos
de las especies de mesocarnívoros en el área de estudio, se utilizaron cámaras
de fototrampeo, un método no invasivo que permite obtener una gran cantidad de
información acerca de la actividad de especies esquivas y/o nocturnas (Kays y Slauson 2008; O’Connell
et al. 2011; Burton et al. 2015).
Concretamente, se colocaron 10 cámaras Apeman H55 situadas a lo largo de la
zona de estudio, separadas entre sí entre 700 y 1400 m (distancias basadas en
limitaciones del área de estudio y limitaciones logísticas). Las estaciones se
situaron en zonas con alta densidad de vegetación con señales claras de paso de
mesocarnívoros (Kays y Slauson 2008; Rovero et al. 2013). En cada estación de muestreo se
colocó una cámara en el tronco de un árbol, a una altura media de 40 cm del
suelo, enfocando hacia un atrayente oloroso (descrito a continuación) colocado
a 2 m de la cámara y activa las 24 horas del día. Las cámaras fueron
configuradas para sacar 2 fotografías seguidas por cada detección.
Para aumentar la probabilidad de detección de las especies,
se utilizaron latas de sardinas en aceite como atrayente oloroso (Ferreira-Rodríguez y Pombal 2019; Sebastián-González et al. 2020) al ser un
atrayente efectivo, accesible y económico. Para su colocación, se realizaron
perforaciones en la tapa de la lata para favorecer la atracción y esta se
sujetó con bridas a un tronco o rama para evitar que las especies pudieran
llevársela. Las cámaras se revisaron cada dos semanas y el atrayente fue
reemplazado cada dos revisiones por uno nuevo. El
esfuerzo de muestreo fue similar en primavera y otoño (460 y 479 cámaras-día
respectivamente), pero fue mayor en verano (856 cámaras-día) y menor en invierno
(329 cámaras-día).
Procesado de las muestras
Una vez obtenidas las imágenes de fototrampeo, estas fueron
procesadas mediante el programa CameraBase (Tobler 2015).
Para cada imagen se registró la especie, la hora y la fecha. Al sacarse dos
fotografías por cada detección y pudiendo un mismo animal permanecer frente a
la cámara durante un tiempo prolongado, hay riesgo de sobreestimar el número de
eventos obtenidos. Por ello, se consideró como un único evento aquel que tenía
lugar con 30 minutos de diferencia con el siguiente (Lucherini et al. 2009; Monterroso et al. 2013; Burton
et al. 2015). Todos los análisis de este trabajo fueron realizados en R (R Core Team 2022) bajo la interfaz gráfica RStudio (RStudio Team 2022).
La duración del día (entendido como horas de luz disponibles
en 24 horas) varía a lo largo del año, por lo que debe tenerse en cuenta esta
variación para evitar un sesgo en los patrones de actividad (Vazquez et al. 2019). Para considerarlo en nuestro
análisis, se transformaron los datos usando el paquete “activity” (Rowcliffe 2021) realizando una transformación de
tiempo (double average anchoring time transformation), que tiene en
cuenta el promedio de horas de salida y puesta del sol para cada periodo en el
área de estudio (Vazquez et al. 2019).
Riqueza y abundancia relativa
A pesar de que el estudio se centra en las especies más
abundantes, tuvimos en cuenta la riqueza total de la comunidad (i.e. número de
especies) y utilizamos el Índice de Abundancia Relativa (RAI) como medida de
abundancia relativa (O’Brien 2011), que tiene en
cuenta el número de eventos obtenidos estandarizados por el esfuerzo de
muestreo.
Análisis de patrones de actividad y solapamiento
temporal
Los patrones de actividad fueron creados para cada estación
del año a partir de los eventos independientes obtenidos en toda el área de
estudio. Nos centramos en zorro, gineta y micromamíferos debido a que fueron
las únicas especies de las cuales se obtuvieron eventos suficientes (n≥10 en
todas las estaciones) para realizar los análisis. Por la naturaleza circular
del tiempo, estos patrones de actividad fueron estimados de forma no paramétrica
usando estimaciones de densidad de Kernel del paquete “overlap” (Ridout y Linkie 2009). Además, se realizaron
comparaciones por pares para observar si existían o no diferencias
significativas entre los patrones de actividad de cada especie a lo largo de
las estaciones usando el test de Watson-Wheeler (Batschelet
1981) dentro del paquete “circular” (Agostinelli
y Lund 2022). Para su representación se utilizó otro tipo de transformación
(equinoctial anchoring) (Vazquez et al. 2019) que establece las horas de
amanecer y anochecer a las 6:00 y a las 18:00, respectivamente, y por tanto
permite representar patrones correspondientes a diferentes estaciones en un
mismo gráfico, solventando el problema que supone las diferentes horas de
salida y puesta de sol en cada una de las estaciones del año.
Respecto al solapamiento temporal, se comparó por una parte
el solapamiento entre los propios mesocarnívoros, y por otro lado el
solapamiento de la actividad de los mesocarnívoros con la de los
micromamíferos. Para evaluar el solapamiento temporal entre las especies, se
hicieron comparaciones por pares en todas las estaciones del año, comparando el
coeficiente de solapamiento (Δ) (Ridout y Linkie
2009). Este coeficiente de solapamiento oscila entre los valores 0
(ausencia total de solapamiento) y 1 (máximo solapamiento posible). Para
tamaños de muestra (i.e. nº de capturas independientes) menores de 75, se
utilizó Δ1, mientras que para aquellas muestras mayores o iguales a
75, se utilizó Δ4 (Meredith y Ridout
2021). Para intentar valorar los coeficientes de solapamiento de forma
descriptiva, se consideraron 3 situaciones: “solapamiento elevado” aquel
solapamiento cuyo coeficiente fuera mayor a 0.75 (Δ>0.75), “solapamiento
moderado” (0.50<Δ≤0.75) y “solapamiento bajo” (Δ≤0.50) siguiendo las
recomendaciones de Monterroso et al. (2014).
Para poder tener una medida de dispersión, se calculó para cada coeficiente de
solapamiento un intervalo de confianza al 95% con un análisis de bootstrap
con 10000 replicaciones. Tanto los coeficientes de solapamiento como sus
respectivos intervalos de confianza fueron obtenidos con paquete “overlap”
(Meredith y Ridout 2021). Finalmente, para
observar si los patrones eran significativamente distintos entre las especies
solapadas, se usó nuevamente el test de Watson-Wheeler (Batschelet 1981).
Resultados
Con un esfuerzo total de muestreo de 2124 cámaras
trampa-día, se obtuvieron 1183 eventos independientes de ocho especies
diferentes de mesocarnívoros: zorro (Vulpes vulpes) (n=78.0 ± 150.9;
medía de detecciones por sitio ± desviación típica) (56.11%), gineta (Genetta
genetta) (n=30.4 ± 35.5) (21.87%), garduña (Martes foina) (n=4.5 ±
9.2) (3.24%), visón americano (Neogale vison) (n=2.8 ± 4.8) (2.01%),
tejón (Meles meles) (n=1.3 ± 1.6) (0.93%), nutria (Lutra lutra)
(n=1.0 ± 3.2) (0.72%), turón (Mustela putorius) (n=0.2 ± 0.3) (0.14%) y
meloncillo (Herpestes ichneumon) (n=0.1 ± 0.3) (0.07%), así como de un
pequeño carnívoro, la comadreja (Mustela nivalis) (< 0.05%) (Tabla A1 del Anexo). Las especies con los RAIs más
altos fueron el zorro y la gineta (36.86 y 14.41 respectivamente), mientras que
el resto de las especies muestran valores más bajos (Fig.
2). El valor de este índice para los micromamíferos fue de 15.25 (Fig. 2).
Centrándonos en el zorro y la gineta, ambas especies
registraron una mayor tasa de captura (expresada como nº eventos/nº cámaras
trampas-día) en verano (0.55 y 0.20, respectivamente) que, en el resto de las
estaciones, mientras que invierno fue la época de menor tasa de captura (0.11 y
0.04, respectivamente) (Tabla A2 del Anexo).
Respecto a las posibles especies presa, solo se tuvo en cuenta a los
micromamíferos, siendo la especie predominante Apodemus sylvaticus. Se
ha decidido tratar como “micromamíferos” en conjunto para ser conservadores
frente a la posibilidad de aparición de individuos del género Mus, ya
que muchas imágenes no permitieron la correcta identificación. De estos
micromamíferos se obtuvieron 321 detecciones (n=32.1 ± 57.5) (Tabla
A1 del Anexo). El periodo con mayor tasa de captura fue el otoño
(0.25), mientras que la de menor tasa fue verano (0.09) (Tabla
A2 del Anexo).
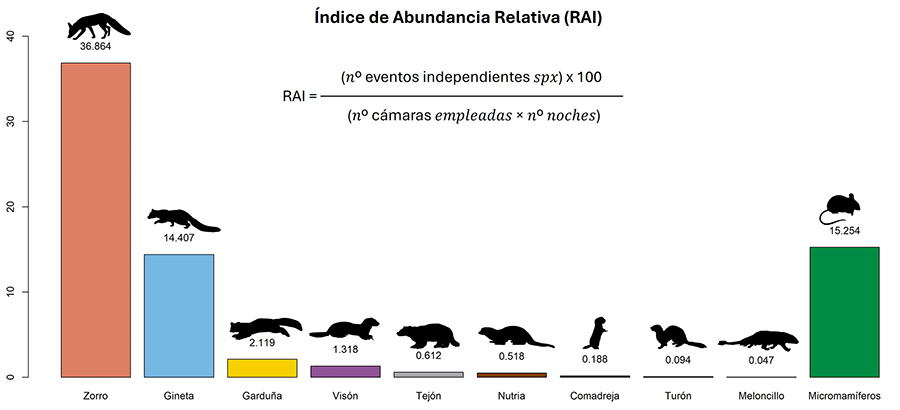
Figura 2. Índice de
Abundancia Relativa (RAI) para las especies de mesocarnívoros y micromamíferos
detectados durante el estudio.
Figure 2. Relative Abundance Index (RAI) for mesocarnivore and small mammal
species detected during the study.
Patrones de actividad
diaria
El zorro mostró un patrón bimodal en todas las estaciones,
con dos picos principales de actividad después del amanecer y del anochecer
(excepto en invierno, que el primer pico se da justo antes del amanecer) (Fig. 3a). Muestra una actividad nocturna moderada y
una baja actividad diurna, excepto en primavera. Al realizar comparaciones por
pares, los test de Watson-Wheeler revelaron la existencia de diferencias
significativas (p<0.05) entre los patrones de primavera y verano (p=0.004) y
entre primavera y otoño (p=0.01) (Tabla 1).
La gineta mostró un patrón unimodal en algunas estaciones
(primavera e invierno), mientras que fue bimodal en otras (verano y otoño) (Fig. 3b). La actividad se dio fundamentalmente
durante la noche, aunque en los patrones bimodales encontramos picos de
actividad antes del amanecer, pudiendo darse algo de actividad en las primeras
horas del día. Los test de Watson-Wheeler revelaron que existen diferencias
significativas entre los patrones de primavera e invierno (p=0.006), así como
entre verano e invierno (p=0.01) y entre otoño e invierno (p=0.008) (Tabla 1).
El patrón mostrado por los micromamíferos fue unimodal en
todas las estaciones, mostrando el pico máximo de actividad a mitad de la
noche, aunque este pico en otoño fue más temprano que en el resto de las
estaciones (Fig. 3c). Los test de Watson-Wheeler
no mostraron diferencias significativas entre ninguna de las estaciones del año
(Tabla 1).
Tabla 1.
Test Watson-Wheeler entre los patrones de actividad en las diferentes
estaciones para cada especie. Pr: primavera; Ve: verano; Ot:
otoño; In: invierno.
Table 1. Watson-Wheeler test between activity patterns in different seasons
for each species. Pr: spring; Ve: summer; Ot: autumn; In: winter.
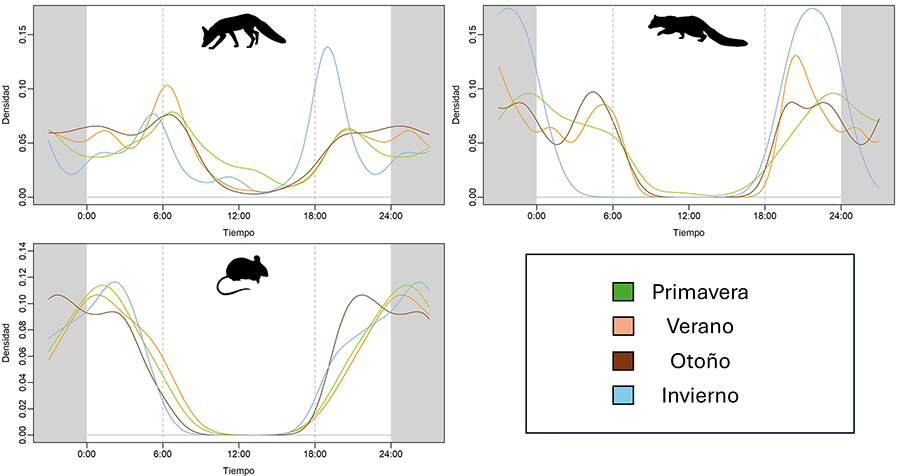
Figura 3. Patrones
por estación. Los gráficos a, b y c representan los patrones de actividad de
las especies en las diferentes estaciones: línea verde primavera, línea
amarilla verano, línea marrón otoño y línea azul invierno.
Figure 3.
Seasonal patterns. Graphs a, b, and c represent the activity patterns of the
species in different seasons: green line for spring, yellow line for summer,
brown line for autumn, and blue line for winter.
Solapamiento y segregación temporal
El solapamiento entre depredadores (Fig.
4) mostró que el zorro solapa de forma moderada con la gineta durante
todo el año excepto en invierno, donde fue significativamente inferior (Δ1=0.39)
(Fig. 4d). Los test de Watson-Wheeler mostraron
la existencia de diferencias muy significativas entre los patrones de actividad
del zorro y la gineta durante todo el año (p<0.01) excepto en otoño, donde
no se encontraron diferencias (Fig. 4).
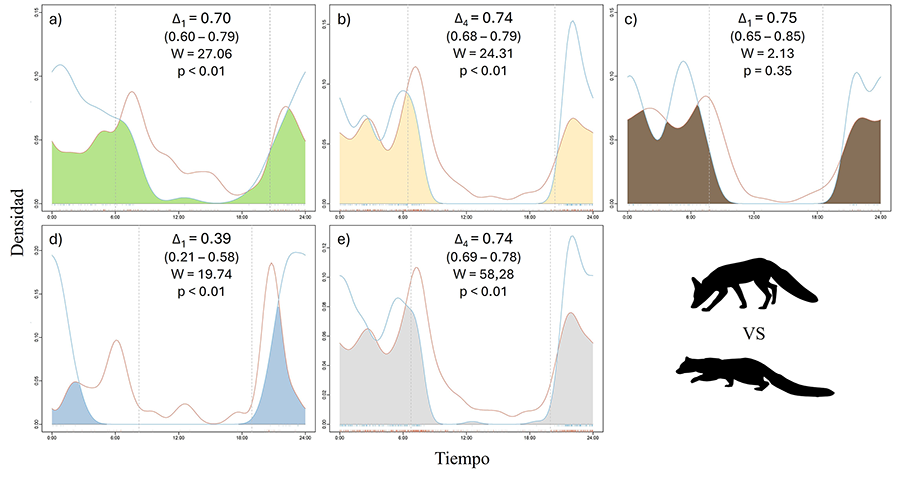
Figura 4. Solapamiento entre depredadores. El
gráfico muestra el solapamiento en la actividad del zorro (línea naranja) y la
gineta (línea azul) en primavera (a), verano (b), otoño (c), invierno (d) y el
solapamiento anual (e).
Figure 4. Overlap
between predators. The graph shows the overlap in activity between the fox
(orange line) and the genet (blue line) in spring (a), summer (b), autumn (c),
winter (d), and the annual overlap (e).
Respecto al solapamiento entre depredadores y presas, se
observó que, en el caso del zorro, este fue menor en comparación con el de la
gineta para todas las estaciones del año (Fig. 5).
El solapamiento entre el zorro y los micromamíferos fue moderado (Δ=0.52-0.70)
en todas las estaciones. En el caso de la gineta, el solapamiento con los
micromamíferos fue moderado en invierno (Δ1=0.57) y elevado en
primavera, verano y otoño (Δ1=0.85, Δ4=0.76 y Δ1=0.80
respectivamente) (Fig. 5). El mayor valor de
solapamiento para zorro-micromamíferos se dio en otoño (Δ4=0.70),
mientras que, en el caso de la gineta, este se dio en primavera (Δ1=0.85),
siendo muy similar al de otoño (Δ1=0.80). Los intervalos de
confianza al 95% (Fig. 5) permitieron observar
que no existieron diferencias estadísticamente significativas entre
zorro-micromamíferos y gineta-micromamíferos en ninguna de las estaciones del
año excepto en primavera, donde la gineta (Δ1=0.85, IC=0.73-0.95)
presentó mayor solapamiento con los micromamíferos que el zorro (Δ1=0.58,
IC=0.48-0.68). En el solapamiento anual, la gineta (Δ4=0.81,
IC=0.75-0.87) presentó también un solapamiento significativamente mayor con los
micromamíferos que el zorro (Δ4=0.65, IC=0.60-0.70).
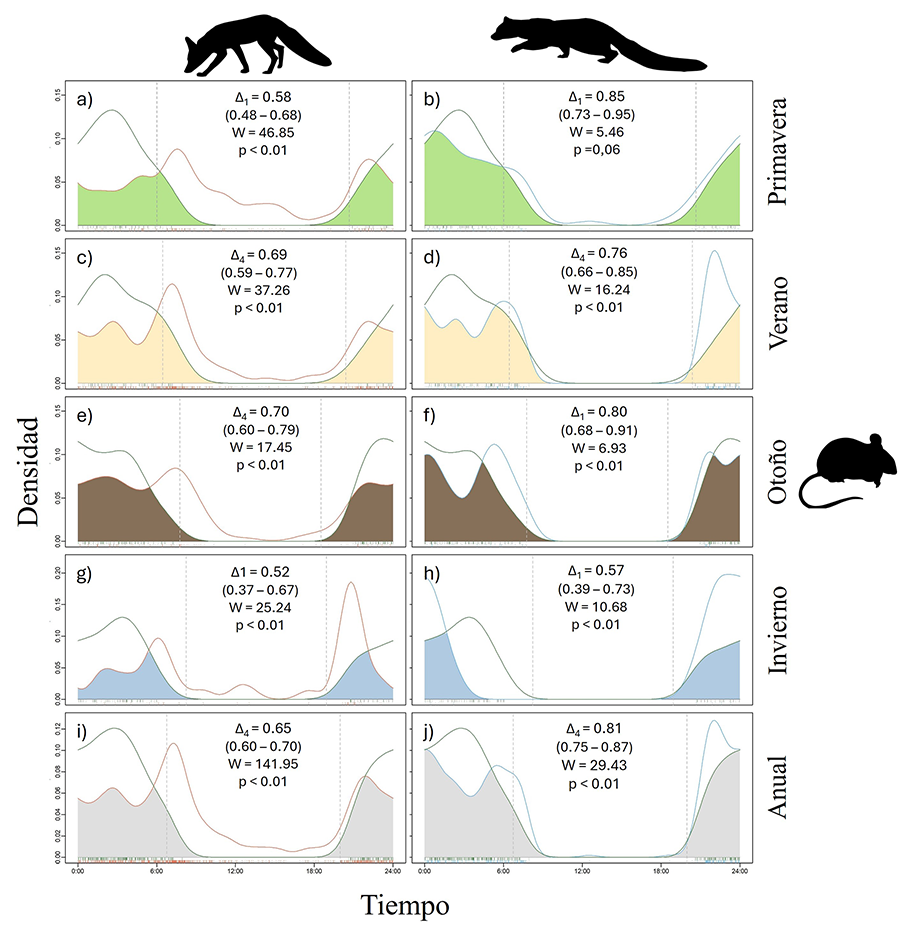
Figura 5. Solapamiento depredador-presa. La columna izquierda (a, c, e, g, i) muestra los gráficos de solapamiento del zorro con los micromamíferos y la columna de la derecha (b, d, f, h, j) el de la gineta. Las filas indican en que estación del año se está realizando el solapamiento
Figure 5. Predator-prey
overlap. The left column (a, c, e, g, i) shows the overlap graphs of the fox
with the small mammals, while the right column (b, d, f, h, j) shows the
overlap for the genet. The rows indicate the season in which the overlap is
being analyzed.
Discusión
Encontramos que el área de estudio ha resultado ser una zona
de gran riqueza de especies de carnívoros, siendo los más abundantes el zorro y
la gineta. Los patrones de actividad del zorro y la gineta variaron a lo largo
del año, afectando esto al grado de solapamiento de su actividad. Con respecto
al solapamiento de los patrones entre depredadores y presas, observamos que
existe un mayor solapamiento de los micromamíferos con la gineta que con el
zorro, sugiriendo una mayor especificidad de la gineta a la hora de escoger a
las presas.
Riqueza de la comunidad
En el área de estudio se han detectado 9 especies de
carnívoros silvestres. Entre ellas, encontramos algunas especies relativamente
comunes en casi todo el territorio peninsular (e. g. zorro, gineta, garduña,
tejón) (Calzada 2007; Gortázar
2007; Reig 2007; Revilla
et al. 2007). También se han detectado especies estrechamente relacionadas
con los hábitats riparios (e. g. visón americano, nutria) (Zuberogoitia et al. 2006; Ruiz-Olmo 2017) También se han detectado otras
especies más raras para el contexto como el meloncillo, que se encuentra en
expansión por a lo largo de la península ibérica (e.g. Descalzo et al. 2021) y cuya aparición añade una
nueva celda UTM (10x10km) en su distribución; el turón, especie que parece
encontrarse en declive en España (Croose et al. 2018);
y la comadreja, de la que existen pocos datos actuales. El hecho de haber
encontrado abundancias relativas bajas para algunas especies a priori comunes
puede deberse al uso de un método atrayente poco eficaz en el caso del tejón
(e. g. Miles et al. 2024) o a un mayor uso del río
para desplazarse y alimentarse en el caso del visón americano o la nutria. La
elevada riqueza de especies hallada podría relacionarse con el carácter casi
relicto del bosque de ribera como medio menos alterado en el contexto agrícola
intensivo, suponiendo un refugio para una gran cantidad de especies.
Patrones de actividad
De las dos especies para las que se estudiaron los patrones
de actividad, el zorro fue la única que, aun mostrando una preferencia nocturna
y crepuscular, mostró una actividad notable durante el día. Esto concuerda con
otros estudios donde se ha observado también esta actividad diurna (Cavallini y Lovari 1991; Travaini et al. 1993;
Monterroso et al. 2014), reflejo del carácter generalista del zorro, que
puede modular su patrón de actividad para explotar más eficientemente los
recursos (Ables 1969; Cavallini
y Lovari 1991; Díaz-Ruiz 2015). Además,
esta especie mostró un patrón multimodal con diferencias significativas entre
las diferentes estaciones que pueden estar relacionadas con períodos clave del
ciclo anual como los cuidados parentales (patrón un poco más constante, con
picos menos marcados en primavera) o el período invernal de celo en el que
exista más actividad diurna (Barrul y Mate 2015).
Respecto a la gineta, esta mostró patrones principalmente
nocturnos durante todas las estaciones, con una mayor actividad en general en
la primera mitad del periodo nocturno, coincidiendo con otros trabajos (e. g. Palomares y Delibes 2000; Camps 2008). Al igual que en el caso del zorro, los
patrones fueron variables a lo largo del año, aunque encontrando solamente
diferencias significativas entre invierno (patrón marcadamente unimodal con el
pico de actividad durante la primera mitad de la noche) y el resto de las
estaciones (patrones bimodales o unimodales con mayor actividad durante la
segunda mitad de la noche). Este hecho puede estar relacionado con que la
duración de la noche altera el momento de inicio y fin de la actividad de esta
especie, por lo que, a menos horas de luz disponibles, más nocturno será su
comportamiento (Camps 2015), como puede observarse en
el invierno. A esto hay que añadir el menor número de capturas durante este
periodo. En general la gineta presenta patrones más estables que el zorro a lo
largo de todo el año, coincidiendo estos con los patrones de actividad de los
micromamíferos, lo que concuerda con su especialización en la captura estas
presas. Este hecho ya ha sido reportado en otros trabajos (Camps
2015), incluso cuando existe una competencia a priori más directa que en
nuestro caso, con especies de nicho trófico similar como la garduña (Vilella et al. 2020), o se da una presión por parte
de un depredador apical (Burgos et al. 2023).
Solapamiento entre mesocarnívoros
En cuanto al solapamiento entre los patrones de actividad de
zorro y gineta, este es moderado en todas las estaciones excepto en invierno,
cuando solapan de forma significativamente menor. Una posible explicación, en
consonancia con los argumentos que explican los patrones individuales de las
especies, podría ser que, en invierno, al haber menos horas de luz y menos
recursos disponibles, el zorro se arriesga a tener una mayor actividad diurna
dedicada a explotar otros recursos o a la búsqueda de pareja (Servín et al. 1991; Monterroso
et al. 2014). En cambio, la gineta, eminentemente nocturna, tiene más
disponibilidad de horas de noche en esta época (Monterroso
et al. 2013). La existencia de un menor solapamiento en invierno concuerda
también con trabajos recientes y comunidades de carnívoros similares (Vilella et al. 2020). No obstante, de acuerdo con
nuestros resultados existen diferencias significativas entre sus patrones de
actividad en todas las estaciones del año excepto en otoño. Esto puede deberse
a que, pese a que el solapamiento es elevado, los picos máximos de actividad
están desplazados, haciendo que los patrones de actividad sean distintos. En
general los resultados apoyan otros trabajos realizados en la península ibérica
(Camps 2008; Barrull et
al. 2013; Vilella et al. 2020). Por lo
tanto, aunque exista solapamiento durante gran parte del año, los picos máximos
de actividad difieren entre la mayoría de las estaciones, pudiendo ello
contribuir a la coexistencia de ambas especies en el área de estudio.
Solapamiento con presas
El solapamiento entre la gineta y los micromamíferos fue
mayor en primavera y en otoño que en el caso del zorro con estos. Estas
diferencias podrían deberse a cambios en la dieta por cambios en la
disponibilidad de recursos (Verdade et al. 2011),
ya que en estas estaciones se concentra la actividad de micromamíferos en
ambientes mediterráneos (Sánchez-González et
al. 2016; Torre et al. 2018). Por lo tanto, la
gineta explotará mejor que el zorro este recurso, al ser una especie
especialista facultativa de micromamíferos (Virgós et
al. 1999; Camps 2015). Un caso muy similar se ha
reportado recientemente en Vilella y colaboradores (2020), donde el
solapamiento de la gineta con los micromamíferos es prácticamente constante en
los dos períodos estudiados (primavera-verano y otoño-invierno) y disminuye notablemente
para el zorro en primavera-verano. Burgos y colaboradores (2023) también muestran un solapamiento alto entre la
gineta y micromamíferos dentro y fuera de la época de cría. En el caso del
zorro, este podría presentar un comportamiento más frugívoro en otoño, lo que
evitaría el posible conflicto con la gineta en la competencia por los recursos
tróficos y podría alimentarse de presas más grandes como liebres en primavera,
teniendo en cuenta las necesidades de las crías durante los cuidados parentales
(Barrull y Mate 2015). Esto es quizá más
evidente en otoño, donde el solapamiento temporal es elevado y sus patrones de
actividad son muy similares. Recurriendo a los datos anuales, el solapamiento
del zorro con los micromamíferos es significativamente menor que el de la gineta
con estos. Por lo tanto, la especialización trófica de la gineta sí que parece
ser un medio que permite la coexistencia entre estas dos especies en el área de
estudio.
Aun así, cabe resaltar que el solapamiento que se da entre
el zorro con los micromamíferos es igualmente alto y más o menos constante a lo
largo del año, coincidiendo con otros estudios (Vilella
et al. 2020; Monterroso et al. 2013),
donde se encuentra una alta sincronización de los ritmos de actividad de
diferentes especies de mesocarnívoros con micromamíferos, sugiriendo que en las
especies con una alimentación más generalista (i.e. zorro), estos
micromamíferos pueden también constituir una parte importante de su dieta
cuando este recurso abunda.
De acuerdo con nuestros resultados, los ambientes riparios
juegan un papel fundamental como refugios de diversidad para los
mesocarnívoros, en un contexto donde la alteración humana es intensa, como son
los campos de regadíos intensivos. Además, encontramos que los ritmos de
actividad de las dos especies de mesocarnívoros más comunes en el área (el
zorro y la gineta) y de micromamíferos como potenciales presas, encontramos
evidencias de una coexistencia parcialmente basada en la variabilidad de los
patrones de actividad anuales y estacionales. El solapamiento de los patrones
de actividad entre la gineta y los micromamíferos es mayor que el existente
entre el zorro y los micromamíferos, especialmente en primavera y otoño, cuando
estos últimos muestran una mayor actividad. La variación de los patrones de
actividad entre zorro y gineta a lo largo de las estaciones, así como con sus
presas, puede estar contribuyendo a la coexistencia de estas especies en el
área de estudio. Estudios que contemplen de forma más precisa más dimensiones
que afecten al nicho de estos dos mesocarnívoros (estudios de análisis de dieta
o de solapamiento espacial) contribuirán a un mejor entendimiento de la
coexistencia entre ellas.
Contribución de los autores
Diego L. Fuentes-Lamas: Análisis formal, escritura –
borrador original, escritura – revisión y edición, investigación, software y
visualización. Fernando Silla: escritura - revisión y edición, supervisión.
Jorge Sereno-Cadierno: Conceptualización, análisis formal, escritura - revisión
y edición, metodología y supervisión, software y visualización.
Disponibilidad de los datos
Los datos originales de este trabajo están disponibles en el
siguiente repositorio; Sereno-Cadierno, Jorge (2025). raw camera trap data for
obtaining activity patterns. figshare. Dataset. https://doi.org/10.6084/m9.figshare.28524494.v1.
Financiación, permisos requeridos, potenciales
conflictos de interés y agradecimientos
Xosé Pardavila aportó en un primer momento ideas sobre el
diseño de muestreo y la conceptualización del experimento. César
Llanos-Guerrero participó en algunas jornadas de campo. A Daniel Saldaña, al
que le encantaba saber de todo y le habría encantado saber los resultados de
este trabajo. A María Belén Lamas-Marcos y a Lorenzo Fuentes-de-Antonio, por el
apoyo logístico, sin el cual no hubiera sido posible desarrollar este trabajo.
A Inés María de-Dios-Franco, por su apoyo constante durante la realización trabajo,
tanto en el campo como fuera de este. A lxs dos revisorxs anónimxs que ayudaron
a mejorar este trabajo sustancialmente.
Los autores/as declaran no tener ningún conflicto de
intereses.
Referencias
Ables, E.D. 1969. Activity studies of red foxes in southern Wisconsin. The
Journal of Wildlife Management 145-153. https://doi.org/10.2307/3799662
Agostinelli,
C., Lund, U. 2022. R package 'circular':
Circular Statistics (version 0.4-94). Available at: https://r-forge.r-project.org/projects/circular/.
Azevedo, F.C., Lemos, F.G., Freitas-Junior, M.C., Rocha, D.G., Azevedo, F.C.C.
2018. Puma activity patterns and temporal overlap with prey in a human-modified
landscape at Southeastern Brazil. Journal of Zoology 305, 246–255. https://doi.org/10.1111/jzo.12558
Barrull, J., Mate, I. 2015. El
zorro. Tundra Ediciones, Almenara,
Castellón, España.
Barrull, J., Mate, I., Ruiz-Olmo, J., Casanovas, J.G.,
Gosàlbez, J., Salicrú, M. 2013. Factors
and mechanisms that explain coexistence in a Mediterranean carnivore
assemblage: An integrated study based on camera trapping and diet. Mammalian
Biology 79, 123–131. https://doi.org/10.1016/j.mambio.2013.11.004
Batschelet, E. 1981. Circular statistics in biology. Academic
Press, New York, NY, USA.
Bennie, J.J., Duffy, J.P., Inger, R., Gaston, K.J. 2014. Biogeography of
time partitioning in mammals. Proceedings of the National Academy of
Sciences 111(38), 13727-13732. https://doi.org/10.1073/pnas.1216063110
Brown, J.S.,
Kotler, B.P., Bouskila, A. 2001. Ecology of fear: Foraging games between
predators and prey with pulsed resources. Annales Zoologici Fennici 38,
17.
Burgos, T., Salesa, J., Fedriani, J.M., Escribano-Ávila, G.,
Jiménez, J., Krofel, M., et al. 2023. Top-down and bottom-up effects modulate species co-existence in a
context of top predator restoration. Scientific Reports 13(1), 4170. https://doi.org/10.1038/s41598-023-31105-w
Burton, A.C., Neilson, E., Moreira, D., Ladle, A., Steenweg, R., Fisher, J.T.,
Bayne, E., Boutin, S. 2015. REVIEW: Wildlife camera trapping: a review and
recommendations for linking surveys to ecological processes. Journal of
Applied Ecology 52(3), 675-685. https://doi.org/10.1111/1365-2664.12432
Buskirk, S.W. 1999. Mesocanivores of Yellowstone. In:
Clark, T.W., Curlee A.P., Minta, S.C., Kareiva, P. (ed.), Carnivores in
ecosystems: the Yellowstone experience, pp. 165-187. Yale University Press. New Haven, CT, USA.
Calzada, J. 2007. Genetta genetta (Linnaeus, 1758). Pp. 330-332. En:
Palomo, L.J., Gisbert, J., Blanco, J.C. (eds.). Atlas y libro rojo de los
mamíferos terrestres de España. Dirección General para la Biodiversidad.
SECEM-SECEMU, Madrid, España. 586 pp.
Camps, D. 2008. Activity patterns of adult common genets Genetta genetta
(Linnaeus, 1758) in northeastern Spain. Galemys: Boletín
informativo de la Sociedad Española para la conservación y estudio de los
mamíferos 20(1), 47-60. https://doi.org/10.7325/Galemys.2008.1.A2
Camps, D. 2015. La gineta.
Monografías Zoológicas, Serie Ibérica, vol. 2. Tundra Ediciones, Almenara, Castellón, España.
Camps, D.
2017. Jineta – Genetta genetta. En:
Enciclopedia Virtual de los Vertebrados Españoles. [Recurso en
línea, Accedido el 21/10/2024]. Museo Nacional de Ciencias Naturales, Madrid.
Disponible en: https://www.vertebradosibericos.org/mamiferos/gengen.html
Carter, N., Jasny, M., Gurung, B., Liu, J. 2015. Impacts of people and tigers on leopard
spatiotemporal activity patterns in a global biodiversity hotspot. Global
Ecology and Conservation 3, 149-162. https://doi.org/10.1016/j.gecco.2014.11.013
Cavallini, P., Lovari, S. 1991. Environmental factors influencing the use
of habitat in the red fox, Vulpes vulpes. Journal of Zoology 223(2),
323-339. https://doi.org/10.1111/j.1469-7998.1991.tb04768.x
Croose, E., Duckworth, J.W., Ruette, S., Skumatov, D.V., Kolesnikov, V.V.,
Saveljev, A.P. 2018. A review of the status of the Western polecat Mustela
putorius: a neglected and declining species? Mammalia 82(6),
550-564. https://doi.org/10.1515/mammalia-2017-0092
Descalzo, E., Ruiz, F.D., Delibes-Mateos, M., Salgado, I.,
Jauregui, M.M., Soliño, M., et al. 2021. Update of the Egyptian mongoose (Herpestes ichneumon)
distribution in Spain. Galemys:
Boletín informativo de la Sociedad Española para la conservación y estudio de
los mamíferos, 33(1), 29-38. https://doi.org/10.7325/Galemys.2021.A4
Di Bitetti, M.S., Di Blanco, Y.E., Pereira, J.A., Paviolo, A., Pírez, I.J. 2009. Time partitioning favors the
coexistence of sympatric crab-eating foxes (Cerdocyon thous) and pampas foxes
(Lycalopex gymnocercus). Journal of Mammalogy 90(2),
479-490. https://doi.org/10.1644/08-MAMM-A-113.1
Díaz‐Ruiz, F., Caro, J., Delibes‐Mateos, M., Arroyo, B.,
Ferreras, P. 2015. Drivers of red fox (Vulpes vulpes) daily activity:
prey availability, human disturbance or habitat structure? Journal of
Zoology 298(2), 128-138. https://doi.org/10.1111/jzo.12294
Ferreira-Rodríguez, N., Pombal, M.A. 2019. Bait effectiveness in camera
trap studies in the Iberian Peninsula. Mammal Research 64(2),
155-164. https://doi.org/10.1007/s13364-018-00414-1
Foster, V.C., Sarmento, P., Sollmann, R.,
Tôrres, N., Jácomo, A.T., Negrões, N., Fonseca, C., et al. 2013. Jaguar and
puma activity patterns and predator‐prey interactions in four Brazilian
biomes. Biotropica 45(3), 373-379. https://doi.org/10.1111/btp.12021
Garrote. G., Pérez de
Ayala, R. 2019. Spatial segregation between Iberian lynx and
other carnivores. Animal biodiversity and conservation 42(2),
347-354. ttps://doi.org/10.32800/abc.2019.42.0347
Gortázar, C. 2007. Vulpes vulpes. Zorro. En: Palomo, L.J., Gisbert, J.,
Blanco, J.C. (Eds.). Atlas y Libro Rojo de los Mamíferos Terrestres de
España, pp. 277-279. Dirección General para la Biodiversidad-SECEM-SECEMU,
Madrid, España.
Halle, S., Stenseth, N.C. (Eds.). 2000. Activity Patterns in Small
Mammals: An Ecological Approach; with 11 Tables (Vol. 141). Springer
Science & Business Media. Berlín,
Heidelberg, Dordrecht y Nueva York.
Hardin, G. 1960. The Competitive Exclusion Principle: An idea that took a
century to be born has implications in ecology, economics, and genetics. Science 131(3409),
1292-1297. https://doi.org/10.1126/science.131.3409.1292
Hilty, J.A., Merenlender, A.M. 2004. Use of riparian
corridors and vineyards by mammalian predators in northern California. Conservation Biology 18(1), 126-135. https://doi.org/10.1111/j.1523-1739.2004.00225.x
Jiménez, J., Nuñez-Arjona, J.C., Rueda, C., González, L.M.,
García-Domínguez, F., Muñoz-Igualada, J., López-Bao, J.V. 2017. Estimating
carnivore community structures. Scientific Reports 7(1), 1-10.
https://doi.org/10.1038/srep41036
Jiménez, J., Nuñez-Arjona, J.C., Mougeot, F., Ferreras, P.,
González, L.M., García-Domínguez, F., et al. 2019. Restoring apex predators can reduce mesopredator
abundances. Biological Conservation 238, 108234. https://doi.org/10.1016/j.biocon.2019.108234
Kays, R.W., Slauson, K.M. 2008. Remote cameras. In: Ray, J., Mackay,
P., Long, R.A. (eds.), Noninvasive survey methods for carnivores, pp.
110-140. Island Press. Washington, DC, USA.
Kronfeld-Schor, N., Dayan, T. 2003. Partitioning of time as an
ecological resource. Annual review of ecology, evolution, and
systematics 34(1), 153-181. https://doi.org/10.1146/annurev.ecolsys.34.011802.132435
Lucherini, M., Reppucci, J.I., Walker, R.S., Villalba, M.L., Wurstten, A.,
Gallardo, G., Iriarte, A., et al. 2009. Activity Pattern Segregation of
Carnivores in the High Andes. Journal of Mammalogy 90(6),
1404–1409. http://www.jstor.org/stable/27755147
Malanson, G.P. 1993. Riparian landscapes.
Cambridge University Press. Cambridge,
UK. https://doi.org/10.1017/CBO9780511565434
Matos,
H.M., Santos, M.J., Palomares, F., Santos-Reis, M. 2009. Does riparian habitat condition
influence mammalian carnivore abundance in Mediterranean ecosystems? Biodiversity
and Conservation 18(2), 373-386. https://doi.org/10.1007/s10531-008-9493-2
Meredith, M., Ridout, M. 2021. Package ‘overlap’. https://doi.org/10.32614/CRAN.package.overlap
Miles, V., Woodroffe, R., Donnelly, C.A., Brotherton, P.N., Ham, C.,
Astley, K., Aurélio, J. 2024. Evaluating camera‐based methods
for estimating badger (Meles meles) density: Implications for wildlife
management. Ecological Solutions and Evidence 5(3), e12378. https://doi.org/10.1002/2688-8319.12378
Monterroso, P., Alves, P.C., Ferreras, P. 2013. Catch me if you can: diel
activity patterns of mammalian prey and predators. Ethology 119(12),
1044-1056. https://doi.org/10.1111/eth.12156
Monterroso, P., Alves, P.C., Ferreras, P. 2014.
Plasticity in circadian activity patterns of mesocarnivores in Southwestern
Europe: implications for species coexistence. Behavioral Ecology and Sociobiology 68(9),
1403-1417. https://doi.org/10.1007/s00265-014-1748-1
Monterroso,
P., Alves, P.C., Ferreras, P. 2015. Ecological interactions and species
coexistence in Iberian mesocarnivore communities-extended summary and main
results. Galemys, Spanish J Mammal 27, 47-57. https://doi.org/10.7325/Galemys.2015.A6
Naiman, R.J., Decamps, H., McClain, M.E.
2010. Riparia: ecology, conservation, and management of streamside
communities. Academic Press,
Burlington, VT, USA. https://doi.org/10.1016/B978-0-12-663315-3.X5000-X
O’Brien, T.G. 2011. Abundance, Density and Relative Abundance: A
Conceptual Framework. In: O’Connell, A.F., Nichols, J.D., Karanth, K.U. (eds) Camera
Traps in Animal Ecology, pp. 71-96 Springer, Tokyo. https://doi.org/10.1007/978-4-431-99495-4_6
O’Connell, A.F., Talancy, N.W., Bailey, L.L., Sauer, J.R., Cook, R., Gilbert,
A.T. 2006. Estimating site occupancy and detection probability parameters for
meso- and large mammals in a coastal ecosystem. Journal of Wildlife
Management 70, 1625–1633. https://doi.org/10.2193/0022-541X(2006)70[1625:ESOADP]2.0.CO;2
O’Connell, A.F., Nichols J.D., Ullas Karanth K. 2011. Camera Traps in Animal
Ecology: Methods and Analyses. Springer. https://doi.org/10.1007/978-4-431-99495-4
Palomares, F., Delibes, M. 2000. Mongooses, civets and genets
- carnivores in southern latitudes. In: Halle, S., Stenseth, N.C. (eds.), Activity
Patterns in Small Mammals. An Ecological Approach, pp. 119-130. Springer,
Berlin, Heidelberg, Germany. https://doi.org/10.1007/978-3-642-18264-8_8
Penido,
G., Astete, S., Jácomo, A.T.A., Sollmann, R., Tôrres, N., Silveira, L., Filho,
J.M. 2017. Mesocarnivore
activity patterns in the semiarid Caatinga: Limited by the harsh environment or
affected by interspecific interactions? Journal of Mammalogy 98,
1732–1740. https://doi.org/10.1093/jmammal/gyx119
Prugh, L.R., Stoner, C.J., Epps, C.W., Bean, W.T., Ripple, W.J.,
Laliberte, A.S., Brashares, J.S. 2009. The rise of the mesopredator. Bioscience 59(9),
779-791.
R Core Team 2022. R: A language and
environment for statistical computing. R Foundation for Statistical
Computing, Vienna, Austria. Available at: https://www.R-project.org/.
Reig, S. 2007. Martes foina
Erxleben, 1777. En: Palomo, L.J., Gisbert, J., Blanco, J.C. (eds.). Atlas y
Libro Rojo de los Mamíferos Terrestres de España, pp. 305 – 307. Dirección
General de Biodiversidad-SECEM-SECEMU, Madrid, España.
Revilla, E., Casanovas,
J.G., Virgós, E. 2007. Meles meles (Linnaeus, 1758). En: Palomo, L.J.,
Gisbert, J., Blanco, J.C. (Eds.). Atlas y libro rojo de los mamíferos de
España, pp. 308-311. Dirección General para la Biodiversidad-SECEM-SECEMU,
Madrid, España. 586 pp.
Ridout, M.S., Linkie, M. 2009. Estimating overlap of daily activity
patterns from camera trap data. Journal of Agricultural, Biological,
and Environmental Statistics 14(3), 322-337. https://doi.org/10.1198/jabes.2009.08038
Roemer, G.W., Gompper, M.E., Van Valkenburgh, B. 2009. The ecological role of
the mammalian mesocarnivore. BioScience 59(2), 165-173. https://doi.org/10.1525/bio.2009.59.2.9
Rovero, F., Zimmermann, F., Berzi, D., Meek, P. 2013. " Which camera trap
type and how many do I need?" A review of camera features and study
designs for a range of wildlife research applications. Hystrix, the Italian Journal of Mammalogy 24(2):148-156. https://doi.org/10.4404/hystrix-24.2-8789
Rowcliffe, M. 2021. activity: Animal Activity Statistics. R package
version 1.3.1. https://CRAN.R-project.org/package=activity
RStudio Team 2022. RStudio: Integrated Development Environment for R.
RStudio, PBC, Boston, MA, USA. Available at: http://www.rstudio.com/.
Ruiz-Olmo, J.
2017 Nutria – Lutra lutra. En: López,
P., Martín, J. (Eds.). Enciclopedia Virtual de los Vertebrados Españoles.
[Recurso en línea, Accedido el 21/10/2024]. Museo Nacional de Ciencias
Naturales, Madrid. Disponible en: https://www.vertebradosibericos.org/mamiferos/lutlut.html
.
Sabo, J.L.,
Sponseller, R., Dixon, M., Gade, K., Harms, T., Heffernan, J., et al. 2005.
Riparian zones increase regional species richness by harboring different, not
more, species. Ecology, 86(1), 56-62. https://doi.org/10.1890/04-0668
Sánchez-González,
B., Navarro-Castilla, A., Hernández, M.C., Barja. I. 2016. Ratón de campo – Apodemus
sylvaticus. En: López, P., Martín, J. (Eds.). Enciclopedia Virtual de
los Vertebrados Españoles. [Recurso en línea, Accedido el 02/03/2025].
Museo Nacional de Ciencias Naturales, Madrid. Disponible en: https://www.vertebradosibericos.org/mamiferos/aposyl.html
.
Santos,
M.J., Rosalino, L.M., Matos, H.M., Santos-Reis,
M. 2016. Riparian ecosystem configuration
influences mesocarnivores presence in Mediterranean landscapes. European Journal of Wildlife Research 62, 251–261. https://doi.org/10.1007/s10344-016-0984-2
Santos, F., Carbone, C., Wearn, O.R., Rowcliffe, J.M., Espinosa,
S., Lima, M.G.M., Ahumada, J.A., et al. 2019. Prey availability and temporal
partitioning modulate felid coexistence in Neotropical forests. PloS one 14(3), e0213671. https://doi.org/10.1371/journal.pone.0213671
Santos-Reis, M., Santos, M.J., Lourenço, S., Marques, J.T., Pereira, I., Pinto, B.
2005. Relationships
between stone martens, genets and cork oak woodlands in Portugal.
In: Harrison, D.J., Fuller, A.K., Proulx, G. (eds.), Martens and
fishers (Martes) in human-altered environments, pp. 147-172. Springer, Boston, MA, USA. https://doi.org/10.1007/0-387-22691-5_7
Sebastián-González, E., Morales-Reyes, Z., Naves-Alegre, L., Durá Alemañ, C.J., Gonçalves
Lima, L., Machado Lima, L., Sánchez-Zapata, J.A. 2020. Which bait should I use? Insights from a camera trap
study in a highly diverse cerrado forest. European Journal of Wildlife
Research 66(6), 1-8. https://doi.org/10.1007/s10344-020-01439-1
Servín, J., Rau, J.R., Delibes, M. 1991. Activity pattern of the red fox
Vulpes vulpes in Dońana, SW Spain. Acta Theriologica 36(3-4),
369-373. https://doi.org/10.4098/AT.arch.91-39
Soulé, M.E., Bolger, D.T., Alberts, A.C., Wrights, J., Sorice, M.,
Hill, S. 1988. Reconstructed dynamics of rapid extinctions of chaparral‐requiring birds in urban
habitat islands. Conservation Biology 2(1), 75-92. https://doi.org/10.1111/j.1523-1739.1988.tb00337.x
Tobler, M.W. 2015. Camera
base version 1.7. http://www.atrium-biodiversity.org/tools/camerabase/.
Torre, I., Raspall, A.,
Arrizabalaga, A., Díaz, M. 2018. Weasel (Mustela nivalis)
decline in NE Spain: prey or land use change? Mammal Research 63(4),
501-505. https://doi.org/10.1007/s13364-018-0388-7
Travaini, A., Aldama, J.J., Delibes, M. 1993. Home range and activity
patterns of red fox Vulpes vulpes breeding females. Acta Theriologica
38(4):427-434. https://doi.org/10.4098/AT.arch.93-33
Vazquez, C., Rowcliffe, J.M., Spoelstra, K., Jansen, P.A. 2019. Comparing diel
activity patterns of wildlife across latitudes and seasons: Time
transformations using day length. Methods in Ecology and Evolution 10(12),
2057-2066. https://doi.org/10.1111/2041-210X.13290
Verdade, L.M., Rosalino, L.M., Gheler-Costa, C., Pedroso, N.M., Lyra-Jorge,
M.C. 2011. Adaptation of mesocarnivores (Mammalia: Carnivora) to agricultural
landscapes of Mediterranean Europe and southeastern Brazil: a trophic
perspective. In: Rosalino, L.M., Gheler-Costa, C. (eds.), Middle-Sized
Carnivores in Agricultural Landscapes, pp. 1-38. Nova Science
Publishers, Inc. Hauppauge, NY, USA.
Vilella, M., Ferrandiz‐Rovira, M., Sayol, F. 2020. Coexistence of predators in time: Effects of season and prey
availability on species activity within a Mediterranean carnivore guild. Ecology
and evolution 10(20), 11408-11422. https://doi.org/10.1002/ece3.6778
Virgós, E. 2001.
Relative value of riparian woodlands in landscapes with different forest cover
for medium-sized Iberian carnivores. Biodiversity & Conservation 10(7),
1039-1049. https://doi.org/10.1023/A:1016684428664
Virgos, E., Llorente, M., Cortesa, Y. 1999. Geographical variation in genet (Genetta genetta L.)
diet: a literature review. Mammal Review 29(2), 117–126. https://doi.org/10.1046/j.1365-2907.1999.00041.x
Zhao, G., Yang, H.,
Xie, B., Gong, Y., Ge, J., Feng, L. 2020. Spatio-temporal coexistence of
sympatric mesocarnivores with a single apex carnivore in a fine-scale
landscape. Global Ecology and Conservation 21, 11. https://doi.org/10.1016/j.gecco.2019.e00897
Zielinski, W.J. 1986. Circadian rhythms of small carnivores and the effect
of restricted feeding on daily activity. Physiology & behavior 38(5),
613-620. https://doi.org/10.1016/0031-9384(86)90254-4
Zuberogoitia, I., Zabala, J., Martínez, J.A. 2006. Diurnal activity and observations of the
hunting and ranging behaviour of the American mink (Mustela vison)/Activité
diurne et observations du comportement de chasse et habitat du vison d’Amerique
(Mustela vison). Mammalia 70(3-4), 310-312. https://doi.org/10.1515/MAMM.2006.046
Anexo / Appendix
Tabla A1. Número de
eventos obtenidos de cada especie en cada una de las estaciones del año y sus
totales.
Table A1. Number of events obtained for each species in each season of the
year and their totals.
Tabla A2. Tasa de
captura (expresada como nº eventos/nº cámaras trampas-día) de las especies
objetivo de estudio en cada una de las estaciones del año y en todo el año.
Table A2. Capture rate (expressed as number of events/number of camera
trap-days) of the target species studied in each season of the year and for the
entire year.
![]() , Fernando
Silla2
, Fernando
Silla2 ![]() , Jorge Sereno-Cadierno3,*
, Jorge Sereno-Cadierno3,* ![]()




