Introducción
En enero de 2016 se produjo la entrada en vigor de los 17
Objetivos de Desarrollo Sostenible (ODS) contemplados en la Agenda 2030 de la
Organización de Naciones Unidas (UN General Assembly 2015).
De entre ellos, el ODS 15 busca promover un uso responsable y sostenible de los
ecosistemas terrestres, enfocándose principalmente en combatir la deforestación
y la degradación del suelo, así como en implementar acciones para preservar la
diversidad biológica. No obstante, la pérdida de biodiversidad viene siendo
objeto de preocupación desde décadas anteriores, siendo la introducción de
especies exóticas invasoras una de las principales causas de la pérdida de
biodiversidad, junto con la destrucción de hábitats, la sobreexplotación de
recursos, la contaminación y el cambio climático (SCBD 2006).
Se prevé que el proceso de globalización mundial provoque un
incremento en la dispersión de organismos exóticos fuera de su área de origen.
Por otro lado, los cambios ambientales asociados al cambio climático podrían
facilitar el establecimiento de especies exóticas fuera de su rango nativo (Caravaca et al. 2022a; Lopez et
al. 2022; Osland et al. 2023). El cambio global, entendido como el conjunto de cambios
ambientales globales influenciados por la actividad humana (Camill 2010), puede reducir las
ventajas evolutivas que las especies nativas han alcanzado mediante adaptación
a las condiciones de un hábitat concreto. Esto podría beneficiar a las especies
exóticas invasoras con mayor plasticidad fenotípica o diversidad genética,
generando importantes impactos en la biodiversidad y en el funcionamiento del
ecosistema (Korpelainen y
Pietiläinen 2023).
De
todos los organismos clasificados como invasores en distintas bases de datos,
las plantas son las que cuentan con mayor presencia (Fig.
1). La capacidad de una planta para invadir
un ecosistema, distinto al de su origen, depende de características específicas
propias y del hábitat a colonizar (Richardson
y Pyšek 2006). Entre los rasgos que incrementan
el potencial invasor de una planta, se consideran una rápida capacidad de
crecimiento, una prolífica producción de semillas, la capacidad de reproducirse
tanto sexual como asexualmente (Korpelainen
y Pietiläinen 2023), un tamaño de genoma pequeño
(Guo et al. 2024) la
emisión de sustancias alelopáticas y una alta capacidad para capturar carbono,
entre otras (Godoy et al. 2012; Kato-Noguchi et al.
2014; Meyer et al.
2014). En cuanto a la invasibilidad del
ecosistema a colonizar, entran en juego tanto factores abióticos como bióticos.
Pueden ser de relevancia las características edáficas del suelo, la
disponibilidad de recursos, las condiciones climatológicas o el grado de
alteración del ecosistema, así como la influencia de las especies nativas o la
ausencia de competidores (Gioria et al. 2023).
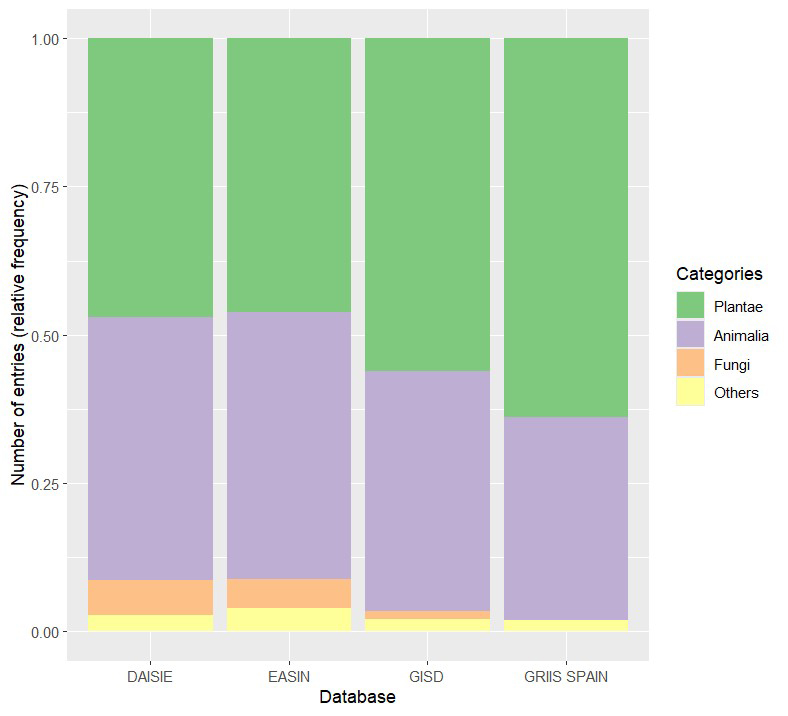
Figura 1. Frecuencias relativas de las
categorías taxonómicas principales representadas en cuatro de las bases de
datos más comunes para especies exóticas e invasoras:“Delivering Alien Invasive
Species Inventories in Europe” (DAISIE); “Global Invasive Species Database”
(GISD); “Global Register of Introduced and Invasive Species” (GRIIS), todas
consultadas vía https://www.gbif.org/; y
European Alien Species Information Network (EASIN, https://easin.jrc.ec.europa.eu/easin).
Figure 1. Relative frequencies of the principal taxonomic categories
represented in four of the most common databases of exotic and invasive
species: “Delivering Alien Invasive Species Inventories in Europe” (DAISIE);
“Global Invasive Species Database” (GISD); and “Global Register of Introduced
and Invasive Species” (GRIIS), all accessed via https://www.gbif.org/, and European Alien Species
Information Network (EASIN, https://easin.jrc.ec.europa.eu/easin).
Entre los factores bióticos
implicados en los procesos de invasión se incluye la relación entre plantas y
microorganismos rizosféricos. Numerosos estudios han confirmado la importancia
de estas relaciones para el rendimiento de la planta y para el funcionamiento y
estabilidad del ecosistema (Hall et al. 2018; Prescott et al. 2019; Osburn et al. 2023). Teniendo en cuenta este precedente, es lógico que,
durante los últimos años, se haya puesto el foco en discernir el papel que la
microbiota rizosférica, entendida como el conjunto de microorganismos que
habitan en la porción de suelo firmemente adherida a las raíces, puede
desempeñar en los procesos de invasión por plantas. Asimismo, el desarrollo de
técnicas de secuenciación masiva que, entre otras funcionalidades, permiten la
obtención de una imagen global de la diversidad y estructura de las comunidades
microbianas edáficas, ha supuesto una poderosa herramienta para abordar el
estudio del papel que los hongos y bacterias rizosféricos, así como los
simbiontes micorrícicos, pueden desempeñar en el éxito de los procesos de
invasión.
El
grupo de investigación “Sostenibilidad de Sistemas Suelo-Planta” del CEBAS-CSIC
ha llevado a cabo varios estudios dirigidos a evaluar el efecto de la invasión
por distintas especies vegetales sobre la composición, estructura y
funcionalidad de las comunidades microbianas de la rizosfera mediante técnicas
de secuenciación masiva tales como el “DNA metabarcoding”, de las regiones rRNA
16S en el caso de las comunidades bacterianas, de la región ITS para las
comunidades de hongos saprófitos o de la región 18S para las comunidades de
hongos micorrícicos arbusculares. En estos trabajos se han incluido, además,
otros factores experimentales que pudieran influir en la variabilidad de dicho
efecto. De esta manera, se han tenido en cuenta ecosistemas con distintas
propiedades edáficas y distinta localización biogeográfica. También se ha
estudiado la microbiota rizosférica durante distintos estados sucesionales del
proceso de invasión, así como posibles escenarios previstos de cambio
climático. Las plantas invasoras que se han estudiado son Carpobrotus edulis
(L.) N.E. Br, Pennisetum setaceum (Forssk.) Chiov., Nicotiana
glauca R.C. Graham y Mirabilis jalapa L., todas ellas
consideradas como invasoras en España y especialmente presentes en los suelos
mediterráneos semiáridos (Fig. 2). A su vez, en estos estudios se han propuesto diversos
mecanismos mediante los cuales el microbioma rizosférico, modificado por la
presencia de las plantas alóctonas, puede favorecer el proceso de invasión. Esta revisión recoge los principales resultados obtenidos
en dichos estudios y su relación con los últimos trabajos publicados en la
materia, así como consideraciones y enfoques para futuras investigaciones.

Figura 2. Especies invasoras estudiadas en los
trabajos del grupo de Sostenibilidad de Sistemas Suelo-Planta (CEBAS-CSIC). Pennisetum
setaceum (Forssk.) Chiov. (A), Nicotiana glauca R.C. Graham (B),
Carpobrotus edulis (L.) N.E. Br (C) y Mirabilis jalapa L.
(D, Fuente: KENPEI, CC BY-SA 3.0 http://creativecommons.org/licenses/by-sa/3.0/,
via Wikimedia Commons).
Figure 2.
Invasive species included in the works of the Group of Sustainability of Soil-Plant Systems
(CEBAS-CSIC) Pennisetum
setaceum (Forssk.) Chiov. (A), Nicotiana
glauca R.C. Graham (B), Carpobrotus edulis (L.) N.E. Br (C) y Mirabilis jalapa L. (D, Fuente:
KENPEI, CC BY-SA 3.0 http://creativecommons.org/licenses/by-sa/3.0/,
via Wikimedia Commons).
Efecto de las plantas invasoras sobre el microbioma
rizosférico en ecosistemas con diferentes propiedades edáficas
Las propiedades físico-químicas y bioquímicas del suelo
pueden tener relevancia en la configuración de la microbiota rizosférica, tal y
como se ha mostrado en numerosos trabajos que incluyen distintos tipos de suelo
y de plantas (Andrew et al. 2012; Berg
et al. 2016; Kim et al. 2016; Nuccio
et al. 2016). Las propiedades edáficas, por tanto, pueden tener influencia
en la manera en que una planta invasora regula o modifica las comunidades
microbianas rizosféricas del hábitat invadido. Del mismo modo, la propia planta
puede modificar las propiedades del suelo, ya sea a través de alteraciones de
la microbiota rizosférica o de manera directa mediante sus exudados radiculares
o la aportación de hojarasca (Xu et al. 2022). Es por
esta razón por lo que consideramos que es de gran importancia incluir en los
análisis variables ambientales relacionadas con las características edáficas
del suelo en el que crece la planta invasora.
A continuación, se recogen los principales resultados
obtenidos al respecto para los casos de las plantas invasoras P. setaceum
y N. glauca. No obstante, a lo largo de esta revisión también se exponen
otros ejemplos con distintas especies invasoras y en los que además de la
variabilidad en las propiedades edáficas se consideran otros factores. De
manera general, las propiedades físico-químicas de los suelos invadidos que se
incluyen en estos estudios son el pH, los contenidos en nitrógeno y carbono
total, el potasio y fósforo disponibles, la conductividad eléctrica, el carbono
orgánico hidrosoluble y la estabilidad de agregados, las cuales pueden tener un
impacto importante en la fertilidad y sostenibilidad de los ecosistemas
edáficos. Como propiedades bioquímicas y biológicas del suelo se analizan las
actividades de enzimas relacionadas con la actividad biológica y con el ciclo
de los principales macronutrientes de las plantas esenciales para su
crecimiento y desarrollo (P y N) tales como la deshidrogenasa, β-glucosidasa,
fosfomonoesterasa alcalina, ureasa, proteasa y la respiración del suelo.
Pennisetum setaceum es una herbácea perenne con
metabolismo C4, tolerante a la sequía y con una gran plasticidad fenotípica en
general (Rahlao et al. 2014). Para el estudio de esta
planta invasora, se seleccionaron cinco localizaciones diferentes en el sureste
español, todas ellas expuestas a clima mediterráneo semiárido y altamente
invadidas por P. setaceum, pero con características edáficas distintas:
un Regosol calcárico, un Solonchak gleico, y tres suelos altamente alterados
por procesos antrópicos. En cada una de las localizaciones también coexistía,
como especie nativa predominante, la también herbácea perenne Hyparrhenia
hirta (L.) Stapf. Para averiguar si existían diferencias entre la
microbiota rizosférica de P. setaceum y la anteriormente dominante pero
ahora desplazada H. hirta se analizaron tantos las comunidades
bacterianas de sus rizosferas como las de hongos micorrícicos en las raíces de
estas plantas (Rodríguez-Caballero et al.
2017; Rodríguez-Caballero et al. 2018).
Por otro lado, también se pretendía evaluar si la posible variabilidad en
dichas comunidades estaba relacionada con los cambios en las propiedades
edáficas del suelo.
Los resultados para
la microbiota bacteriana reflejaban diferencias significativas entre las
comunidades albergadas por la planta invasora con respecto a la nativa, aunque
no había diferencias en cuanto a los índices de alfa diversidad analizados
(Shannon, Pielou y Chao). Con respecto a las propiedades del suelo, se
observaron diferencias debidas al tipo de suelo, pero éstas no diferían en
los suelos procedentes de la rizosfera de la planta invasora con respecto a la
nativa. Sólo el pH y la actividad
de la enzima proteasa, implicada en la liberación de N de fuentes complejas,
aumentaron significativamente en la rizosfera de P. setaceum con
respecto a la de la planta nativa. Este hallazgo podía estar relacionado con
una mayor liberación de compuestos nitrogenados a través de la producción de
una hojarasca con una ratio C/N menor en el caso de la planta invasora (Kourtev et al. 2002; Kuebbing et al. 2014; McLeod et
al. 2016). En estudios recientes se
indica también un efecto sobre el ciclo del nitrógeno mediado por la planta
invasora Megathyrsus maximus (Jacq.)
B.K. Simon & S.W.L. Jacobs(Thomas et al. 2023). La
influencia de la invasora sobre el ciclo del nitrógeno también puede verse
reflejada en el análisis de especies indicadoras llevado a cabo para las
comunidades bacterianas. Este análisis permite encontrar especies que son
características de un tipo concreto de comunidad o grupo (Dufrêne y Legendre
1997). En nuestro caso, varias de las especies indicadoras de la
rizosfera de P.
setaceum estaban relacionadas con procesos pertenecientes al ciclo
del nitrógeno. Por ejemplo, el género indicador más abundante, Ohtaekwangia ha
sido descrito como nitrificante además de productor de sustancias con
propiedades antibióticas y antifúngicas (Okanya et al. 2011; Tabassum et al. 2015),
mientras que los géneros indicadores Opitutus e Hyphomicrobium son
capaces de reducir nitrato a nitrito, y de fijar N2 y realizar la
desnitrificación, respectivamente (Kloos et al. 1995; Chin et al. 2001).
En referencia a las comunidades de hongos micorrícicos
arbusculares, y al contrario de lo que ocurría con las comunidades bacterianas,
no existían diferencias significativas entre las rizosferas de la planta
invasora y de la nativa, siendo ambas similares. De manera coherente a este
resultado, no se encontraron especies indicadoras según el carácter invasor de
la planta. Sin embargo, sí se encontraron diferencias en la composición y
estructura de las comunidades micorrícicas según el tipo de suelo invadido. La
variabilidad observada al respecto se relacionaba con parámetros como el
carbono orgánico total del suelo, la conductividad eléctrica, la respiración
del suelo o las actividades enzimáticas proteasa y ureasa. En distintos
trabajos se han publicado efectos de las invasoras sobre las comunidades de
hongos micorrícicos tanto positivos, como negativos o neutrales (Sun et al. 2022), lo
cual podría explicarse según las semejanzas filogenéticas existentes entre la
planta invasora estudiada y la vegetación nativa con la que se compara (Lanfranco et al. 2018).
En el caso de la invasora N. glauca, una especie de
la familia Solanaceae distribuida ampliamente en regiones semiáridas y con un
fuerte carácter invasor, los estudios realizados revelaron cambios tanto en las
comunidades bacterianas como en las fúngicas (Rodríguez-Caballero
et al. 2020a). Los muestreos se realizaron, de nuevo, en localizaciones con
suelos de distintas características edáficas, todos ellos en la Región de
Murcia: dos Regosoles lépticos con un alto nivel de alteración por el ser
humano, un suelo salino, y un Gipsisol pétrico con alto contenido en yeso. La
planta invasora fue capaz de modificar su microbiota rizosférica con respecto a
la de la flora nativa en todas las localizaciones estudiadas. Esto sugiere una elevada capacidad de alteración de las
comunidades microbianas por parte de la planta invasora, independiente de
las características edáficas de cada lugar invadido. No obstante, en la
microbiota de la rizosfera de N. glauca también se observaba influencia
de las características de cada suelo estando relacionada con la disponibilidad
de potasio del suelo o con la actividad de enzimas como la deshidrogenasa y la
proteasa. El análisis predictivo de las posibles rutas metabólicas implicadas
en la funcionalidad de la microbiota rizosférica de N. glauca indicó un
incremento del metabolismo de los compuestos de carbono y azufre. En los suelos
salinos y yesíferos la planta invasora mostró, sin embargo, un decrecimiento de
la potencial actividad relacionada con el ciclo de nutrientes, lo cual podría
tener un efecto negativo en los ecosistemas invadidos a largo plazo.
El género Aspergillus
(familia Trichocomaceae) fue propuesto como especie indicadora de la rizosfera
de N. glauca. Los hongos pertenecientes a este género tienen reconocida
capacidad para solubilizar el fosfato del suelo (Caravaca
et al. 2005; Mengual et al. 2016; Doilom et al. 2020), lo cual podría promover una mayor
adquisición de fósforo por parte de la planta invasora. En cuanto a las
comunidades bacterianas, se observó una predominancia general de taxones
pertenecientes al orden Actinomycetales, y en particular del género Streptomyces,
como indicadores de la rizosfera de la planta invasora. En la rizosfera de la
invasora Flaveria bidentis (L.) Kuntze también se observó una mayor
abundancia de este género con respecto a la flora nativa (Song
et al. 2017). Recientemente, además, se ha analizado el potencial del
género Streptomyces como herramienta de control biológico debido a su
capacidad para producir compuestos antimicrobianos (Khan et
al. 2023). Esto podría suponer un claro beneficio para la planta invasora y
podría ser la explicación por la que el único indicador fúngico para la
rizosfera de la flora nativa sea el hongo patógeno Didymella
phacae, lo cual sugiere que este hongo no es capaz de parasitar a la
planta invasora.
Efecto de las plantas invasoras sobre el microbioma
rizosférico en ecosistemas con distinta localización biogeográfica
Algunas plantas
invasoras son capaces de colonizar hábitats muy alejados geográficamente entre
sí. Es el caso de C. edulis, una suculenta perenne, originaria de
Sudáfrica, que está presente en ecosistemas costeros repartidos por hasta 24
países distintos (GBIF
2023; GISD 2023). Con el objetivo de averiguar si C. edulis es capaz de
seleccionar una microbiota rizosférica diferente a la de la flora nativa
(considerando muestras compuestas, formadas por el suelo rizosférico procedente
de distintas especies locales vegetales) en una variedad de hábitats de
diferente distribución geográfica, se llevó a cabo un estudio en el que se
compararon las comunidades microbianas de la rizosfera según el carácter
invasor de la planta y según su biogeografía. Para el
análisis metagenómico de las secuencias se siguió una aproximación mediante la
construcción de OTUs (unidades taxonómicas operativas) (Rodríguez-Caballero
et al. 2020b) y también mediante
la generación de ASVs (variantes de secuencias de amplicones) (Caravaca et al.
2022b). Se seleccionaron siete localizaciones donde
realizar los muestreos, tanto de C. edulis como de la vegetación
autóctona de cada zona: Valparaíso (Chile), Almería (España), La Llana (España)
El Prat de Llobregat (España) y Túnez (Túnez), todas ellas sometidas a clima
mediterráneo; mientras que como localizaciones de clima atlántico se seleccionaron
lugares de muestreo en Santoña (España) y Cádiz (España). Los resultados
obtenidos tras las secuenciación y generación de OTUs/ASVs mostraron que había
diferencias significativas en la composición y estructura de la microbiota
rizosférica según el carácter invasor de la planta y también dependientes de la
localización geográfica de las muestras. Estas diferencias eran patentes tanto
para las comunidades de bacterias como para las de hongos, independientemente
de la aproximación utilizada. Sin embargo, la
resolución alcanzada mediante la construcción de ASVs fue mayor que con la
aproximación de OTUs, obteniéndose una mayor riqueza taxonómica y una
descripción más completa de las comunidades microbianas rizosféricas. En el
caso de los ASVs, además, se pudo corroborar que las comunidades bacterianas y
fúngicas procedentes de la planta invasora eran distintas de las procedentes de
la flora nativa en todas las localizaciones estudiadas (Fig. 3). También se han registrado cambios en la
estructura y funcionalidad de la comunidad bacteriana como consecuencia de la
invasión de C. edulis en las dunas costeras, empleando la técnica de
PCR-DGGE (Souza-Alonso
et al. 2022).
Tras la realización de un análisis de especies indicadoras
para las comunidades fúngicas (Rodríguez-Caballero
et al. 2020b), se detectaron como indicadores de la rizosfera de C.
edulis varios miembros del género Aspergillus. Este género fúngico
se había detectado en estudios realizados con la invasora N. glauca,
como se ha indicado anteriormente (Rodríguez-Caballero
et al. 2020a) y se relaciona con procesos de solubilización de fosfato en
el suelo (Caravaca et al. 2005; Mengual et al. 2016; Doilom et
al. 2020). En cuanto a las comunidades bacterianas
rizosféricas, la familia Methylocystaceae fue propuesta como indicadora
de la rizosfera de C. edulis. Miembros de esta familia tienen la
capacidad de fijar nitrógeno en un proceso dependiente de la oxidación de
metano (Cui et al. 2022), lo cual produce un
enriquecimiento nutricional de la rizosfera en compuestos nitrogenados que
beneficiaría a la planta invasora.
Al realizar un análisis de correspondencias canónicas (CCA),
la variabilidad en la composición y estructura de las comunidades microbianas,
especialmente en bacterias, seguía patrones biogeográficos, de tal manera que
podía observarse cómo estaba fuertemente relacionada con los gradientes de
latitud y precipitación anual media para las distintas localizaciones. Para las
comunidades fúngicas la relación con este último parámetro era más importante
que la distancia geográfica, de manera análoga a como se había reportado
previamente en otros trabajos (Glynou et al. 2016).
Con respecto a las propiedades edáficas de los suelos invadidos, el CCA también
reveló la relación entre la variabilidad en la estructura de la microbiota
rizosférica y la variabilidad de parámetros como la concentración de potasio y
fósforo disponibles en el suelo, o los carbohidratos hidrosolubles, según la
localización o el carácter invasor de la planta. C. edulis produjo
cambios en las actividades enzimáticas del suelo y en parámetros como la
respiración del suelo, pero no se pudo observar un patrón concreto que se
repitiera en todas las localizaciones, lo cual coincidía con otros estudios
como el de Novoa et al. 2014. La variabilidad en la
respuesta de la microbiota rizosférica de C. edulis, dependiente de las
características del lugar invadido y relacionada con las condiciones
ambientales locales, se ha corroborado en estudios posteriores como el de Canini et al. (2024) y se ha observado también en
trabajos realizados con otras especies invasoras (Kamutando
et al. 2017; Farrer et al. 2021).
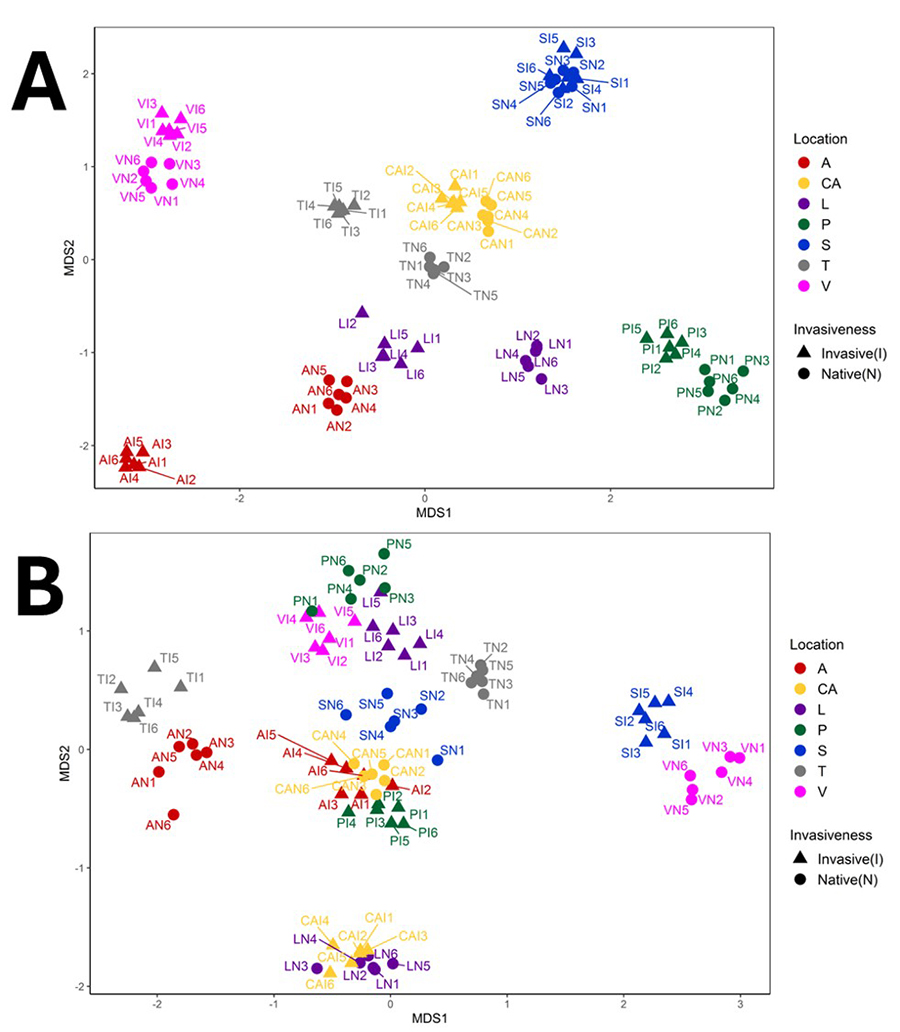
Figura 3. Gráfico de ordenación NMDS
(Bray-Curtis), basado en los ASVs generados para las comunidades bacterianas (A)
o fúngicas (B) de la rizosfera de la planta invasora C. edulis y
de la flora nativa en siete ecosistemas costeros localizados en diferentes
regiones biogeográficas (datos publicados en Caravaca
et al. 2022b).
Figure 3. NMDS ordination plot (Bray-Curtis) dissimilarity matrix based on
the ASVs dataset generated for the bacterial (A) or fungal (B) communities from the rhizosphere of the invasive plant C. edulis and native flora in coastal
ecosystems located in different biogeographical regions (data published in Caravaca et al. 2022b).
Por otro lado, cuando se llevó a cabo un análisis predictivo
de la distribución de distintos grupos funcionales en las comunidades fúngicas
de C. edulis con respecto a las de la vegetación nativa, se observó una
predominancia de los patógenos y saprófitos en la rizosfera de la invasora.
Esto puede estar relacionado con la hipótesis de que una planta invasora es
capaz de acumular microorganismos patógenos que afecten negativamente a la
vegetación autóctona del ecosistema invadido (Hierro et
al. 2005), y se ha podido observar también en experimentos llevados a cabo
con las invasoras Chromolaena odorata (L.) R.M. King & H. Rob.(Mangla et al. 2008), Alliaria petiolata (M.Bieb.)
Cavara & Grande(Duchesneau
et al. 2021), Phragmites australis (Cav.) Trin. ex
Steud. (Schroeder et al. 2020) y Cirsium
arvense (L.) Scop. (Eberly et al. 2024).
En cuanto al análisis funcional predictivo para las
comunidades bacterianas, se detectó en la planta invasora una mayor abundancia
de rutas metabólicas relacionadas con la biodegradación de compuestos orgánicos
de distinto grado de complejidad, así como de enzimas implicadas en el ciclo
del nitrógeno, del fósforo y, en general, de la degradación de la materia
orgánica. También se encontraron rutas asociadas a la producción y reserva de
energía a través de la biosíntesis de lípidos y carbohidratos, siendo de
especial relevancia para este último la biosíntesis de almidón. Todo ello
conduce a pensar que C. edulis es capaz de fomentar especies bacterianas
en su rizosfera que conduzcan a un mayor aprovechamiento de los recursos
nutricionales del suelo. Es también destacable la presencia de rutas
metabólicas implicadas en la síntesis de compuestos antibacterianos, como
estreptomicina o quinolonas, sólo en la rizosfera de la planta invasora, lo
cual sugiere que C. edulis podría estar ejerciendo una presión selectiva
sobre la microbiota edáfica de los ecosistemas invadidos. Por último, según la
composición de la microbiota bacteriana de la planta invasora también se
predijo una mayor producción de los nucleótidos ppGpp y pppGpp, para los cuales
se ha descrito su posible implicación en mecanismos de resistencia a
condiciones ambientales desfavorables como el estrés nutricional (Das y Bhadra 2020).
Efecto del estado sucesional de las plantas invasoras
sobre el microbioma rizosférico en ecosistemas con diferentes propiedades
edáficas
Otra de las preguntas que se pueden plantear sobre el
proceso de invasión es si la interacción de las plantas invasoras con respecto
a las comunidades microbianas edáficas varía en el transcurso de la invasión.
Para contrastar esta hipótesis se llevó a cabo un estudio en el que se
compararon las comunidades de hongos micorrícicos arbusculares (HMA) que
colonizaban las raíces de la planta invasora N. glauca analizando
ejemplares de distinta edad (uno o 20 años, aproximadamente) con respecto a las
comunidades de HMA de la vegetación nativa de cuatro localizaciones distintas (Caravaca et al. 2020). Este diseño experimental
permitió comprobar, por un lado, si la interacción entre N. glauca y las
comunidades de HMA dependían de la etapa del desarrollo en la que se encontraba
la planta invasora mientras que también se analizó si existía variabilidad
dependiente de las características bióticas y abióticas de los cuatro
ecosistemas invadidos que se contemplaron. El análisis metagenómico llevado a
cabo reveló diferencias significativas entre las comunidades de HMA procedentes
de los ejemplares jóvenes de N. glauca con respecto a las comunidades de
la flora nativa. Sin embargo, estas diferencias no se encontraron cuando se
analizó el sistema radicular de la planta invasora pasados 20 años desde su
establecimiento en el ecosistema invadido. Tal y como se explicó anteriormente,
esta similitud encontrada entre las comunidades de HMA de la planta invasora
con respecto a las de la vegetación nativa ya se observó cuando se estudió la
rizosfera de ejemplares plenamente desarrollados de P. setaceum con
respecto a ejemplares de la especie nativa y concurrente, H. hirta, en
la misma etapa de desarrollo (Rodríguez-Caballero
et al. 2018). Estos resultados podrían indicar que la planta invasora se
asocia inicialmente con especies de HMA que favorecen su establecimiento y
supervivencia en estadios tempranos de desarrollo en los que es más vulnerable
(Caravaca et al. 2003; Querejeta
et al. 2006), lo cual concuerda con otros trabajos en los que, tras
monitorizar las comunidades de HMA de una especie vegetal concreta, se han
observado patrones de sucesión y variación en la composición de las mismas a lo
largo del tiempo (Hart et al. 2001; Gao
et al. 2019; Qiao et al. 2022). Como especies
indicadoras de las rizosferas de las plantas nativas o de las de N. glauca
adultas se encontraron dos especies de Glomus, siendo Glomus
VeGlo18 la especie más abundante en el conjunto de secuencias analizadas.
Por otro lado, la composición y estructura de las
comunidades micorrícicas también variaba dependiendo de si las rizosferas
estudiadas procedían de un ecosistema u otro y de sus características edáficas
(Rodríguez-Caballero et al. 2018), siendo
especialmente relevante su relación con la conductividad eléctrica del suelo.
También se observó una alteración de algunas propiedades físico-químicas y
biológicas del suelo tras el establecimiento de la planta invasora,
independientemente de la etapa de desarrollo en la que se encontrase. Así, se
produjo un descenso de la actividad deshidrogenasa en la rizosfera de N.
glauca así como una disminución de la respiración basal del suelo y, de
manera general, también se observó un efecto negativo en otras enzimas
implicadas en los procesos de mineralización de la materia orgánica
relacionados con los ciclos del nitrógeno, carbono y fósforo. Estas actividades
enzimáticas están estrechamente ligadas a los procesos metabólicos llevados a
cabo por la microbiota rizosférica y los cambios descritos en ellas pueden
deberse a alteraciones en las comunidades de HMA pero también de bacterias y
hongos saprófitos.
Efecto de las plantas invasoras sobre el microbioma
rizosférico en ecosistemas sometidos a condiciones simuladas de cambio
climático
Los cambios ambientales globales a los que nos enfrentamos
pueden afectar a los procesos de invasión e incluso en algunas situaciones
facilitarlos (Dukes y Mooney 1999; Dai et al. 2022). En el caso del aumento de la
concentración de CO2 atmosférico, los efectos sobre las comunidades
vegetales podrían ser consecuencia no sólo de la influencia de este gas de
efecto invernadero sobre el clima (Stachowicz et al.
2002; Bradley et al. 2010), sino también debidos
al propio incremento de este compuesto en la atmósfera (Bradley
et al. 2010). El incremento de CO2 atmosférico puede suponer una
ventaja para las plantas alóctonas invasoras con metabolismo C3 (Poorter y Navas 2003). Niveles elevados de CO2
aumentan la abundancia de carbono en la raíz de la planta con el
consiguiente incremento de la liberación de fotosintatos al suelo, de tal
manera que su contenido en carbono orgánico puede aumentar alrededor de un 20%.
Esto conlleva un efecto sobre la microbiota rizosférica, incrementándose no
sólo su biomasa o su tasa de respiración sino también produciendo cambios en su
diversidad y estructura (Tariq et al. 2024).
Con el objetivo de conocer si el incremento de CO2
atmosférico afecta a la función que la microbiota rizosférica desempeña en los
procesos de invasión vegetal, se llevó a cabo un experimento de mesocosmos,
bajo condiciones controladas, en el que se consideraron tres factores
experimentales: se cultivaron dos especies invasoras (N. glauca y M. jalapa),
con exposición a dos niveles de CO2 distintos (nivel ambiental
actual, 410 ppm; y nivel elevado previsto, 760 ppm) y, como sustrato, se
utilizaron cinco suelos semiáridos con características edáficas distintas
(salino, margoso, yesífero, forestal y un suelo altamente alterado por procesos
antrópicos) (Caravaca et al. 2022a).
Los resultados obtenidos
mostraron que sólo en el caso de N. glauca el incremento de CO2 produjo
un efecto beneficioso en la biomasa foliar de la planta (Fig.
4). Este efecto positivo era, de hecho, más pronunciado en los suelos
margosos y yesíferos con respecto a los mismos casos para M. jalapa.
Ambas plantas fijan CO2 mediante la ruta metabólica C3. Sin embargo,
N. glauca es considerada como una invasora de carácter mucho más
agresivo que M. jalapa (Sanz Elorza et al.
2004; Florentine et al. 2016). Con respecto a
la microbiota rizosférica, se encontró un efecto significativo del tipo de
planta invasora y del tipo de suelo sobre la composición y estructura de las
comunidades tanto bacterianas como fúngicas. La búsqueda de especies
indicadoras para cada especie invasora generó un mayor número de bacterias y
hongos indicadores en la rizosfera de N. glauca, siendo las especies
bacterianas Bacillus simplex y Phormidiaceae
cyanoabcterium 11P sus indicadoras más abundantes. Estas especies tienen
actividad antifúngica y antimicrobiana respectivamente (Soltani et al. 2005; Schwartz
et al. 2013). Además, B. simplex, que ha sido descrita como bacteria
promotora del crecimiento vegetal (Schwartz et al. 2013),
también puede promover la formación de agregados en suelos salinos (Kucuk 2020). El género bacteriano Skermanella se
obtuvo como indicador de la rizosfera de M. jalapa. La presencia de este
organismo está relacionada con niveles más altos de ácido gamma-aminobutírico (Badri et al. 2013), cuya producción por la planta es
estimulada por la presencia de HMA (Okada y
Matsubara 2012; Saia et al. 2015). En cuanto a las
comunidades fúngicas, cabe destacar la presencia de Mortierella alpina como
indicadora de la rizosfera de N. glauca. Esta especie es un hongo
oleaginoso que induce resistencia en la planta huésped contra patógenos
mediante la producción y liberación de ácido araquidónico (Wani
et al. 2017).
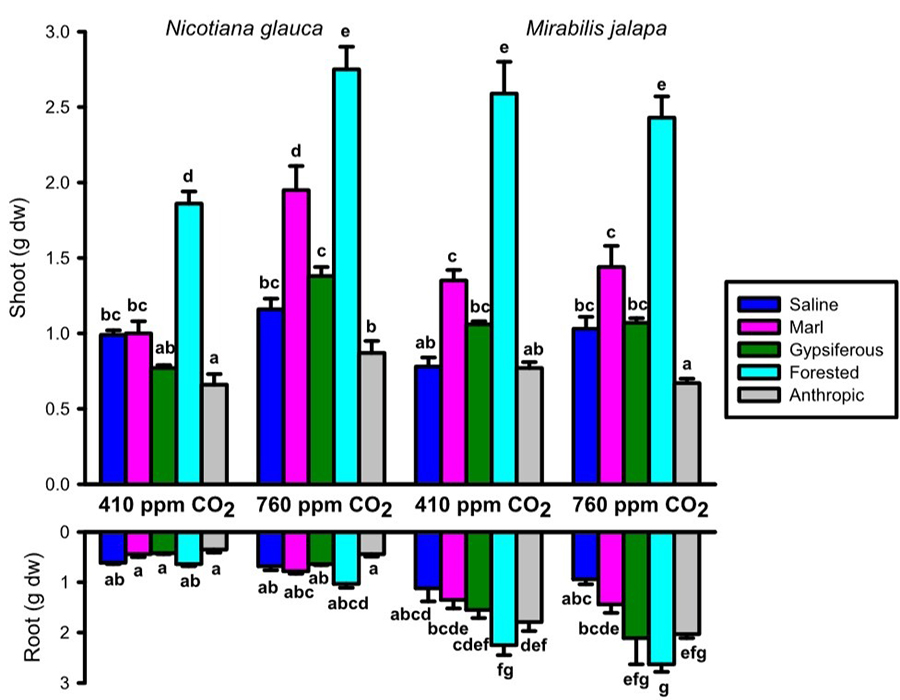
Figura 4. Biomasa
foliar y radicular de ejemplares de N. glauca y M. jalapa
cultivados en cinco suelos diferentes y expuestos a dos niveles diferentes de
CO2 atmosférico. Para cada especie vegetal y parámetro de
crecimiento, los valores representados por las barras que contienen la misma
letra no diferían significativamente entre sí, de acuerdo con el test Tukey-HSD
(p < 0.05) realizado (datos publicados en Caravaca
et al. 2022a).
Figure 4. Foliar and root biomass of N. glauca and M. jalapa specimens grown in five different soils and exposed to two
different atmospheric CO2 levels. For each plant species and growth
parameter, the values represented by bars with the same letter did not differ
significantly from each other, according to the Tukey-HSD test (p < 0.05)
performed (data published in Caravaca et al. 2022a).
Por otro lado, y solo en el caso de las bacterias, el factor
“nivel de CO2” produjo un efecto en dichas comunidades, pero
únicamente cuando se consideraba su interacción con el factor “tipo de suelo” o
con el factor “especie de planta invasora”, siendo las diferencias únicamente
significativas cuando se comparaban las rizosferas de N. glauca
expuestas a los dos niveles de CO2 para todos los suelos excepto el
margoso. En estudios posteriores, como el de Liu et al.
(2023), se observaron cambios en las comunidades rizosféricas, en este caso
de hongos micorrícicos arbusculares, cuando la planta crecía expuesta a niveles
elevados de CO2, pero estos cambios eran también dependientes de la
especie vegetal hospedadora, puesto que se observaron en la rizosfera de trigo,
pero no así en la de maíz. Como especies indicadoras de las rizosferas
expuestas al nivel elevado de CO2 se obtuvieron los géneros
bacterianos Sphingomonas, Stenotrophobacter y Gaiella, los
cuales eran más abundantes en las rizosferas de N. glauca que en las de M.
jalapa. Stenotrophobacter es una bacteria
quimiorganotrofa aerobia capaz de utilizar sustratos como el protocatecuato
procedente de la despolimerización de sustancias húmicas y otros hidrocarburos
de cierta complejidad (Ryu et al. 2021; Dai et al. 2024). De manera análoga, Gaiella y
Sphingomonas son géneros bacterianos asociados con la degradación de
materia orgánica de naturaleza recalcitrante, como la lignocelulosa y los
hidrocarburos poliaromáticos, respectivamente (Leys et al.
2004; Zhang et al. 2019). La predominancia de
estos géneros bacterianos en la rizosfera de plantas que han crecido bajo
niveles elevados de CO2 podría estar relacionada con el aumento de
la biomasa radicular de N. glauca y, en consecuencia, con una mayor
secreción radicular de compuestos orgánicos biodisponibles que se produjo bajo
estas condiciones. En cuanto a los indicadores fúngicos de las plantas
expuestas a elevado CO2 destacó Mycosphaerella
tassiana, particularmente abundante en la rizosfera de M. jalapa.
Este hongo fitopatógeno ha sido considerado como persistente pese a ser
sometido a las condiciones previstas de cambio climático (Wahdan et al. 2020).
Los resultados del trabajo de Caravaca
et al. (2022a) también demuestran, una vez más, que la variabilidad
observada, tanto en las comunidades de hongos como de bacterias, se relaciona
con cambios en las propiedades edáficas de los suelos estudiados. En este
sentido, la concentración de potasio disponible y el grado de estabilidad de
los agregados guardaban relación con la composición de las comunidades fúngicas
mientras que la composición de las comunidades bacterianas se relacionaba,
además, con los niveles de enzimas hidrolíticas asociadas a los ciclos del
fósforo y nitrógeno o con el contenido en carbono orgánico total. En un estudio
más reciente, llevado a cabo por Jin et al. (2022)
también se observó que niveles elevados de CO2 atmosférico no sólo
produjeron modificaciones sobre las comunidades microbianas en la rizosfera de Triticum
aestivum. L. sino que, además, estos cambios favorecieron la mineralización
y biodisponibilidad del fósforo del suelo. Jin et al. (2022)
también reportan en su trabajo una presencia predominante de las rutas
metabólicas relacionadas con la biosíntesis de precursores de RNA/DNA en las
comunidades bacterianas expuestas a elevado CO2. Esto coincide
con los resultados de Caravaca et al. (2022a) en
los que, tras el mismo análisis predictivo mediante PICRUST (Douglas et al. 2020), se observó igualmente un aumento
significativo de las rutas metabólicas relacionadas con la síntesis de
nucleósidos y nucleótidos, compuestos en los que el fósforo es un constituyente
esencial.
Conclusiones
En los trabajos recogidos en esta
revisión se ha puesto de manifiesto el papel modulador que ejercen distintas
especies vegetales alóctonas con carácter invasor sobre la microbiota
rizosférica en el ecosistema invadido. Si bien cada suelo estudiado se caracterizaba
por su propia microbiota debido a las características edáficas del mismo, todas
las especies invasoras analizadas albergaban comunidades rizosféricas
bacterianas significativamente distintas a las de la flora nativa en cuanto a
su composición, estructura y funcionalidad. De manera análoga, las plantas
invasoras también eran capaces de modificar las comunidades rizosféricas de
hongos saprófitos en los casos estudiados. Sin embargo, cuando se estudiaron
las comunidades de hongos micorrícicos arbusculares (HMA) no se observó ningún
cambio en estas comunidades en respuesta a la presencia de las invasoras P.
setaceum y N. glauca, salvo en el caso de esta última, donde
sí se notaron diferencias cuando se compararon las raíces de plántulas jóvenes
con las de la flora nativa. Esto podría indicar que
los HMA juegan un papel determinante en las primeras fases del establecimiento
de la planta invasora en el ecosistema invadido mientras que las modificaciones
producidas en las comunidades de hongos saprófitos y bacterias son de carácter
permanente, y parecen ir encaminadas a una mejora en la obtención de nutrientes
mediante la optimización de ciclos como el del nitrógeno, carbono o fósforo,
así como a promover mecanismos de defensa frente al estrés biótico y abiótico
en la rizosfera de la planta.
Por otro lado, se ha comprobado
que las diferencias observadas en la microbiota rizosférica entre planta
invasora y nativa es también dependiente de parámetros globales como las
variables geográficas, en particular la latitud, así como de variables climáticas,
específicamente la precipitación anual media de los ecosistemas invadidos.
Además, algunos cambios globales como el incremento previsto de CO2 atmosférico,
pueden tener influencia sobre la regulación que la planta invasora establece
sobre la microbiota edáfica, particularmente en plantas invasoras muy
agresivas. En esta línea y de cara a futuras investigaciones, creemos necesario
incluir la influencia que otros factores ambientales relacionados con el cambio
climático, tales como el incremento de la temperatura o la menor disponibilidad
de recursos hídricos, puedan tener sobre las relaciones establecidas entre la
planta invasora y la microbiota edáfica.
El impacto que una planta invasora
es capaz de generar sobre el ecosistema invadido queda patente en los
resultados obtenidos en estos estudios en los que se ponen de manifiesto las
alteraciones que la especie invasora genera sobre las propiedades edáficas y
microbiológicas del suelo de manera directa o a través de la modificación de la
microbiota rizosférica. Estos hallazgos refuerzan la necesidad de proteger los
ecosistemas semiáridos de la invasión de plantas exóticas, no solo para
preservar su biodiversidad y funcionalidad, sino también para garantizar su
resiliencia frente a las presiones ambientales futuras. En nuestros estudios se
ha utilizado una aproximación metagenómica enfocada al análisis de la
biodiversidad microbiana de los suelos rizosféricos, mientras que los análisis
de la funcionalidad de las comunidades microbianas se han abordado mediante
métodos predictivos sobre los anteriores resultados. No obstante, dada la
implicación comprobada de la microbiota rizosférica en los procesos de invasión
vegetal, creemos necesario seguir ampliando el conocimiento de las relaciones
planta-microorganismo en este sentido mediante aproximaciones multiómicas que
combinen técnicas como la metagenómica shotgun, metatranscriptómica,
metaproteómica o metabolómica para alcanzar una caracterización funcional
completa de rutas y mecanismos implicados en el proceso de invasión.
Contribución de los autores
G. Rodríguez-Caballero: Conceptualización, Preservación
de datos, Análisis formal, Visualización, Redacción - preparación del borrador
original, Validación. A. Roldán: Conceptualización, Administración del
proyecto, Adquisición de fondos, Recursos, Redacción - revisión y edición,
Supervisión. F. Caravaca: Conceptualización, Investigación, Análisis
formal, Recursos, Administración del proyecto, Supervisión, Redacción -
revisión y edición.
Disponibilidad de los datos
Los ficheros con las
secuencias analizadas en los trabajos de los propios autores de este artículo
de revisión se encuentran depositados en el repositorio público “NCBI
Sequence Read Archive” (www.ncbi.nlm.nih.gov/sra) y pueden ser consultados a través de los siguientes
códigos: BioProject PRJNA521301 (Caravaca et al. 2020), BioProject PRJNA312563 (Rodríguez-Caballero et al. 2017), BioProject PRJNA386742 (Rodríguez-Caballero
et al. 2018), BioProject PRJNA437444
(Rodríguez-Caballero
2020a) and BioProject PRJNA472435 (Rodríguez-Caballero
2020b).
Financiación, permisos requeridos, potenciales
conflictos de interés y agradecimientos
Los trabajos realizados por los propios autores de
este artículo de revisión han sido financiados a través de los Proyectos del
Plan Nacional Español – FEDER con las referencias CGL-2015-64168-R (Rodríguez-Caballero
et al. 2017; Rodríguez-Caballero
et al. 2018), RTI2018-094731-B-I00 (Caravaca et al. 2020; Rodríguez-Caballero 2020a; Rodríguez-Caballero 2020b; Caravaca et al. 2022a; Caravaca et al. 2022b).
Los
autores/as declaran no tener ningún conflicto de intereses.
Referencias
Andrew, D., Fitak, R.,
Munguia-Vega, A., Racolta, A., Martinson, V., Dontsova, K. 2012. Abiotic factors shape microbial diversity in sonoran desert soils. Applied
and Environmental Microbiology 78: 7527-7537. https://doi.org/10.1128/AEM.01459-12
Badri, D., Chaparro, J., Zhang, R., Shen, Q., Vivanco, J. 2013.
Application of natural blends of phytochemicals derived from the root exudates
of Arabidopsis to the soil reveal that phenolic-related compounds
predominantly modulate the soil microbiome. Journal of Biological Chemistry
288: 4502-4512. https://doi.org/10.1074/jbc.M112.433300
Berg, G., Rybakova, D., Grube, M., Köberl, M. 2016. The plant microbiome
explored: implications for experimental botany. Journal of Experimental
Botany 67: 995-1002. https://doi.org/10.1093/jxb/erv466
Bradley, B., Blumenthal, D., Wilcove, D., Ziska, L. 2010. Predicting plant
invasions in an era of global change. Trends in Ecology and Evolution
25: 310-318. https://doi.org/10.1016/j.tree.2009.12.003
Camill, P. 2010. Global Change. Nature Education Knowledge 3: 49.
Canini, F., Borruso, L., Magrini,
S., D’Acqui, L., Buzzini, P., Cavallini, G., Zucconi, L. 2024. Soil microbial communities dynamics in response to invasive
groundcover Carpobrotus: Insights into native species interactions and
edaphic influence. Applied Soil Ecology 202: 105537. https://doi.org/10.1016/j.apsoil.2024.105537
Caravaca, F., Figueroa, D., Roldán, A., Azcón-Aguilar, C. 2003. Alteration in rhizosphere soil properties of afforested Rhamnus
lycioides seedlings in short-term response to mycorrhizal inoculation with Glomus
intraradices and organic amendment. Environmental Management
31: 412-420. https://doi.org/10.1007/s00267-002-2879-0
Caravaca, F., Alguacil, M.,
Azcón, R., Parladé, J., Torres, P., Roldán, A. 2005. Establishment
of two ectomycorrhizal shrub species in a semiarid site after in situ amendment
with sugar beet, rock phosphate, and Aspergillus niger. Microbial
Ecology 49: 73-82. https://doi.org/10.1007/s00248-003-0131-y
Caravaca, F.,
Rodríguez-Caballero, G., Campoy, M., Sanleandro, P., Roldán, A. 2020. The invasion of semiarid Mediterranean sites by Nicotiana glauca
mediates temporary changes in mycorrhizal associations and a permanent decrease
in rhizosphere activity. Plant and Soil 450: 217-229. https://doi.org/10.1007/s11104-020-04497-1
Caravaca, F., Torres, P., Díaz, G., Roldán, A. 2022a. Elevated CO2
affects the rhizosphere microbial community and the growth of two invader plant
species differently in semiarid Mediterranean soils. Land Degradation and
Development 33: 117-132. https://doi.org/10.1002/ldr.4133
Caravaca, F., Torres, P., Díaz, G., Roldán, A. 2022b. Elevated functional
versatility of the soil microbial community associated with the invader Carpobrotus
edulis across a broad geographical scale. Science of the Total
Environment 813: 152627. https://doi.org/10.1016/j.scitotenv.2021.152627
Chin, K., Liesack, W., Janssen, P. 2001. Opitutus terrae gen nov,
sp nov, to accommodate novel strains of the division «Verrucomicrobia»
isolated from rice paddy soil. International Journal of Systematic and
Evolutionary Microbiology 51: 1965-1968. https://doi.org/10.1099/00207713-51-6-1965
Cui, J., Zhang, M., Chen, L., Zhang, S., Luo, Y., Cao, W., Zhao, J., et
al. 2022. Methanotrophs contribute to nitrogen fixation in emergent
macrophytes. Frontiers in Microbiology 13: 851424. https://doi.org/10.3389/fmicb.2022.851424
Dai, Z., Zhu, B., Wan, J., Rutherford, S. 2022. Editorial: global
changes and plant invasions. Frontiers in Ecology and Evolution 10: 845816.
https://doi.org/10.3389/fevo.2022.845816
Dai, N., Yao, D., Li, Y., Xie, H., Hu, Z., Zhang, J., Liang, S. 2024.
Enhanced adaptability of pyrite-based constructed wetlands for low carbon to
nitrogen ratio wastewater treatments: Modulation of nitrogen removal mechanisms
and reduction of carbon emissions. Bioresource Technology 395: 130348. https://doi.org/10.1016/j.biortech.2024.130348
Das, B., Bhadra, R. 2020. (p)ppGpp metabolism and antimicrobial resistance in
bacterial pathogens. Frontiers in Microbiology 11: 563944. https://doi.org/10.3389/fmicb.2020.563944
Doilom, M., Guo, J., Phookamsak, R., Mortimer, P., Karunarathna, S., Dong,
W., Liao, C., et al. 2020. Screening of phosphate-solubilizing fungi from air
and soil in Yunnan, china: four novel species in Aspergillus, Gongronella,
Penicillium, and Talaromyces. Frontiers in Microbiology
11: 585215. https://doi.org/10.3389/fmicb.2020.585215
Douglas, G., Maffei, V., Zaneveld, J., Yurgel, S., Brown, J., Taylor, C.,
Huttenhower, C., Langille, M. 2020. PICRUSt2 for prediction of metagenome
functions. Nature Biotechnology 38: 685-688. https://doi.org/10.1038/s41587-020-0548-6
Duchesneau, K., Golemiec, A., Colautti, R., Antunes, P. 2021. Functional
shifts of soil microbial communities associated with Alliaria petiolata
invasion. Pedobiologia 84: 150700. https://doi.org/10.1016/j.pedobi.2020.150700
Dufrene, M., Legendre,
P. 1997. Species assemblages and indicator species: The need
for a flexible asymmetrical approach. Ecological Monographs 67: 345-366.
https://doi.org/10.1890/0012-9615(1997)067[0345:SAAIST]2.0.CO;2
Dukes, J.,
Mooney, H. 1999. Does global change increase the
success of biological invaders? Trends in Ecology and Evolution 14:
135-139. https://doi.org/10.1016/S0169-5347(98)01554-7
Eberly, J., Hurd, A., Oli, D., Dyer, A., Seipel, T., Carr, P. 2024.
Compositional profiling of the rhizosphere microbiome of Canada thistle reveals
consistent patterns across the United States northern Great Plains. Scientific
Reports 14: 18016. https://doi.org/10.1038/s41598-024-69082-3
Farrer, E., Birnbaum, C., Halbrook, S., Brady, M., Bumby, C., Candaele,
H., Kulick, N., et al. 2021. Plant and microbial impacts of an invasive species
vary across an environmental gradient. Journal of Ecology 109:
2163-2176. https://doi.org/10.1111/1365-2745.13629
Florentine, S., Weller, S., Graz, P., Westbrooke, M., Florentine, A., Javaid,
M., Fernando, N., et al. 2016. Influence of selected environmental factors on
seed germination and seedling survival of the arid zone invasive species
tobacco bush (Nicotiana glauca R. Graham). Rangeland Journal 38:
417-425. https://doi.org/10.1071/RJ16022
Gao, C., Montoya, L., Xu, L., Madera, M., Hollingsworth, J., Purdom,
E., Hutmacher, R., et al. 2019. Strong succession in arbuscular mycorrhizal
fungal communities. ISME Journal 13: 214-226. https://doi.org/10.1038/s41396-018-0264-0
GBIF 2023. Backbone Taxonomy. Checklist dataset. Carpobrotus
edulis (L.) N.E.Br. in GBIF Secretariat. [usado 6 septiembre 2024]. https://doi.org/10.15468/39omei
Gioria, M., Hulme, P., Richardson,
D., Pyšek, P. 2023. Why are invasive plants successful? Annual
Review of Plant Biology 74: 635-670. https://doi.org/10.1146/annurev-arplant-070522-071021
GISD 2023. Global Invasive Species
Database. [usado 6 septiembre 2024]. Disponible en: http://www.iucngisd.org/gisd/search.php
Glynou, K., Ali, T., Buch, A., Kia,
S., Ploch, S., Xia, X., Çelik, A., et al. 2016. The local
environment determines the assembly of root endophytic fungi at a continental
scale. Environmental Microbiology 18: 2418-2434. https://doi.org/10.1111/1462-2920.13112
Godoy, O., Valladares, F.,
Castro-Díez, P. 2012. The relative importance for plant
invasiveness of trait means, and their plasticity and integration in a
multivariate framework. New Phytologist 195: 912-922. https://doi.org/10.1111/j.1469-8137.2012.04205.x
Guo, K., Pyšek, P., van Kleunen, M., Kinlock, N., Lucanová, M., Leitch,
I., Pierce, S., et al. 2024. Plant invasion and naturalization are influenced
by genome size, ecology and economic use globally. Nature Communications
15: 1330. https://doi.org/10.1038/s41467-024-45667-4
Hall, E., Bernhardt, E., Bier, R., Bradford, M., Boot, C., Cotner, J.,
del Giorgio, P., et al. 2018. Understanding how microbiomes influence the
systems they inhabit. Nature Microbiology 3: 977-982. https://doi.org/10.1038/s41564-018-0201-z
Hart, M., Reader, R., Klironomos, J.
2001. Life-history strategies of arbuscular mycorrhizal fungi
in relation to their successional dynamics. Mycologia 93: 1186-1194. https://doi.org/10.1080/00275514.2001.12063251
Hierro, J., Maron, J., Callaway, R. 2005. A biogeographical approach to
plant invasions: the importance of studying exotics in their introduced and
native range. Journal of Ecology 93: 5-15. https://doi.org/10.1111/j.0022-0477.2004.00953.x
Jin, J., Krohn, C., Franks, A., Wang, X., Wood, J., Petrovski, S.,
McCaskill, M., et al. 2022. Elevated atmospheric CO2 alters the
microbial community composition and metabolic potential to mineralize organic
phosphorus in the rhizosphere of wheat. Microbiome 10: 12. https://doi.org/10.1186/s40168-021-01203-w
Kamutando, C., Vikram, S., Kamgan-Nkuekam, G., Makhalanyane, T., Greve, M.,
Le Roux, J., Richardson, D. et al. 2017. Soil nutritional status and
biogeography influence rhizosphere microbial communities associated with the
invasive tree Acacia dealbata. Scientific Reports 7: 6472. https://doi.org/10.1038/s41598-017-07018-w
Kato-Noguchi, H., Kobayashi, A., Ohno, O., Kimura, F., Fujii, Y., Suenaga, K.
2014. Phytotoxic substances with allelopathic activity may be central to the
strong invasive potential of Brachiaria brizantha. Journal of Plant
Physiology 171: 525-530. https://doi.org/10.1016/j.jplph.2013.11.010
Khan, S., Srivastava, S., Karnwal, A., Malik, T. 2023. Streptomyces
as a promising biological control agents for plant pathogens. Frontiers in
Microbiology 14: 1285543. https://doi.org/10.3389/fmicb.2023.1285543
Kim, J., Roh, A., Choi, S., Kim, E., Choi, M., Ahn, B., Kim, S., et al.
2016. Soil pH and electrical conductivity are key edaphic factors shaping
bacterial communities of greenhouse soils in Korea. Journal of Microbiology
54: 838-845. https://doi.org/10.1007/s12275-016-6526-5
Kloos, K., Fesefeldt, A., Gliesche, C., Bothe, H. 1995. DNA-probing
indicates the occurrence of denitrification and nitrogen-fixation genes in Hyphomicrobium
- distribution of denitrifying and nitrogen-fixing isolates of Hyphomicrobium
in a sewage-treatment plant. FEMS Microbiology Ecology 18: 205-213. https://doi.org/10.1111/j.1574-6941.1995.tb00177.x
Korpelainen,
H., Pietiläinen, M. 2023. What makes a good plant
invader? Life-Basel 13: 1596. https://doi.org/10.3390/life13071596
Kourtev, P., Ehrenfeld, J., Huang, W. 2002. Enzyme activities during litter
decomposition of two exotic and two native plant species in hardwood forests of
New Jersey. Soil Biology and Biochemistry 34: 1207-1218. https://doi.org/10.1016/S0038-0717(02)00057-3
Kucuk, C. 2020. In vitro exopolysaccharide production of some soil bacterial
isolated from soil affected by salt. European Journal of Biology and
Biotechnology 1:1-6. https://doi.org/10.24018/ejbio.2020.1.4.56
Kuebbing, S., Classen, A., Simberloff, D. 2014. Two co-occurring invasive
woody shrubs alter soil properties and promote subdominant invasive species. Journal
of Applied Ecology 51: 124-133. https://doi.org/10.1111/1365-2664.12161
Lanfranco, L., Fiorilli, V., Gutjahr, C. 2018. Partner communication and role
of nutrients in the arbuscular mycorrhizal symbiosis. New Phytologist
220: 1031-1046. https://doi.org/10.1111/nph.15230
Leys, N., Ryngaert, A., Bastiaens, L., Verstraete, W., Top, E.,
Springael, D. 2004. Occurrence and phylogenetic diversity of Sphingomonas
strains in soils contaminated with polycyclic aromatic hydrocarbons. Applied
and Environmental Microbiology 70: 1944-1955. https://doi.org/10.1128/AEM.70.4.1944-1955.2004
Liu, Z., Yu, Z., Song, B., Li, Y., Fang, J., Guo, Y., Jin, J., Adams,
J. 2023. Elevated CO2 and temperature increase arbuscular
mycorrhizal fungal diversity, but decrease root colonization, in maize and
wheat. Science of the Total Environment 873: 162321. https://doi.org/10.1016/j.scitotenv.2023.162321
Lopez, B.E., Allen, J.M., Dukes, J.S., Lenoir, J., Vilà, M., Blumenthal,
D.M., Beaury, E.M., et al. 2022. Global environmental changes more frequently
offset than intensify detrimental effects of biological invasions. Proceedings
of the National Academy of Sciences 119: e2117389119. https://doi.org/10.1073/pnas.2117389119
Mangla, S., Inderjit, Callaway, R. 2008. Exotic invasive plant accumulates
native soil pathogens which inhibit native plants. Journal of Ecology
96: 58-67. https://doi.org/10.1111/j.1365-2745.2007.01312.x
McLeod, M., Cleveland, C., Lekberg, Y., Maron, J., Philippot, L., Bru, D.,
Callaway, R. 2016. Exotic invasive plants increase productivity, abundance of
ammonia-oxidizing bacteria and nitrogen availability in intermountain
grasslands. Journal of Ecology 104: 994-1002. https://doi.org/10.1111/1365-2745.12584
Mengual, C., Schoebitz, M., Caravaca, F., Roldán, A. 2016. Assessment of
the potential role of Streptomyces strains in the revegetation of
semiarid sites: the relative incidence of strain origin and plantation site on
plant performance and soil quality indicators. Biology and Fertility of
Soils 52: 53-64. https://doi.org/10.1007/s00374-015-1052-x
Meyer, S., Franke, J., Baughman, O., Beckstead, J., Geary, B. 2014. Does Fusarium-caused
seed mortality contribute to Bromus tectorum stand failure in the Great
Basin? Weed Research 54: 511-519. https://doi.org/10.1111/wre.12094
Novoa, A., Rodríguez, R., Richardson, D., González, L. 2014. Soil
quality: a key factor in understanding plant invasion? The case of Carpobrotus
edulis (L.) N.E.Br. Biological Invasions 16: 429-443. https://doi.org/10.1007/s10530-013-0531-y
Nuccio, E., Anderson-Furgeson, J., Estera, K., Pett-Ridge, J., de Valpine,
P., Brodie, E., Firestone, M. 2016. Climate and edaphic controllers influence
rhizosphere community assembly for a wild annual grass. Ecology 97:
1307-1318. https://doi.org/10.1890/15-0882.1
Okada, T.,
Matsubara, Y. 2012. Tolerance to Fusarium
root rot and the changes in free amino acid contents in mycorrhizal Asparagus
plants. Hortscience 47: 751-754. https://doi.org/10.21273/HORTSCI.47.6.751
Okanya, P., Mohr, K., Gerth, K., Jansen, R., Müller, R. 2011.
Marinoquinolines A-F, pyrroloquinolines from Ohtaekwangia kribbensis
(Bacteroidetes). Journal of Natural Products 74: 603-608. https://doi.org/10.1021/np100625a
Osburn, E., Yang, G., Rillig, M., Strickland, M. 2023. Evaluating the role
of bacterial diversity in supporting soil ecosystem functions under
anthropogenic stress. ISME Communications 3: 66. https://doi.org/10.1038/s43705-023-00273-1
Osland, M.J., Chivoiu, B., Feher, L.C., Dale, L.L., Lieurance, D., Daniel,
W.M., Spencer, J.E. 2023. Plant migration due to winter climate change: range
expansion of tropical invasive plants in response to warming winters. Biological
Invasions 25: 2813-2830. https://doi.org/10.1007/s10530-023-03075-7
Poorter, H.,
Navas, M. 2003. Plant growth and competition at
elevated CO2: on winners, losers and functional groups. New
Phytologist 157: 175-198. https://doi.org/10.1046/j.1469-8137.2003.00680.x
Prescott, C., Frouz, J., Grayston, S., Quideau, S., Straker, J. 2019.
Rehabilitating forest soils after disturbance. In: Busse, M., Giardina, C.,
Morris, D., PageDumroese, D. (eds.), Global Change and Forest Soils:
Cultivating Stewardship of a Finite Natural Resource, Vol 36, pp. 309-343.
Elsevier. https://doi.org/10.1016/B978-0-444-63998-1.00013-6
Qiao, X., Sun, T., Lei, J., Xiao, L., Xue, L., Zhang, H., Jia, J., et
al. 2022. Arbuscular mycorrhizal fungi contribute to wheat yield in an
agroforestry system with different tree ages. Frontiers in Microbiology
13: 1024128. https://doi.org/10.3389/fmicb.2022.1024128
Querejeta, J., Allen, M., Caravaca, F., Roldán, A. 2006. Differential
modulation of host plant δ13C and δ18O by native and
nonnative arbuscular mycorrhizal fungi in a semiarid environment. New
Phytologist 169: 379-387. https://doi.org/10.1111/j.1469-8137.2005.01599.x
Rahlao, S.J., Milton, S.J., Esler, K.J., Barnard, P. 2014. Performance of
invasive alien fountain grass (Pennisetum setaceum) along a climatic
gradient through three South African biomes. South African Journal of Botany
91:43-48. https://doi.org/10.1016/j.sajb.2013.11.013
Richardson,
D., Pyšek, P. 2006. Plant invasions: merging the
concepts of species invasiveness and community invasibility. Progress in Physical Geography-Earth and Environment 30: 409-431. https://doi.org/10.1191/0309133306pp490pr
Rodríguez-Caballero,
G., Caravaca, F., Alguacil, M., Fernández-López, M., Fernández-González, A.,
Roldán, A. 2017. Striking alterations in the soil bacterial
community structure and functioning of the biological N cycle induced by Pennisetum
setaceum invasion in a semiarid environment. Soil Biology and
Biochemistry 109: 176-187. https://doi.org/10.1016/j.soilbio.2017.02.012
Rodríguez-Caballero, G., Caravaca, F., Roldán, A. 2018. The
unspecificity of the relationships between the invasive Pennisetum setaceum
and mycorrhizal fungi may provide advantages during its establishment at
semiarid Mediterranean sites. Science of the Total Environment 630:
1464-1471. https://doi.org/10.1016/j.scitotenv.2018.02.321
Rodríguez-Caballero,
G., Roldán, A., Caravaca, F. 2020a. Invasive Nicotiana
glauca shifts the soil microbial community composition and functioning of
harsh and disturbed semiarid Mediterranean environments. Biological
Invasions 22: 2923-2940. https://doi.org/10.1007/s10530-020-02299-1
Rodríguez-Caballero,
G., Caravaca, F., Díaz, G., Torres, P., Roldán, A. 2020b. The
invader Carpobrotus edulis promotes a specific rhizosphere microbiome
across globally distributed coastal ecosystems. Science of the Total
Environment 719: 137347. https://doi.org/10.1016/j.scitotenv.2020.137347
Ryu, J., Jung, J., Park, K., Song, W., Choi, B., Kweon, J. 2021. Humic
acid removal and microbial community function in membrane bioreactor. Journal
of Hazardous Materials 417: 126088. https://doi.org/10.1016/j.jhazmat.2021.126088
Saia, S., Ruisi, P., Fileccia, V., Di Miceli, G., Amato, G., Martinelli,
F. 2015. Metabolomics suggests that soil inoculation with arbuscular
mycorrhizal fungi decreased free amino acid content in roots of durum wheat
grown under N-limited, P-rich field conditions. Plos One 10:
e0129591. https://doi.org/10.1371/journal.pone.0129591
Sanz-Elorza, M., Dana-Sánchez,
E.D., Sobrino-Vesperinas, E. 2004. Atlas de las plantas alóctonas invasoras en
España. Dirección General para la Biodiversidad, Madrid, España.
SCBD 2006. Global biodiversity outlook 2. Secretariat of the
Convention on Biological Diversity, Montrèal. Canada.
Schroeder, C., Halbrook, S., Birnbaum, C., Waryszak, P., Wilber, W., Farrer,
E. 2020. Phragmites australis associates with belowground fungal
communities characterized by high diversity and pathogen abundance. Diversity-Basel
12: 363. https://doi.org/10.3390/d12090363
Schwartz, A., Ortiz, I., Maymon, M., Herbold, C., Fujishige, N., Vijanderan,
J., Villella, W., et al. 2013. Bacillus simplex-a little known PGPB with
anti-fungal activity-alters pea legume root architecture and nodule morphology
when coinoculated with Rhizobium leguminosarum bv.viciae. Agronomy-Basel
3: 595-620. https://doi.org/10.3390/agronomy3040595
Soltani, N., Khavari-Nejad, R.,
Yazdi, M., Shokravi, S., Fernández-Valiente, E. 2005. Screening
of soil cyanobacteria for antifungal and antibacterial activity. Pharmaceutical
Biology 43: 455-459. https://doi.org/10.1080/13880200590963871
Song, Z., Zhang, R., Fu, W., Zhang, T., Yan, J., Zhang, G. 2017.
High-throughput sequencing reveals bacterial community composition in the
rhizosphere of the invasive plant Flaveria bidentis. Weed
Research 57: 204-211. https://doi.org/10.1111/wre.12250
Souza-Alonso, P.,
Lechuga-Lago, Y., Guisande-Collazo, A., González, L. 2022. Evidence
of functional and structural changes in the microbial community beneath a
succulent invasive plant in coastal dunes. Journal of Plant Ecology 15:
1154-1167. https://doi.org/10.1111/wre.12250
Stachowicz, J., Terwin, J., Whitlatch, R., Osman, R. 2002. Linking climate
change and biological invasions: Ocean warming facilitates nonindigenous
species invasions. Proceedings of the National Academy of Sciences of the
United States of America 99: 15497-15500. https://doi.org/10.1073/pnas.242437499
Sun, D., Yang, X., Wang, Y., Fan, Y., Ding, P., Song, X., Yuan, X., et
al. 2022. Stronger mutualistic interactions with arbuscular mycorrhizal fungi
help Asteraceae invaders outcompete the phylogenetically related natives. New
Phytologist 236: 1487-1496. https://doi.org/10.1111/nph.18435
Tabassum, S., Wang, Y., Zhang, X., Zhang, Z. 2015. Novel Mass Bio System
(MBS) and its potential application in advanced treatment of coal gasification
wastewater. RSC Advances 5: 88692-88702. https://doi.org/10.1039/C5RA11506J
Tariq, M., Liu, Y., Rizwan, A., Shoukat, C., Aftab, Q., Lu, J., Zhang, Y.
2024. Impact of elevated CO2 on soil microbiota: A meta-analytical
review of carbon and nitrogen metabolism. Science of the Total Environment
950: 175354. https://doi.org/10.1016/j.scitotenv.2024.175354
Thomas, V., Torres-Avila, M., Soti,
P. 2023. Litter-mediated soil alterations by Guinea grass (Megathyrsus
maximus) in semiarid rangelands. Rangeland Ecology and Management
90: 101-108. https://doi.org/10.1016/j.rama.2023.06.003
UN General Assembly 2015. Transforming our
world: the 2030 Agenda for Sustainable Development: resolution / adopted by the
General Assembly,
A/RES/70/1, 21 October 2015. Available at: https://digitallibrary.un.org/record/3923923?ln=es&v=pdf
Wahdan, S., Hossen, S., Tanunchai, B., Schädler, M., Buscot, F., Purahong,
W. 2020. Future climate significantly alters fungal plant pathogen dynamics
during the early phase of wheat litter decomposition. Microorganisms 8:
908. https://doi.org/10.3390/microorganisms8060908
Wani, Z., Kumar, A., Sultan, P., Bindu, K., Riyaz-Ul-Hassan, S., Ashraf,
N. 2017. Mortierella alpina CS10E4, an oleaginous fungal endophyte of Crocus
sativus L. enhances apocarotenoid biosynthesis and stress tolerance in the
host plant. Scientific Reports 7: 8598. https://doi.org/10.1038/s41598-017-08974-z
Xu, H.W., Liu, W., Wang, S.Y., Yang, G.S., Xue, S. 2022. A global
meta-analysis of the impacts of exotic plant species invasion on plant
diversity and soil properties. Science of the Total Environment 810:
152286. https://doi.org/10.1016/j.scitotenv.2021.152286
Zhang, C., Tayyab, M., Abubakar, A., Yang, Z., Pang, Z., Islam, W., Lin,
Z., et al. 2019. Bacteria with different assemblages in the soil profile drive
the diverse nutrient cycles in the sugarcane straw retention ecosystem. Diversity-Basel 11: 194. https://doi.org/10.3390/d11100194
![]() , Antonio
Roldán2
, Antonio
Roldán2 ![]() , Fuensanta Caravaca2,*
, Fuensanta Caravaca2,* ![]()



