Introducción
El área de
distribución actual de especies es el resultado de millones de años de
evolución condicionados por filtros ambientales, dispersión y barreras
biogeográficas (p. ej., cadenas montañosas y océanos; Robinson et al. 2017). Así, las preferencias ecológicas de las especies están
estrechamente ligadas a las condiciones ambientales en las que han evolucionado
(Emlen y Zimmer 2019). Sin embargo, durante los últimos siglos los humanos han
modificado bruscamente la distribución de los organismos. Las actividades
antropogénicas causan perturbaciones ambientales (p. ej., cambio climático,
cambio en los usos del suelo, eutrofización, contaminación, etc.) que modifican
el ambiente de las especies nativas (Pereira et al.
2010; Pecl et al. 2017; Essl et al. 2019). Estos cambios provocan la reducción del
área de distribución de muchas especies, llevando a algunas a la extinción (Wessely et al. 2017), mientras que otras especies se han beneficiado de los
cambios y han aumentado su abundancia y distribución (Chen et al. 2011; Essl
et al. 2019). Los humanos
también transportan especies más allá de sus áreas de distribución natural, de
forma intencionada o accidental (Vitousek et al. 1997; Pyšek
et al. 2004). Algunas de
estas especies se convierten en invasoras, una vez que se establecen y
dispersan en el área introducida, causando impactos ambientales, sociales y
económicos. El proceso de invasión puede ir ligado a la adaptación ecológica a
nuevas condiciones, pudiendo causar cambios fenotípicos (Maron et al. 2004; Brandenburger
et al. 2019; Lázaro‐Lobo et al. 2021). Sin embargo, en muchos casos las especies conservan
su nicho ecológico y tienden a ocupar ambientes similares en las áreas
originales e introducidas (Pearman et al. 2008;
Petitpierre et al. 2012; Liu
et al. 2020). Estudiar las
preferencias ecológicas de las especies invasoras en sus lugares de origen es
un paso necesario para entender los mecanismos de invasión y diseñar posibles
medidas para prevenir una mayor expansión.
Cortaderia
selloana (plumero
o hierba de la Pampa) es una
gramínea de alto porte y hoja perenne nativa de regiones templadas y
subtropicales de Argentina, Brasil, Chile y Uruguay (Astegiano et al. 1995). La especie se ha introducido como planta ornamental y
estabilizadora de suelos en todos los continentes excepto en la Antártida,
favoreciendo su posterior invasión (Lázaro-Lobo et al. 2024a). La invasión de C. selloana se ha constatado en la
mayor parte de las regiones donde ha sido introducida, especialmente en
hábitats con alta disponibilidad de luz, provocando reducción de biodiversidad
y cambios en el funcionamiento de los ecosistemas (p. ej., alteración de la sucesión
y la dinámica de nutrientes) (Herrera y Campos 2006; Bacchetta
et al. 2010; Company et al. 2019). Cortaderia selloana también causa
impactos socioeconómicos al reducir la productividad de las plantaciones de
árboles, provocar alergias respiratorias y disminuir el valor recreativo de las
áreas invadidas (Nkuna et al. 2018; Rodríguez
et al. 2021). Una vez
establecida, C. selloana requiere grandes esfuerzos económicos y humanos
para controlar sus poblaciones debido al extenso sistema radicular que
desarrolla y a la alta capacidad de rebrote (Lázaro-Lobo et al. 2024a). Por ejemplo, proyectos como “Stop Cortaderia” en el norte
de la Península Ibérica han invertido dos millones de euros para erradicar la
especie en 405 ha hasta la fecha (http://stopcortaderia.org/).
Estudios
anteriores indican que los principales factores limitantes para la expansión de
C. selloana en las áreas introducidas son las bajas temperaturas y la
escasez de agua, las cuales limitan la germinación de las semillas y el
establecimiento de las plántulas (Stanton y DiTomaso 2004; Domènech y Vilà 2008; Tarabon
et al. 2018; Lázaro-Lobo et al. 2024b). En climas oceánicos,
caracterizados por temperaturas moderadas y un elevado nivel de humedad y
precipitación, C. selloana invade hábitats antrópicos perturbados donde
encuentra poca competencia con otras plantas y alta disponibilidad de recursos (Domenech y Vilà
2007; Charpentier et al. 2020). En climas mediterráneos con déficit
hídrico estival, C. selloana ocupa principalmente suelos con mayor
humedad (Lázaro-Lobo et al. 2024a). A pesar de la extensa bibliografía disponible sobre la
especie, existe muy poca información sobre las preferencias ecológicas en su
lugar de origen. Esta información es importante para identificar el posible
límite ecológico de la especie a escala global, lo que podría mejorar su
gestión en ambientes naturales y seminaturales. En este estudio evaluamos las
preferencias ecológicas de C. selloana en su área de distribución nativa
de Argentina, uno de los principales centros de distribución de la especie en
América del Sur (Lázaro-Lobo et al. 2024a). Nuestros principales objetivos son (1) definir el nicho
climático de C. selloana y la variación climática en las principales
provincias fitogeográficas de Argentina; (2) describir las preferencias de
hábitat de la especie y su variación a lo largo de gradientes de altitud y las
diferentes provincias fitogeográficas.
Material y
métodos
Evaluación del nicho climático
Obtuvimos datos globales de presencia de C. selloana a partir de
la base de datos Global Biodiversity Information Facility (GBIF; https://www.gbif.org/; datos descargados el 1 de junio del
2023; Fig. 1a). Filtramos los puntos de ocurrencia
obtenidos de GBIF para usar (1) registros con una resolución de 1 km o mayor,
(2) registros relativamente recientes (es decir, aquellos registrados después
de 1950), (3) registros de fuentes de datos adecuadas (eliminamos fuentes de
datos desconocidas y especímenes fósiles y vivos, como plantas cultivadas en
jardines botánicos) y (4) registros separados por al menos 1 km, para reducir
el efecto de autocorrelación espacial. A partir de los puntos de presencia,
generamos puntos de pseudoausencia en un área máxima de 100 km de radio, con el
fin de generar modelos predictivos con alta capacidad de identificar
condiciones que limitan la distribución de la especie a escala fina (VanDerWal et al. 2009). Estudios anteriores sugieren que distancias en torno a 100
km proporcionan resultados precisos y biológicamente significativos (VanDerWal et al. 2009; Martinuzzi
et al. 2018).
Para evaluar el
nicho climático global de C. selloana, obtuvimos 19 variables
bioclimáticas de la base de datos Climatologías de Alta Resolución para las
Áreas de Superficie Terrestre de la Tierra (CHELSA), la cual incluye el
promedio de los años 1981 a 2010 a una resolución de ~1 km (Karger et al. 2017). Realizamos pruebas de correlación para reducir la
colinealidad de variables (r de Pearson < 0,7; sensu Dormann
et al. 2013). Mantuvimos
los siguientes predictores climáticos: precipitación anual (mm), temperatura
media anual (°C), estacionalidad de la precipitación (desviación estándar de
las precipitaciones medias mensuales; mm) y estacionalidad de la temperatura
(desviación estándar de las temperaturas medias mensuales; °C/100).
Generamos predicciones de idoneidad climática usando tres
algoritmos de aprendizaje automático (“machine learning”): máxima
entropía (MaxEnt;
Phillips et al. 2006), random forest (RF;
Breiman 2001)
y árboles de regresión (“Gradient Boosting model” [GBM];
Friedman 2001). Estos algoritmos son capaces de ajustar funciones complejas y cuentan
con estrategias para evitar el sobreajuste, lo que aumenta su rendimiento al
modelar distribuciones de especies (Valavi et al. 2022). Los modelos se generaron utilizando el paquete Biomod2 de R
(4.2-4;
Thuiller et al. 2009; Thuiller et al. 2023). También utilizamos un procedimiento de 5 validaciones
cruzadas para evaluar el poder predictivo de cada modelo, manteniendo el 80 %
del conjunto de datos para la calibración y el 20 % para la estimación de la
precisión predictiva en cada ejecución. El rendimiento del modelo (bondad de
ajuste) se evaluó mediante el área bajo la curva (“Area Under the Curve”
[AUC]) de la Característica Operativa del Receptor (“Receiver Operating
Characteristic” [ROC]) (Franklin
2010) y la estadística de Habilidad
Real (“True Skill Statistic” [TSS]; Allouche et al. 2006). Los valores de AUC varían de 0 a 1 (los valores más altos
representan un mejor rendimiento del modelo, es decir, mayor poder predictivo),
mientras que TSS varía de -1 a 1 (los valores ≤ 0 indican que el modelo no es
diferente al aleatorio y un valor de 1 representa un 100 % de concordancia del
modelo con los datos (Allouche et al. 2006; Franklin
2010). Realizamos tres
permutaciones para cada variable ambiental para estimar su importancia
relativa. Los modelos se proyectaron sobre el área de
distribución nativa de C. selloana en Argentina para generar cuadrículas
de predicción de idoneidad climática con una resolución de 1 km, con
valores de píxeles que varían de 0 (baja idoneidad) a 1 (alta idoneidad; Fig. 1b).
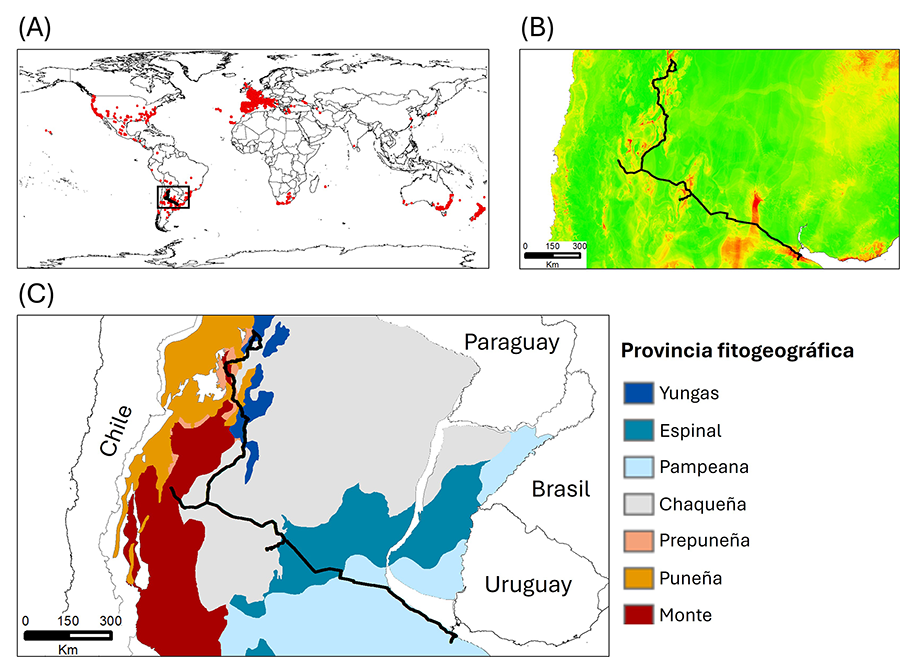
Figura 1. (A) Distribución global de Cortaderia
selloana (puntos rojos). El cuadro negro indica el área de muestreo y la
línea negra representa el transecto de muestreo realizado para evaluar la
preferencia de hábitat de la especie en Argentina. (B) Mapa de idoneidad
climática para C. selloana en el área de muestreo. Los colores rojos
indican alta idoneidad climática, mientras que los colores verdes indican lo
opuesto. La línea negra representa el transecto de muestreo. (C)
Provincias fitogeográficas del centro y norte de Argentina, obtenidas de Oyarzabal
et al. (2018). La línea negra representa la ruta de muestreo.
Figure 1. (A)
Global distribution of Cortaderia selloana (red dots). The
black square includes the surveyed areas, and the black line represents the
transect designed to evaluate the species´ habitat preferences in Argentina. (B) Habitat suitability map for C. selloana in the
surveyed area. Red colors indicate higher suitability, while green colors
illustrate the opposite. The black line represents the surveyed route. (C) Phytogeographic provinces of central and northern
Argentina, obtained from Oyarzabal et al. (2018). The black line
represents the surveyed route.
Muestreo de campo
A partir de las
predicciones de idoneidad climática para C. selloana, diseñamos un
transecto a lo largo de ~2800 km en su área de distribución nativa, maximizando
la visita de las regiones con alta idoneidad climática, desde la zona oriental
de la pampa argentina hasta la cordillera de los Andes. En mayo de 2024,
realizamos un muestro a lo largo del transecto, enfocado principalmente en
cubrir el gradiente de altitud por zonas accesibles en carretera, desde el
nivel del mar hasta 3457 m de altitud. En esta época del año C. selloana
está terminando la fase de dispersión de semillas, por lo que la planta
mantiene sus características inflorescencias (plumas), aumentando su
detectabilidad desde relativamente largas distancias. El muestreo se realizó
por siete provincias fitogeográficas: Yungas, Espinal, Pampeana, Chaqueña, Prepuneña, Puneña y
Monte (Oyarzabal
et al. 2018). El tipo de vegetación dominante es altamente variable
entre las provincias fitogeográficas, desde las estepas de arbustos xerofíticos
del Monte hasta las selvas subtropicales de las Yungas (resumido en Tabla 1). Para evaluar las características climáticas
de cada provincia fitogeográfica
muestreada, creamos 500 puntos aleatorios separados por al menos 1 km
para cada provincia y extrajimos las siguientes variables de la base de datos
CHELSA: precipitación anual (mm), temperatura media anual (°C), estacionalidad
de la precipitación (desviación estándar de las precipitaciones medias
mensuales; mm) y estacionalidad de la temperatura (desviación estándar de las
temperaturas medias mensuales; °C/100).
Dado que el objetivo del transecto era cubrir la mayor
distancia y el mayor número de regiones geográficas posibles, el muestreo se
redujo a una interpretación cualitativa del hábitat de C. selloana. En
cada región fitogeográfica se hicieron un mínimo de cinco paradas en aquellos
hábitats donde se observó la presencia de poblaciones naturales de la especie
(excluyendo zonas ajardinadas o áreas próximas a zonas urbanas para evitar
posibles zonas de dispersión a partir de plantaciones ornamentales). Durante cada
parada se registró la preferencia de hábitat y las principales especies
acompañantes de C. selloana. Las paradas se realizaban con una distancia
mínima de 10 km, excepto en el caso de observar cambios importantes en el
hábitat o cualquier otro requerimiento ecológico. En cada parada, la
preferencia de hábitat se realizó en base a tres categorías principales: 1)
hábitats de ribera; 2) hábitats antrópicos perturbados y 3) otros hábitats. Las
primeras dos categorías incluyen el hábitat principal descrito en la literatura
sobre C. selloana. La tercera categoría se mantuvo como opción para
describir otras situaciones no conocidas, en cuyo caso se recogía información
adicional sobre el hábitat y su relación con el tipo de vegetación dominante en
cada provincia fitogeográfica.
Tabla 1.
Provincias fitogeográficas muestreadas y sus tipos de vegetación dominante. Información obtenida de Oyarzabal et al. (2018).
Table 1. Surveyed phytogeographic provinces and their dominant vegetation
types. Information obtained from Oyarzabal et al. (2018).
Resultados
Modelos de nicho
climático
Los modelos globales de distribución de especies mostraron
un alto poder predictivo de ocurrencias de C. selloana (AUC > 0.86;
TSS > 0.55). El algoritmo con mayor capacidad para discriminar entre
presencias y pseudoausencias de C. selloana fue random forests
(AUC: 0.99; TSS: 0.96). Por lo tanto, usamos los resultados de este modelo para
generar predicciones de idoneidad climática. Esto nos permitió identificar
áreas idóneas para muestrear C. selloana en su área de
distribución nativa (Fig.
1b).
Todas las variables climáticas tuvieron una alta
contribución en los modelos globales. La temperatura media anual tuvo mayor
importancia (contribuyendo con un 30 %), seguida de la estacionalidad de la
temperatura (28 %), la estacionalidad de la precipitación (21 %) y la
precipitación anual (20 %). Las condiciones más adecuadas para C. selloana
fueron temperaturas medias entre 10 y 20 °C y precipitación anual de al menos
500 mm, alcanzando valores óptimos de idoneidad con precipitación anual
>1000 mm (Fig. 2). Finalmente, las áreas con
una alta estacionalidad de temperatura y precipitación fueron las menos
adecuadas para C. selloana (Fig. 2).
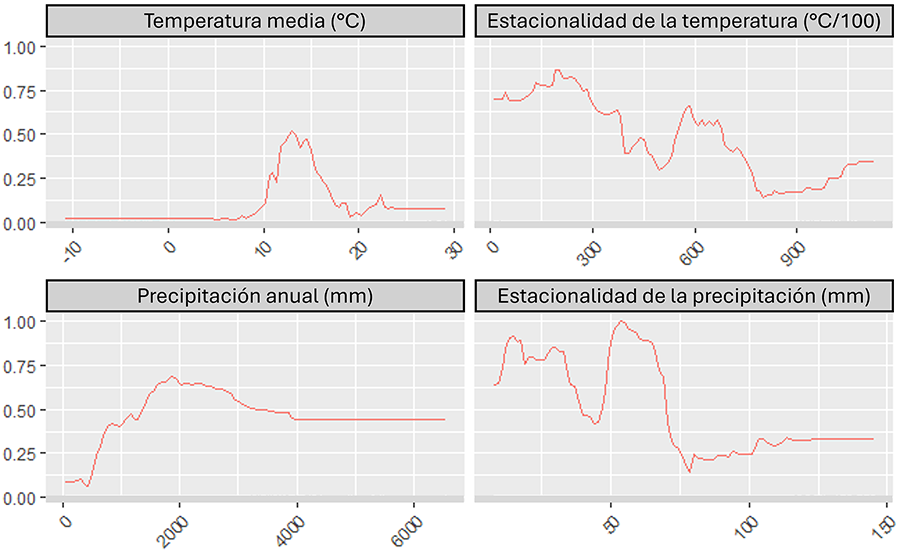
Figura 2. Curvas de respuesta generadas por el
algoritmo Random Forest (RF) para cada variable climática usada en el
modelo: temperatura media anual (°C), precipitación anual (mm), estacionalidad
de la temperatura (desviación estándar de las temperaturas medias mensuales;
°C/100) y estacionalidad de la precipitación (desviación estándar de las
precipitaciones medias mensuales; mm). El eje "x" indica la variación
de las variables climáticas y el eje "y" indica la probabilidad de
hallar Cortaderia selloana, con valores que varían de 0 (baja
probabilidad) a 1 (alta probabilidad). De esta forma, se puede evaluar la
idoneidad climática para C. selloana.
Figure 2.
Response curves generated by the Random Forest (RF) algorithm for each
climatic variable used to fit the model: annual mean temperature (°C), annual
precipitation (mm), temperature seasonality (standard deviation of the monthly
mean temperatures; °C/100) and precipitation seasonality (standard deviation of
the monthly mean precipitation; mm). The "x" axis indicates the
variation in climatic variables, and the "y" axis indicates the
probability of finding Cortaderia selloana, with values ranging from 0
(low probability) to 1 (high probability). Thus, the climate suitability for C.
selloana can be assessed.
Preferencias de hábitat
Encontramos poblaciones de C.
selloana en todas las provincias fitogeográficas muestreadas en su rango de
distribución nativo. Las preferencias de hábitat de la especie fueron muy
homogéneas dentro de cada provincia fitogeográfica, con diferencias
constatables únicamente en los hábitats más extremos, como se indica a
continuación (Figs. 3 y 4). Las poblaciones más abundantes de la especie se
localizaron en los cauces aluviales de los ríos que descienden de los Andes,
incluyendo las provincias fitogeográficas del Monte y Prepuna, a lo largo de la
Ruta Nacional 40. Como ejemplo destacan los valles Calchaquíes, un sistema de
más de 500 km de longitud que discurre bajo la cordillera Andina, donde C.
selloana domina los hábitats de ribera representados por cauces fluviales
con suelos arenosos sujetos a crecidas estacionales a modo de “rambla”. En todos
los sistemas ribereños visitados en estas provincias fitogeográficas la especie
dominante fue siempre C. selloana, participando en más del 80 % de la
biomasa total de la vegetación riparia. Algunas de las especies
acompañantes más comunes incluían Nicotiana glauca, Tessaria integrifolia
y Baccharis salicifolia. En las zonas de alta montaña caracterizadas por
una precipitación más escasa (provincia Puneña), la especie ocupa hábitats de
ribera similares, si bien son más escasos, apareciendo de forma ocasional en
cauces temporalmente secos y en otros hábitats representados por taludes
rezumantes húmedos. La población a mayor altitud la encontramos a 3200 m
s.n.m., en una pared rezumante próxima a un collado de montaña. En las zonas de
menor altitud y mayor humedad ambiental (provincias Chaqueña, Pampeana y
Espinal), C. selloana ocupa principalmente hábitats ribereños (bordes de
ríos y arroyos) donde participa de comunidades más diversas, incluyendo
especies arbóreas como Fraxinus americana y otras acompañantes como N.
glauca. En estas regiones también es común encontrar C. selloana en
hábitats antrópicos perturbados (terrenos removidos y baldíos, taludes,
cultivos abandonados, escombreras y márgenes de carreteras, senderos o vías
férreas). Cortaderia selloana es relativamente escasa en la provincia
Pampeana, donde ocupa principalmente zonas perturbadas con cierta humedad
edáfica, además de hábitats antrópicos periurbanos y comunidades halófilas en
la desembocadura del río de la Plata. En la provincia de las Yungas,
caracterizada por abundante precipitación y bosques subtropicales
estratificados, C. selloana se encontró puntualmente en hábitats
antrópicos perturbados, a lo largo de taludes de carretera, con poblaciones
dispersas y muy localizadas. Los ríos de esta provincia son especialmente
torrenciales y su vegetación ribereña es de carácter arbóreo, con ausencia de
las comunidades de ambientes perturbados típicas de las otras provincias
visitadas.
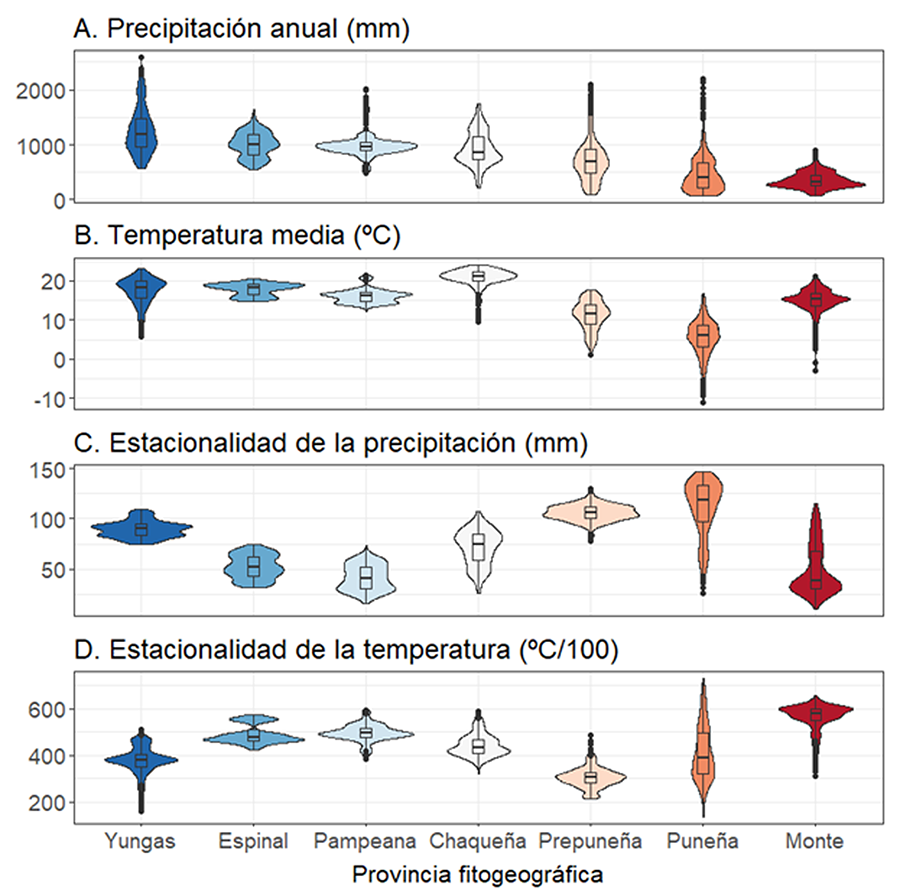
Figura 3. Datos
climáticos para cada provincia fitogeográfica del norte de Argentina. Generamos
500 puntos aleatorios para cada provincia y extrajimos las siguientes
variables: (A) precipitación anual (mm), (B) temperatura media
anual (°C), (C) estacionalidad de la precipitación (mm) y (D)
estacionalidad de la temperatura (°C/100).
Figure 3.
Climatic data for each phytogeographic province of Northern Argentina. We
generated 500 random points for each province and extracted the following
variables: (A) annual precipitation amount (mm), (B) mean annual
temperature (°C), (C) precipitation seasonality (mm), and (D)
temperature seasonality (°C/100).

Figura 4. Hábitas
donde vive Cortaderia selloana en las provincias fitogeográficas del
norte de Argentina.
Figure 4.
Habitats of Cortaderia selloana in the phytogeographic provinces of
Northern Argentina.
Discusión
Variación climática en el
área nativa de Cortaderia selloana
Nuestros resultados indican que C. selloana ocupa una
alta variabilidad climática en su área de distribución nativa, desde regiones
con climas muy secos hasta regiones subtropicales húmedas. De acuerdo con
estudios previos, encontramos que los niveles de precipitación en el área
nativa de C. selloana oscilan entre ~250 y 1750 mm anuales (Tarabon et al. 2018). Fuera de su área nativa, C.
selloana se naturaliza en regiones con clima similar a su ambiente
original, principalmente en climas oceánicos y mediterráneos de áreas templadas
(Lázaro-Lobo et al. 2024a). Nuestros resultados
también indican que las zonas climáticas idóneas para C. selloana
presentan temperaturas medias anuales suaves (entre ~10 y 20 °C), con abundante
precipitación (>1000 mm) y baja estacionalidad climática, lo que concuerda
con otros estudios (Tarabon et al. 2018).
Cortaderia selloana también ocupa un gradiente
altitudinal muy amplio en su área de distribución nativa, encontrándose desde
el nivel del mar, en la provincia fitogeográfica Pampeana, hasta los 3200 m
s.n.m. en la provincia Puneña. A pesar de la extensa información sobre la
especie en su área nativa, existen pocas referencias señalando el amplio
gradiente altitudinal de la especie, así como una escasa presencia de citas
próximas a los 3600 m s.n.m. en las bases de datos consultadas. Los esfuerzos
futuros deberían centrarse en estudiar poblaciones de C. selloana en la
provincia Puneña para evaluar las preferencias de hábitat y la fenología de la
especie en los Andes, y su relación con las poblaciones más abundantes de las
cabeceras de los ríos de montaña (provincia Prepuneña). Este conocimiento
ayudaría a predecir la capacidad de establecimiento o avance de C. selloana
en ecosistemas montañosos de las regiones donde ha sido introducida, donde por
el momento no se tiene constancia de invasión. No obstante, algunos estudios
sugieren que las plántulas de C. selloana son muy sensibles a las
heladas, reduciendo su capacidad de colonización a medida que disminuyen las
temperaturas mínimas invernales (Knowles y
Ecroyd 1985; Herrera y Campos 2006).
Dado que algunos de los climas en que hemos encontrado C. selloana son
relativamente fríos (temperatura media de ~7 °C), es posible que su
establecimiento esté favorecido principalmente en el periodo cálido, que en el
cono sur coincide con el periodo de mayor precipitación. No obstante, existen
otros factores que pueden influir en la distribución o expansión de C.
selloana en su área de distribución nativa, tanto abióticos (luminosidad,
propiedades químicas del suelo, salinidad, etc.) como bióticos (competencia,
depredación, etc.; Lázaro-Lobo et al. 2024a).
Preferencias de hábitat en el área nativa de Cortaderia
selloana
En los climas de invierno seco que dominan el área de
distribución nativa de C. selloana, hemos observado cómo la especie
forma densas poblaciones a lo largo de cauces fluviales
con suelos arenosos, a modo de rambla, para luego desaparecer a pocos
metros del margen del río, donde la humedad edáfica disminuye. Estos hábitats
de ribera sufren perturbaciones periódicas durante las fuertes crecidas de los
ríos en la estación húmeda, dejando espacios abiertos que ocupan comunidades de
especies oportunistas como C. selloana y N. glauca, ambas
especies invasoras a nivel mundial. En zonas de alta montaña, C. selloana
ocupa cauces arenosos y márgenes de barras de grava,
los cuales son muy dinámicos y sufren una gran erosión estacional (Kalníková et al. 2021). Es en estos hábitats de
ribera donde hemos observado las poblaciones más abundantes de la especie, en
muchos casos formando poblaciones continuas de decenas de kilómetros de
extensión a lo largo de los grandes ríos que descienden de los Andes hacia el océano
Atlántico. De hecho, informantes locales de las regiones del Monte y Prepuneña
aseguran que estos hábitats proporcionaban abundante cantidad de C. selloana
para su uso en actividades tradicionales, principalmente como forraje para
animales y para la elaboración de moldes para la producción de queso, trenzando
con guantes especiales las hojas cortantes de la especie. También son
frecuentes los topónimos referidos a “cortadera” a lo largo de los ríos
próximos a la Ruta nacional 40, indicando la importancia de la especie como
indicadora de humedad y planta representativa del paisaje en los grandes valles
preandinos de Argentina.
La presencia constate de C. selloana en hábitats
riparios y bien conservados de las regiones más secas del noroeste de Argentina
sugiere que este podría ser uno de los hábitats primarios de la especie en
estas regiones. La fenología de dispersión de semillas de C. selloana, concentrada
tras las lluvias del verano, favorece la colonización de espacios abiertos
generados después de las grandes crecidas de los ríos. A esto se suma la gran
cantidad de semillas producidas por cada individuo (~1 millón en adultos; Lambrinos
2002), permitiendo a C. selloana dispersarse por grandes extensiones
de terreno húmedo removido por el agua, ocupando nichos recién creados. Sin
embargo, sólo podrán establecerse aquellas semillas que lleguen a sitios
suficientemente húmedos y fuera del alcance de los torrentes de agua que
transcurren durante el periodo de lluvias intensas. En las zonas bajas de la
pampa (de donde la planta recibe su nombre vulgar), C. selloana ocupa
principalmente hábitats ruderales y perturbados, en acequias y suelos encharcados
periódicamente, mostrando una preferencia de hábitat similar, si bien en estos
casos las poblaciones son menos abundantes y su ocupación espacial es
esporádica en el paisaje. En ausencia de datos más precisos, nuestras
observaciones sugieren que los hábitats ocupados por la especie en la región
pampeana son principalmente hábitats secundarios y de reciente colonización, al
menos aquellos ligados a las grandes extensiones de cultivos pampeanos. Ello
apunta a que la distribución natural de la especie estaría ligada a los
hábitats de las cuencas de los grandes ríos que desembocan en el océano
Atlántico, pudiendo ocurrir lo mismo en los cauces fluviales que descienden de
los Andes al océano Pacífico, donde la especie también está presente.
Entre los sistemas muestreados, la provincia de las Yungas constituye
un caso especial por tratarse de un bioma subtropical sin estación seca,
formando el límite meridional de los bosques tropicales pluriestratificados del
sur de América (Oyarzabal et al. 2018). En esta provincia, C. selloana
aparece esporádicamente en hábitats antrópicos perturbados, pero está ausente
en los cauces fluviales, cuyos márgenes están ocupados por la selva subtropical
de neblina con árboles de follaje denso, perenne o semicaducifolio, con varios
estratos y abundantes lianas y epífitas (Oyarzabal et al. 2018). Estas características,
junto a la falta de una estacionalidad clara de precipitaciones, impiden la
presencia de espacios abiertos en los márgenes fluviales, y por tanto la
ocupación de especies oportunistas como C. selloana. Además, estos ríos
presentan un lecho de grava con alta movilidad del material a causa de las
fuertes pendientes y la frecuencia de fuertes lluvias (López-Silva et al. 2024), lo cual limita el
establecimiento de vegetación. Según informantes locales, durante la estación
húmeda “las crecidas de los ríos arrastran vacas y caballos”, lo que
impediría el establecimiento de plantas oportunistas que frecuentemente ocupan
los lechos de los ríos en las provincias fitogeográficas próximas. Todo esto
sugiere que C. selloana no forma parte de la flora nativa de las Yungas,
estando su presencia ligada a introducciones recientes localizadas en bordes de
carreteras, donde la perturbación del suelo y la humedad ambiental favorecen la
regeneración de la especie.
Implicaciones ecológicas en áreas introducidas
Nuestros resultados sugieren que el hábitat principal de C.
selloana en su área de distribución nativa está ligada a lechos de ríos con
crecidas estacionales y sometidos a una perturbación natural periódica. Las
adaptaciones biológicas de la especie en estos hábitats facilitarían también su
establecimiento en áreas perturbadas por los humanos, siempre que exista una
humedad edáfica o ambiental suficiente. Hemos observado cómo la colonización de
zonas perturbadas ya sea de forma natural o inducida por actividades humanas,
es común en el área nativa de la especie, explicando así la preferencia de
estos hábitats en las áreas introducidas. Siguiendo el mismo patrón que
observamos en los climas más secos de su área de distribución nativa, C.
selloana se distribuye por suelos húmedos en los márgenes de ríos y
humedales en las zonas con escasa precipitación donde se ha naturalizado, como
en las regiones de clima mediterráneo. La dificultad de C. selloana para
establecerse en sistemas húmedos subtropicales de su área de distribución
nativa también podría explicar la ausencia de la especie en selvas
subtropicales y tropicales del resto del mundo, si bien no debería excluirse
una colonización puntual, posiblemente no seguida de procesos de invasión, en
el caso de una combinación de factores (dispersión de semillas por vía humana y
establecimiento en zonas perturbadas con reducida competencia de la flora
local).
A nivel global, la capacidad de invasión de C. selloana
en las regiones introducidas se ve favorecida mayormente en climas templados
con suaves temperaturas invernales (Lázaro-Lobo et al. 2024a). En zonas donde las
condiciones climáticas permiten el crecimiento de C. selloana, la
humedad del suelo parece ser el factor limitante para su establecimiento, con
valores bajos de germinación y crecimiento en condiciones de estrés hídrico (Stanton y DiTomaso 2004; Mircea
et al. 2023; Lázaro-Lobo et al. 2024b). Esta necesidad hídrica explicaría la
preferencia de la especie por hábitats acuáticos o ribereños en la región
mediterránea, emulando la preferencia de hábitat de C. selloana en su
área de distribución nativa. En las regiones introducidas de clima templado y
con mayor humedad ambiental (p. ej., norte de España o sur de Francia), C.
selloana se distribuye ampliamente en suelos alterados por los humanos, sin
necesidad de ocupar hábitats acuáticos o ribereños (Domenech y Vilà
2007; Charpentier et al. 2020). De hecho, los hábitats templados ruderales y
no acuáticos constituyen el principal hábitat de la especie en su área
naturalizada a nivel global (Lázaro-Lobo et al. 2024a). Las características
biológicas que permiten el establecimiento de plántulas de C. selloana
en estos hábitats derivan de adaptaciones de la especie a sus hábitats
primarios en América del Sur, incluyendo: 1) producción de numerosas semillas
con gran capacidad de dispersión por el viento, aumentando la probabilidad de
llegar a sitios recientemente alterados (Connor 1973; Lambrinos 2002),
2) rápido desarrollo del sistema radicular que la permite fijarse al sustrato,
especialmente en suelos inestables propios de zonas altamente perturbadas (Bossard et al.
2000; Domènech et al. 2006) y 3) hojas
cortantes que la defienden de los herbívoros, los cuales son abundantes en sus
ecosistemas nativos y también en los sistemas antrópicos de sucesión temprana (DiTomaso et al. 1999; Global Invasive Species Database 2023).
Conclusiones
Nuestros resultados indican que los hábitats ocupados por C.
selloana en su rango de distribución nativo son consistentes con los
hábitats ocupados en el rango naturalizado, dentro de la alta variabilidad
altitudinal y climática en que vive la especie. En los climas secos del centro
y oriente de Argentina, C. selloana se distribuye por cauces fluviales
con suelos arenosos y márgenes de barras de grava en lechos de rambla, mientras
que en los climas más húmedos también es capaz de colonizar hábitats alterados
por los humanos (p. ej., taludes, cultivos abandonados, baldíos, etc.), donde
no existen restricciones edáficas para la germinación. Sin embargo, en selvas
subtropicales, la densa vegetación impide que C. selloana se establezca
en los márgenes de los ríos, ocupando esporádicamente hábitats antrópicos
perturbados. Curiosamente, C. selloana parece ocupar principalmente
hábitats secundarios en la Pampa, región que le da su nombre, si bien se hace
más abundante en los humedales costeros de dicha región. Nuestros resultados
también indican que la especie puede ocupar regiones frías de montaña,
siempre que exista una estación cálida y húmeda necesaria para la regeneración
por semillas, lo que indicaría potencial para extenderse en zonas de montaña de
las regiones introducidas. En conclusión, este estudio demuestra que la
descripción del nicho climático y las preferencias de hábitat de especies
invasoras en su lugar de origen permite comprender algunos aspectos de su
biología de invasión. Esta información es clave para optimizar los planes de
manejo de especies invasoras en las áreas donde causan impactos ecológicos,
sociales y económicos, así como establecer medidas de prevención en los
hábitats que aún no han sido colonizados.
Disponibilidad de los datos
Este artículo no utiliza conjuntos de
datos.
Contribución de los autores
Adrián Lázaro-Lobo: Conceptualización, Investigación,
Metodología, Redacción - borrador original, Redacción - revisión y edición,
Visualización. Melisa A. Giorgis: Conceptualización, Investigación,
Metodología, Redacción - revisión y edición. Borja Jiménez-Alfaro:
Conceptualización, Investigación, Metodología, Redacción - Revisión y edición,
Visualización.
Financiación, permisos requeridos, potenciales
conflictos de interés y agradecimientos
Este trabajo ha sido financiado por el Ministerio de Ciencia
e Innovación de España (MCI) y por la Unión Europea [ayuda Juan de la
Cierva-Formación (FJC2021-046657-I)], por el Jardín Botánico Atlántico de
Gijón/Xixón (SV-20-GIJON-JBA) y por National Geographic
Society (EC-106640R-23).
Los autores/as declaran no tener ningún conflicto de
intereses.
Referencias
Allouche, O., Tsoar, A., Kadmon, R. 2006.
Assessing the accuracy of species distribution models: prevalence, kappa and
the true skill statistic (TSS). Journal of Applied Ecology 43:
1223-1232. https://doi.org/10.1111/j.1365-2664.2006.01214.x
Astegiano, M.E., Anton, A.M., Connor, H.E. 1995. Sinopsis del género Cortaderia
(Poaceae) en Argentina. Darwiniana43-51.
Bacchetta, G., Dettori, C.A.,
Mascia, F., Meloni, F., Podda, L. 2010. Assessing the
potential invasiveness of Cortaderia selloana in Sardinian wetlands
through seed germination study. Plant Biosystems 144: 518-527. https://doi.org/10.1080/11263500903403465
Bossard, C.C., Randall, J.M., Hoshovsky, M.C. 2000. Invasive plants of
California’s wildlands. University of California Press.
Brandenburger, C.R., Sherwin, W.B., Creer, S.M., Buitenwerf, R., Poore, A.G.,
Frankham, R., Finnerty, P.B., Moles, A.T. 2019. Rapid reshaping: the evolution
of morphological changes in an introduced beach daisy. Proceedings of the
Royal Society B 286: 20181713. https://doi.org/10.1098/rspb.2018.1713https://doi.org/10.1098/rspb.2018.1713
Breiman, L. 2001. Random forests. Machine learning 45: 5-32. https://doi.org/10.1023/A:1010933404324
Charpentier, A., Kreder, M., Besnard, A., Gauthier, P., Bouffet, C. 2020. How Cortaderia
selloana, an ornamental plant considered highly invasive, fails to spread
from urban to natural habitats in Southern France. Urban Ecosystems 23:
1181-1190. https://doi.org/10.1007/s11252-020-01003-4
Chen, I.-C., Hill, J.K., Ohlemüller, R., Roy, D.B., Thomas, C.D. 2011.
Rapid range shifts of species associated with high levels of climate warming. Science
333: 1024-1026. https://doi.org/10.1126/science.1206432
Company, T., Soriano, P., Estrelles, E., Mayoral, O. 2019. Seed bank
longevity and germination ecology of invasive and native grass species from
Mediterranean wetlands. Folia Geobotanica 54: 151-161. https://doi.org/10.1007/s12224-019-09350-7
Connor, H. 1973. Breeding systems in Cortaderia (Gramineae). Evolution
27: 663-678. https://doi.org/10.1111/j.1558-5646.1973.tb00714.x
DiTomaso, J., Healy, E., Bell, C., Drewitz, J., Tshohl, A. 1999. Pampasgrass
and jubata grass threaten California coastal habitats. UC WeedRIC Cooperative
Extension Leaflet# 99-1.
Domenech, R.,
Vilà, M. 2007. Cortaderia selloana invasion
across a Mediterranean coastal strip. Acta Oecologica 32: 255-261. https://doi.org/10.1016/j.actao.2007.05.006
Domènech, R.,
Vilà, M. 2008. Cortaderia selloana seed
germination under different ecological conditions. Acta Oecologica
33: 93-96. https://doi.org/10.1016/j.actao.2007.09.004
Domènech, R., Vilà, M., Gesti,
J., Serrasolses, I. 2006. Neighbourhood association of Cortaderia
selloana invasion, soil properties and plant community structure in
Mediterranean coastal grasslands. Acta Oecologica 29: 171-177. https://doi.org/10.1016/j.actao.2005.09.004
Dormann, C.F., Elith, J., Bacher, S., Buchmann, C., Carl, G., Carré, G.,
Marquéz, J.R.G., et al. 2013. Collinearity: a review of methods to deal
with it and a simulation study evaluating their performance. Ecography
36: 27-46. https://doi.org/10.1111/j.1600-0587.2012.07348.x
Emlen, D.J.,
Zimmer, C. 2019. Evolution: making sense of
life, 3rd edition. W. H. Freeman and Company, New York, USA.
Essl, F., Dullinger, S., Genovesi, P., Hulme, P.E., Jeschke, J.M.,
Katsanevakis, S., Kühn, I., et al. 2019. A conceptual framework for
range-expanding species that track human-induced environmental change. BioScience
69: 908-919. https://doi.org/10.1093/biosci/biz101
Franklin, J. 2010. Mapping Species Distribution: Spatial Inference and
Prediction. Cambridge University Press. Cambridge, United Kingdom. https://doi.org/10.1017/CBO9780511810602
Friedman, J.H. 2001. Greedy function approximation: a gradient boosting
machine. Annals of Statistics 29: 1189-1232. https://doi.org/10.1214/aos/1013203451
Global
Invasive Species Database 2023. Species profile: Cortaderia
selloana. Downloaded from https://www.iucngisd.org/gisd/speciesname/Cortaderia+selloana
[ Accessed on 06-10-2023].
Herrera, M., Campos, J.A.
2006. El Carrizo de la Pampa (Cortaderia selloana) en Bizkaia: guía práctica
para su control. Instituto de Estudios Territoriales de Bizkaia, Diputación
Foral de Bizkaia.
Kalníková, V., Chytrý, K., Biţa‐Nicolae, C., Bracco, F., Font,
X., Iakushenko, D., Kącki,
Z., et al. 2021. Vegetation of the European mountain river gravel bars: A formalized
classification. Applied Vegetation Science 24: e12542. https://doi.org/10.1111/avsc.12542
Karger, D.N., Conrad, O., Böhner, J., Kawohl, T., Kreft, H., Soria-Auza,
R.W., Zimmermann, N.E., et al. 2017. Climatologies at high resolution for
the earth’s land surface areas. Scientific Data 4: 1-20. https://doi.org/10.1038/sdata.2017.122
Knowles,
F.B., Ecroyd, C.E. 1985. Species of Cortaderia
(pampas grasses and toetoe) in New Zealand. Forest Research Institute, New
Zealand Forest Service.
Lambrinos, J.G. 2002. The variable invasive success of Cortaderia
species in a complex landscape. Ecology 83: 518-529. https://doi.org/10.1890/0012-9658(2002)083[0518:TVISOC]2.0.CO;2
Lázaro‐Lobo, A., Moles, A.T., Fried, G., Verloove, F.,
Antonio Campos, J., Herrera, M., Goñi,
E., et al. 2021. Phenotypic differentiation among native, expansive and introduced
populations influences invasion success. Journal of Biogeography 48:
2907-2918. https://doi.org/10.1111/jbi.14252
Lázaro-Lobo, A., Andrade, B.O., Canavan, K., Ervin, G.N., Essl, F.,
Fernández-Pascual, E., Follak, S., et al. 2024a. Monographs on invasive
plants in Europe N° 8: Cortaderia selloana (Schult. & Schult. f.)
Asch. & Graebn. Botany Letters1-25.
Lázaro-Lobo, A., Alonso-Zaldívar, H., Sagrera, S.J.M., del Alba, C.E.,
Fernández-Pascual, E., González-García, V., Jiménez-Alfaro, B. 2024b.
Regeneration niche of Cortaderia selloana in an invaded region: Flower
predation, environmental stress, and transgenerational effects. Plant Stress
12: 100483. https://doi.org/10.1016/j.stress.2024.100483
Liu, C., Wolter, C., Xian, W., Jeschke, J.M. 2020. Most invasive
species largely conserve their climatic niche. Proceedings of the National
Academy of Sciences 117: 23643-23651. https://doi.org/10.1073/pnas.2004289117
López-Silva, M., Carmenates-Hernández, D., Poma-Puente, R., Calderón-Rufasto,
J., Sanchez-Verastegui, W. 2024. Modelos de resistencia al flujo en río
de montaña: semiempíricos, HEC-RAS y GEP. Ingeniería del agua 28:
123-140. https://doi.org/10.4995/ia.2024.20629
Maron, J.L., Vilà, M., Bommarco, R.,
Elmendorf, S., Beardsley, P. 2004. Rapid evolution of an invasive plant. Ecological
Monographs 74: 261-280. https://doi.org/10.1890/03-4027
Martinuzzi, S., Rivera, L.,
Politi, N., Bateman, B.L., De los Lllanos, E.R., Lizarraga, L., De Bustos, M.S.,
et al. 2018. Enhancing biodiversity conservation in
existing land-use plans with widely available datasets and spatial analysis
techniques. Environmental Conservation 45: 252-260. https://doi.org/10.1017/S0376892917000455
Mircea, D.M., Estrelles, E., Al
Hassan, M., Soriano, P., Sestras, R.E., Boscaiu, M., Sestras, A.F., et al.
2023. Effect of water deficit on germination, growth and
biochemical responses of four potentially invasive ornamental grass species. Plants
12: 1260. https://doi.org/10.3390/plants12061260
Nkuna, K.V., Visser, V., Wilson, J.R., Kumschick, S. 2018. Global
environmental and socio-economic impacts of selected alien grasses as a basis
for ranking threats to South Africa. NeoBiota 41: 19-65. https://doi.org/10.3897/neobiota.41.26599
Oyarzabal, M., Clavijo, J., Oakley, L., Biganzoli, F., Tognetti, P.,
Barberis, I., Maturo, H.M., et al. 2018. Unidades de vegetación de
la Argentina. Ecología Austral 28: 40-63. https://doi.org/10.25260/EA.18.28.1.0.399
Pearman, P.B., Guisan, A.,
Broennimann, O., Randin, C.F. 2008. Niche dynamics in space
and time. Trends in Ecology & Evolution 23: 149-158. https://doi.org/10.1016/j.tree.2007.11.005
Pecl, G.T., Araújo, M.B., Bell, J.D., Blanchard, J., Bonebrake, T.C.,
Chen, I.-C., Clark, T.D., et al. 2017. Biodiversity redistribution under
climate change: Impacts on ecosystems and human well-being. Science 355:
eaai9214. https://doi.org/10.1126/science.aai9214
Pereira, H.M., Leadley, P.W., Proença, V., Alkemade, R., Scharlemann, J.P.,
Fernandez-Manjarrés, J.F., Araújo, M.B., et al. 2010. Scenarios for global
biodiversity in the 21st century. Science 330: 1496-1501. https://doi.org/10.1126/science.1196624
Petitpierre, B., Kueffer, C., Broennimann, O., Randin, C., Daehler, C., Guisan,
A. 2012. Climatic niche shifts are rare among terrestrial plant invaders. Science
335: 1344-1348. https://doi.org/10.1126/science.1215933
Phillips, S.J., Anderson, R.P., Schapire, R.E. 2006. Maximum entropy
modeling of species geographic distributions. Ecological modelling 190:
231-259. https://doi.org/10.1016/j.ecolmodel.2005.03.026
Pyšek, P., Richardson, D.M., Rejmánek, M., Webster, G.L., Williamson, M.,
Kirschner, J. 2004. Alien plants in checklists and floras: towards better
communication between taxonomists and ecologists. Taxon 53: 131-143. https://doi.org/10.2307/4135498
Robinson, A.P., Walshe, T., Burgman, M.A., Nunn, M. 2017. Invasive
species: Risk assessment and management. Cambridge University Press.
Cambridge, United Kingdom. https://doi.org/10.1017/9781139019606
Rodríguez, F., Lombardero-Vega,
M., San Juan, L., De las Vecillas, L., Alonso, S., Morchón, E., Liendo, D.,
et al. 2021. Allergenicity to worldwide invasive grass Cortaderia
selloana as environmental risk to public health. Scientific Reports
11: 24426. https://doi.org/10.1038/s41598-021-03581-5
Stanton,
A.E., DiTomaso, J.M. 2004. Growth response of Cortaderia
selloana and Cortaderia jubata (Poaceae) seedlings to temperature,
light, and water. Madroño 51: 312-321.
Tarabon, S., Bertrand, R., Lavoie, C., Vigouroux, T., Isselin‐Nondedeu,
F. 2018. The effects of climate warming and urbanised areas on the future
distribution of Cortaderia selloana, pampas grass, in France. Weed
Research 58: 413-423. https://doi.org/10.1111/wre.12330
Thuiller, W., Lafourcade, B., Engler, R., Araújo, M.B. 2009. BIOMOD–a
platform for ensemble forecasting of species distributions. Ecography
32: 369-373. https://doi.org/10.1111/j.1600-0587.2008.05742.x
Thuiller, W., Georges, D., Engler, R., Breiner, F. 2023. biomod2: Ensemble
Platform for Species Distribution Modeling. R package version 4.2-4.
https://cran.r-project.org/package=biomod2
Valavi, R., Guillera‐Arroita, G., Lahoz‐Monfort, J.J., Elith, J. 2022.
Predictive performance of presence‐only species
distribution models: a benchmark study with reproducible code. Ecological
Monographs 92: e01486. https://doi.org/10.1002/ecm.1486
VanDerWal, J., Shoo, L.P., Graham, C., Williams, S.E. 2009. Selecting
pseudo-absence data for presence-only distribution modeling: how far should you
stray from what you know? Ecological Modelling 220: 589-594. https://doi.org/10.1016/j.ecolmodel.2008.11.010
Vitousek, P.M., D’antonio, C.M., Loope, L.L., Rejmanek, M., Westbrooks, R.
1997. Introduced species: a significant component of human-caused global
change. New Zealand Journal of Ecology 21: 1-16.
Wessely, J., Hülber, K., Gattringer, A., Kuttner, M., Moser, D., Rabitsch,
W., Schindler, S., et al. 2017. Habitat-based conservation strategies
cannot compensate for climate-change-induced range loss. Nature Climate
Change 7: 823-827. https://doi.org/10.1038/nclimate3414
![]() , Melisa A.
Giorgis3,4
, Melisa A.
Giorgis3,4 ![]() , Borja Jiménez-Alfaro1,2
, Borja Jiménez-Alfaro1,2 ![]()



