Introducción
Aunque algunos recursos pueden estar
disponibles a lo largo de todo el año, otros se concentran en un periodo de
tiempo específico o en un espacio determinado (Ostfeld
y Keesing 2000; Jentsch
y White 2019). Los eventos en los que los recursos aparecen en alta
disponibilidad respecto a otro momento dado, de forma predecible o no, se
denominan pulsos de recursos (resource pulse, como se conoce en inglés; Yang et al. 2008). Muchas especies oportunistas con
una dieta generalista pueden aprovechar estos pulsos de recursos. Por ejemplo,
carnívoros como el oso negro americano (Ursus americanus) incorpora en
gran proporción bellotas en su dieta los años en que hay una elevada
productividad de este fruto (McDonald y Fuller
2005). En el caso del zorro ártico (Vulpes lagopus), se ha detectado
un menor consumo de huevos de ánsar nival (Chen caerulescens) cuando la
abundancia de otras presas es media o elevada, ajustando su dieta a la
disponibilidad de recursos que aparecen en pulso (Careau
et al. 2008).
Los recursos en pulso pueden influir en el funcionamiento de
los ecosistemas a nivel individual, poblacional y comunitario (Nowlin et al. 2008). Esto adquiere especial
relevancia en aquellos entornos conformados por hábitats singulares en relación
con la conservación del ecosistema y de las especies que en él habitan, como
son los humedales. Tanto a nivel europeo como en la península ibérica, los
humedales se han reducido y degradado significativamente desde inicios del
siglo pasado debido a causas antrópicas, como la desecación, la extracción
excesiva de agua, la contaminación por nutrientes derivados de la agricultura
intensiva, el desarrollo agrícola y los efectos del cambio climático (Villar-Argáiz et al. 2022; van Dam et al.
2023). Este fenómeno es especialmente alarmante en el caso de humedales de
importancia internacional, como el Parque Nacional de Tablas de Daimiel (PNTD),
que a pesar de la sobreexplotación de sus recursos hídricos y de la consecuente
reducción de su superficie inundable, sigue albergando algunas de las
principales poblaciones reproductoras de aves amenazadas en España, entre ellas
especies en peligro crítico como el avetoro (Botaurus stellaris), el
porrón pardo (Aythya nyroca), la cerceta pardilla (Marmaronetta
angustirostris) y la malvasía cabeciblanca (Oxyura
leucocephala) (Thorup 2006; Wetlands International 2012). En
primavera, durante la época de reproducción, las aves asociadas a estos
ecosistemas y los huevos que colocan en sus nidos suponen un recurso trófico
clave para depredadores (O’Donnell et al. 2015).
Diversos trabajos en Europa han evaluado la depredación de
nidos de especies que nidifican en el suelo. Carpio y
colaboradores (2016) analizaron la depredación sobre nidos de aves
limícolas en distintos hábitats (humedales y bosque boreales) en Suecia. Este trabajo
encontró una tasa de depredación del 59.2% de los nidos artificiales empleados,
destacando la depredación por zorro rojo (Vulpes vulpes), tejón (Meles
meles), jabalí (Sus scrofa), así como especies de aves
(principalmente córvidos). Otro estudio en humedales del norte de Europa (Holopainen et al.
2020) mostró una
tasa de depredación del 45% destacando la urraca (Pica Pica), la corneja
cenicienta (Corvus cornix) y el perro mapache (Nyctereutes
procyonoides). Elmberg et al. (2009) compararon
la supervivencia de nidos simulados en 30 humedales, de los cuales 14 correspondían
a humedales mediterráneos y 16 a boreales, encontrando que la tasa de
depredación era mayor en los humedales mediterráneos en comparación con los
boreales, y en áreas con mayor densidad de nidos, especialmente en los primeros
días de incubación. Purger y Mészáros (2006)
encontraron en humedales de Hungría que la reducción en los niveles de agua
alrededor de los nidos aumentaba el acceso a depredadores como el jabalí, lo
que incrementaba la depredación. En este trabajo después de la semana 1, el 80%
de los nidos estaban intactos, después de 2 semanas solo el 46%, y después de 3
y 4 semanas, solo el 2% permaneció sin daños.
Debido a que la depredación es uno de los factores que
determina el declive en el éxito reproductivo de estas aves, la evaluación de
las tasas de depredación en los nidos así como identificar los principales
depredadores potenciales de las especies en estos entornos singulares,
permitiría obtener resultados que proporcionarían una base sólida para la
implementación de medidas de gestión y conservación efectivas que aseguraran la
persistencia de estas especies en este humedal, actualmente en decadencia.
Bajo este contexto, el objetivo principal de este estudio
fue caracterizar la depredación de nidos de anátidas en un humedal,
concretamente en el Parque Nacional de Tablas de Daimiel (España).
Específicamente, se pretende i) estimar la tasa de depredación de nidos
y huevos; ii) identificar a las especies depredadoras y sus patrones de
consumo (hora, proporción de consumo de nido); y iii) evaluar el tiempo
que están disponibles los nidos hasta su consumo por parte de los depredadores
(tiempo de eliminación). En contextos de altas tasas de depredación y pérdida
de hábitats singulares como los humedales, es esencial comprender las dinámicas
depredador-presa y los factores que influyen en la vulnerabilidad de los nidos
para poder diseñar e implementar estrategias de conservación más efectivas.
Material y métodos
Área de estudio
Este estudio se llevó a cabo en el Parque Nacional de las
Tablas de Daimiel (PNTD), localizado en la provincia de Ciudad Real
(Castilla-La Mancha, España; Fig. 1). El PNTD fue
creado en 1973, declarado Reserva de la Biosfera e incluido en el Convenio
Ramsar en 1982. Es uno de los escasos representantes del ecosistema de tabla
fluvial, que se forma por el desbordamiento del río (o ríos) en sus tramos
medios, donde la pendiente es escasa. El PNTD tiene una superficie total de
3030.0 ha, y una zona periférica de protección de 4337.3 ha. Además, se
encuentra rodeado de cultivos, principalmente de regadío.
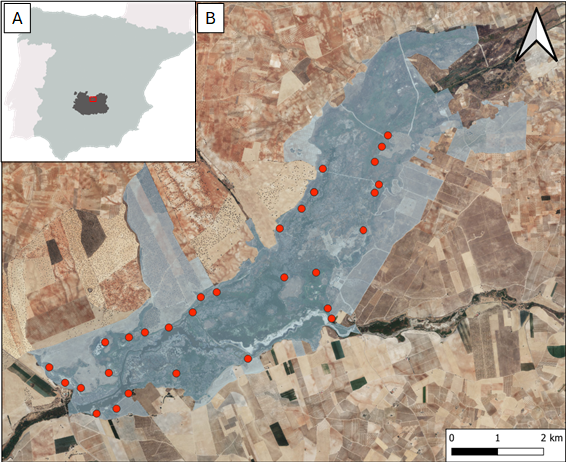
Figura 1. (A) Ubicación de la provincia
de Ciudad Real (gris oscuro) y el Parque Nacional de las Tablas de Daimiel
(cuadro rojo) en España. (B) Límites del Parque Nacional de las Tablas
de Daimiel (sombreado azul) y localización de los nidos artificiales colocados
(puntos rojos).
Figure 1. (A) Location
of the Ciudad Real province (dark gray) and the Tablas de Daimiel National Park
(red square) in Spain. (B) Boundaries of the Tablas de Daimiel National Park (blue shading)
and location of the artificial nests placed (red dots).
La declaración de Parque Nacional se estableció como medida
de protección con el fin de frenar la desecación propuesta para este enclave,
así como proteger a las especies ligadas a estos ecosistemas, desde anfibios y
reptiles a mamíferos y aves. Entre las especies de mamíferos del PNTD destacan
el jabalí y el corzo (Capreolus capreolus) entre los ungulados, junto
con diversas especies de carnívoros como el zorro rojo, el tejón, el meloncillo
(Herpestes ichneumon), la comadreja (Mustela nivalis), la gineta
(Genetta genetta) y el gato montés (Felis silvestris). En
términos de conservación es particularmente relevante la comunidad de aves en
este enclave, ya que acoge a gran diversidad de especies migradoras y
residentes. La avifauna del PNTD más destacable la componen especies de
anátidas como el pato colorado (Netta rufina), el silbón europeo (Mareca
penelope), la cerceta común (Anas crecca), el pato cuchara (Spatula
clypeata), el ánade friso (Mareca strepera) o el ánade azulón (Anas
platyrhynchos). También aparecen especies de ardeidas, como la garza real (Ardea
cinerea) y la imperial (Ardea purpurea); rapaces, como el aguilucho
lagunero occidental (Circus aeruginosus), o córvidos, como la urraca.
Cabe destacar la presencia de especies amenazadas como el escribano palustre (Emberiza
schoeniclus), el porrón pardo (Aythya nyroca) y la cerceta pardilla
(Marmaronetta angustirostris).
Colocación y monitorización de los nidos
Para llevar a cabo el experimento, simulamos artificialmente
nidos de anátidas (Nnidos = 30) durante su época reproductora
(aunque varía entre especies, se extiende desde marzo a julio, Del Hoyo et al. 1992; Fournier
et al. 2021). La localización general de los nidos se decidió junto con los
responsables del parque, para no acceder a ninguna de las zonas acotadas por
motivos de conservación. El punto concreto en que se colocó cada nido se
decidió en el campo conociendo el nivel del agua, ya que era necesario
colocarlos próximos a la orilla, y en este ecosistema el nivel del agua varía
según la precipitación caída en la cuenca. Los nidos quedaron separados 549.2 ±
64.9 m (media ± error estándar) del nido más cercano (mínimo: 76.2 m; máximo:
1588.2 m). Los nidos simulados fueron construidos con material del alrededor
(ramas, palos, juncos, hojas secas…) a una distancia máxima de 15 metros
respecto al nivel del agua en el momento de la colocación del nido (media ±
error estándar: 2.9 ± 0.6; mediana: 1.5 metros). Se llegó a la localización de
los nidos a pie, evitando la creación de vías de acceso a los nidos. Los nidos
los creamos colocando seis huevos blancos de gallina en el suelo (en dos casos
se colocaron cuatro huevos por motivos logísticos), próximos a la orilla (Nhuevos
= 176; Fig. A1 del Anexo). Los huevos
fueron colocados por un máximo de dos personas y con guantes, para reducir al
máximo el posible rastro humano. Los 30 nidos artificiales estuvieron colocados
durante 28 días durante dos periodos: los veinte primeros nidos fueron
colocados el 15 de abril, y los diez restantes el 13 de junio. La vegetación
que rodea el humedal incluye carrizo (Phragmites australis), junco (Juncus
spp.), taray (Tamarix gallica) y chopo blanco (Populus alba),
variando la predominancia de cada especie en las distintas zonas. La altura
media de la vegetación alrededor de los nidos fue de 2.3 ± 0.2 metros.
A una distancia de entre medio metro y un metro de cada nido
artificial se colocó una cámara de fototrampeo (Browning Strike Force HD Pro X
modelo BTC-5HDPX) unida a una estaca de madera a una altura de entre 50 y 80 cm
(según la profundidad necesaria para fijar la estaca) apuntando desde arriba
oblicuamente hacia los huevos con una separación menor de 1.5 metros, quedando
estos en el centro de la imagen. Las cámaras fueron programadas para tomar tres
fotografías separadas por 0.3 segundos al detectar movimiento durante las 24
horas del día, dejando tres minutos de descanso entre ráfagas para evitar la
saturación de fotos de un mismo evento. Estuvieron colocadas 28 días, para
simular el periodo de incubación promedio de las aves acuáticas (Fredrickson y Reid 1988; Baldassarre y Bolen 2006). En el momento que
se recogieron las cámaras, los nidos fueron revisados para comprobar en caso de
que hubiese habido depredación, si ésta fue total (todos los huevos depredados)
o parcial (menos huevos depredados de todos los disponibles).
Análisis de las imágenes
Las fotografías fueron procesadas inicialmente en el
software DeepFaune (Rigoudy et al. 2023),
proyecto colaborativo que permite el reconocimiento automático mediante
inteligencia artificial de imágenes de fauna silvestre. Una vez identificada la
fauna silvestre que visitaba los nidos y clasificadas, se extrajeron los datos
temporales, para establecer el tiempo de eliminación, es decir, el número de
días desde su colocación hasta su depredación.
Análisis estadístico
Para conocer el tiempo que los nidos artificiales están
disponibles hasta que son depredados (i.e., tiempo de eliminación), llevamos a
cabo un Modelo Lineal Generalizado (GLM, por sus siglas en inglés) con una
distribución de error Poisson y una función de enlace “identity”. La variable
dependiente fue el número de días hasta que fue depredado el nido artificial.
La variable independiente incluida en el modelo fue la especie depredadora
identificada, siendo un factor de tres niveles (jabalí, zorro rojo y urraca).
Aquellas especies que identificamos en un único evento de depredación no fueron
incluidas en el GLM, como fueron el tejón, el meloncillo y el aguilucho
lagunero occidental.
En caso de depredación por parte de más de un depredador,
consideramos únicamente al primero que accede al nido, ya que no podemos
excluir la posibilidad que la detección por parte del segundo depredador se
deba a haber identificado el recurso a través del primer depredador que
accedió. Posteriormente se llevó a cabo un test post hoc para determinar
entre qué niveles del factor depredadores se encontraron diferencias
significativas. El análisis estadístico se realizó con el paquete “stats” y el
software R (R Core
Team 2022).
Resultados
Se produjeron eventos de depredación en el 73.3% de los
nidos artificiales (N=22), mientras que el 26,7% restante de los nidos no
fueron depredados. Además, algunos de los nidos fueron depredados parcialmente
(N=6), es decir, no se consumieron todos los huevos disponibles en el nido,
siendo depredados el 59.1% de los huevos disponibles.
Especies identificadas y depredadoras de nidos
Las cámaras de fototrampeo permitieron identificar que la
depredación de los huevos de los nidos artificiales en el PNTD se llevó a cabo
por cuatro especies de mamíferos y dos especies de aves. Entre los mamíferos
identificados como depredadores encontramos el zorro rojo, el jabalí, el tejón y
el meloncillo, apareciendo en un 43.3% de los nidos. También identificamos
eventos de depredación por parte de ratas y ratones (6.7% de los nidos), que en
todos los casos lo hacían tras haber sido alguno de los huevos abierto por otro
depredador (debido a su incapacidad para consumirlos sin la facilitación de
otros depredadores (no contabilizamos estos eventos). Las aves que depredaron
fueron la urraca y el aguilucho lagunero occidental, apareciendo en un 30.0% de
los nidos (Fig. 2A y Fig.
A2 del Anexo). El jabalí y el tejón
únicamente depredaron durante horas nocturnas, mientras que el meloncillo, el
aguilucho lagunero y la urraca solo aparecieron depredando durante el día. En
el caso del zorro rojo, encontramos eventos de depredación tanto durante las
horas diurnas como nocturnas (Tabla A1 del Anexo).
En algunos casos, los depredadores consumían solo una parte
de los huevos del nido al que accedían (Fig. 2B),
quedando el resto disponible para otros depredadores que acababan consumiendo
la totalidad de los huevos. Esto ocurrió en un 10.0% de los nidos artificiales.
En otros casos, estos nidos parcialmente depredados no fueron consumidos
posteriormente por ningún otro depredador, como sucedió en el 13.3% del total
de los nidos.
Además de los eventos de depredación, en algunos casos
aparecieron depredadores como el meloncillo y la urraca en nidos con huevos
disponibles, pero sobre los que no depredaron (un caso registrado para cada una
de estas especies). Otra especie que intenta depredar huevos de los nidos
artificiales, pero no lo logra, es la comadreja (un caso registrado).
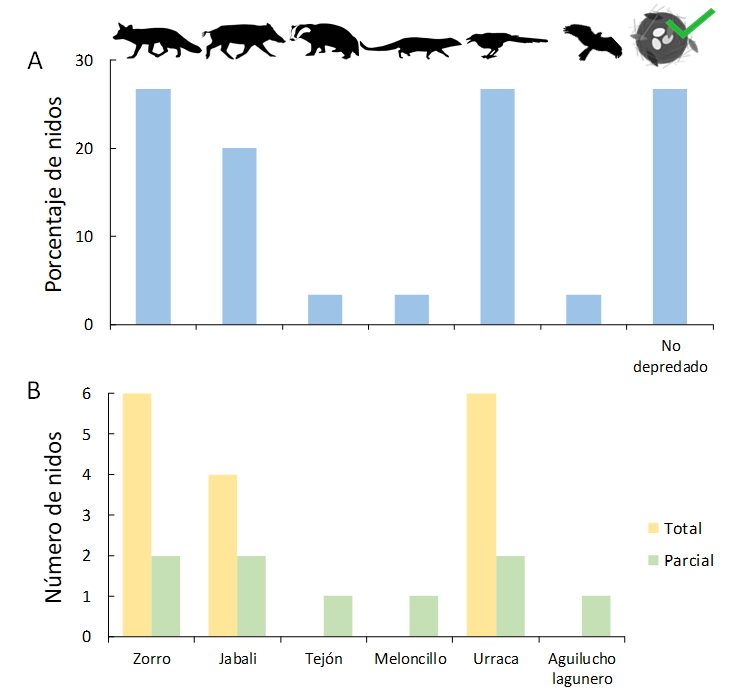
Figura 2. (A) Porcentaje de nidos
depredados por cada especie y no depredados. (B) Número de nidos en los
que cada especie ha depredado huevos, diferenciando aquéllos en los que la
depredación conllevó la eliminación de todos los huevos del nido (depredación
total), y aquéllos en los que se consumían uno o más huevos, pero no la totalidad
(depredación parcial).
Figure 2. (A) Percentage of predated nests by species, and
non-predated nests. (B) Number of nests in which each species predated
eggs, including those in which predation event implied total consumption of the
nest (total predation), and those in which not all available eggs were consumed
(partial predation).
Disponibilidad de los nidos y su depredación
Los nidos no depredados estuvieron disponibles los
28 días que permanecieron en el medio. En el caso de los nidos depredados, el
número de días transcurridos hasta su depredación (considerando como
depredación el primer evento de consumo de algún huevo por parte de algún
depredador) varió en función de la especie depredadora (Tabla
1). De acuerdo con nuestros resultados, hubo diferencias significativas
en el tiempo de eliminación entre los distintos depredadores incluidos en el
modelo (Fig. 3). Los nidos artificiales fueron
depredados a los 8.5 ± 6.3 días desde que fueron colocados. El zorro rojo es el
depredador que antes localiza y depreda los nidos desde su colocación (3.6 ± 4.3
días), seguido por el jabalí (7.7 ± 4.0 días) y la urraca (11.9 ± 6.8 días).
Tabla 1.
Resultado del Modelo Lineal Generalizado (GLM, por sus siglas en inglés) para
evaluar el tiempo de eliminación (días) del nido artificial. EE: error
estándar. La especie 'jabalí' fue utilizada como el nivel de referencia para el
factor especies.
Table 1. Result of the Generalized Linear Model (GLM) fitted for testing the
removal time (days). SE: standard error. The species 'wild boar' was used as
the reference level for the species factor.
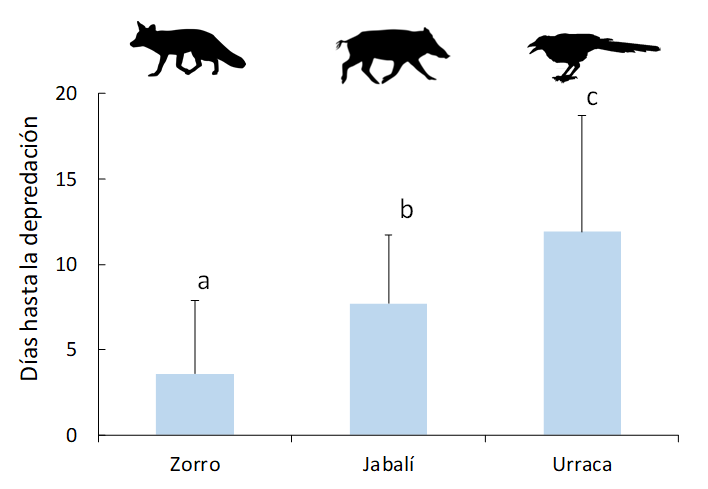
Figura 3. Número de días promedio que las
principales especies depredadoras tardan en localizar y depredar sobre los
nidos artificiales. Las barras indican el error estándar. Las diferencias
significativas entre el tiempo de eliminación de cada depredador vienen
indicadas por las letras (a, b, c).
Figure 3. Average
number of days it takes for the main predator species to locate and prey on the
artificial nests. Bars indicate standard error. Significant differences among
predation time by species are indicated by letters (a, b, c).
Discusión
El carácter oportunista de algunos depredadores les
permite explotar los recursos disponibles en función de su abundancia en cada
momento (Barrull y Mate 2015). En este trabajo,
los principales depredadores detectados en el humedal PNTD consumieron nidos
artificiales, colocados para simular los de anátidas, aprovechando este recurso
en pulso cuando está disponible.
Se detectó la depredación total o parcial en el 73.3%
de los nidos artificiales, principalmente por tres especies generalistas (zorro
rojo, jabalí y urraca), siendo además las únicas que consumieron en algún caso
todos los huevos del nido. Además, se identificó que un 10% de los nidos
artificiales fueron depredados por más de una especie. Estos resultados
sugieren que, cuando los nidos son parcialmente depredados por un primer
depredador, los rastros olfativos podrían contribuir a que otros depredadores
secundarios localicen el nido y consuman el recurso todavía disponible (Holopainen et al. 2020). De hecho, el consumo
por parte de ratones y ratas que hemos detectado únicamente se dio cuando un
primer depredador dejó restos de huevo en las cáscaras rotas. Estos resultados
concuerdan con los encontrados por Coates et al.
(2008) que encontraron que los roedores visitaron con frecuencia los nidos,
pero ninguno consumió huevos. Sin embargo, consumieron cáscaras de huevos y
restos después de la depredación por otro depredador.
El resto de los nidos no fueron depredados (26.7%), a pesar
de estar en condiciones que facilitan este proceso ecológico, como la ausencia
de progenitores que defiendan el nido de depredadores durante la nidificación (Kleindorfer et al. 2005). Por ello, la tasa de
depredación que estimamos en este experimento podría estar indicando la tasa
máxima de depredación que puede darse sobre los nidos, ya que la depredación se
vería reducida en aquellos casos en que el nido sea protegido (Smith y Edwards 2018). Además, la localización
de los nidos también influye en su probabilidad de detección y, por tanto, de depredación
y efectividad de la defensa por los progenitores (Mérö
y Žuljević 2017). Aunque los nidos artificiales pretendían simular la
realidad, es posible que no reunieran todos los requisitos que las aves
acuáticas necesitan para ubicar sus nidos, dado que debían ser accesibles para
los investigadores. A pesar de haber sido colocados en zonas con
características similares a las de los nidos reales, las limitaciones de acceso
pudieron hacer que no siempre fueran las más representativas, lo que podría
haberlos hecho más conspicuos y, en consecuencia, haber incrementado la
probabilidad de depredación.
Entre los depredadores que fueron detectados consumiendo
huevos de los nidos artificiales hubo especies como el jabalí y el tejón que únicamente
aparecieron de noche. Sin embargo, el meloncillo, el aguilucho lagunero y la
urraca tan solo fueron detectados de día. Esta segregación temporal concuerda
con trabajos previos sobre la ecología de estas especies, siendo el jabalí y el
tejón de hábitos nocturnos (Rosalino et al. 2005;
Brivio et al. 2017), mientras que el meloncillo o
las aves son depredadores diurnos (Palomares
y Delibes 1993; Blázquez et al. 2009). En
cambio, el zorro rojo aparece tanto durante las horas diurnas como nocturnas. La
actividad del zorro rojo se concentra en horas crepusculares y nocturnas a lo
largo del año, pero durante la primavera, momento en el que tuvo lugar el
experimento, su actividad puede aumentar durante el día (Pascual-Rico et al. 2023). Debemos mencionar
que hubo potenciales depredadores presentes en el PNTD que no fueron detectados
depredando sobre los nidos artificiales. Por ejemplo, la gineta y el gato
montés son especies que habitan el PNTD, sin embargo, son especies poco
abundantes (Carrasco-Redondo 2014), lo que
dificulta su detectabilidad mediante el uso de herramientas como el
fototrampeo. Además, en el caso de la gineta, a pesar de que es una especie que
puede incorporar el consumo de huevos en su dieta, es una especie que prefiere
zonas de cobertura vegetal leñosa, que es un hábitat distinto al que albergaba
los nidos artificiales (Camps 2015).
Los eventos de depredación de los nidos artificiales tuvieron
lugar en los primeros 20 días desde la colocación del nido, variando el tiempo
en que es depredado según la especie. En contraposición a lo encontrado en
estudios previos (Mori et al. 2021), en este
trabajo fueron el zorro rojo y el jabalí las especies que antes depredan sobre
los nidos artificiales, siendo la urraca la especie que más tarda en depredar. La
discrepancia entre nuestros resultados y los hallazgos de Mori et al. (2021) podría explicarse por las
diferencias en el tipo de hábitat. Mori realizó su estudio en un hábitat
mediterráneo más abierto, donde los nidos son más fácilmente visibles para
depredadores visuales, como la urraca (Møller 1989), que tienden a localizar los nidos rápidamente. En
cambio, nuestro estudio se llevó a cabo en un entorno más cerrado, como áreas
de carrizo, donde los nidos son menos visibles. En estos hábitats más densos,
los mamíferos con un sentido del olfato más agudo tienen ventaja para encontrar
los nidos antes (Krüger
et al. 2018) respecto a las urracas que, a pesar de tener olfato, tienen
más dificultades para localizarlos o tardan más en hacerlo (Molina-Morales et al. 2020). Un aspecto a
tener en cuenta es la posibilidad de haber creado accesos o “pasillos” en el
hábitat al colocar los nidos artificiales, que podría aumentar el riesgo de
depredación de los nidos. Sin embargo, de acuerdo con Ibáñez-Álamo et al. (2012), este efecto no se
da, o incluso se reduce la depredación en el caso de algunos grupos de aves.
No podemos descartar que la depredación pueda suponer un
riesgo para el éxito reproductivo de algunas aves (Roos
et al. 2018), en nuestro caso acuáticas, particularmente en escenarios de
alta abundancia de depredadores (Carpio et al. 2014;
Mori et al. 2021). Aunque la depredación es un
proceso ecosistémico natural, cambios en el hábitat y en la comunidad de
vertebrados debido a causas humanas pueden alterar la presión de los
depredadores sobre sus presas (Ritchie y
Johnson 2009). Sería necesario un monitoreo de las poblaciones de
depredadores para conocer la evolución de sus poblaciones, y evaluar si existe
un efecto significativo sobre poblaciones de aves amenazadas en nuestra área de
estudio. En caso de considerar necesario intervenir, existen diversas
propuestas para la protección de los nidos frente a la depredación, por
ejemplo, mediante barreras físicas (Gautschi et al.
2024). Además, la alteración y destrucción del hábitat es una de las
principales causas del declive poblacional que están experimentando algunas de
estas especies de aves (International Wader Study Group
2003). De acuerdo con Evans (2004) existe una
relación entre la depredación y la alteración del hábitat que pueden afectar al
descenso poblacional de estas aves. Por ello, para la conservación de las
especies afectadas puede tratarse de controlar los impactos de los depredadores
a través de la gestión del hábitat.
La evaluación de la depredación sobre los nidos artificiales
empleando las cámaras de fototrampeo, simulando el recurso en pulso que suponen
en el ecosistema, nos permite determinar los principales depredadores
existentes en el PNTD. El desarrollo tecnológico que han experimentado las
cámaras de fototrampeo durante las últimas décadas ha facilitado el monitoreo
de la fauna silvestre y el estudio del funcionamiento de los ecosistemas de
forma muy efectiva y causando una baja perturbación, permitiendo evaluar la
tasa de depredación de nidos artificiales por distintos depredadores (Carpio et al. 2016; Holopainen
et al. 2020).
En conclusión, este estudio proporciona una visión detallada
sobre los depredadores de nidos de anátidas en el Parque Nacional de las Tablas
de Daimiel, revelando una compleja interacción entre diversas especies. La
identificación de los principales depredadores y la evaluación de su actividad
temporal ofrecen información valiosa para el manejo y la conservación de estas
aves acuáticas en un ecosistema tan delicado. A medida que el conocimiento
sobre las dinámicas de depredación se expande, es crucial que se continúen
desarrollando e implementando medidas basadas en evidencia para asegurar la
preservación efectiva de estas especies y el equilibrio ecológico del ecosistema.
Contribución de los autores
Mario Sebastián-Pardo: Investigación, Redacción – borrador
original. Antonio Carpio: Adquisición de fondos, Conceptualización, Redacción –
revisión y edición. Eduardo Laguna: Investigación, Redacción – revisión y
edición. Eva de la Peña: Investigación, Análisis. Roberto Pascual-Rico:
Conceptualización, Investigación, Administración del proyecto, Redacción –
revisión y edición.
Disponibilidad de los datos
Los datos de este estudio están disponibles en el repositorio digital
Zenodo: https://zenodo.org/records/14998558?token=eyJhbGciOiJIUzUxMiJ9.eyJpZCI6ImQ5NjIzMGU5LTUwZGYtNDJjZi1hNmUyLWVkODlmOWYxMzEyYSIsImRhdGEiOnt9LCJyYW5kb20iOiJlMjI0ZTE1ZTc0YTkxMDJhNzcwMzdjMDRlOGIwNDBjYyJ9.MD9q5iceY1KfgXeiSp0GkJMcSmgaSyaegBfu7TzwD24ayRLE2KXEboqF_BzEclj0_k3UOpmtVOZFt4aFr_SSYA
Financiación, permisos requeridos, potenciales
conflictos de interés y agradecimientos
MSP ha sido financiado por un contrato predoctoral para
personal investigador en formación en el marco del Plan Propio de I+D+i,
cofinanciada por el Fondo Social Europeo Plus (FSE+) (2023-PRED-21315). Durante
el trabajo de campo y escritura del manuscrito EdP ha sido financiada por un
contrato 'Juan de la Cierva' (FJC2020-046302-I) financiado por MCIN/AEI/
10.13039/501100011033 y por la Unión Europea (NextGenerationEU). RPR ha sido
financiado por FJC2020-045938-I/MCIN/AEI/10.13039/501100011033 y European Union
“NextGenerationEU”/“PRTR”. Este trabajo fue financiado por el proyecto
SBPLY/23/180225/000163 de la Junta de Castilla-La Mancha.
Agradecemos a Carlos Antonio Ruíz de la Hermosa y a Juan
Cirilo Felipe por su ayuda y buena disposición para llevar a cabo el trabajo de
campo.
Los autores/as declaran no tener ningún conflicto de
intereses.
Referencias
Baldassarre, G.A., Bolen, E.G. 2006. Waterfowl Ecology and Management. Krieger Publishing Company, Malabar,
USA. 580 pp.
Barrull, J., Mate, I. 2015. El zorro. Monografías Zoológicas, Serie Ibérica,
Vol. 3. Tundra Ediciones,
Almenara, España. 430 pp.
Blázquez,
M., Sanchez-Zapata, J.A., Botella, F., Carrete, M., Eguía, S. 2009. Spatio-temporal segregation of
facultative avian scavengers at ungulate carcasses. Acta Oecologica 35(5): 645-650. https://doi.org/10.1016/j.actao.2009.06.002
Brivio, F., Grignolio, S., Brogi, R., Benazzi, M., Bertolucci, C., Apollonio,
M. 2017. An
analysis of intrinsic and extrinsic factors affecting the activity of a
nocturnal species: the wild boar. Mammalian Biology 84: 73-81. https://doi.org/10.1016/j.mambio.2017.01.007
Camps, D. 2015. La gineta. Monografías Zoológicas, Serie Ibérica,
Vol.2. Tundra Ediciones, Almenara, España. 275 pp.
Careau,
V., Lecomte, N., Bêty, J., Giroux, J.F., Gauthier, G., Berteaux, D. 2008. Hoarding of pulsed resources:
Temporal variations in egg-caching by arctic fox. Ecoscience 15(2): 268-276. https://doi.org/10.2980/15-2-3097
Carpio,
A.J., Guerrero-Casado, J., Tortosa, F.S., Vicente, J. 2014. Predation of simulated
red-legged partridge nests in big game estates from South Central Spain. European
Journal of Wildlife Research 60: 391-394. https://https://doi.org/10.1007/s10344-013-0786-8
Carpio,
A.J., Hillström, L., Tortosa, F.S. 2016. Effects of wild boar predation on nests of
wading birds in various Swedish habitats. European Journal of Wildlife Research 62: 423-430. https://doi.org/10.1007/s10344-016-1016-y
Carrasco-Redondo, M. 2014. Guía de visita Parque Nacional Las
Tablas de Daimiel. Organismo
Autónomo de Parques Nacionales. Catálogo de Publicaciones de la Administración
General del Estado. Disponible en: https://www.miteco.gob.es/content/dam/miteco/es/ceneam/recursos/
materiales/guia-tablas_tcm30-68595.pdf
Coates, P.S., Connelly, J.W., Delehanty, D.J.
2008. Predators of greater sage‐grouse nests identified by video monitoring. Journal of
Field Ornithology 79(4): 421-428. https://doi.org/10.1111/j.1557-9263.2008.00189.x
Del Hoyo, J., Elliott, A., Sargatal, J. 1992. Handbook of the birds of the
world (Vol. 1).
Lynx ediciones, Barcelona, Spain.
Elmberg, J., Folkesson, K., Guillemain, M., Gunnarsson,
G. 2009. Putting density dependence in perspective: nest density, nesting
phenology, and biome, all matter to survival of simulated mallard Anas
platyrhynchos nests. Journal of Avian Biology 40(3): 317-326. https://doi.org/10.1111/j.1600-048X.2008.04543.x
Evans, K.L. 2004. The potential for interactions between predation and
habitat change to cause population declines of farmland birds. Ibis 146(1):
1-13. https://doi.org/10.1111/j.1474-919X.2004.00231.x
Fredrickson, L.H., Reid, F.A. 1988. Waterfowl
management handbook. Fish and Wildlife Leaflet 13(1): 1.
Fournier, A., Lancaster, J.D., Yetter, A.P., Hine,
C.S., Beckerman, T., Figge, J., et al. 2021. Nest success and nest site
selection of wetland birds in a restored wetland system. Avian
Conservation & Ecology 16(1). https://doi.org/10.5751/ACE-01782-160106
Gautschi, D., Čulina, A., Heinsohn, R.,
Stojanovic, D., Crates, R. 2024. Protecting wild bird nests against predators:
A systematic review and meta‐analysis of non‐lethal methods. Journal of Applied
Ecology 61(6): 1187-1198. https://doi.org/10.1111/1365-2664.14619
Holopainen, S., Väänänen, V.M., Fox, A.D. 2020.
Artificial nest experiment reveals inter-guild facilitation in duck nest
predation. Global Ecology and Conservation 24: e01305. https://doi.org/10.1016/j.gecco.2020.e01305
Ibáñez‐Álamo, J.D., Sanllorente, O., Soler, M. 2012. The impact of researcher
disturbance on nest predation rates: a meta‐analysis. Ibis 154(1): 5-14. https://doi.org/10.1111/j.1474-919X.2011.01186.x
International Wader Study Group. 2003. Are waders world-wide in
decline? Reviewing the evidence. In: Annual conference of the International Wader Study
Group, Cadiz, Spain, 25-28 September 2003. Wader Study Group Bulletin 101/102. Available at: https://sora.unm.edu/sites/
default/files/journals/iwsgb/v101-102/p0008-p0012.pdf
Jentsch, A., White, P. 2019. A theory of pulse dynamics and
disturbance in ecology. Ecology 100(7): e02734. https://doi.org/10.1002/ecy.2734
Kleindorfer, S., Fessl, B., Hoi, H. 2005. Avian nest defence behaviour:
assessment in relation to predator distance and type, and nest height. Animal Behaviour 69(2): 307-313. https://doi.org/10.1016/j.anbehav.2004.06.003
Krüger, H., Väänänen, V.M., Holopainen, S.,
Nummi, P. 2018. The new faces of nest predation in agricultural landscapes—a
wildlife camera survey with artificial nests. European Journal of Wildlife
Research 64(6): 76. https://doi.org/10.1007/s10344-018-1233-7
McDonald Jr, J.E., Fuller, T.K. 2005. Effects of spring
acorn availability on black bear diet, milk composition, and cub
survival. Journal
of Mammalogy 86(5):
1022-1028. https://doi.org/10.1644/1545-1542(2005)86[1022:EOSAAO]2.0.CO;2
Mérő, T.O., Žuljević, A. 2017. Nest position and reed density
influence nest defence behaviour of Great Reed Warbler. Ethology Ecology &
Evolution
29(1): 94-101. https://doi.org/10.1080/03949370.2015.1081295
Møller, A.P. 1989. Nest
site selection across field-woodland ecotones: the effect of nest predation. Oikos: 240-246. https://doi.org/10.2307/3565342
Molina-Morales, M., Castro, J., Albaladejo, G., Parejo, D. 2020. Precise cache detection by
olfaction in a scatter-hoarder bird. Animal Behaviour 167, 185-191. https://https://doi.org/10.1016/j.anbehav.2020.07.002
Mori, E., Lazzeri, L., Ferretti, F., Gordigiani, L., Rubolini, D. 2021. The wild boar Sus scrofa
as a threat to ground‐nesting bird species: an artificial nest experiment. Journal of Zoology 314(4): 311-320. https://doi.org/10.1111/jzo.12887
Nowlin, W.H., Vanni, M. J., Yang, L. H. 2008.
Comparing resource pulses in aquatic and terrestrial ecosystems. Ecology 89(3): 647-659. https://doi.org/10.1890/07-0303.1
O’Donnell, C.F., Clapperton, B.K., Monks, J.M.
2015. Impacts of introduced mammalian predators on indigenous birds of
freshwater wetlands in New Zealand. New Zealand Journal of Ecology 39(1): 19-33. www.jstor.org/stable/26198691
Ostfeld, R.S., Keesing, F. 2000. Pulsed resources and
community dynamics of consumers in terrestrial ecosystems. Trends in ecology &
evolution 15(6):
232-237. https://doi.org/10.1016/S0169-5347(00)01862-0
Palomares, F., Delibes, M. 1993. Key habitats for
Egyptian mongooses in Doñana National Park, south-western Spain. Journal of Applied Ecology 30: 752-758. https://doi.org/10.2307/2404253
Pascual-Rico, R., Rodriguez, R.P., Martínez-García, J.A. 2023. Comportamiento
espacial de depredadores translocados para control biológico: el caso del zorro
rojo en el sureste ibérico. Ecosistemas 32(2): 2409. https://doi.org/10.7818/ECOS.2409
Purger, J.J., Mészáros, L.A. 2006. Possible effects of nest predation on the breeding success of
Ferruginous Ducks Aythya nyroca. Bird Conservation International 16(4):
309-316. https://doi.org/10.1017/S0959270906000451
R Core Team. 2022. R: A language and
environment for statistical computing (version 4.3.3). R Foundation for
Statistical Computing, Vienna, Austria. Available at: www.R-project.org/.
Rigoudy, N., Dussert, G., Benyoub, A., Besnard,
A., Birck, C., Boyer, J., Bollet, Y., et al. 2023. The DeepFaune initiative: a
collaborative effort towards the automatic identification of European fauna in
camera trap images. European Journal of Wildlife Research 69(6): 113. https://doi.org/10.1007/s10344-023-01742-7
Ritchie, E.G., Johnson, C.N. 2009. Predator
interactions, mesopredator release and biodiversity conservation. Ecology
letters 12(9): 982-998. https://doi.org/10.1111/j.1461-0248.2009.01347.x
Roos, S., Smart, J., Gibbons, D.W., Wilson, J.D. 2018. A review
of predation as a limiting factor for bird populations in mesopredator‐rich landscapes: a case study
of the UK. Biological
Reviews 93(4):
1915-1937. https://doi.org/10.1111/brv.12426
Rosalino, L., Macdonald, D., Santos-Reis, M. 2005.
Activity rhythms,
movements and patterns of sett use by badgers, Meles meles, in a
Mediterranean woodland. Mammalia 69(3-4): 395-408. https://doi.org/10.1515/mamm.2005.031
Smith, P.A., Edwards, D.B. 2018. Deceptive nest
defence in ground-nesting birds and the risk of intermediate strategies. PLoS
One 13(10): e0205236. https://doi.org/10.1371/journal.pone.0205236
Thorup, O. 2006. Breeding waders in Europe 2000.
International Wader Study Group, Thetford, UK. 142 pp.
van Dam, A.A.,
Fennessy, M.S., Finlayson, C.M. 2023. What’s driving wetland loss and
degradation? En: Gell, P.A., Davidson, N.C., Finlayson, C.M. (eds), Ramsar
Wetlands: Values, assessment, management, pp. 259-306. Elsevier. https://doi.org/10.1016/B978-0-12-817803-4.00012-7
Villar‐Argáiz, M., Medina‐Sánchez, J.M., Biddanda, B.A.
2022. National parks in Spain are failing to protect wetlands. Frontiers
in Ecology & the Environment 20(8). https://doi.org/10.1002/fee.2559
Wetlands International. 2012. Waterbird Population
Estimates, Fifth Edition. Summary Report. Wetlands International,
Wageningen, The Netherlands. Disponible en: https://www.wetlands.org/download/4594/?tmstv=1741086523
Yang, L.H., Bastow, J.L., Spence, K.O., Wright, A.N. 2008. What
can we learn from resource pulses. Ecology 89(3): 621-634. https://doi.org/10.1890/07-0175.1
Anexo / Appendix

Figura A1. A y B son ejemplos de nidos
artificiales colocados en el Parque Nacional de Las Tablas de Daimiel. C. Nido
artificial consumido totalmente por depredadores (ausencia de huevos). D. Nido
artificial parcialmente depredado.
Figure A1. A and B are instances of artificial
nests placed in the Tablas de Daimiel National Park. C. Artificial nest totally predated (no eggs). D. Artificial
nest partially predated.

Figura A2. Depredadores captados en los nidos. A
y B imágenes de zorro rojo en dos nidos artificiales. C jabalí
depredando huevos durante la noche. D urraca depredando huevos durante
el día. E y F muestran un mismo nido depredado por urraca y
aguilucho lagunero occidental, respectivamente. G y H muestran un
consumo por parte de rata y ratón, respectivamente, de los restos de huevos
dejados por otro depredador previamente. I y J muestra un
meloncillo y un tejón, respectivamente, visitando un nido ya depredado.
Figure A2. Predators
in the artificial nests. A and B are red fox pictures in two
artifical nest. C wild boar is consuming eggs at night. D magpie
predating eggs at daytime. E and F show the same
artificial nest predated by magpie and western marsh harrier, respectively.
G and H show a rat and a mouse consuming eggs after other species
predated previously this artificial nest. I and J show an
Egyptian moongoose and a badger, respectively, in predated artificial nests.
Tabla A1. Horas del
día en las que aparecieron los depredadores en los nidos. En naranja se indican
los eventos de depredación, en verde aquellos eventos en los que no se efectúa
la depredación. Las horas en azul indican que era de noche; en amarillo las
horas de día.
Table A1. Time
in which predators appeared in the nests. In orange it is indicated predation,
in green when predator appeared but predation did not happen. In blue it is
indicated at nighttime; in yellow daytime.
![]() , Antonio
Carpio2,*
, Antonio
Carpio2,* ![]() , Eduardo Laguna3
, Eduardo Laguna3 ![]() , Eva de la Peña4,5
, Eva de la Peña4,5 ![]() , Roberto Pascual-Rico1
, Roberto Pascual-Rico1 ![]()




