Entre los carroñeros exóticos, se registró un gato
consumiendo carroña en un punto de bosque secundario fuera del PN Ranomafana
durante la noche, siendo la única especie que visitó dicha carroña. Entre los
roedores, la rata negra se alimentó de carroña en cuatro puntos en bosque
secundario: dos dentro y dos fuera del PN Ranomafana, siendo así la única
especie introducida detectada en las carroñas en el área protegida. Todos los
registros son de individuos solitarios durante la noche, en carroñas visitadas
también por ratas de bosque, ratas de cola de penacho y mangostas de cola
anillada. Adicionalmente, un ratón casero se detectó alrededor de un punto de
carroña en bosque secundario fuera del PN Ranomafana, pero no se obtiene
evidencia de uso de la carroña.
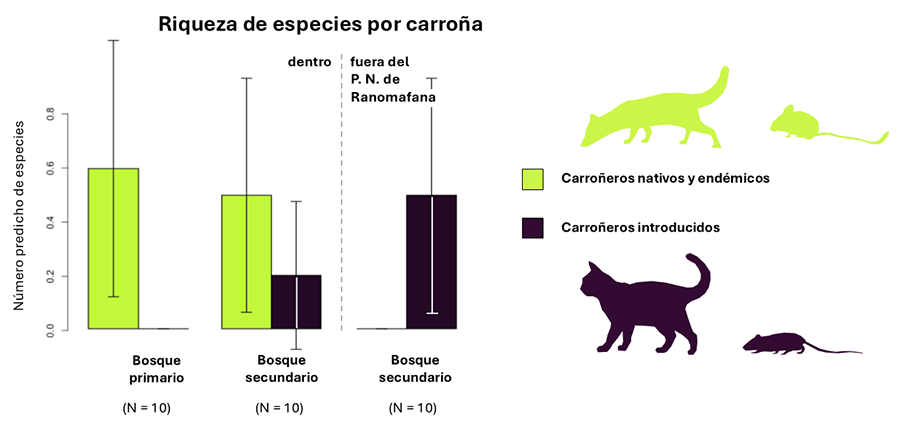
Los valores de riqueza y abundancia totales y tiempo de
detección de las carroñas en Madagascar no variaron significativamente entre
tipos de carroña utilizados, hábitats o regímenes de protección. Sin embargo,
analizando la comunidad de carroñeros endémicos e introducidos por separado, se
han obtenido diferencias significativas (p < 0.05) en los valores de riqueza
y abundancia de especies introducidas según el régimen de protección del suelo
(Tabla 3).
|
|
Nivel de protección del suelo (dentro vs. fuera del PN
Ranomafana)
|
Tipo de hábitat (bosque primario vs. secundario)
|
Tipo de cebo utilizado (carroña de carne vs. pescado)
|
|
Coef.
|
p
|
Coef.
|
p
|
Coef.
|
p
|
|
Riqueza
total
|
0.49
|
0.40
|
-0.09
|
0.86
|
0.09
|
0.86
|
|
Riqueza
spp. introducidas
|
-2.20
|
0.03 *
|
18.95
|
1
|
-18.95
|
1
|
|
Riqueza
spp. endémicas
|
18.70
|
1
|
-0.88
|
0.15
|
0.88
|
0.15
|
|
Abundancia
total
|
0.56
|
0.32
|
-0.24
|
0.62
|
0.24
|
0.62
|
|
Abundancia
spp. introducidas
|
-2.20
|
0.03 *
|
18.95
|
1
|
-18.95
|
1
|
|
Abundancia
spp. endémicas
|
18.87
|
1
|
-0.85
|
0.13
|
0.85
|
0.13
|
|
Tiempo
de detección
|
0.22
|
0.55
|
0.08
|
0.83
|
0.08
|
0.83
|
Discusión
Este trabajo supone la primera aproximación reciente al
conocimiento de la diversidad de carroñeros vertebrados en Madagascar. La
comunidad de carroñeros dentro y alrededor del PN Ranomafana está compuesta por
mesomamíferos carnívoros y micromamíferos, sin registros de aves o reptiles
necrófagos durante las primeras 24 h tras la instalación de las carroñas. Entre
estos mamíferos se cuentan especies introducidas e invasoras en Madagascar,
detectados tanto fuera como dentro del PN Ranomafana.
Debido a los hábitos esquivos de los carnívoros endémicos de
Madagascar (familia Eupleridae), los estudios de dieta han estado
tradicionalmente basados en el análisis de heces (Hawkins
y Racey 2008) o del contenido de estómagos (Rand 1935),
impidiendo determinar si existe o no necrofagia. Sin embargo, el uso de cámaras
de fototrampeo ha permitido registrar seis especies de carnívoros como
necrófagas en el PN Ranomafana, incluyendo cuatro miembros de la familia Eupleridae:
la mangosta de cola anillada, la civeta de Madagascar, el fosa (Cryptoprocta
ferox) y la mangosta de franjas anchas (Galidictis fasciata), las
tres últimas clasificadas como vulnerables (IUCN 2024);
y dos especies introducidas: la civeta enana (Viverricula indica) y el
perro (Canis familiaris) (Gerber et al. 2010).
Los resultados del presente muestreo amplían la lista de especies que explotan
las carroñas en la región en tres especies, incluyendo una especie endémica, la
rata de cola de penacho, y dos introducidas: el gato y la rata negra.
Este trabajo ha abordado solamente las primeras 24 h tras la
aparición de la carroña para un total de 30 carroñas de pequeño tamaño.
Diversas especies de vertebrados carroñeros conocidos en el área no han sido
detectadas en este muestreo. Si bien los resultados del muestreo sugieren que
existe un reemplazo de vertebrados carroñeros introducidos sobre los nativos
fuera del área protegida sin diferencias significativas en el tiempo de
detección de carroña, las limitaciones del muestreo hacen que estos resultados
no sean concluyentes. Sugerimos que futuros muestreos se extiendan por periodos
de tiempo mayores y se centren en patrones de consumo y de competencia
interespecífica.
La comunidad de carroñeros nativos en el PN Ranomafana
incluye como mínimo las cuatro especies endémicas de carnívoros de la familia Eupleridae
presentes en el parque. Además, algunas especies de tenrec (familia Tenrecidae)
complementan su dieta con cadáveres de vertebrados (Soarimalala y Goodman 2011). Entre las
especies introducidas, actualmente existe evidencia de consumo directo de
carroña en el PN Ranomafana por parte de la civeta enana, el perro, el gato y
la rata negra. Un ratón casero detectado en un punto de carroña de este
muestreo no ha consumido, pero al ser un conocido consumidor de carroña (Carr et al. 1981) es esperable que forme parte de la
comunidad carroñeros de Madagascar. Además, una especie introducida no
detectada en el muestreo, el potamóquero de río (Potamochoerus larvatus),
es seguramente consumidor de carroña en el PN Ranomafana, dada su presencia en
el área (Beaudrot et al. 2018) y sus hábitos
carroñeros en su distribución nativa (Meijaard et
al. 2011).
El conocimiento sobre la dieta de los mamíferos endémicos de
Madagascar es limitado. La dieta de los roedores endémicos de la isla
(subfamilia Nesomyinae) está fundamentalmente compuesta por semillas y
otros materiales vegetales (Goodman y Schütz
2003; Goodman y Monadjem 2017),
adaptando su dieta a los alimentos disponibles durante las distintas estaciones
(Soarimalala y Goodman 2011). El
registro de dos individuos de ratas de cola de penacho utilizando la carroña
como recurso alimentario en este muestreo por primera vez revela la falta de
conocimiento sobre la dieta de este grupo. Aunque no se puede extraer del
material obtenido si la alimentación se ha dado sobre macroinvertebrados
carroñeros o sobre la misma carroña, es evidente que la rata de cola de penacho
puede explotar fuentes de proteína animal y que utiliza las carroñas como
fuente de alimentación. Por otro lado, la presencia repetida de diferentes
ratas de bosque junto a varias carroñas apunta a que estos roedores se podrían
beneficiar también de la carroña, consumiéndola directamente o alimentándose de
invertebrados carroñeros.
Este estudio ha encontrado diferencias en la comunidad de
carroñeros según el régimen de protección y el estado de sucesión del bosque.
Este hecho puede deberse a diferencias en los requerimientos del hábitat de
cada especie, problemas de conservación de las especies nativas, y competencia
entre especies nativas e invasoras. Los carnívoros introducidos compiten por
recursos en tiempo y espacio con las especies de carnívoros endémicos de
Madagascar (Farris et al. 2017). Por otro lado, los
roedores endémicos registrados en este muestreo podrían presentar alta
probabilidad de competencia con la rata negra debido a sus similares
características ecológicas (Miljutin y
Lehtonen 2008). En este muestreo hemos detectado
solapamiento en la misma carroña de rata negra con ratas de bosque, ratas de
cola de penacho y mangostas de cola anillada. Debido a estos antecedentes, los
lugares donde detectamos que hay superposición entre nativas y exóticas (bosque
secundario dentro de zonas protegidas) y donde no detectamos especies nativas
(zonas no protegidas) deberían ser prioritarios para estudiar si existe
realmente competencia y reemplazo mediante muestreos a mayor escala.
Concretamente, la rata negra ha sido la especie detectada en
un mayor número de carroñas, en bosque secundario tanto fuera como dentro del
PN Ranomafana, coincidiendo con una rata de cola de penacho en una carroña. La
rata negra es el roedor introducido más ampliamente distribuido en Madagascar,
ocupando desde ambientes urbanos hasta bosques primarios (Goodman 1995). Esta especie presenta parásitos
potencialmente nocivos para la fauna local que han supuesto la extinción de
roedores endémicos en otros ecosistemas insulares (Rasambainarivo y Goodman 2019). Su
presencia ya ha desplazado a especies de roedores endémicas en diversas áreas
de Madagascar (Amori y Clout 2003). La
problemática de los roedores introducidos es particularmente compleja en la
isla, dada la alta adaptabilidad al hábitat de la rata negra, así como las
dificultades de implementar métodos de control efectivos que no afecten a los
roedores endémicos (Goodman 1995).
Por otro lado, el gato ha sido el único carnívoro
introducido detectado en este muestreo. En los bosques de algunas regiones de
Madagascar existen poblaciones de “gatos de bosque” ferales establecidas hace
varios siglos (Sauther et al. 2020), aunque este
no parece ser el caso en el PN Ranomafana a la luz de la ausencia de “gatos de
bosque” en estudios anteriores (Gerber et al. 2010)
y la única presencia de un ejemplar doméstico en este muestreo. Pese a que este
único registro pueda suponer un nivel de presión por competencia de consumo de
carroña limitado, estudiar el papel en las redes tróficas en la isla de esta y
otras especies introducidas es primordial en el contexto de la ecología de la
carroña en Madagascar.
La destrucción y pérdida del hábitat es una de las mayores
causas de amenaza a la biodiversidad en Madagascar (Ralimanana et al. 2022). En el área de bosque
mejor conservada dentro del PN Ranomafana se han registrado únicamente
carroñeros de especies nativas y endémicas. Las áreas protegidas de Madagascar
juegan un papel importante en la conservación del hábitat (Eklund et al. 2016), y diferentes vertebrados
nativos se encargan de consumir carroña dentro de ellas. Sin embargo, en esta
primera aproximación encontramos una comunidad de carroñeros en áreas no
protegidas compuesta únicamente por especies invasoras, indicando que la antropización
podría tener un efecto importante en el ensamblaje de la comunidad de
carroñeros. El estudio de las comunidades de carroñeros y su respuesta a
cambios en el hábitat en Madagascar es fundamental para dilucidar las claves de
este proceso ecológico en la isla y determinar las especies que participan en
él, entre las que se cuentan varias bajo categoría de amenaza global (IUCN 2024).
Contribuciones de los autores
Adrián Colino-Barea: Conceptualization, Data Curation,
Writing. Lola Fernández-Multigner: Methodology. José Antonio
Sánchez-Zapata: Supervision, Writing – Review and Editing. Esther
Sebastián-González: Conceptualization, Formal analysis, Supervision, Writing –
Review and Editing.
Disponibilidad de los datos
Los datos de este estudio se encuentran disponibles en el
repositorio digital Figshare https://figshare.com/projects/Los_carro_eros_ex_ticos_reemplazan_a_los_nativos_fuera_de_un_rea_protegida_en_Madagascar/242333
(Colino-Barea
et al. 2025).
Financiación, permisos requeridos, potenciales
conflictos de interés y agradecimientos
A Mar Cabeza y Eric M. Temba por el apoyo logístico. A
Miharisoa Caren y el equipo de guías de Centre ValBio por su valiosa asistencia
durante las campañas de campo y su ayuda en la identificación de especies. ESG
ha sido financiada por las ayudas RYC2019-027216-I y CNS2023-144791 del
Ministerio de Ciencia y Universidades (MCIN/AEI /10.13039/501100011033) y por
El FSE invierte en tu futuro.
Los autores/as declaran no tener ningún conflicto de
intereses.
Referencias
Amori, G., Clout, M. 2003. Rodents on Islands: A Conservation Challenge. In: Singleton, G.R.,
Hinds, L.A., Krebs, C.J., Spratt, D.M. (Eds.), Rats, Mice and People: Rodent
Biology and Management, pp. 62-68. Australian Centre for International
Agriculture Research, Canberra, Australia.
Beasley, J.C., Olson, Z.H., DeVault, T.L. 2015. Ecological Role of
Vertebrate Scavengerss. En: Benbow, M.E., Tomberlin, J.K., Tarone, A.M. (Eds.),
Carrion Ecology, Evolution, and Their Applications, pp. 122-143. CSC
Press, Boca Raton, Florida, Estados Unidos. https://doi.org/10.1201/b18819-9
Beaudrot, L., Acevedo, M., Lessard, J., Sheil, D., Larney, E., Wright, P.,
Ahumada, J. 2018. Distributional shifts in a biodiversity hotspot. Biological
Conservation 228: 252-258. https://doi.org/10.1016/j.biocon.2018.10.016
Brooke, Z.M., Bielby, J., Nambiar, K., Carbone, C. 2014. Correlates of
research effort in carnivores: body size, range size and diet matter. PloS
One 9(4): e93195. https://doi.org/10.1371/journal.pone.0093195
Burgin, C.J., Wilson, D.E., Mittermeier, R.A., Rylands, A.B., Lacher,
T.E., Sechrest, W. 2020. Illustrated Checklist of the Mammals of the World
(Vols. 1–2). Lynx, Barcelona, España.
Carr, W.J., Schwartz, D., Chism, E., Thomas, B. 1981. A natural food
aversion in Norway rats and in house mice. Behavioral and Neural Biology
31: 314-323. https://doi.org/10.1016/S0163-1047(81)91349-2
Del Hoyo,
J., Collar, N.J. 2016. Illustrated
Checklist of the Birds of the World (Vols. 1–2). Lynx,
Barcelona, España.
DeVault, T.L., Rhodes, O.E.,
Shivik, J.A. 2003. Scavenging by vertebrates: behavioral,
ecological, and evolutionary perspectives on an important energy transfer
pathway in terrestrial ecosystems. Oikos 102(2): 225-234. https://doi.org/10.1034/j.1600-
0706.2003.12378.x
Eklund, J., Blanchet, F.G., Nyman, J., Rocha, R., Virtanen, T., Cabeza, M.
2016. Contrasting spatial and temporal trends of protected area effectiveness
in mitigating deforestation in Madagascar. Biological Conservation 203:
290-297. https://doi.org/10.1016/j.biocon.2016.09.033
Farris, Z.J., Golden, C.D., Karpanty, S., Murphy, A., Stauffer, D.,
Ratelolahy, F., Andrianjakarivelo, V., et al. 2015. Hunting, exotic carnivores,
and habitat loss: Anthropogenic effects on a native carnivore community,
Madagascar. PLOS One 10(9): e0136456. https://doi.org/10.1371/journal.pone.0136456
Farris, Z.J., Kelly, M.J., Karpanty, S., Murphy, A., Ratelolahy, F.,
Andrianjakarivelo, V., Holmes, C. 2017. The times they are a changin’:
Multi-year surveys reveal exotics replace native carnivores at a Madagascar
rainforest site. Biological Conservation 206: 320-328. https://doi.org/10.1016/j.biocon.2016.10.025
Gerber, B.D., Karpanty, S.M., Crawford, C., Kotschwar, M.,
Randrianantenaina, J. 2010. An assessment of carnivore relative abundance and
density in the eastern rainforests of Madagascar using remotely-triggered
camera traps. Oryx 44(2): 219-222. https://doi.org/10.1017/s0030605309991037
Gerber, B.D., Karpanty, S.M., Kelly, M.J. 2011. Evaluating the potential
biases in carnivore capture–recapture studies associated with the use of lure
and varying density estimation techniques using photographic‐sampling
data of the Malagasy civet. Population Ecology 54(1): 43-54. https://doi.org/10.1007/s10144-011-0276-3
Goodman, S.M. 1995. Rattus on Madagascar and the dilemma of
protecting the endemic rodent fauna. Conservation Biology 9(2): 450-453.
https://doi.org/10.1046/j.1523-1739.1995.9020450.x
Goodman,
S.M., Schütz, H. 2003. Specimen evidence of the
continued existence of the Malagasy rodent Nesomys lambertoni (Muridae:
Nesomyinae). Mammalia 67(3): 445-468. https://doi.org/10.1515/mamm.2003.67.3.445
Goodman,
S.M., Benstead, J.P. 2005. Updated estimates of
biotic diversity and endemism for Madagascar. Oryx 39(1): 73-77. https://doi.org/10.1017/s0030605305000128
Goodman,
S., Monadjem, A. 2017. Family Nesomyidae. In:
Wilson, D.E., Mittermeier, R.A., Lacher, T.E. (Eds.) Handbook of the Mammals
of the World. Vol. 7. Rodents II. Lynx, Barcelona, España.
Harris, N.L., Gibbs, D.A.,
Baccini, A., Birdsey, R.A., De Bruin, S., Farina, M., Fatoyinbo, L., et al.
2021. Global maps of twenty-first century forest carbon
fluxes. Nature Climate Change 11(3), 234-240. https://doi.org/10.1038/s41558-020-00976-6
Hawkins,
C.E., Racey, P.A. 2008. Food habits of an
endangered carnivore, Cryptoprocta ferox, in the dry deciduous forests
of western Madagascar. Journal of Mammalogy 89(1), 64-74. https://doi.org/10.1644/06-mamm-a-366.1
Inagaki, A., Allen, M.L., Maruyama, T., Yamazaki, K., Tochigi, K.,
Naganuma, T., Koike, S. 2022. Carcass detection and
consumption by facultative scavengers in forest ecosystem highlights the value
of their ecosystem services. Scientific Reports 12(1). https://doi.org/10.1038/s41598-022-20465-4
IUCN. 2024. The IUCN Red List of Threatened Species. Version 2024-1. https://www.iucnredlist.org.
Meijaard, E., D’Huart, J.P., Oliver, W. 2011. Family Suidae. In: Wilson,
D.E., Mittermeier, R.A. (Eds.), Handbook of the Mammals of the World
(Vol. 2). Lynx.
Miljutin,
A., Lehtonen, J.T. 2008. Probability of competition
between introduced and native rodents in Madagascar: An estimation based on
morphological traits. Estonian Journal of Ecology, 57(2), 133. https://doi.org/10.3176/eco.2008.2.05
Monar-Barragán, H.P., Araújo, E.E., Restrepo-Cardona, J.S., Kohn, S.,
Paredes-Bracho, A., Vargas, F.H. 2023. Impacts of free-ranging dogs on a
community of vertebrate scavengers in a High Andean ecosystem. Tropical
Conservation Science, 16(1). https://doi.org/10.1177/19400829231218409
Muehlbauer, J.D., Collins, S.F., Doyle, M.W., Tockner, K. 2014. How wide is a
stream? Spatial extent of the potential “stream signature” in terrestrial food
webs using meta‐analysis. Ecology 95(1): 44-55. https://doi.org/10.1890/12-1628.1
Olson, Z.H., Beasley, J.C., DeVault, T.L., Rhodes, O.E. 2011. Scavenger
community response to the removal of a dominant scavenger. Oikos
121(1): 77-84. https://doi.org/10.1111/j.1600-0706.2011.19771.x
Orihuela-Torres, A.,
Pérez-García, J.M., Sánchez-Zapata, J.A., Botella, F. Sebastián-González, E.
2022. Scavenger guild and consumption patterns of an invasive
alien fish species in a Mediterranean wetland. Ecology and Evolution 12,
e9133. https://doi.org/10.1002/ece3.9133
R Core Team.
2021. R: A language and environment for
statistical computing, Version (4.4.2). R Foundation for Statistical
Computing, https://www.R-project.org/
Ralimanana, H., Perrigo, A.L., Smith, R.J., Borrell, J.S., Faurby, S.,
Rajaonah, M.T., Randriamboavonjy, et al. 2022. Madagascar’s extraordinary
biodiversity: Threats and opportunities. Science 378(6623). https://doi.org/10.1126/science.adf1466
Rand, A.L. 1935. On the habits of some Madagascar mammals. Journal of
Mammalogy 16(2): 89-104. https://doi.org/10.2307/1374353
Rasambainarivo, F., Farris, Z.J., Andrianalizah, H., Parker, P.G. 2017.
Interactions between carnivores in Madagascar and the risk of disease
transmission. Ecohealth 14(4): 691-703. https://doi.org/10.1007/s10393-017-1280-7
Rasambainarivo,
F., Goodman, S.M. 2019. Disease risk to endemic
animals from introduced species on Madagascar. In: Miller, R.E., Lamberski, N.,
Calle, P.P. (Eds.), Fowler's Zoo and Wild Animal Medicine Current Therapy (Vol.
9), pp. 292-297. https://doi.org/10.1016/b978-0-323-55228-8.00043-6
Rooney, N., McCann, K., Gellner, G., Moore, J.C. 2006. Structural
asymmetry and the stability of diverse food webs. Nature 442: 265-269. https://doi.org/10.1038/nature04887
Ruxton,
G.D., Houston, D.C. 2004. Obligate vertebrate
scavengers must be large soaring fliers. Journal of Theoretical Biology
228: 431–436. https://doi.org/10.1016/j.jtbi.2004.02.005
Sauther, M.L., Bertolini, F., Dollar, L.J., Pomerantz, J., Alves, P.C.,
Gandolfi, B., Kurushima, J.D., et al. 2020. Taxonomic identification of
Madagascar’s free-ranging “forest cats”. Conservation Genetics 21(3):
443-451. https://doi.org/10.1007/s10592-020-01261-x
Sebastián-González,
E., Morant, M., Moleón, M., Redondo, D., Morales-Reyes, Z., Pascual-Rico, R,
Sánchez-Zapata, J.A., et al. 2023. The underestimated role of
carrion in diet studies. Global Ecology and Biogeography 32: 1302-1310. https://doi.org/10.1111/geb.13707
Selva, N., Moleón, M.,
Sebastián-González, E., DeVault, T.L., Quaggiotto, M.M., Bailey, D.M., et al.
2019. Vertebrate Scavenging Communities. In: Olea, P.P.,
Mateo-Tomás, P., Sánchez-Zapata, J.A. (Eds.), Carrion Ecology and
Management, pp. 122-143. Springer, Ciudad Real, España. https://doi.org/10.1007/978-3-030-16501-7_4
Soarimalala, V.,
Goodman, S.M. 2011. Les Petits Nammifères de Madagascar. Association Vahatra, Antananarivo, Madagascar.
Turk, R.D. 1997. Survey and species - screening trials of indigenous trees from
the vicinity of Ranomafana National Park, Madagascar [Tesis de doctorado].
North Carolina State University.
Wenting, E., Rinzema, S.C.Y., Langevelde, F. 2022. Functional differences
in scavenger communities and the speed of carcass decomposition. Ecology and
Evolution 12(2). https://doi.org/10.1002/ece3.8576
Wilson,
E.E., Wolkovich, E.M. 2011. Scavenging: how
carnivores and carrion structure communities. Trends in Ecology Evolution 26(3):
129-135. https://doi.org/10.1016/j.tree.2010.12.011
![]() , José Antonio Sánchez-Zapata2
, José Antonio Sánchez-Zapata2 ![]() ,
Esther Sebastián-González3,4
,
Esther Sebastián-González3,4 ![]()