ecosistemas
ISSN 1697-2473
Open access / CC BY-NC 4.0
© 2025 Los autores [ECOSISTEMAS no se hace responsable del uso indebido de material sujeto a derecho de autor] / © 2025 The authors [ECOSISTEMAS is not responsible for the misuse of copyrighted material]
Ecosistemas 34(2): 2827 [mayo-agosto / May-August, 2025]: https://doi.org/10.7818/ECOS.2827
Editora asociada / Associate editor: Gemma Clemente
ARTÍCULO DE INVESTIGACIÓN / RESEARCH ARTICLE
Efectos
del tipo de bosque y la aridez en la comunidad de artrópodos de bosques de Pinus
y Quercus del Sur de la península ibérica
Ginés Rodriguez1,*  , Cristina C. Bastias1
, Cristina C. Bastias1  , Angela Villar-Ruiz1
, Angela Villar-Ruiz1  , Pablo C. Salazar-Zarzosa1
, Pablo C. Salazar-Zarzosa1  ,
Aurelio Diaz Herraiz1,2
,
Aurelio Diaz Herraiz1,2  , Sergio Pérez-Guerrero3
, Sergio Pérez-Guerrero3  , Vidal Barron4
, Vidal Barron4  , José Luis Quero Pérez5
, José Luis Quero Pérez5  ,
Rafael Villar1
,
Rafael Villar1 
(1)
Área de Ecología, Departamento de
Botánica, Ecología y Fisiología Vegetal, Campus de Rabanales, Universidad de
Córdoba, 14071 Córdoba, España.
(2)
Instituto Federal de Educação,
Ciência e Tecnologia do Amazonas, Campus Humaitá, 69800.000, Amazonas, Brasil.
(3)
Laboratorio de Entomología, IFAPA,
Centro “Las Torres”, Crta. Sevilla-Cazalla de la Sierra, Km 12,2, 41200 Alcalá
del Río (Sevilla), España.
(4)
Departamento de Agronomía, Campus
de Rabanales, Universidad de Córdoba, 14071 Córdoba, España.
(5) Departamento de Ingeniería Forestal, Escuela Técnica
Superior de Ingeniería Agronómica y Montes (ETSIAM), Campus de Rabanales,
Universidad de Córdoba, 14071 Córdoba, España.
*
Autor para correspondencia / Corresponding author:
Ginés Rodríguez [b52rocag@uco.es]
|
> Recibido / Received: 01/08/2024
– Aceptado / Accepted: 01/07/2025
|
Cómo
citar / How to cite: Rodríguez Castilla, G., Bastias, C.C.,
Villar-Ruíz, A., Salazar-Zarzosa, P.C., Díaz Herraiz, A., Pérez-Guerrero, S.,
Barrón, V., Quero Pérez, J.L., Villar, R. 2025. Efectos del tipo de bosque y la
aridez en la comunidad de artrópodos de bosques de Pinus y Quercus
del Sur de la península ibérica. Ecosistemas 34(2): 2827. https://doi.org/10.7818/ECOS.2827
|
Efectos del tipo de bosque y la aridez en la comunidad de
artrópodos de bosques de Pinus y Quercus del Sur de la península
ibérica
Resumen: Los artrópodos representan una alta diversidad faunística
en los bosques, siendo clave en el funcionamiento de los ecosistemas. Su
diversidad y composición puede estar afectada por distintos factores como la
aridez, la estructura forestal y las características del suelo. Sin embargo,
no se conoce el efecto de estos factores sobre la riqueza y composición de
diferentes grupos funcionales de artrópodos en los bosques del Sur de la península
ibérica. Por ello, se realizaron muestreos en Andalucía utilizando parcelas
del Inventario Forestal Nacional con dos niveles de aridez (húmedo y seco) en
bosques con dominancia de: Pinus halepensis, Pinus pinaster, Quercus faginea o Quercus ilex subsp ballota. Se evaluó la estructura forestal y las características
del suelo, así como la riqueza de especies de artrópodos y la proporción de
cuatro grupos funcionales: fitófagos, depredadores, detritívoros y polífagos.
Nuestros resultados indican que cada tipo de bosque presenta unas
características edáficas y estructurales distintas. El tipo de bosque fue
determinante para la riqueza de artrópodos, siendo Q. ilex, el bosque
con mayor riqueza. La riqueza de artrópodos estuvo influenciada
significativamente por la interacción entre la especie forestal y la aridez.
Particularmente, se observaron diferencias de riqueza de artrópodos en los
bosques de Q. ilex y de P. pinaster en función de la aridez
(menor riqueza en parcelas secas), mientras que estas diferencias no fueron
observadas en bosques dominados por Q. faginea y P. halepensis.
En conclusión, la comunidad de artrópodos está influida negativamente por la
aridez, pero este efecto está modulado por la especie forestal dominante.
Palabras clave: arthropoda; cambio climático;
estructura forestal; fertilidad del suelo; grupos funcionales
Effects of
forest type and aridity on the arthropod community in Pinus and Quercus
forests of the southern Iberian Peninsula
Abstract: Arthropods represent a high faunal diversity in forests and play a
key role in ecosystem functioning. Their diversity and composition can be
affected by various factors such as aridity, forest structure, and soil
characteristics. However, the effect of these factors on the richness and
composition of different functional groups of arthropods in the forests of
the southern Iberian Peninsula remains unknown. For this reason, samplings
were conducted in Andalusia using plots from the National Forest Inventory,
considering two levels of aridity (humid and dry) in forests dominated by Pinus
halepensis, Pinus pinaster, Quercus faginea, or Quercus
ilex subsp. ballota. Forest structure and soil characteristics
were evaluated, as well as arthropod species richness and the proportion of
four functional groups: phytophagous, predators, detritivores, and
polyphagous. Our results indicate that each forest type has distinct edaphic
and structural characteristics. Forest type was a key determinant of
arthropod richness, with Q. ilex forests showing the highest richness.
Arthropod richness was significantly influenced by the interaction between
tree species and aridity. Specifically, differences in arthropod richness
were observed in Q. ilex and P. pinaster forests depending on
aridity (lower richness in dry plots), whereas these differences were not
observed in forests dominated by Q. faginea and P. halepensis.
In conclusion, the arthropod community is negatively affected by aridity, but
this effect is modulated by the dominant tree species.
Keywords:
arthropoda; climate
change; soil fertility; functional groups; forest structure
|
Introducción
Los artrópodos representan un alto porcentaje de la
diversidad faunística total de los bosques. Su presencia es clave ya que
realizan una gran variedad de funciones ecosistémicas garantizando el buen
funcionamiento de los bosques. Por ejemplo, dentro de la interacción
artrópodo-planta, se puede considerar la herbivoría mediada por artrópodos
fitófagos, la cual se ha relacionado directamente con funciones ecosistémicas
como el almacenamiento de carbono del ecosistema y la composición de la
comunidad vegetal (Haddad et al. 2009) o si
consideramos las interacciones mutualistas entre artrópodo-planta, tenemos
funciones ecosistémicas importantes como la polinización y la dispersión de
semillas (Corbet 1997). Por otro lado, los
artrópodos descomponedores intervienen directamente en la fragmentación del
material vegetal y animal del bosque dinamizando los ciclos de los nutrientes
en el suelo (Sayer 2005). Por último, la interacción
entre artrópodos o entre artrópodos con animales depredadores y parasitoides es
esenciales para el control poblacional y el mantenimiento de la red trófica (Finke y Denno 2004). Sin embargo, el desempeño de
estas funciones ecosistémicas puede verse amenazado por la reducción de este
grupo de animales ante el escenario de cambio climático actual. Existen escasos
registros de monitoreo de artrópodos en bosques en respuesta al ambiente (Culliney 2013) y los que hay están centrados en órdenes
taxonómicos muy concretos (Peguero et al. 2021). Por
tanto, es importante conocer cómo la diversidad (taxonómica y funcional) de los
artrópodos puede verse afectada por esta crisis climática, lo que supone un
desafío para la comunidad científica si se quiere mantener en equilibrio el
funcionamiento de los bosques (Shivanna 2022).
Las predicciones de los modelos globales climáticos en el
sur de la península ibérica indican un aumento de las temperaturas medias en
los próximos 100 años (Herraiz et al. 2023), olas de
calor más frecuentes e intensas en la época estival y unos patrones de
precipitación variables y poco predecibles que pueden dar lugar a pronunciadas
sequías o lluvias torrenciales (Semenza y Menne 2009).
Andalucía, se encuentra entre las regiones de la península ibérica y de Europa
con mayor riesgo de sufrir los efectos del cambio climático, que puede
desembocar en un incremento de la desertificación. Este aumento de la aridez
puede conducir a una homogeneización funcional y taxonómica de la flora y fauna
de los ecosistemas (Sánchez-Bayo y Wyckhuys
2019; Hulshof et al. 2024).
En zonas cálidas del neotrópico se ha constatado la estrecha
relación que existe entre el aumento de temperatura y la disminución de riqueza
de artrópodos y de grupos funcionales, como los descomponedores (Lister y García 2018). De la misma manera, las
precipitaciones también son un factor determinante para la abundancia de
artrópodos en los ecosistemas (Andrew y Hughes 2005).
Entre los grupos que más se ven afectados por las bajas precipitaciones se
encuentra la fauna edáfica, dado que con un mayor grado de aridez disminuye la
hidratación del suelo y los nutrientes disponibles, afectando negativamente a
la riqueza de artrópodos (Harris et al. 2019). Por
otro lado, los cambios en precipitaciones alteran los procesos de
descomposición, en concreto limitando el crecimiento de hongos y bacterias.
Además, se ralentiza la ruptura de la lignina y celulosa llevadas a cabo por
colémbolos y ácaros, afectando así a las poblaciones de estos artrópodos, y
produciendo un descenso en la biodiversidad e inestabilidad en sus funciones
ecosistémicas (Wise y Lensing 2019).
Además del clima, otro de los factores que puede afectar a
la diversidad de artrópodos es la fertilidad del suelo, a través de la
estructura y biomasa forestal (Souza et al. 2016). Por
ejemplo, un incremento de la biomasa forestal y de sotobosque determina un
aumento de material en descomposición como hojarasca y madera, además de la
formación de diversos microhábitats para las comunidades de artrópodos (Pestana et al. 2020). Factores como la materia
orgánica, la capacidad de retención de agua o el contenido de nutrientes, son
determinantes para la presencia de determinados órdenes taxonómicos de estos
animales. Así, la falta de nutrientes como el fósforo, limita la diversidad de
artrópodos (McGlynn et al. 2007), reduciendo
significativamente la cantidad de órdenes de descomponedores y en menor medida
de depredadores (Sterner y Elser 2002). En ese
sentido, la presencia de algunos grupos como Acari y Collembola se consideran
predictores de la calidad del suelo (Menta y Remelli
2020) y otros órdenes (Coleoptera, Diptera y Araneae) también se han
relacionado con la calidad o contaminación del suelo (Menta
y Remelli 2020).
A menudo, las características químicas del suelo se
relacionan con la roca madre, pero también se asocia a la identidad de la
especie arbórea dominante en las masas forestales, que a través del aporte de
hojarasca y madera muerta modifica la fertilidad del suelo. En el sur de la península
ibérica, los dos géneros forestales más representativos de los bosques
mediterráneos son los géneros Pinus y Quercus (Hernández et al. 2011), géneros que parecen mostrar
diferentes respuestas frente al estrés hídrico asociado al cambio climático (Herraiz et al. 2023). Los bosques dominados por
especies del género Pinus, en ocasiones tienen su origen en
repoblaciones altamente densificadas, realizadas hace 50-75 años (Pemán et al. 2017). A nivel funcional, los bosques de Pinus
halepensis Mill., y Pinus pinaster Ait., destacan por el secuestro
de carbono y la producción de madera debido a sus rápidas tasas de crecimiento
y sus densas masas forestales (Pemán et al. 2017). El
aporte de madera muerta que tienen los bosques de Pinus son elevados, y
las acículas caídas de difícil descomposición por su alto contenido en lignina
y taninos hace que sea menos atractiva para microorganismos y detritívoros,
resultando en una liberación de minerales lenta en comparación a otras especies
forestales. En cambio, esta capa de acículas favorece el mantenimiento de la
humedad en el suelo. Por otro lado, los bosques dominados por Quercus tienen
una importancia ecológica y cultural muy relevante (Marañón
et al 2014; Löf et al. 2016). Estos bosques se
caracterizan por copas de hoja ancha con ramificaciones complejas y sistemas de
raíces profundas, y pueden superar a los bosques de Pinus en
biodiversidad. Además los bosques de Quercus suelen ser más fértiles (Alameda et al. 2012) gracias a los nutrientes de sus
hojas y a una menor relación de Carbono/Nitrógeno que las acículas de Pinus,
lo que aumenta el contenido en materia orgánica en el suelo y favorece la
producción de matorral y pasto (Alameda et al. 2012;
da Silva et al. 2019; Landuyt
et al. 2020).
Por tanto, ambos géneros se diferencian claramente
estructural y funcionalmente, así como en la heterogeneidad ambiental que
pueden generar a su alrededor (Ampoorter et al. 2016;
Bastias et al. 2019). Aun así, dentro del género
también se encuentran ciertas diferencias funcionales entre identidades de
especies, sobre todo en aquellos donde las especies aun perteneciendo al mismo
género tienen diferentes estrategias de vida (e.g. Q. faginea Lam. vs. Q.
ilex L., marcescente vs. perennifolia, respectivamente). Q. ilex funcionalmente
se considera una especie más conservadora en el uso de recursos (con hojas más
densas y esclerófilas), localizada en condiciones de menor disponibilidad de
agua frente a Q. faginea, la cual es considerada una especie más
adquisitiva (hojas menos densas y gruesas reduciendo el contenido en materia
seca) que se localiza en zonas más húmedas donde la tasa de descomposición y la
disponibilidad de nutrientes puede ser más elevada (de
la Riva et al. 2014). La diferencia entre bosques caducifolios/marcescentes
vs. perennifolios, puede modificar la fertilidad del suelo y la cantidad y
calidad de hojarasca y madera muerta aportada, material consumible para
numerosos órdenes de artrópodos. Es así como, no sólo el género, sino que
también la especie forestal se convierte en uno de los factores críticos que
condicionan la riqueza y la composición de las comunidades de artrópodos en
bosques (O'Brien et al.
2017; Bastias et al. 2025). Sin embargo,
el efecto que tiene la especie forestal y su interacción con la aridez en la
riqueza y la composición de comunidades de artrópodos ha sido poco estudiado (Culliney 2013).
Este trabajo plantea
abordar los siguientes objetivos específicos: (i) comparar las características
del suelo y de la estructura forestal entre las cuatro especies forestales
dominantes en Andalucía (P. halepensis, P. pinaster, Q. faginea y Q. ilex),
(ii) establecer cuáles son los factores (tipo de bosque, aridez, propiedades
del suelo y estructura forestal) que condicionan la riqueza de artrópodos y
(iii) estudiar cómo estos mismos factores influyen en la composición de los
diferentes grupos funcionales de artrópodos (fitófagos, depredadores,
detritívoros y polífagos). La hipótesis fundamental de este estudio es que la
aridez tiene un efecto negativo sobre la riqueza y composición de los
artrópodos en bosques del sur de la península ibérica y que este efecto está
mediado también por el tipo de bosque, los cuales tienen características
estructurales y edáficas específicas.
Material y Métodos
Área de estudio
Localizada en el sur occidental
de Europa y con 87.268 km2, Andalucía (36 - 38.75 N, y 7.37 - 1.53
O, WGS84, Fig. 1) es la región más meridional y
la segunda más grande de España (López Tirado e
Hidalgo 2016). Andalucía tiene un clima mediterráneo, caracterizado por
veranos calurosos y secos (AEMET 2011), pero su alta
variabilidad orográfica hace que aparezcan tipos climáticos contrastantes lo
que explica en parte su alta biodiversidad (Anaya-Romero
et al. 2016). Hay un fuerte gradiente bioclimático desde el Paraje Natural
Sierra de Alhamilla (36.98 N, 2.35 O, en el este de Andalucía), con menos de
300 mm de precipitación anual acumulada y 20 ºC de temperatura media anual,
hasta el Parque Nacional de Grazalema (36.73 N, 5.37 O, oeste de Andalucía) con
2200 mm de precipitación anual acumulada y 17 ºC de temperatura media anual (AEMET 2011).
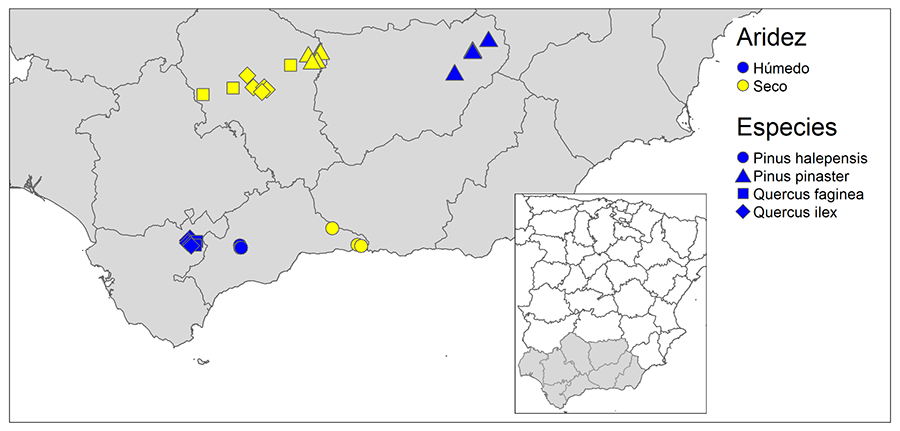
Figura 1. Distribución de las parcelas
seleccionadas para las cuatro especies forestales estudiadas (símbolos
diferentes para cada una de ellas) en dos situaciones contrastadas de aridez:
Húmedas (Azul) y Secas (Amarillo) en el sur de la península ibérica.
Figure 1. Distribution of the plots selected for the four forest species
studied (different symbols for each of them) in two contrasting situations of
aridity: Wet (Blue) and Dry (Yellow) in the south of
the Iberian Peninsula.
Selección de parcelas
Para el desarrollo de la investigación se utilizó la red de
parcelas del tercer Inventario Forestal Nacional Español (IFN3 2006-2007), una
iniciativa nacional que estudia una red de parcelas permanentes de seguimiento
forestal en todo el territorio nacional, caracterizadas por tener 25 m de radio
y una distribución espacial de una parcela por km2 en la superficie
forestal española (Alberdi et al. 2016).
De todas las parcelas del IFN3 de Andalucía, se
seleccionaron parcelas monoespecíficas dominadas por P. halepensis, P.
pinaster, Q. faginea y Q. ilex subsp ballota. Para considerar que
las parcelas eran monoespecíficas, al menos un 85 % de la biomasa total de la
parcela [calculada en base al diámetro a la altura del pecho de los árboles del
IFN3 siguiendo las ecuaciones alométricas de Montero et
al. (2005)] estaba representada por una de las especies de interés. Las
parcelas se eligieron en zonas con algún tipo de protección como Parque
Nacional o Parque Natural (excepto las parcelas de la Sierra Cordobesa, pero
que tenían un uso y estructura similar a las de zonas conservadas). La razón
por la que se realizó en zonas protegidas se debió al hecho de la dificultad de
acceder a parcelas privadas en Andalucía, donde la mayoría de las parcelas
están valladas y es complicado conseguir los datos de la propiedad de las
fincas. Al elegir las parcelas en zonas conservadas, se pudo contactar con los
propietarios y obtener el permiso de entrada gracias a la ayuda de los
directores-conservadores y agentes de medio ambiente. Además, la selección tuvo
en cuenta la accesibilidad y la ausencia de otras alteraciones, cómo incendios,
que a lo largo de los últimos años hubiera podido afectar al ecosistema.
Posteriormente, para cada parcela
se calculó el índice de aridez modificado de Martonne (AIm) atendiendo a la
siguiente fórmula (Stephen 2005):
AIm
= {[MAP] / [MAT + 10]} + {[12 × DMP] / [DMT + 10] / 2}
Dónde, MAP es la precipitación anual, MAT es la temperatura
media anual, DMP y DMT son la precipitación y temperatura del mes más seco,
respectivamente.
Estas variables fueron calculadas a partir de un promedio de
30 años obtenido de Worldclim 2.1 (1970-2000) (Fick y
Hijmans 2017). Dado que los valores más altos de AIm indican una alta
disponibilidad de agua, transformamos esta variable de la siguiente manera: AI
= 100-AIm. La transformación de AI (100 − AIm) es completamente lineal y no
afecta a los resultados (Salazar-Zarzosa et al.
2021).
Una vez obtenido el valor del
índice de aridez se clasificaron las parcelas a lo largo del rango de aridez en
Andalucía para cada tipo de bosque, lo cual nos permitió diferenciar entre
parcelas húmedas y parcelas secas, restringiéndonos a aquellas localizadas
dentro de zonas conservadas (Fig. A1 del
Anexo). Finalmente, seleccionamos entre 3 y 5 parcelas por especie forestal en
cada categoría de aridez. Además, se procuró que las parcelas para cada tipo de
bosque y categoría de aridez estuvieran situadas en la misma zona conservada,
para evitar influencias de distintos tipos de suelo, manejo, etc. Se procuró
que las parcelas dentro del mismo tipo de bosque y categoría de aridez no
estuvieran muy cercanas, de forma que la distancia entre ellas fuera suficiente
para evitar problemas de pseudoreplicación (la distancia media ± SD fue 9.1 ±
7.1 km). En definitiva, se muestrearon 6 parcelas de P. halepensis, 8 de
P. pinaster, 6 de Q. faginea y 9 parcelas de Q. ilex (Fig. 1; Tabla 1),
resultando en un total de 29 parcelas. Un resumen de las características de las
parcelas seleccionadas de cada lugar se puede encontrar en la Tabla
1. De las 29 parcelas seleccionadas en este estudio, 24 parcelas son
clasificadas como “bosques naturales” y sólo 5 (de 3 P. pinaster y 2 de P.
halepensis) como “bosques de plantación”. Sin embargo, la denominación de
“bosque natural” hace referencia al grado de naturalización y no al origen del
bosque por lo que no podemos decir con seguridad si los bosques del género Pinus
fueron plantados o no. Un análisis preliminar encontró que las categorías de
parcelas secas y húmedas para cada especie forestal difirieron estadísticamente
en el índice de aridez (p=0.002 en P. pinaster y p<0.001
para el resto de las especies, test de Tuckey-Kramer) (Fig.
A1 del Anexo).
Tabla 1. Resumen de
las características climáticas y de localización de las parcelas utilizadas
para el muestreo. Se indican los valores medios ± desviación estándar. Grado de
aridez: Húmedo (H), Seco (S). AI: índice de aridez derivado del índice de
aridez de Martonne (Stephen 2005), con valores
altos indicando mayor aridez.
Table
1. Summary of the climate and location
characteristics of the plots used for sampling. Average values ± standard
deviations are indicated. Degree of aridity: Humid (H), Dry (S). AI: aridity
index derived from the Martonne aridity index (Stephen
2005), with higher values indicating higher aridity.
Muestreo de artrópodos
Se realizó un único muestreo de artrópodos en cada una de
las parcelas seleccionadas, entre los meses de mayo y octubre de 2021 y 2022,
coincidiendo con la época de mayor temperatura y menor precipitación en
Andalucía. El muestreo se realizó en días soleados, específicamente en las
horas de mayor insolación (10-14 horas; hora solar).
Dentro de cada parcela, se trazaron tres transectos lineales
de 20 m, perpendiculares a la pendiente y paralelos entre sí, separados 10 m (uno de ellos pasando por el centro de la parcela). La
captura de artrópodos se realizó recorriendo
los tres transectos lineales hasta 1 m de ancho a ambos lados de la línea, en
dos estratos: (i) sobre la vegetación leñosa donde se recogían artrópodos
presentes en los arbustos y árboles con un aspirador InsectaZooka Field Aspirator (BioQuip Products, California, EE.
UU.) y (ii) epiedáfico, en el cual se recogieron los artrópodos del medio
mediante un aspirador manual. El tiempo dedicado al muestreo fue de una hora
para cada estrato y parcela (20 minutos por transecto). Para el análisis de
datos se consideró la suma total de morfoespecies de los dos estratos
(vegetación leñosa y epiedáfico).
Los ejemplares recogidos en campo
se conservaron en tubos con alcohol al 96 %.
Una vez en el laboratorio, la identificación
de los artrópodos se realizó inicialmente a nivel de Orden, y seguidamente pudieron
identificarse a nivel de especie o morfoespecie, obteniendo así la
variable riqueza de especies. Además, se procedió a clasificar los artrópodos según su
grupo funcional trófico, obteniendo la proporción
de cuatro grupos funcionales,
dividiendo la riqueza de especies de cada grupo funcional entre la riqueza
total. Los cuatro grupos funcionales considerados fueron: 1) fitófagos o insectos
herbívoros, que explotan diversas partes de las plantas (Pérez-Contreras 1999); 2) depredadores, los
cuales se alimentan de animales al menos en uno de sus estadios vitales (Urbaneja et al. 2005); 3) detritivoros, que
degradan o fragmentan los restos de materia orgánica vegetal (Graça et al. 2001); 4) polífagos o multifuncional,
en el que se incluyen otras especies de artrópodos polífagos y ecológicamente
complejos, como las hormigas (Del Toro et al. 2012).
Textura y fertilidad del suelo
Para medir las características
fisicoquímicas del suelo, se tomaron aleatoriamente 5 muestras de suelo dentro
de cada parcela en el año de muestreo (2021-2022), tanto en cielo abierto
como bajo el dosel, eliminando previamente la capa de hojarasca. Estas
muestras fueron secadas al aire y conservadas hasta su determinación analítica.
Una vez en el laboratorio, se realizó una mezcla compuesta de las muestras
recogidas, una para el cielo abierto y otra bajo el dosel. Posteriormente se
tamizaron, (tamaño de partículas de menos de 2 mm) y se procedió a medir: pH
(pHmetro digital, Crison Instruments SA, GLP21), textura (método del densímetro
de Bouyoucos), conductividad eléctrica (conductímetro digital, Crison
Instruments SA, micro-CM 2200, proporción 1:5), materia orgánica (método de
Walkley-Black), humedad higroscópica, microelementos como el hierro, cobre,
zinc, manganeso (Método de Lindsay y Norvell) y macroelementos como el sodio,
calcio, potasio y magnesio (método del acetato amónico), así como el nitrógeno,
azufre y carbono edáfico, siguiendo los protocolos estandarizados (Guitián Ojea y Carballas 1976) (Tabla 2).
Estructura forestal
Nuestro muestreo de la estructura forestal en cada parcela
seleccionada del IFN en el año 2021-2022 consistió en la medida de los
diámetros a la altura del pecho (DAP) de todos los árboles con más de 75 mm de
diámetro dentro de la parcela. A diferencia del muestreo típico del IFN donde
los árboles son medidos en función de su tamaño en diferentes parcelas
concéntricas.
Posteriormente, mediante ecuaciones alométricas forestales
específicas para cada una de las especies se calculó la biomasa total aérea a
nivel de individuo, y mediante el sumatorio de la biomasa de todos los
individuos en la parcela se obtuvo la biomasa arbórea aérea de la parcela en Mg
ha-1 (Montero et al. 2005) (Tabla 2). La producción forestal aérea (Mg ha-1
año-1) se calculó como la diferencia de biomasas entre los árboles
del IFN3 que seguían vivos en el 2021-2022 y la biomasa del IFN3 (2006-2007).
Este resultado se dividió entre el número de años transcurridos entre ambas
mediciones (Tabla 2).
Además, en los años de
muestreo 2021-2022, se hizo una caracterización del sotobosque en los mismos
tres transectos lineales del muestreo de artrópodos. La caracterización
consistió en la identificación de todas las especies leñosas de matorral
encontradas a partir de la cual se calculó la riqueza. También, se estimó el
porcentaje de cobertura de cada una de las especies y la altura media por
especie (tomando un máximo de diez individuos). Con los datos de porcentaje de
cobertura (en porcentaje) y altura media (en dm), se calculó la biomasa (Mg ha-1)
y la producción del sotobosque (Mg ha-1 año-1) a nivel de
parcela utilizando las ecuaciones alométricas para las formaciones de matorral
de la España peninsular y balear que se encuentran recogidas en Montero et al. (2020, página 151, nótese que hay un
error en la fórmula de la productividad del sotobosque en el libro) (Tabla 2). Las fórmulas son las siguientes:
Biomasa sotobosque =
1.6894 * {Altura media sotobosque * arcoseno [(Cobertura/100)]1/2}0.9117
Producción sotobosque (Mg ha-1 año-1)
= 0.6605 * Altura media del sotobosque * 0.4348 * arcoseno
[(Cobertura/100)1.6818]1/2
El volumen de madera
muerta (m3), se estimó mediante la medición del largo y ancho de
cada rama de madera muerta interceptada por los transectos lineales donde se
midió el matorral. Luego, se calculó el volumen de madera muerta asumiendo una
forma de cilindro. El valor a nivel de parcela se calculó como el sumatorio de
todos los volúmenes de madera muerta (Tabla 2).
La cantidad de hojarasca media (kg m-2) se
calculó a partir del peso seco (estufa a 60 ° C) de 5 puntos aleatorios dentro
de cada parcela (cuadro metálico de 0.25 × 0.25 m) (Tabla 2).
Todas las variables consideradas, así como sus unidades y
los métodos de cálculo usados se recogen en la Tabla 2.
Tabla 2. Resumen de
las variables climáticas, edáficas y de estructura forestal, así como las
unidades, el método de cálculo y las abreviaturas utilizadas en los análisis.
Table
2. Summary of climate, edaphic and forest structure
variables, as well as units, calculation method and abbreviations used in the
analyses.
Análisis estadístico
Para abordar el primer objetivo sobre la evaluación de las
diferencias entre los cuatro tipos de bosque en términos de características del
suelo y estructura forestal, se llevaron a cabo dos análisis de componentes
principales (PCA) independientes, uno con las variables medidas de las
propiedades del suelo y otro con las variables relacionadas a la estructura
forestal de las masas. Antes de hacer el PCA todas
las variables fueron estandarizadas para que fueran comparables en magnitud
entre ellas.
Para el PCA del suelo se
incluyeron las variables: pH, conductividad eléctrica (CE), carbono orgánico
(CO), humedad higroscópica (HH), micronutrientes (Fe, Zn, Mn, Cu),
macronutrientes (N, S, Mg, Ca, Na y K). Posteriormente, utilizando los dos
primeros componentes del análisis PCA, se crearon dos nuevas variables
ortogonales (no correlacionadas) llamadas PC1Suelo y PC2Suelo que sintetizan la
información clave del suelo sin perder la variabilidad original de los datos. La textura del suelo no se incluyó en el PCA, ya
que representa una característica estructural, que conviene analizar de forma
independiente, ya que el resto de las características son de tipo físico o
químico. Para el PCA de estructura forestal, se incluyeron las variables
bióticas: biomasa forestal, producción forestal, biomasa de sotobosque,
producción del sotobosque, riqueza de especies del sotobosque, cantidad de
hojarasca y madera muerta. De forma similar, se extrajeron las dos variables
nuevas llamadas PC1Bos y PC2Bos.
A continuación, para evaluar diferencias en las
características de suelo y la estructura forestal por tipo de bosque, las
nuevas variables extraídas de los PCAs con distribución normal se analizaron
mediante ANOVAs de una vía, utilizando primero el género (dos niveles; Pinus
vs. Quercus) de la especie forestal dominante y posteriormente la especie
forestal dominante como variable explicativa (cuatro niveles; P. halepensis,
P. pinaster, Q. ilex y Q. faginea). En este último caso, cuando la
variable especie forestal resultó significativa, se aplicó un test post-hoc
de Tukey-Kramer, para diseños desbalanceados (réplicas de cada grupo no
iguales), incluido en el paquete de Rstudio (R Core Team
2021) llamado “stats” con la función TukeyHSD para determinar las
diferencias entre las especies forestales.
En el objetivo dos y tres de este estudio analizamos si
existían diferencias en la riqueza y la composición de grupos funcionales de
artrópodos en función de la interacción entre tipo de bosque y aridez, así como
con las características del suelo y la estructura forestal. El primer paso fue
comprobar la normalidad de las variables de respuesta (riqueza de especies de
artrópodos y proporción de cada grupo funcional dentro de la comunidad)
incluido en el paquete de Rstudio (R Core Team 2021)
llamado “rriskDistributions” (Belgorodski et al.
2017). Con el argumento fit. cont, establecimos que distribución seguían
cada una de las variables respuesta, obteniendo una distribución tipo Poisson
para la variable de riqueza de especies, y distribución de tipo gaussiana para
todas las variables que incluyen proporciones de cada grupo funcional de
artrópodos.
Para abordar el objetivo
dos, se llevó a cabo un modelo lineal generalizado (GLM) utilizando la riqueza
de especies de artrópodos como variable respuesta y como variables predictoras
el tipo de bosque (categórica, cuatro niveles) y aridez (categórica, seco o
húmedo) y su interacción, junto con las variables de estructura forestal (PC1Bos,
PC2Bos) y de suelo (PC1Suelo, PC2Suelo)
obtenidas de los PCAs previos y detalladas en la Tabla 2. El modelo lineal generalizado permite analizar variables que siguen
una distribución diferente a la normal, como es la variable riqueza de
especies, la cual expresa conteo de especies siguiendo una distribución de
Poisson. Esto se llevó a cabo utilizando la función ‘glm’ del paquete de R
‘stats’ (R
Core Team 2021). Se partió del
modelo completo con todas las variables antes mencionadas para posteriormente
simplificar de forma secuencial eliminando aquellas variables que no resultaban
significativas utilizando la función ‘step’ en el
paquete de Rstudio “stats” (R Core Team 2021), hasta llegar al modelo de máxima parsimonia con el AIC (Akaike
Information Criterion; Akaike 1983) más bajo.
De forma similar, en el
objetivo tres, evaluamos como la interacción del tipo de bosque y aridez junto
con las variables de estructura forestal (PC1Bos, PC2Bos)
y de suelo (PC1Suelo, PC2Suelo) afectan a variaciones, en
este caso, en las proporciones de grupos funcionales de artrópodos utilizadas
como variables respuesta. Como las proporciones de grupos funcionales seguían
una distribución normal, aplicamos diferentes modelos lineales generalizados
entre las variables predictoras y las de respuesta, utilizando la familia
gaussiana, hasta llegar al modelo de máxima parsimonia con el AIC (Akaike
Information Criterion; Akaike 1983) más bajo.
Por último, se analizó la relación que podía existir entre
las proporciones de los diferentes grupos funcionales. Para ello, mediante un
análisis de regresión lineal se enfrentaron las diferentes proporciones de
grupos funcionales de artrópodos. Su relación se estimó mediante el modelo
lineal incluido en el paquete de Rstudio llamado “stats” (R
Core Team 2021).
Todos los análisis estadísticos y gráficos se realizaron
mediante R software v.4.1.2 (R Core Team 2021).
Resultados
Diferencias en las características del suelo y de
la estructura forestal por tipo de bosque
La varianza absorbida por los dos primeros componentes
principales integrando las características fisicoquímicas del suelo fue
elevada, con un total de 62.4 % (PC1Suelo: 41.8 % y PC2Suelo:
20.6 %) (Fig. 2). Las variables edáficas más
determinantes en el PC1Suelo fueron: la humedad higroscópica, el
nitrógeno, el carbono orgánico y el potasio (macronutrientes) (Fig. A2 del Anexo). Para el PC2Suelo,
las variables más determinantes fueron: el pH, manganeso, hierro y zinc
(micronutrientes) (Fig. A2 del Anexo).
Los resultados de los
ANOVAs indicaron diferencias entre los dos géneros forestales (Pinus y Quercus).
Los bosques dominados por el género Pinus y Quercus, reflejaron
ser distintos significativamente en las dos dimensiones del PCA edáfico (PC1Suelo
p=0.011; PC2Suelo p=0.017) presentando los suelos de
bosques de quercíneas una mayor cantidad de nutrientes (macro y micro) y una
mayor humedad higroscópica (Fig. 2). A nivel de especie forestal, también encontramos diferencias
significativas en las características químicas del suelo. Se hallaron amplias
diferencias entre Q. ilex y P. pinaster en el PC1Suelo,
(p=0.001), presentando los bosques de Q. ilex una mayor cantidad
de nutrientes (N y K) y una mayor humedad higroscópica (HH) que los de P.
pinaster. Además, los bosques de Q. ilex y P. halepensis
presentaron diferencias significativas en el PC2Suelo (p=0.03),
presentando los bosques de Q. ilex una mayor cantidad de micronutrientes
(Mn, Zn, Fe) y un pH más ácido con respecto a los de P. halepensis. En
consideración a la textura, los suelos de los bosques de Q. ilex,
tuvieron texturas más arcillosas (39.4 ± 10.3 %), mientras que los dominados
por P. pinaster presentaron menor proporción de arcilla (18.1 ± 12.4 %; p
<0.001) (Fig.
A3 del Anexo).
En relación con las diferencias en estructura forestal, el
análisis de componentes principales nos indicó que el porcentaje de varianza
absorbida por los dos primeros componentes principales fue un total de 58.4 %
(PC1Bos: 37.3 % y PC2Bos: 21.1 %) (Fig.
3). Las variables de la estructura forestal más determinantes en el PC1
fueron; la biomasa y producción del sotobosque, además del peso de la hojarasca
en menor medida (Fig. A2B del Anexo).
Para el PC2, las variables más determinantes fueron: la biomasa y
producción forestal (Fig. A2B del Anexo).
A nivel de estructura forestal,
los bosques dominados por Quercus y Pinus se diferenciaron
significativamente a nivel del PC1Bos, presentando los bosques de Quercus
una mayor biomasa y producción del sotobosque (p=0.002) con respecto a
los bosques de Pinus (Fig. 3A). Para el PC2Bos,
que dependía de la biomasa y producción forestal, los bosques de Pinus y
Quercus no reflejaron diferencias significativas (p=0.42). Las
diferencias a nivel de género en el PC1Bos estaban determinadas
principalmente por las encontradas a nivel de especie forestal entre las dos
especies de Pinus, y Q. ilex (p=0.02 para P. halepensis
y p=0.005 para P. pinaster) (Fig. 3B).
La biomasa y producción del sotobosque y el peso de la hojarasca fueron
notablemente superiores en los bosques de Q. ilex, e inferiores en los
bosques de pinos.
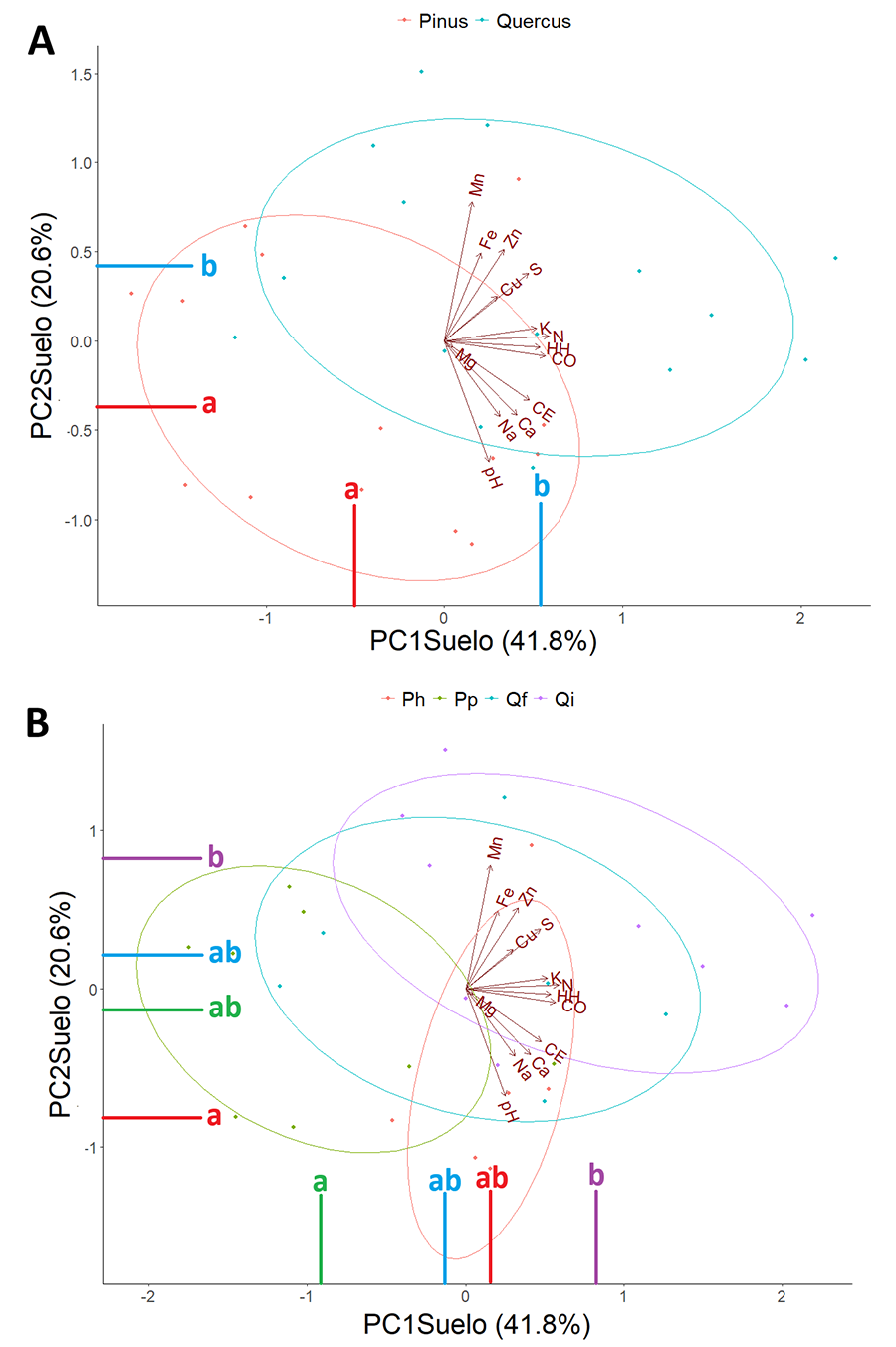
Figura 2. Análisis de componentes principales
de las características del suelo con representación de los dos primeros
componentes principales (PC1 Suelo
y PC2 Suelo). A) Distribución de
las parcelas a nivel de género forestal. B) Distribución de las parcelas a
nivel de especie forestal (Ph: P. halepensis; Pp: P. pinaster; Qf:
Q. faginea; Qi: Q. ilex). Con letras distintas se indican las
diferencias estadísticas analizadas mediante test de Tukey (p<0.05)
entre los grupos. Ver significado de las abreviaturas de las variables en Tabla 2.
Figure 2.
Principal component analysis of soil characteristics with representation of the
first two principal components (PC1Soil y PC2Soil). A) Distribution of plots at the forest genus level. B)
Distribution of the plots at the level of forest species (Ph: P. halepensis;
Pp: P. pinaster; Qf: Q. faginea; Qi: Q. ilex).
Different letters indicate the statistical differences analyzed by the Tukey
test (p<0.05) between
the groups. See the meaning of the variable abbreviations in Table 2.
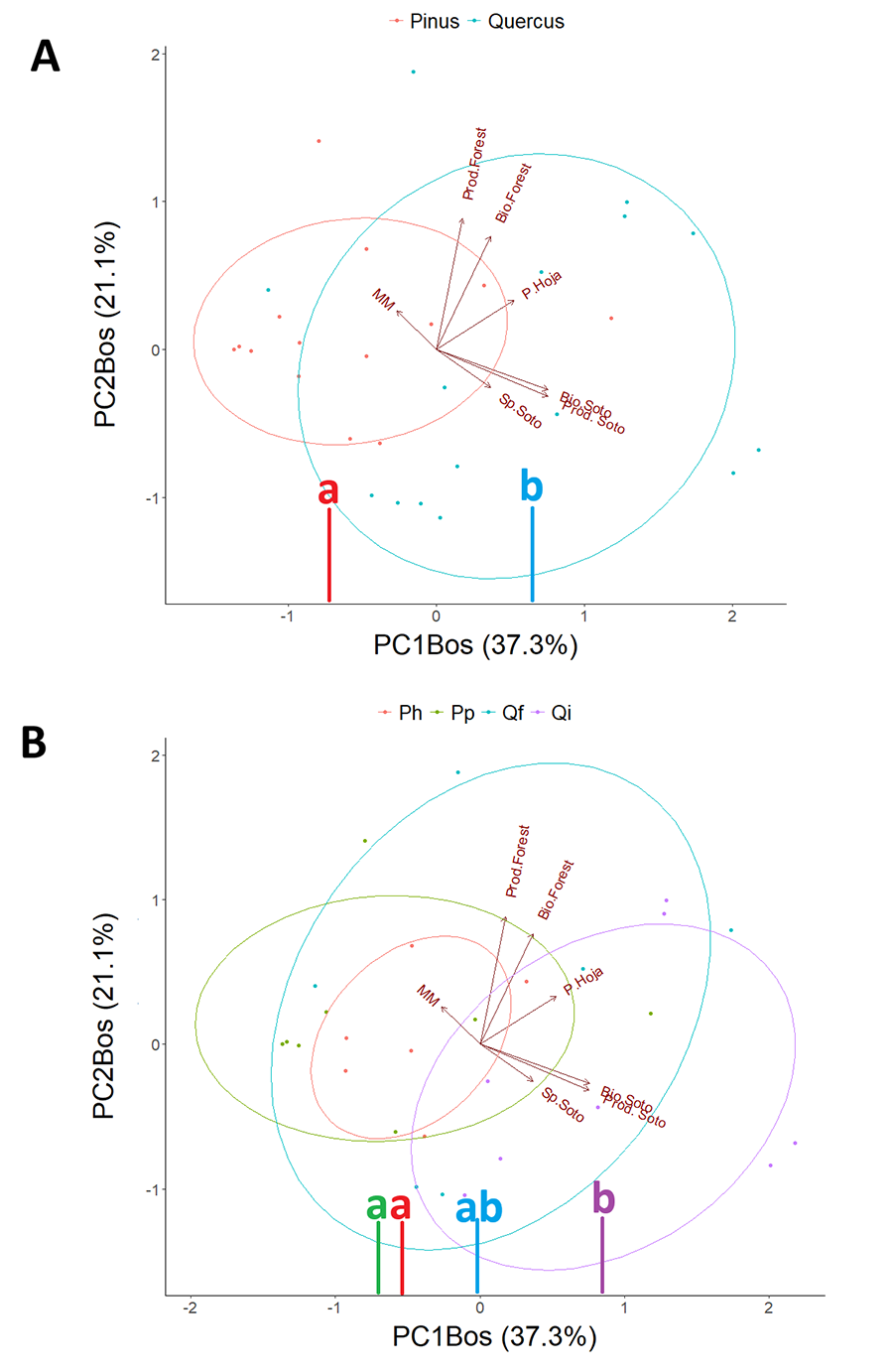
Figura 3. Análisis de componentes principales
de la estructura forestal con representación de los dos primeros componentes
principales (PC1 Bos y PC2 Bos). A) Distribución de las
parcelas a nivel de género forestal. B) Distribución de las parcelas a nivel de
especie forestal (Ph: P. halepensis; Pp: P. pinaster; Qf: Q.
faginea; Qi: Q. ilex). Con letras distintas se indican las
diferencias estadísticas encontradas mediante test de Tukey (p<0.05)
entre los grupos. Ver significado de las abreviaturas de las variables en Tabla 2.
Figure 3.
Principal component analysis of forest structure with representation of the
first two principal components (PC1Bos and PC2Bos). A) Distribution of plots at the forest genus level. B)
Distribution of the plots at the level of forest species (Ph: P. halepensis;
Pp: P. pinaster; Qf: Q. faginea; Qi: Q. ilex). Different
letters indicate the statistical differences found by the Tukey test (p<0.05)
between the groups. See the meaning of the variable abbreviations in Table 2.
Riqueza de artrópodos y los efectos de la aridez,
estructura forestal y las propiedades edáficas sobre ésta
La riqueza total de artrópodos
muestreados fue de 200 especies o morfoespecies pertenecientes a 18 grupos
taxonómicos distintos, siendo los más numerosos tanto en abundancia cómo en
riqueza, el suborden Auchenorrhyncha y los órdenes Araneae, Diptera e Hymenoptera.
Un resumen de las características de la comunidad de artrópodos en parcelas
seleccionadas se puede encontrar en la Tabla 3.
Tabla 3. Resumen de las
características de la comunidad de artrópodos en las parcelas estudiadas. Se
indican los valores medios ± desviación estándar. Grado de aridez: Húmedo (H),
Seco (S). Riqueza de especies, Riqueza de grupos taxonómicos (órdenes,
subórdenes o familia), Proporción de cada grupo funcional (%); Depredadores,
Detritívoros, Fitófagos y Polífagos.
Table 3. Summary of the characteristics of the arthropod community in the studied plots. Average values ± standard
deviations are indicated. Degree of aridity: Humid (H), Dry (S). Species
Richness, Taxonomic group richness, Proportion of each functional group (%);
Detritivores, Polyphagous, Phytophagous and Predators.
El modelo lineal generalizado
seleccionado (AIC más bajo) indicó que la
riqueza de artrópodos estaba afectada significativamente por la especie
forestal (p<0.001) y su interacción con la aridez (p<0.001)
(Tabla A1 del Anexo). De forma independiente, la
aridez no tuvo efecto significativo sobre la riqueza de artrópodos (p=0.41)
(Fig. 4A). En general, los bosques de Q. ilex
presentaron una mayor riqueza de artrópodos que los bosques de Pinus (p=0.003
para P. halepensis y p<0.001 para P. pinaster) (Fig. 4B). Además, se encontró que la riqueza de
especies fue significativamente mayor en las parcelas clasificadas como húmedas
con respecto a las secas en los bosques de Q. ilex (p=0.004) y de
P. pinaster (p<0.001) (Fig. 4C).
Las parcelas dominadas por Q. faginea y P. halepensis, presentaron
la misma riqueza independientemente del grado de aridez (Fig.
4C). Por otra parte, no tuvieron efecto significativo sobre la riqueza
de artrópodos, ni las características de suelo (PC1suelo y PC2suelo)
ni las de estructura forestal (PC1Bos y PC2Bos) (Tabla A1 del Anexo).
Grupos funcionales de artrópodos y los efectos de
la aridez, estructura forestal y las propiedades edáficas
Los resultados indicaron que los depredadores forman
aproximadamente el 50-60 % de las especies de la comunidad de artrópodos en
todos los tipos de bosques analizados (Fig. 5A).
Los depredadores encontrados fueron fundamentalmente arácnidos, y en menor
medida, himenópteros no formícidos (estrato vegetativo) y quilópodos (estrato
epiedáfico). La proporción de fitófagos estuvo representada por entre un 10-30 %
del total de artrópodos recolectados en los diferentes tipos de bosques (Fig. 5C). La mayoría de las especies se encontraron
en el estrato vegetativo, estando compuesto por distintos órdenes como:
Auchenorrhyncha, dípteros, ortópteros y algunas especies de coleópteros. La
proporción de detritívoros en las comunidades forestales fue muy variable 0-30 %
(Fig. 5B). Este grupo fundamentalmente se
encontró en el estrato epiedáfico, y estuvo dominado fundamentalmente por
diplópodos, isópodos, blatodeos y algunas especies de coleópteros. El grupo
multifuncional o polífagos fue el más escaso con una proporción aproximada del
10 % de la comunidad (Fig. 5D). La práctica
totalidad de las especies del grupo de polífagos son formícidos y muy pocas
especies de coleópteros.
No se encontró ningún efecto significativo de la aridez, el
tipo de bosque o las variables edáficas y de estructura forestal sobre la
proporción de los grupos funcionales estudiados (Tabla A2
del Anexo).
Por último, al relacionar entre
sí los cuatro grupos funcionales de artrópodos, se encontró una relación
significativamente negativa entre la proporción de depredadores y la proporción
de fitófagos (p<0.001) y polífagos (p=0.002);
sin embargo, no tuvo ninguna relación con los detritívoros. La proporción de
fitófagos estuvo relacionada negativamente con la proporción de detritívoros (p=0.014)
(Fig. A4 del Anexo).
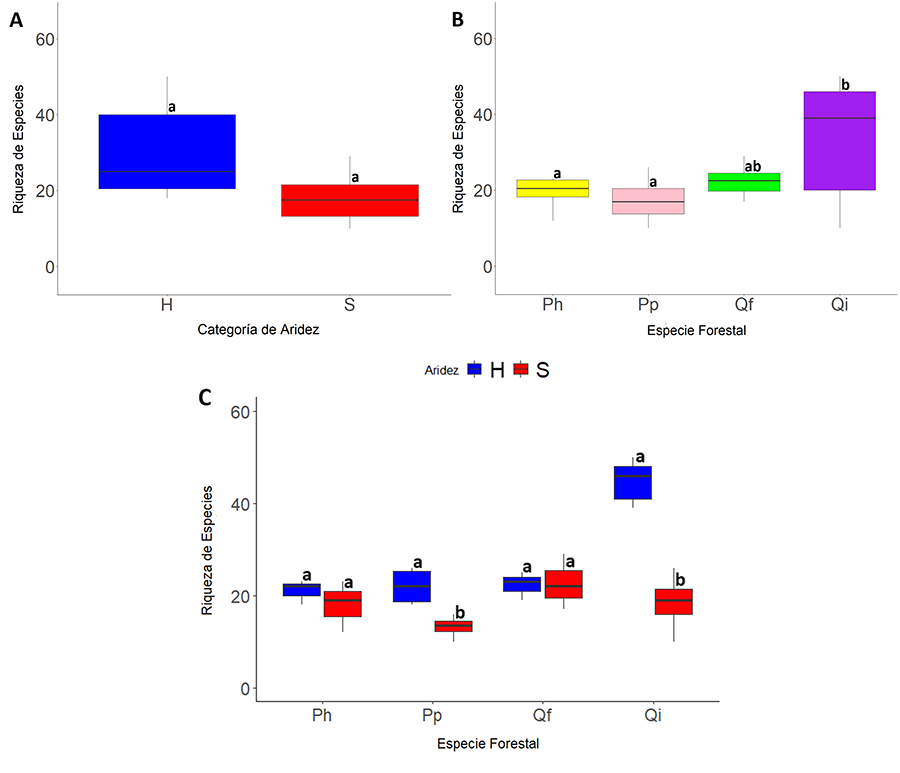
Figura 4. Variación de la riqueza de morfoespecies
de artrópodos con (A) el grado de aridez (H: húmedo; S: seco), (B)
la especie forestal, (C) grado de aridez para cada especie forestal.
(Ph: P. halepensis; Pp: P. pinaster; Qf: Q. faginea; Qi: Q.
ilex). Con letras distintas se indican las diferencias estadísticas
encontradas mediante test de Tukey (p<0.05) entre los dos grados de
aridez para cada especie forestal.
Figure
4. Variation of the number of arthropod
morphospecies with (A)
the degree of aridity (H: humid; S: dry), (B) the forest species, (C) degree of aridity for each forest species. (Ph: P. halepensis;
Pp: P. pinaster; Qf: Q. faginea; Qi: Q. ilex). Different letters indicate
the statistical differences found using the Tukey test (p<0.05) between the two degrees of
aridity for each forest species.
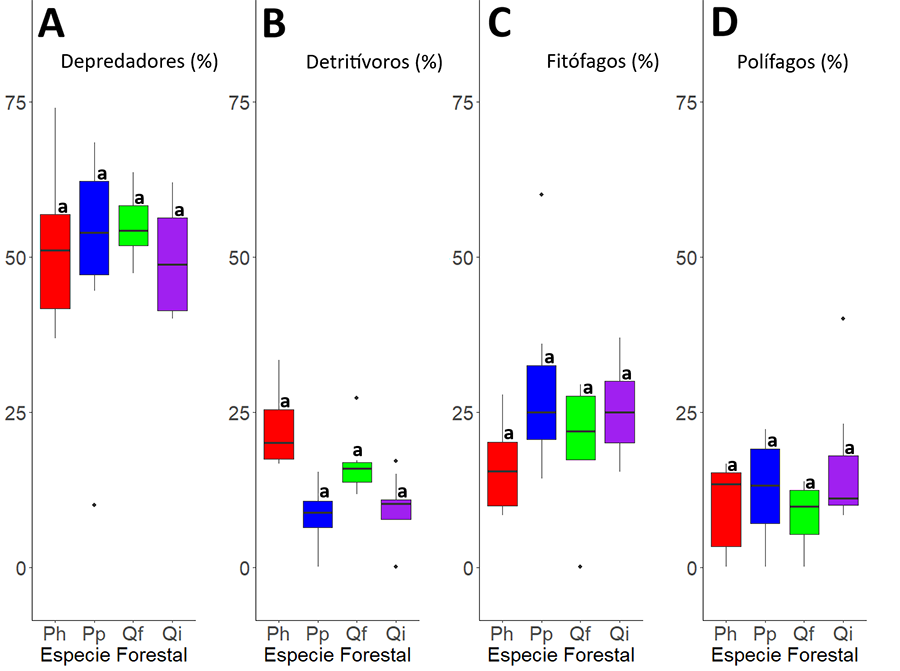
Figura 5. Variación de la proporción de
depredadores (A), detritívoros (B), fitófagos (C) y polífagos (D) con relación
al tipo de bosque. Grupos con distintas letras indican que hay diferencias
significativas (p<0.05).
Figure
5. Variation in the proportion of predators (A),
detritivores (B), phytophagous (C) and polyphagous (D) in relation to the type
of forest. Groups with different letters indicate that there are significant
differences (p<0.05).
Discusión
El presente estudio muestra evidencias de las diferencias en
estructura forestal y suelo de los bosques estudiados, además se ha constatado
que la riqueza de la comunidad de artrópodos está afectada por la especie
forestal dominante de la masa en interacción con el grado de aridez. Por el
contrario, no encontramos variación en las proporciones de los diferentes
grupos funcionales de artrópodos con las condiciones abióticas y bióticas de la
masa forestal.
La especie forestal ha demostrado tener un efecto
significativo en la alteración y creación de un mosaico de nuevas condiciones
ambientales ligadas a su presencia (Díaz-Pinés et al.
2011; Ampoorter et al. 2016).
Consecuentemente, esto ha tenido una alteración de múltiples funciones
ecosistémicas como la diversidad de sotobosque (Landuyt
et al. 2019), la regeneración de diferentes especies (Bastias
et al. 2019) las tasas de descomposición de hojarasca (Joly
et al. 2017), etc. Particularmente, en nuestro estudio relacionamos la
especie forestal dominante con las propiedades fisicoquímicas del suelo y la estructura
forestal. Más específicamente, encontramos que los bosques dominados por Q. ilex presentan suelos con mayor
abundancia de nutrientes, texturas arcillosas,
con altos valores de biomasa y producción del sotobosque y con mayor cantidad de hojarasca frente a los bosques de Pinus.
Aunque en las parcelas estudiadas de Pinus no tenemos datos de su
origen, el hecho de que las masas de Pinus en Andalucía, hayan sido
principalmente fruto de planes de reforestación y hayan sido manejadas
reiteradamente hasta hace escasas décadas, ha podido ocasionar que la
funcionalidad del sistema y las condiciones ambientales se vean alteradas con
respecto a una evolución natural del bosque. Concretamente, en ese
sentido, el hecho de que haya mayor biomasa y producción del sotobosque en los
bosques de Q. ilex habilita mayor refugio y fuentes de alimentación para
diferentes familias de artrópodos (Tobisch et al. 2023). Además, un mayor
contenido de hojarasca que presentan estos bosques determina una mayor
liberación de nutrientes al suelo creando las condiciones favorables para la
proliferación de la comunidad vegetal y de micro y meso fauna (Prieto et al. 2018), en detrimento de los bosques
dominados por especies de pinos.
Además de la identidad de la especie, nuestro estudio mostró
que las diferencias de aridez para un mismo bosque han hecho que disminuya
significativamente la riqueza de artrópodos, aunque sólo en el caso de bosques
dominados por Q. ilex o P. pinaster. Se ha evidenciado que los
hábitats más húmedos reflejan una mayor disponibilidad de recursos y, por ende,
un incremento en la riqueza de especies (Lister y
García 2018), propiciando la presencia de determinados grupos taxonómicos y
consecuentemente, aumentando la complejidad de las redes tróficas de los
bosques (Cole et al. 2016). Esto corrobora en parte
nuestra hipótesis inicial la cual sugería que la aridez afectaría negativamente
a la riqueza de artrópodos. Sin embargo, el efecto de la aridez no fue general,
ya que para ciertos bosques no encontramos esa disminución de diversidad de
artrópodos con la aridez como por ejemplo en bosques de Q. faginea o P.
halepensis. Esto puede ser porque las parcelas secas y húmedas elegidas
aquí para estas especies no difieren lo suficiente en aridez para la percepción
de la especie. Por ejemplo, los bosques dominados por Q. faginea en
Andalucía suelen estar vinculados a umbrías y vaguadas de ríos, lo que hace
que, aunque la zona en general posea valores de aridez altos, las condiciones
microclimáticas no se correspondan con esos valores generales (Alía et al. 2009). El caso contrario ocurre para P.
halepensis, por su distribución circunmediterránea, la mayoría de
las masas forestales en Andalucía se encuentran en zonas de elevada aridez, no
existiendo parcelas excesivamente húmedas para esta especie (Fig.
A1 del Anexo) y por tanto el gradiente de aridez en Andalucía es
bastante corto en comparación a otras especies (Alía et al.
2009).
A nivel de grupo funcional, encontramos que los
depredadores, responsables de regulación de poblaciones de otros taxones, son
el grupo predominante en los bosques, constituyendo más del 50 % de las
especies de la comunidad. En cambio, los fitófagos, encontrados en menor
proporción (23.1 ± 11 %) desempeñan un papel crucial en el control de la
biomasa forestal (Mattson y Addy 1975). El
siguiente grupo en importancia encontrado son los detritívoros (13.2 ± 7.8 %),
un grupo con una amplia especialización, y que modulan significativamente el
reciclaje de nutrientes (Joly et al. 2020). Y, por
último, el grupo multifuncional o polífago, es un grupo capaz de ajustarse al
uso de diferentes recursos, y, en consecuencia, son menos sensibles a los
cambios en el ecosistema (Andersen et al. 2015).
Para ninguno de estos grupos, encontramos variaciones en sus abundancias en
función de las variables evaluadas, entre ellas la aridez, tipo de bosque,
componentes de estructura forestal y suelo.
Esta situación puede ser explicada de distintas formas para
cada variable. Para la aridez, por ejemplo, solo se han constatado cambios en
la comunidad de hormigas en amplios gradientes ambientales (Gibb
et al. 2015; Arnan et al. 2016) y, por tanto, esto
podría explicar que no se aprecie el efecto de la aridez a pequeña escala (sur
de la península). Además, en los bosques tiende a producirse una substitución
de grupos taxonómicos, pero manteniendo la funcionalidad trófica, como se plantea
en Wimp et al. (2019) donde hay sustituciones de
depredadores especialistas por especies generalistas cuando se produce una
degradación del bosque. Para el caso del tipo de bosque, cada uno posee una
comunidad adaptada a las condiciones del hábitat, no encontrándose diferencias
cuantitativas en los grupos funcionales, pero si en su composición de especies
(Lamarre et al. 2016). La estructura forestal y el
suelo tienen una influencia sobre la riqueza y composición de las comunidades
de artrópodos (de Abreu Pestana et al. 2020),
y como se ha constatado, existe una relación de la especie forestal con una
estructura forestal y suelo específicos (Ampoorter et
al. 2016; Pemán et al. 2017; Bastias
et al. 2019), por lo cual en nuestros análisis, es plausible que al incluir
los PCA en busca de un efecto general de ambos grupos de variables, se incurra
en cierta redundancia con la especie forestal.
Por último, detectamos que la proporción de cada grupo
funcional puede influir en los otros. Por ejemplo, en el caso de los
depredadores, encontramos que su incremento causa reducciones en los fitófagos
y polífagos (Finke y Denno 2004). Un aumento en la
proporción de depredadores condiciona la disminución de ciertas especies de
presas por un aumento de la intensidad de depredación (Klein
et al. 2002). Adicionalmente, encontramos una relación negativa entre los
detritívoros y los fitófagos, lo que difiere de lo demostrado por Stadler y Michalzik (2000), donde se detectó un
incremento en la eficiencia de los descomponedores a medida que se
incrementaron los fitófagos. Una explicación plausible podría estar vinculada
con el alto grado de procesamiento de la biomasa vegetal realizado por los
fitófagos, su elevada proporción en los bosques puede evitar la acumulación de
material vegetal poco fragmentado (Rafes 1970),
disminuyendo los recursos de los descomponedores (Robertson
y Mann 1980).
Conclusiones
Las propiedades del suelo y la estructura forestal difieren
entre los bosques de diferente género y especie estudiados. Los bosques
andaluces dominados por especies del género Quercus, en especial Q.
ilex presentan suelos con una mayor cantidad de nutrientes y texturas más
arcillosas, con una mayor biomasa y producción del sotobosque. La riqueza de
especies de artrópodos está influenciada por la aridez en función del tipo de
bosque, siendo este efecto negativo y significativo sólo en bosques de P.
pinaster y Q. ilex. Sin embargo, la proporción de los distintos
grupos funcionales de artrópodos no está afectada por ninguna de las variables
analizadas. La proporción de depredadores disminuye significativamente con las
de los fitófagos y polífagos. Además, la proporción de detritívoros disminuye
cuando aumentan los fitófagos.
Contribución de los autores
Rodríguez, G.: Conceptualización, Preparación de
Datos, Análisis Formal, Metodología, Redacción del borrador original, Revisión
y edición. Bastias, C.C.: Conceptualización, Preparación de Datos,
Análisis Formal, Metodología, Revisión y edición. Villar-Ruiz, A.:
Preparación de Datos, Análisis Formal, Redacción del borrador original. Salazar-Zarzosa,
P.C.: Conceptualización, Preparación de Datos, Análisis Formal,
Metodología, Revisión y edición. D. Herraiz, A.: Preparación de Datos,
revisión y edición. Pérez-Guerrero, S.: Conceptualización, Preparación
de Datos, Metodología. Barrón, V.: Conceptualización, Metodología. Quero
Pérez, J.L.: Conceptualización, Financiación, Metodología, Revisión y
edición. Villar, R.: Conceptualización, Financiación, Metodología,
Revisión y edición.
Financiación, permisos requeridos, potenciales
conflictos de interés y agradecimientos
Los autores/as declaran no tener ningún conflicto de
intereses.
Agradecemos a Vicente Jesús Sandoval Altelarrea (jefe de
Servicio de Inventario Forestal, Ministerio para la Transición Ecológica y el
Reto Demográfico) por la ayuda en la
localización de las parcelas del IFN y a Paloma Ruíz-Benito por su ayuda en las
bases de datos del IFN. El apoyo financiero lo proporcionaron los proyectos
“Ecología funcional de los bosques andaluces y predicciones sobre sus cambios futuros”
(For-Change) (UCO-FEDER 18 REF 27943 MOD B), “Funcionalidad y servicios
ecosistémicos de los bosques andaluces y normarroquíes: relaciones con la
diversidad vegetal y edáfica ante el cambio climático” (P18-RT-3455) de la
Junta de Andalucía (España), los proyectos MEC “ECO-MEDIT” (CGL2014-53236-R),
“FOR_FUN” (PID2020-115809RB-I00), “Early detection of oak decline:
disentangling biotic-abiotic stress interaction through the spectral plant
traits dynamics (D-Traits)” (PID2021-124058OA-I00, en el marco del Plan Estatal
de Investigación Científica, Técnica e Innovación 2021-2023, subprograma de
generación de conocimiento y “FORMEDY” (TED2021-131722B-I00) y fondos FEDER.
Agradecemos al MAPA (Ministerio de Agricultura, Pesca y Alimentación) y al
MITECO (Ministerio de Transición Ecológica) el acceso y la disponibilidad en
abierto del Inventario Forestal Español (https://www.miteco.gob.es/es/biodiversidad/temas/
inventarios-nacionales/inventario-forestal-nacional.html). A la Dirección
General de Medio Ambiente de la Junta de Andalucía por facilitarnos el permiso
necesario para llevar a cabo los muestreos.
Disponibilidad de datos
Los datos procesados de este trabajo se encuentran
depositados en el repositorio online Zenodo.org (https://doi.org/10.5281/zenodo.15047870) y en Rodríguez et al. 2025.
Para el acceso a los
datos de censos de árboles y artrópodos por parcela se deben poner en contacto
con el autor de correspondencia y para el acceso a los datos brutos de censos
de árboles en el IFN3, son accesibles a través del siguiente enlace: https://www.miteco.gob.es/es/biodiversidad/servicios/banco-datos-naturaleza/informacion-disponible/ifn3.html
Referencias
AEMET 2011. Atlas climático
ibérico. Temperatura del aire y precipitación (1971-2000). Agencia
Estatal de Meteorología Ministerio de Medio Ambiente y Medio Rural y Marino,
Madrid, España.
Alameda, D., Villar, R., Iriondo,
J.M. 2012. Spatial pattern of soil compaction: Trees'
footprint on soil physical properties. Forest Ecology and Management 283,
128–137. https://doi.org/10.1016/j.foreco.2012.07.018
Alberdi, I., Sandoval, V., Condes, S., Cañellas, I., Vallejo, R. 2016. El
Inventario Forestal Nacional español, una herramienta para el conocimiento, la
gestión y la conservación de los ecosistemas forestales arbolados. Ecosistemas 25(3),
88–97. https://doi.org/10.7818/ECOS.2016.25-3.10
Alía, R., GarcíadelBarrio, J.M.,
Iglesias, S., Mancha, J.A., deMiguelydelÁngel, J., Nicolás, J.L., et al. 2009. Regiones
de procedencia de especies forestales españolas. Organismo Autónomo
Parques Nacionales, Madrid, España.
Akaike, H. 1983. Information measures and model selection. International
Statistical Institute 44, 277–291.
Anaya-Romero, M., Munoz-Rojas,
M., Ibañez, B., Marañón, T. 2016. Evaluation of forest
ecosystem services in Mediterranean areas. A regional case study in South
Spain. Ecosystem Services 20, 82–90. https://doi.org/10.1016/j.ecoser.2016.07.002
Andersen, A.N., DelToro, I., Parr, C.L. 2015. Savanna ant species richness
is maintained along a bioclimatic gradient of increasing latitude and
decreasing rainfall in northern Australia. Journal of Biogeography 42(12),
2313–2322. https://doi.org/10.1111/jbi.12599
Andrew, N.R.,
Hughes, L. 2005. Arthropod community structure
along a latitudinal gradient: Implications for future impacts of climate
change. Austral Ecology 30, 281–297. https://doi.org/10.1111/j.1442-9993.2005.01464.x
Ampoorter, E., Selvi, F., Auge, H., Baeten, L., Berger, S., Carrari, E.,
Coppi, A., et al. 2016. Driving mechanisms of overstorey–understorey diversity
relationships in European forests. Perspectives in Plant Ecology
Evolution and Systematics 19, 21–29. https://doi.org/10.1016/j.ppees.2016.02.001
Arnan, X., Cerdá, X., Retana, J.
2016. Relationships among taxonomic, functional, and
phylogenetic ant diversity across the biogeographic regions of Europe. Ecography 40(3),
448–457. https://doi.org/10.1111/ecog.01938
Bastias, C.C., Morán-López, T.,
Valladares, F., Benavides, R. 2019. Seed size underlies the
uncoupling in species composition between canopy and recruitment layers in
European forests. Forest Ecology and Management 449, 117471. https://doi.org/10.1016/j.foreco.2019.117471
Bastias, C.C., Rodríguez Castilla
G., Salazar-Zarzosa, P., Díaz Herraiz, A., González Herranz, N., Ruiz-Benito,
P., Barrón, V., et al. 2025. Differential aridity-induced
variations in ecosystem multifunctionality between Iberian Pinus and Quercus
Mediterranean forests. Ecological Indicators 173, 113411. https://doi.org/10.1016/j.ecolind.2025.113411
Belgorodski, N., Greiner, M., Tolksdorf, K., Schueller, K. 2017. rriskDistributions:
Fitting Distributions to Given Data or Known Quantiles. https://cran.r-project.org/web/packages/rriskDistributions/index.html
Cole, R.J., Holl, K.D., Zahawi, R.A., Wickey, P., Townsend, A.R. 2016.
Leaf litter arthropod responses to tropical forest restoration. Ecology
and Evolution 6, 5158–5168. https://doi.org/10.1002/ece3.2220
Corbet, S.A. 1997. Role of pollinators in species preservation, conservation,
ecosystem stability and genetic diversity. Acta Horticulturae 437,
219–230. https://doi.org/10.17660/ActaHortic.1997.437.23
Culliney, T.W. 2013. Role of arthropods in maintaining soil fertility. Agriculture 3,
629–659. https://doi.org/10.3390/agriculture3040629
da Silva, L.P., Heleno, R.H.,
Costa, J.M., Valente, M., Mata, V.A., Gonçalves, S.C., DaSilva, A.A., et al.
2019. Natural woodlands hold more diverse, abundant, and
unique biota than novel anthropogenic forests: a multi-group assessment. European
Journal of Forest Research 138, 461–472. https://doi.org/10.1007/s10342-019-01183-5
de
AbreuPestana, L.F., deSouza, A.L.T., Tanaka, M.O.,
Labarque, F.M., Soares, J.A.H. 2020. Interactive effects between vegetation
structure and soil fertility on tropical ground-dwelling arthropod
assemblages. Applied Soil Ecology 155, 103624. https://doi.org/10.1016/j.apsoil.2020.103624
de la Riva, E.G., Pérez-Ramos,
I., Fernández, C.N., Olmo, M., Arana, T.M., Villar, R. 2014. Rasgos funcionales
en el género Quercus: estrategias adquisitivas frente a conservativas en el uso
de recursos. Ecosistemas 23(2), 82–89. https://doi.org/10.7818/ECOS.2014.23-2.11
DelToro, I., Ribbons, R.R.,
Pelini, S.L. 2012. The little things that run the world
revisited: a review of ant-mediated ecosystem services and disservices
(Hymenoptera: Formicidae). Myrmecological News 17,
133–146.
Díaz-Pinés, E., Rubio, A.,
VanMiegroet, H., Montes, F., Benito, M. 2011. Does tree
species composition control soil organic carbon pools in Mediterranean mountain
forests? Forest Ecology and Management 262(10), 1895–1904. https://doi.org/10.1016/j.foreco.2011.02.004
Gibb, H., Sanders, N.J., Dunn, R.R., Watson, S., Photakis, M., Abril, S.,
Parr, C.L. 2015. Climate mediates the effects of disturbance on ant assemblage
structure. Proceedings of the Royal Society B: Biological Sciences 282(1808),
20150418. https://doi.org/10.1098/rspb.2015.0418
GuitiánOjea, F.,
Carballas, T. 1976. Técnicas de análisis de suelos. Pico Sacro.
Santiago de Compostela, España. http://hdl.handle.net/10261/59235
Llorca, M. 1991. Prácticas de
Edafología. Universidad Politécnica de Valencia. Valencia, España.
Fick, S.E.,
Hijmans, R.J. 2017. WorldClim 2: new 1‐km
spatial resolution climate surfaces for global land areas. International
Journal of Climatology 37(12), 4302–4315. https://doi.org/10.1002/joc.5086
Finke, D.L.,
Denno, R.F. 2004. Predator diversity dampens
trophic cascades. Nature 429(6990), 407–410. https://doi.org/10.1038/nature02554
Graça, M.A.S., Ferreira, R.C.F., Coimbra, C.N. 2001. Litter processing
along a stream gradient: The role of invertebrates and decomposers. Journal
of the North American Benthological Society 20(3), 408–420. https://doi.org/10.2307/1468038
Haddad, N.M., Crutsinger, G.M., Gross, K., Haarstad, J., Knops, J.M.H.,
Tilman, D. 2009. Plant species loss decreases arthropod diversity and shifts
trophic structure. Ecology Letters 12(10), 1029–1039. https://doi.org/10.1111/j.1461-0248.2009.01356.x
Harris, J.E., Rodenhouse, N.L., Holmes, R.T. 2019. Decline in beetle
abundance and diversity in an intact temperate forest linked to climate
warming. Biological Conservation 240, 108219. https://doi.org/10.1016/j.biocon.2019.108219
Hernández, L., Rubiales, J.M.,
Morales-Molino, C., Romero, F., Sanz, C., Gómez Manzaneque, F. 2011. Reconstructing forest history from archaeological data: a case study
in the Duero basin assessing the natural origin of controversial forests and
the loss of tree populations of great biogeographical interest. Forest
Ecology and Management 261(7), 1178–1187. https://doi.org/10.1016/j.foreco.2010.12.033
Herraiz, A.D., Salazar-Zarzosa, P.C., Mesas, F.J., Arenas-Castro, S.,
Ruiz-Benito, P., Villar, R. 2023. Modelling aboveground biomass and
productivity and the impact of climate change in Mediterranean forests of South
Spain. Agricultural and Forest Meteorology 337, 109498. https://doi.org/10.1016/j.agrformet.2023.109498
Hulshof, C.M., Ackerman, J.D., Franqui, R.A., Kawahara, A.Y., Restrepo, C.
2024. Temperature seasonality drives taxonomic and functional homogenization of
tropical butterflies. Diversity and Distributions 30(7),
e13814. https://doi.org/10.1111/ddi.13814
Joly, F.X., Milcu, A., Scherer-Lorenzen, M., Jean, L.K., Bussotti, F.,
Dawud, S.M., Hättenschwiler, S. 2017. Tree species diversity affects
decomposition through modified micro-environmental conditions across European
forests. New Phytologist 214(3), 1281–1293. https://doi.org/10.1111/nph.14452
Joly, F.X., Coq, S., Coulis, M., David, J.F., Hättenschwiler, S.,
Mueller, C.W., Subke, J.A. 2020. Detritivore conversion of litter into faeces
accelerates organic matter turnover. Communications Biology 3(1).
https://doi.org/10.1038/s42003-020-01392-4
Klein, A.M., Steffan-Dewenter, I., Tscharntke, T. 2002. Predator–prey
ratios on cocoa along a land-use gradient in Indonesia. Biodiversity
and Conservation 11, 683–693. https://doi.org/10.1023/A:1015548426672
Landuyt, D., DeLombaerde, E., Perring, M.P., Hertzog, L.R., Ampoorter, E.,
Maes, S.L., Verheyen, K. 2019. The functional role of temperate forest
understorey vegetation in a changing world. Global Change Biology 25(11),
3625–3641. https://doi.org/10.1111/gcb.14756
Landuyt, D., Ampoorter, E., Bastias, C.C., Benavides, R., Müller, S.,
Scherer-Lorenzen, M., Valladares, F., Wasof, S., et al. 2020. Importance of
overstorey attributes for understorey litter production and nutrient cycling in
European forests. Forest Ecosystems 7, 45. https://doi.org/10.1186/s40663-020-00256-x
Lamarre, G.P., Hérault, B., Fine, P.V.A., Vedel, V., Lupoli, R., Mesones,
I., Baraloto, C. 2016. Taxonomic and functional composition of arthropod
assemblages across contrasting Amazonian forests. Journal of Animal
Ecology 85, 227–239. https://doi.org/10.1111/1365-2656.12445
Lister, B.C.,
Garcia, A. 2018. Climate-driven declines in
arthropod abundance restructure a rainforest food web. Proceedings of
the National Academy of Sciences of the United States of America 115,
201722477. https://doi.org/10.1073/pnas.1722477115
Löf, M., Brunet, J., Filyushkina, A., Lindbladh, M., Skovsgaard, J.P.,
Felton, A. 2015. Management of oak forests: striking a balance between timber
production, biodiversity and cultural services. International Journal
of Biodiversity Science Ecosystem Services and Management 12(1–2),
59–73. https://doi.org/10.1080/21513732.2015.1120780
Lopez-Tirado, J., Hidalgo,
P.J. 2016. Ecological niche modelling of three Mediterranean
pine species in the south of Spain: a tool for afforestation/reforestation
programs in the twenty-first century. New Forests 47(3),
411–429. https://doi.org/10.1007/s11056-015-9523-3
Marañón, T., Díaz, C.M.P., Ramos,
I.M.P., Villar, R. 2014. Tendencias en la investigación sobre ecología y
gestión de las especies de Quercus. Ecosistemas 23(2), 124–129. https://doi.org/10.7818/ECOS.2014.23-2.16
Mattson, W.,
Addy, N. 1975. Phytophagous insects as regulators
of forest primary production. Science 190, 515–522. https://doi.org/10.1126/science.190.4214.515
McGlynn, T.P., Salinas, D.J., Dunn, R.R., Wood, T.E., Lawrence, D., Clark,
D.A. 2007. Phosphorus limits tropical rain forest litter fauna. Biotropica 39,
50–53. https://doi.org/10.1111/j.1744-7429.2006.00241.x
Menta, C.,
Remelli, S. 2020. Soil health and arthropods: from
complex system to worthwhile investigation. Insects 11(1).
https://doi.org/10.3390/insects11010054
Montero, G., Ruiz-Peinado, R.,
Muñoz, M. 2005. Producción de biomasa y fijación de CO₂ por los bosques
españoles. Instituto Nacional de Investigación y Tecnología Agraria y
Alimentaria (INIA). Madrid, España.
Montero, G., Lopez-Leiva, C.,
Ruiz-Peinado, R., Lopez-Senespleda, E., Onrubia, R., Pasalodos, M. 2020. Producción
de biomasa y fijación de carbono por los matorrales españoles y por el
horizonte orgánico superficial de los suelos forestales. Ministerio de
Agricultura Pesca y Alimentación Secretaría General Técnica Gobierno de España,
Madrid, España.
O'Brien, M.J., Brezzi, M., Schuldt,
A., Zhang, J.-Y., Ma, K., Schmid, B., Niklaus, P.A. 2017. Tree
diversity drives diversity of arthropod herbivores, but successional stage
mediates detritivores. Ecology and Evolution 7,
8753–8760. https://doi.org/10.1002/ece3.3411
Pemán, J., Iriarte, I., Lario, F.J.
2017. La restauración forestal de España: 75 años de una ilusión. Ministerio
de Agricultura y Pesca Alimentación y Medio Ambiente, Madrid, España.
Pérez-Contreras, T. 1999.
La especialización en los insectos fitófagos: una regla más que una
excepción. Boletín de la Sociedad Entomológica Aragonesa 26,
759–776.
Peguero, G., Folch, E., Liu, L.,
Ogaya, R., Peñuelas, J. 2021. Divergent effects of drought and
nitrogen deposition on microbial and arthropod soil communities in a
Mediterranean forest. European Journal of Soil Biology 103,
103275. https://doi.org/10.1016/j.ejsobi.2020.103275
Pestana, L.F.deA., Souza, A.L.T.de, Tanaka, M.O., Labarque, F.M., Soares,
J.A.H. 2020. Interactive effects between vegetation structure and soil
fertility on tropical ground-dwelling arthropod assemblages. Applied
Soil Ecology 155, 103624. https://doi.org/10.1016/j.apsoil.2020.103624
Prieto, I., Almagro, M., Bastida,
F., Querejeta, J. 2019. Altered leaf litter quality
exacerbates the negative impact of climate change on decomposition. Journal
of Ecology 107, 2364–2382. https://doi.org/10.1111/1365-2745.13168
R Core Team 2021. R: A language and environment for statistical computing. R
Foundation for Statistical Computing, Vienna, Austria. http://www.R-project.org/
Rafes, P.M. 1970. Estimation of the effects of phytophagous insects on
forest production. In: Reichle, D.E. (ed.) Analysis of Temperate Forest
Ecosystems. Ecological Studies 1, pp. 100–106. Springer-Verlag New
York. https://doi.org/10.1007/978-3-642-85587-0_9
Robertson,
A., Mann, K. 1980. The role of isopods and
amphipods in the initial fragmentation of eelgrass detritus in Nova Scotia,
Canada. Marine Biology 59, 63–69. https://doi.org/10.1007/BF00396983
Rodríguez, G., Bastias, C.C.,
Villar-Ruíz, Á., Herraiz, A., Salazar-Zarzosa, P., Pérez-Guerrero, S., Barrón,
V., et al. 2025. Efectos del tipo de bosque y la aridez en la comunidad de
artrópodos de los bosques de Pinus y Quercus del Sur de la
Península Ibérica [Data set]. Zenodo. https://doi.org/10.5281/zenodo.15047870
Salazar-Zarzosa, P.C.,
Diaz, A., Olmo, M., Ruiz-Benito, P., Barrón, V., CrespoBastias, C., de la Riva,
E., Villar, R. 2021. Linking functional traits with tree
growth and forest productivity in Quercus ilex forests along a climatic
gradient. Science of The Total Environment 786, 147468. https://doi.org/10.1016/j.scitotenv.2021.147468
Sánchez-Bayo,
F., Wyckhuys, K.A.G. 2019. Worldwide decline of the
entomofauna: A review of its drivers. Biological Conservation 232,
8–27. https://doi.org/10.1016/j.biocon.2019.01.020
Sayer, E.J. 2005. Using experimental manipulation to assess the roles of
leaf litter in the functioning of forest ecosystems. Biological Reviews 81(1),
1. https://doi.org/10.1017/S1464793105006846
Semenza, J.C.,
Menne, B. 2009. Climate change and infectious
diseases in Europe. The Lancet Infectious Diseases 9(6),
365–375. https://doi.org/10.1016/S1473-3099(09)70104-5
Shivanna, K.R. 2022. Climate change and its impact on biodiversity and human
welfare. Proceedings of the Indian National Science Academy 88,
160–171. https://doi.org/10.1007/s43538-022-00073-6
Souza, L., Zelikova, T.J., Sanders, N.J. 2016. Bottom-up and top-down
effects on plant communities: nutrients limit productivity, but insects
determine diversity and composition. Oikos 125, 566–575. https://doi.org/10.1111/oik.02579
Stadler,
B., Michalzik, B. 2000. Effects of phytophagous
insects on micro-organisms and throughfall chemistry in forested ecosystems:
herbivores as switches for the nutrient dynamics in the canopy. Basic
and Applied Ecology 1(2), 109–116. https://doi.org/10.1078/1439-1791-00016
Stephen, J. 2005. Aridity Indexes. In: Oliver, J.E. (ed.) Encyclopedia of
World Climatology. Encyclopedia of Earth Sciences Series, pp.
89–94. Springer Dordrecht, The Netherlands.
Sterner, R.W.,
Elser, J.J. 2002. Ecological stoichiometry: The
biology of elements from molecules to the biosphere. Princeton
University Press Princeton. https://doi.org/10.1515/9781400885695
Tobisch, C., Rojas-Botero, S., Uhler, J., Müller, J., Kollmann, J., Moning,
C., Brändle, M., et al. 2023. Plant species composition and local habitat
conditions as primary determinants of terrestrial arthropod assemblages. Oecologia 201,
813–825. https://doi.org/10.1007/s00442-023-05345-6
Urbaneja, A., Ripollés, J.L.,
Abad, R., Calvo, J., Vanaclocha, P., Tortosa, D., Jacas, J.A. 2005. Importancia
de los artrópodos depredadores de insectos y ácaros en España. Boletín
de Sanidad Vegetal. Plagas 31, 209–223.
Wimp, G.M., Ries, L., Lewis, D.,
Murphy, S.M. 2019. Habitat edge responses of generalist
predators are predicted by prey and structural resources. Ecology 100(6),
e02662. https://doi.org/10.1002/ecy.2662
Wise, D.H.,
Lensing, J.R. 2019. Impacts of rainfall extremes
predicted by climate-change models on major trophic groups in the leaf litter
arthropod community. Journal of Animal Ecology 88(10), 1486–1497. https://doi.org/10.1111/1365-2656.13046
Anexo / Appendix
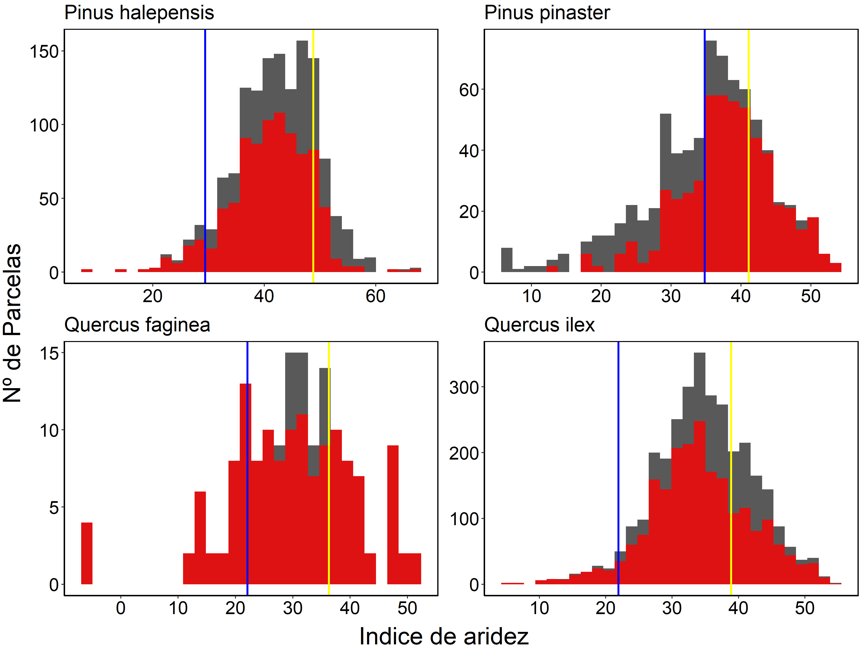
Figura A1. Distribución de las parcelas de las
cuatro especies estudiadas. En color gris todas las parcelas del IFN3 en
Andalucía, en rojo aquellas parcelas que se encuentran en zonas conservadas.
Las líneas azul y amarilla representan los niveles de aridez de las parcelas en
el extremo húmedo (azul) y seco (amarillo), que se han muestreado en este
trabajo.
Figure A1. Distribution of the plots of the four studied species. All IFN3
plots in Andalusia are shown in grey, while plots located in conserved areas
are highlighted in red. The blue and yellow lines represent the aridity levels
of the plots at the humid (blue) and dry (yellow) extremes, which were sampled
in this study.
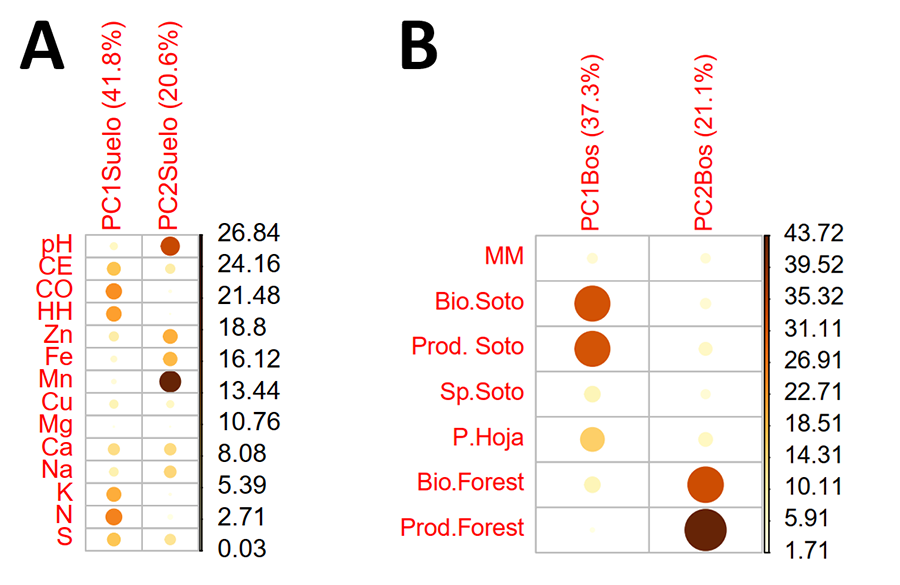
Figura A2. Contribución de las variables en los
PCA de suelo (A) y de estructura forestal (B) para todos los tipos de bosques
juntos. Los números que aparecen a la derecha de cada figura corresponden con
el porcentaje de varianza absorbida y su escala en color. PC1Suelo (Primer
componente del PCA de las propiedades físico-químicas del suelo), PC2Suelo
(Segunda componente del PCA de las propiedades físico-químicas del suelo),
PC1Bos (Primer componente del PCA de las propiedades físico-químicas del
suelo), PC2Bos (Segunda componente del PCA de las propiedades físico-químicas
del suelo).
Figure A2. Contribution of the variables in the PCA of soil (A) and forest
structure (B). The numbers that appear to the right of each figure correspond
to the percentage of variance absorbed and its colour scale. PC1Suelo (First
principal component of the PCA of soil physico-chemical properties), PC2Suelo
(Second principal component of the PCA of soil physico-chemical properties),
PC1Bos (First principal component of the PCA of forest physico-chemical
properties), PC2Bos (Second principal component of the PCA of forest
physico-chemical properties).
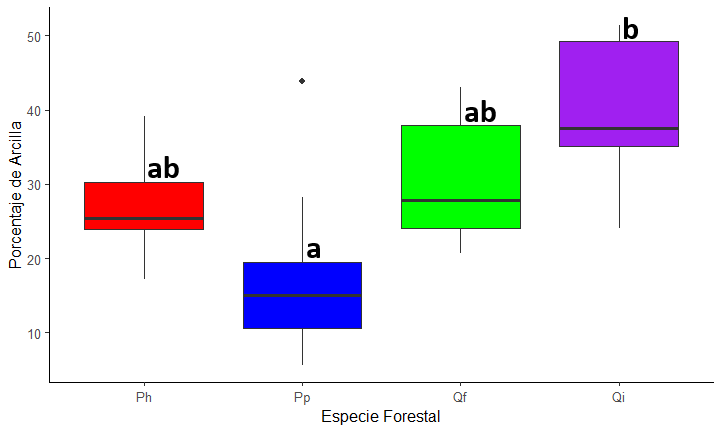
Figura A3. Diferencias en el porcentaje de
arcilla en los distintos bosques (Ph: P. halepensis; Pp: P. pinaster;
Qf: Q. faginea; Qi: Q. ilex). Especies con distintas letras reflejan
diferencias significativas (p<0.05) analizadas mediante test de
Tukey-Kramer.
Figure A3. Differences in the percentage of clay across different forests
(Ph: P. halepensis; Pp: P. pinaster; Qf: Q. faginea; Qi: Q.
ilex). Species with different letters indicate significant differences (p<0.05) analyzed using the
Tukey-Kramer test.
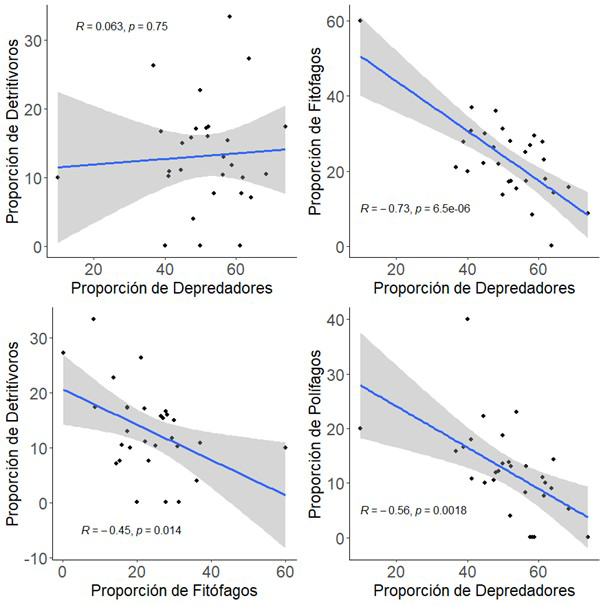
Figura A4. Relaciones lineales entre los
distintos grupos funcionales de artrópodos (Depredadores, Fitófagos,
Detritívoros y Polífagos). Se indica el coeficiente de correlación (R) y el
valor de p. La zona sombreada indica el intervalo de confianza al 95% de la recta
de regresión.
Figure A4. Linear relationships between the different functional groups of
arthropods (Predators, Phytophages, Detritivores and Polyphages). The
correlation coefficient (R) and the p-value are indicated. The shaded area
indicates the 95% confidence interval of the regression line.
Tabla A1.
Selección del modelo lineal generalizado más parsimonioso para estimar la
riqueza de especies de artrópodos, según AIC (Akaike Information Criterion,
seleccionando el de menor AIC, Akaike, 1983). NS (p>0.05), * (p<0.05),
**(p<0.01), ***(p<0.001), - (no incluido en el modelo).
Categoría de aridez (Húmedo o Seco), Especie Forestal (P. halepensis, P.
pinaster, Q.ilex y Q. faginea), PC1Suelo (Primer componente del PCA
de las propiedades físico-químicas del suelo), PC2Suelo (Segunda componente del
PCA de las propiedades físico-químicas del suelo), PC1Bos (Primer componente
del PCA de las propiedades físico-químicas del suelo), PC2Bos (Segunda
componente del PCA de las propiedades físico-químicas del suelo).
Table A1. Selection of the most parsimonious generalized linear model to
estimate arthropod species richness, based on AIC (Akaike Information
Criterion, selecting the model with the lowest AIC, Akaike, 1983). NS (p>0.05), * (p<0.05), ** (p<0.01), *** (p<0.001), - (not included in the
model). Aridity category (Humid or Dry), Forest Species (P. halepensis, P.
pinaster, Q. ilex, and
Q. faginea), PC1Suelo (First principal component of
the PCA of soil physico-chemical properties), PC2Suelo (Second principal component
of the PCA of soil physico-chemical properties), PC1Bos (First principal
component of the PCA of forest physico-chemical properties), PC2Bos (Second
principal component of the PCA of forest physico-chemical properties).
Tabla A2. Selección del
modelo lineal generalizado más parsimonioso para estimar la proporción de los
distintos grupos funcionales (Depredadores, Detritívoros, Fitófagos y
Polífagos), según AIC (Akaike Information Criterion, seleccionando el de menor
AIC, Akaike, 1983). NS (p>0.05), * (p<0.05), **(p<0.01),
***(p<0.001), - (no incluido en el modelo). Categoría de aridez;
(Húmedo o Seco), Especie Forestal (P. halepensis, P. pinaster, Q.ilex y
Q. faginea), PC1Suelo (Primer componente del PCA de las propiedades
físico-químicas del suelo), PC2Suelo (Segunda componente del PCA de las
propiedades físico-químicas del suelo), PC1Bos (Primer componente del PCA de
las propiedades físico-químicas del suelo), PC2Bos (Segunda componente del PCA
de las propiedades físico-químicas del suelo).
Table
A2. Selection of the most parsimonious generalized
linear model to estimate the proportion of different functional groups
(Predators, Detritivores, Phytophages, and Polyphages), based on AIC (Akaike
Information Criterion, selecting the model with the lowest AIC, Akaike, 1983).
NS (p>0.05), * (p<0.05), ** (p<0.01), *** (p<0.001), - (not
included in the model). Aridity Category; (Humid or Dry), Forest Species (P.
halepensis, P. pinaster, Q. ilex, and Q. faginea), PC1Suelo (First principal
component of the PCA of soil physico-chemical properties), PC2Suelo (Second
principal component of the PCA of soil physico-chemical properties), PC1Bos
(First principal component of the PCA of forest physico-chemical properties),
PC2Bos (Second principal component of the PCA of forest physico-chemical
properties).
Depredadores
Detritívoros
Continuación Tabla A2 /
Table A2 continued
Fitófagos
Polífagos
![]() , Cristina C. Bastias1
, Cristina C. Bastias1 ![]() , Angela Villar-Ruiz1
, Angela Villar-Ruiz1 ![]() , Pablo C. Salazar-Zarzosa1
, Pablo C. Salazar-Zarzosa1 ![]() ,
Aurelio Diaz Herraiz1,2
,
Aurelio Diaz Herraiz1,2 ![]() , Sergio Pérez-Guerrero3
, Sergio Pérez-Guerrero3 ![]() , Vidal Barron4
, Vidal Barron4 ![]() , José Luis Quero Pérez5
, José Luis Quero Pérez5 ![]() ,
Rafael Villar1
,
Rafael Villar1 ![]()








