ecosistemas
ISSN 1697-2473
Open access / CC BY-NC 4.0
© 2025 Los autores [ECOSISTEMAS no se hace responsable del uso indebido de material sujeto a derecho de autor] / © 2025 The authors [ECOSISTEMAS is not responsible for the misuse of copyrighted material]
Ecosistemas 34(1): 2822 [enero - abril / January - April, 2025]: https://doi.org/10.7818/ECOS.2822
MONOGRÁFICO: Fototrampeo en ecología / MONOGRAPHIC: Camera Trapping in Ecology
Editores invitados / Guest editors: Lara Naves-Alegre, Adrián Orihuela Torres y Roberto Pascual-Rico
ARTÍCULO DE INVESTIGACIÓN / RESEARCH ARTICLE
El papel de los carroñeros vertebrados terrestres en el aprovechamiento de restos de caza de aves acuáticas en un humedal Mediterráneo
Tatiana Pessano-Serrat1,* ![]() , Esther
Sebastián-González1,2
, Esther
Sebastián-González1,2 ![]() , Adrian Orihuela-Torres1
, Adrian Orihuela-Torres1 ![]()
(1) Departamento de Ecología, Universidad de Alicante, Ctra. San Vicente del Raspeig s/n, 03690, Alicante, Spain.
(2) Instituto Multidisciplinar para el Estudio del Medio Ramón Margalef (IMEM), Universidad de Alicante, Ctra. San Vicente del Raspeig s/n, 03690, Alicante, Spain.
* Autora de correspondencia / Correspondig author: Tatiana Pessano-Serrat [tapesse@gmail.com].
|
> Recibido / Received: 29/07/2024 – Aceptado / Accepted: 15/01/2025 |
Cómo citar / How to cite: Pessano Serrat, T., Sebastián González, E., Orihuela Torres, A. 2025. El papel de los carroñeros vertebrados terrestres en el aprovechamiento de restos de caza de aves acuáticas en un humedal Mediterráneo. Ecosistemas 34(1): 2822. https://doi.org/10.7818/ECOS.2822
|
El papel de los carroñeros vertebrados terrestres en el aprovechamiento de restos de caza de aves acuáticas en un humedal Mediterráneo Resumen: Los carroñeros vertebrados son esenciales en los ecosistemas, estabilizando las cadenas tróficas, acelerando el reciclaje de nutrientes y eliminando posibles focos de enfermedades. En el Parque Natural de El Hondo, un humedal de importancia internacional para las aves (sudeste de España), se producen eventos periódicos de mortalidad, como la caza de aves acuáticas. Los restos no recuperados de la caza generan pulsos predecibles de carroña que diversas especies de carroñeros aprovechan. Este estudio describe la comunidad de carroñeros vertebrados terrestres y sus patrones de consumo de carroñas que simulan eventos de caza en El Hondo. Se colocaron 39 carroñas de aves acuáticas tras eventos de caza en tres áreas adyacentes a cotos y se monitoreó su consumo con cámaras trampa. Registramos siete especies de carroñeros destacando el zorro rojo (Vulpes vulpes) y la rata parda (Rattus norvegicus) como principales consumidores de carroña, aunque esta última mostró menor eficiencia, aumentando el tiempo de permanencia de las carroñas en el ecosistema. También identificamos otras especies de vertebrados, como aves insectívoras, que consumieron invertebrados atraídos por las carroñas. Los resultados mostraron que los restos de la caza de aves acuáticas son aprovechados por una diversa comunidad de vertebrados en los humedales. Además, nuestros resultados sugieren que la caza en áreas protegidas puede favorecer la presencia de especies invasoras, como la rata parda. Esto subraya la necesidad de gestionar las interacciones entre las actividades humanas y las comunidades de carroñeros, crucial para la conservación efectiva de ecosistemas amenazados y esenciales para la biodiversidad, como los humedales. Palabras clave: actividad cinegética; actividades humanas; aves acuáticas; carroña; especies invasoras; fototrampeo The role of terrestrial vertebrate scavengers in the utilization of waterfowl hunting carcasses in a Mediterranean wetland Abstract: Vertebrate scavengers play a crucial role in ecosystems by stabilizing food webs, accelerating nutrient recycling, and eliminating potential disease sources. In El Hondo Natural Park (SE Spain), a wetland of international importance for birds, periodic mortality events occur, such as the hunting of waterfowl. Uncollected hunting remains create predictable pulses of carrion utilized by different scavenger species. This study describes the community of terrestrial vertebrate scavengers and their patterns of consumption of carrion that simulates hunting in El Hondo. Thirty-nine waterfowl carcasses were placed after hunting events in three areas adjacent to the hunting reserves, and their consumption was monitored with camera traps. We recorded seven species of vertebrate scavengers, highlighting the role of the red fox (Vulpes vulpes) and the brown rat (Rattus norvegicus) as the main carrion consumers, although the latter showed lower efficiency, increasing the persistence time of carrion in the ecosystem. We also identified other vertebrate species, such as insectivorous birds, that consumed invertebrates attracted by the carrion. The results demonstrated that waterfowl hunting remains are used by a diverse community of vertebrates in wetlands. Additionally, our results suggest that hunting in protected areas can favour the presence of invasive species, such as the brown rat. This highlights the need to adequately manage the interactions between human activities and scavenger communities for the effective conservation of threatened ecosystems that are essential for biodiversity, such as wetlands. Keywords: alien species; camera trap; carrion; human activities; hunting activity; waterfowl |
Introducción
Algunas actividades antrópicas, como la caza, han modificado la dinámica de la disponibilidad espacio-temporal de carroña en los ecosistemas, cambiando con ello los procesos ecológicos de recirculación de los nutrientes (Moleón et al. 2014; Moleón y Sánchez-Zapata 2022). Originalmente, el objetivo de la caza era proporcionar recursos alimenticios a las comunidades humanas, aprovechándose los cadáveres generados casi en su totalidad. Sin embargo, con el desarrollo de las sociedades, esta práctica se ha convertido mayoritariamente en una actividad recreativa (Mithen 1999). Además, a menudo un porcentaje de las presas cazadas no son recuperadas, especialmente en humedales donde el acceso a algunas zonas es difícil, lo que resulta en numerosos cadáveres o partes de estos abandonados en el medio natural, quedando a disposición de los carroñeros (Darimont et al. 2017). En Estados Unidos se estimó que el 19% de las aves acuáticas no son recuperadas del medio tras ser cazadas (USFWS 1975). Adicionalmente, esta carroña puede representar un riesgo para las especies que la consumen si la munición empleada contiene elementos tóxicos, como el plomo (García-Fernández et al. 1998; Gangoso et al. 2009).
La disponibilidad de carroña generada por la caza sigue patrones periódicos previsibles, concentrándose temporal y espacialmente en ciertos meses del año y ciertas zonas acotadas para esta actividad. Este recurso, rico en nutrientes y libre de costos energéticos asociados a la caza activa por parte de depredadores, es de alto valor para los organismos consumidores (DeVault et al. 2003; Wilson y Wolkovich 2011). Sin embargo, estos picos de disponibilidad de carroña pueden tener consecuencias directas no solo sobre las comunidades de carroñeros, sino sobre el resto del ecosistema (Olea et al. 2019). Por ejemplo, a nivel individual, el aumento de los recursos tróficos en los ecosistemas mediado por la caza puede tener un impacto en la fertilidad, tamaño corporal, fisiología, supervivencia y el área de campeo de las especies carroñeras (Oro et al. 2008, 2013; Margalida et al. 2011, 2013). A nivel poblacional, se pueden producir cambios en el tamaño y/o densidad poblacional, estructura demográfica, comportamiento (patrones de búsqueda de alimentos o migración) o en la dieta de las especies (Mundy et al. 1992; Pulido 2007; Jackson et al. 2008; Donázar et al. 2010). Por último, a nivel de comunidad y ecosistémico, se pueden ver modificadas la competencia, las relaciones depredador-presa, la composición de especies de la comunidad o el ciclo de nutrientes (Carrete et al. 2006; Barton et al. 2013; Moreno-Opo et al. 2015).
Numerosas especies animales consumen carroña, desde los carroñeros obligados (i.e., buitres), que dependen casi exclusivamente de la carroña, hasta los carroñeros facultativos (e.g., zorro) cuya alimentación no depende estrictamente de la carroña (Ruxton y Houston 2004; Pereira et al. 2014). Los carroñeros vertebrados terrestres desempeñan funciones ecológicas cruciales, en la estabilización de las redes tróficas estando presentes en casi la mitad de sus enlaces (Wilson y Wolkovich 2011). Al consumir carroña, estos animales secuestran recursos en niveles tróficos superiores y dispersan nutrientes entre y dentro de los ecosistemas (Selva 2004; Schlichting et al. 2019). Además, contribuyen a la reducción de patógenos al eliminar rápidamente los cadáveres, disminuyendo potencialmente la propagación de enfermedades (Evelsizer et al. 2010; Mateo-Tomás et al. 2015).
A pesar de la gran cantidad de trabajos que han evaluado los patrones de consumo de carroña procedente de caza mayor (Blázquez et al. 2009; Mateo-Tomás et al. 2015; Tobajas et al. 2022), existe una notable carencia de estudios sobre los carroñeros que aprovechan las carroñas generadas por la caza menor (ver Mctee et al. 2019; Carpio et al. 2023), una actividad muy extendida en España, como por ejemplo la caza de aves acuáticas en humedales. Por otro lado, se ha observado que el tamaño de las carroñas es un factor determinante en la estructura y funcionamiento de las comunidades de carroñeros (Moleón et al. 2015). La mayor parte de la biomasa de carroñas de tamaño medio, similar a las resultantes de la caza de aves acuáticas, es consumida principalmente por carroñeros vertebrados (DeVault et al. 2003; Sebastián-González et al. 2013). En España, la mayoría de los humedales están protegidos, aun así, en muchos de ellos se permite la caza de aves acuáticas, como es el caso del Parque Natural de El Hondo (sudeste de España), nuestro lugar de estudio. Por lo tanto, el objetivo principal de este trabajo es estudiar la comunidad de carroñeros y los patrones de consumo de carroña que simula eventos de caza de aves acuáticas en un humedal de importancia internacional para las aves. Asimismo, como objetivos secundarios (i) evaluamos como afecta la presencia de las diferentes especies de carroñeros al tiempo de detección y eliminación de la carroña y (ii) describimos la riqueza y abundancia media por carroña (número mínimo medio de individuos de cada especie por carroña) de las especies que realizan un uso indirecto de las carroñas consumiendo los invertebrados atraídos por estas. Predecimos que: (i) la comunidad de carroñeros estará compuesta principalmente por especies oportunistas —aquellas con una elevada capacidad de adaptación de su dieta a la disponibilidad de recursos— (Dell’Arte et al. 2007), debido al carácter previsible (temporal- y espacialmente) de la fuente de alimento, (ii) el consumo de las carroñas será más eficiente cuando aparezcan carroñeros de mayor tamaño (e.g., jabalíes, zorros) que cuando aparezcan especies pequeñas (e.g., roedores) (Orihuela-Torres et al. 2023) y (iii) las especies de aves detectarán las carroñas en un tiempo menor que las especies de mamíferos debido a su gran capacidad de movimiento mediante el vuelo (Ruxton y Houston 2004).
Material y métodos
Área de estudio
Este estudio se realizó en El Parque Natural de El Hondo (2387 ha; El Hondo a partir de ahora), un humedal mesohialino de origen natural pero actualmente modificado completamente por el ser humano, situado en el sur de Alicante (Fig. 1, 38°11′16″N, 0°47′28″O) (Abellán-Contreras 2019). El Hondo se encuentra conformado por dos grandes embalses y más de veinte lagunas de menor tamaño utilizadas para la conservación de especies, la pesca y la caza deportiva (Orihuela-Torres et al. 2022). El clima de El Hondo es árido termo-mediterráneo, con escasas precipitaciones (media: 280 mm anuales) y altas temperaturas, con una media anual de 19°C, siendo enero el mes más frío (11°C) y agosto el más cálido (26°C). En cuanto a la vegetación, la formación predominante es el carrizal de Phragmites australis, junto con juncos (Juncus spp.) y especies halófilas como Sarcocornia fruticosa, Suaeda spp., y Limonium spp. (Sedín 2005).
El Hondo está incluido en la lista de humedales de importancia internacional del Convenio Ramsar, ha sido declarado Zona de Especial Conservación para las Aves (ZEPA) y propuesto como Zona de Especial Conservación (ZEC) según la Directiva Europea de Hábitats (Escuder 2003). Dentro de los grupos faunísticos, las aves acuáticas conforman el grupo más importante del parque, destacando la cerceta pardilla (Marmaronetta angustirostris) y la malvasía cabeciblanca (Oxyura leucocephala), que encuentran en El Hondo una de las áreas más importantes de Europa. Por otro lado, también es hábitat de diferentes especies de gaviotas, rapaces y mesocarnívoros como el zorro rojo (Vulpes vulpes), la gineta común (Genetta genetta), la garduña (Martes foina) y la nutria europea (Lutra lutra), también encontramos otros mamíferos como el jabalí (Sus scrofa) (Carrión Jaén 2022), todos ellos potenciales carroñeros facultativos. Cabe destacar que El Hondo carece de carroñeros obligados (i.e., buitres) y depredadores apicales.
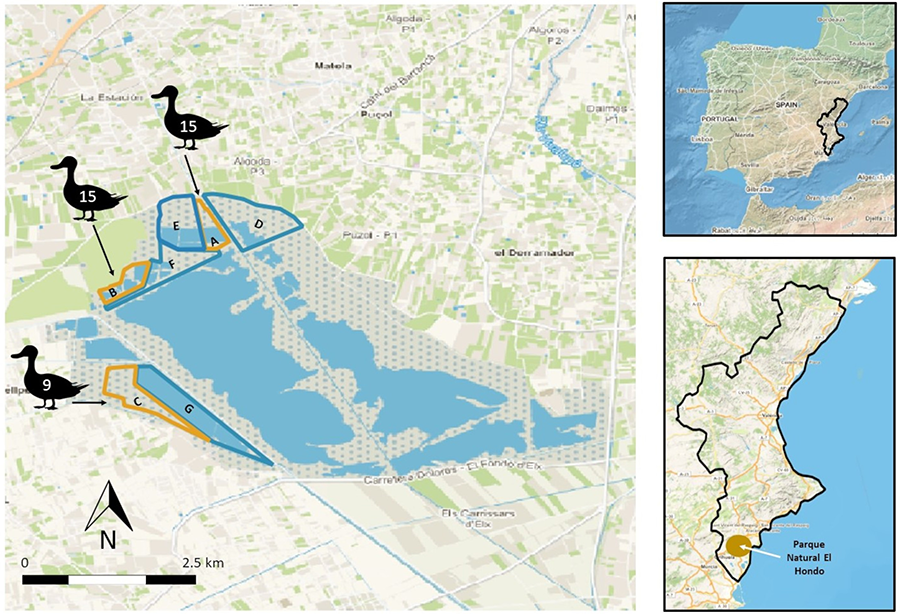
Figura 1. Mapa del área de estudio en El Parque Natural de El Hondo, Alicante. Se colocaron 39 carroñas de aves acuáticas en tres áreas adyacentes a los cotos de caza de aves acuáticas (color naranja): A) Charca El Canal, B) Balserones y C) El Espigar. En el interior de la silueta de la anátida se indica el número de carroñas colocadas en cada zona. Junto a estas áreas se pueden encontrar terrenos privados destinados a la caza (color azul): D) La Prada, E) El Bosquet, F) Lo Vaquero y G) La Raja.
Figure 1. Map of the study area in El Hondo Natural Park, Alicante. Thirty-nine waterbird carcasses were placed in three areas adjacent to waterbird hunting grounds: A) El Canal Pond, B) Balserones, and C) El Espigar. The number of carcasses located in each zone is indicated within the silhouette of a waterfowl. Adjacent to these areas, private hunting grounds can be found: D) La Prada, E) El Bosquet, F) Lo Vaquero, and G) La Raja.
Diseño experimental
Entre noviembre de 2022 y febrero de 2023; lo que coincide con la temporada de caza, se colocaron un total de 39 carroñas de aves acuáticas (13 grupos de 3 carroñas) en áreas adyacentes a tres cotos privados de caza (i.e., a menos de 50 metros) (Fig. 1), dentro de El Hondo. Las carroñas se colocaban tras la actividad cinegética (entre 8 - 14 horas después) en el parque natural. Con el fin de simular los patrones de caída natural de las aves acuáticas en el territorio durante su caza, las carroñas se dispusieron de manera aleatoria en grupos de tres (separados un mínimo de 300 metros por grupo), a distancias de 10 - 20 metros entre cada carroña del mismo grupo. Sin embargo, debido a limitaciones técnicas, las carroñas se colocaron exclusivamente en áreas terrestres y accesibles desde tierra, evitando zonas de difícil acceso como cuerpos de agua o pequeñas islas.
Para el seguimiento de la comunidad de carroñeros consumidora de los cadáveres de aves acuáticas, se utilizaron cámaras de fototrampeo activadas por movimiento (78 cámaras en total, Modelo: Browning Strike Force pro-HD). Se colocaron dos cámaras en cada carroña. Una de ellas se programó para que una vez activada por el movimiento tomase dos imágenes cada 20 segundos. La otra cámara una vez activada realizó vídeos de 10 segundos cada 30 segundos. Colocamos dos cámaras con el fin de poder evidenciar el consumo de carroña y descartar posibles visitas sin ingesta, así como poder diferenciarlo del consumo de invertebrados asociados a las carroñas (Orihuela-Torres et al. 2022). Se visitaron las cámaras aproximadamente cada dos días para comprobar el estado de la tarjeta de memoria y la batería, y se sustituyeron cuando fue necesario. Asimismo, se evaluó el estado de consumo de la carroña en cada visita, estimando visualmente el porcentaje de la carroña (grasa, músculos y tejidos, excluyendo huesos y plumas) consumida por vertebrados e invertebrados, siguiendo una metodología similar a la de Redondo-Gómez et al. (2022). Para ello, se inspeccionaron los invertebrados presentes en la carroña (principalmente se trató de larvas de mosca) y, se identificaron marcas visibles que indicaran consumo por parte de vertebrados (como mordeduras o picotazos). Además, se revisaron in situ las imágenes y vídeos de las cámaras trampa correspondientes a los dos días previos, lo que proporcionó información visual directa sobre el consumo por vertebrados (Orihuela-Torres et al. 2022). La biomasa faltante que no había sido consumida por vertebrados –confirmado mediante las cámaras trampa-, se atribuyó al consumo por invertebrados cuando estos estuvieron presentes en la carroña. Es importante señalar que los invertebrados tuvieron un papel poco relevante (únicamente consumieron en el 10% de las carroñas). En ninguno de esos casos se detectó la presencia de vertebrados antes de la revisión, lo que indicó que los invertebrados fueron los únicos en consumir la carroña hasta ese momento y por lo tanto los responsables de la disminución en la biomasa de ésta entre las dos visitas. Cabe destacar que el tiempo medio de eliminación de las carroñas en nuestro estudio fue de aproximadamente 4 días, durante los meses de invierno, cuando las temperaturas eran bajas. La velocidad de descomposición por bacterias y hongos depende considerablemente de la temperatura, siendo más rápida a mayores temperaturas (Paul y Clark 1989). Lo mismo ocurre con los insectos, cuya actividad aumenta en condiciones más cálidas (Mellanby 1939). Por lo tanto, dado el tiempo de permanencia de las carroñas en el campo y las bajas temperaturas, consideramos que la descomposición por bacterias y hongos fue poco significativa, ya que estos organismos suelen descomponer la materia orgánica en periodos más largos. La retirada de las cámaras se llevó a cabo una vez que la carroña había sido totalmente consumida exceptuando las plumas y huesos (Blázquez et al. 2009; Sebastián-González et al. 2016).
Tratamiento y procesado de imágenes y vídeos
Posteriormente, se revisaron todas las imágenes (n=11 682) y vídeos (n=4580). En primer lugar; para cada carroña, se calcularon dos variables descriptoras de la comunidad de carroñeros: (1) riqueza: número de especies de vertebrados consumidores de la carroña y (2) abundancia media por carroña: número mínimo medio de individuos de vertebrados consumidores de la carroña de cada especie. Esta se calculó de dos posibles maneras: a) identificando el número de individuos de una especie que aparecen simultáneamente en un mismo vídeo/imagen y/o b) distinguiendo cada individuo inequívocamente por su sexo, edad o características físicas (pelaje, marcas, manchas, etc.) en diferentes vídeos/imágenes (Naves‐Alegre et al. 2021). Este último método (b) solo se aplicó cuando la identificación de dos o más individuos en imágenes/vídeos diferentes fue inequívoca. En los casos en que se logró diferenciar claramente a dos individuos, se pudo establecer que la abundancia mínima de esa especie en la carroña era de al menos dos individuos. Un ejemplo de diferenciación por características físicas es la observación de dos zorros en la misma carroña: uno afectado por sarna y otro sin signos de la enfermedad, en diferentes imágenes o vídeos. En segundo lugar, se calcularon cinco variables descriptoras de los patrones de consumo de los carroñeros: (1) tiempo de detección: tiempo transcurrido desde que se colocó la carroña hasta que el primer carroñero se alimentó de esta; y (2) tiempo de eliminación: tiempo transcurrido desde que se situó la carroña hasta que esta fue totalmente consumida o bien cuando esta fue retirada del foco de la cámara por un carroñero (Naves‐Alegre et al. 2021); (3) especie detectora: la primera especie en consumir la carroña; (4) porcentaje biomasa de carroña consumida por vertebrados, invertebrados y total; y (5) grupo: indicando por qué tipo de vertebrados fue consumida la carroña (aves (A), mamíferos (M) o ambos (A_M)).
Finalmente, para aquellas especies que realizaron un consumo indirecto de la carroña (consumo de los invertebrados presentes en ésta) se calculó también su riqueza (número de especies de vertebrados consumidores de la carroña) y abundancia media por carroña (número mínimo medio de individuos de cada especie por carroña) siguiendo el mismo criterio descrito arriba. El consumo indirecto de la carroña se pudo identificar gracias al uso de dos cámaras en cada carroña: una configurada para capturar imágenes y otra para grabar vídeos. Este enfoque nos permitió observar con claridad el comportamiento de los carroñeros. Al alimentarse de carroña, los animales suelen mover o desgarrar el cuerpo, lo que se manifiesta en cambios visibles, como la exposición de carne o plumas. En contraste, cuando se alimentan de invertebrados, realizan movimientos rápidos alrededor de la carroña y no permanecen mucho tiempo en un mismo lugar, ya que buscan invertebrados en otras áreas.
Análisis estadístico
En primer lugar, para confirmar que el esfuerzo de muestreo fue suficiente para identificar todos los vertebrados carroñeros se realizó una curva de acumulación de la riqueza de especies mediante el software R 3.3.3 (R Core Team 2013) utilizando la función “accumresult” del paquete “BiodiversityR” (Kindt y Coe 2005) (Fig. A1 del Apéndice).
A continuación, con la intención de comprobar si el tiempo de detección y el tiempo de eliminación varían según la especie consumidora de la carroña proveniente de la caza se llevaron a cabo varios Modelos Lineales Generalizados Mixtos (GLMMs) en R 3.3.3 utilizando la función “lmer” del paquete “lmerTest” (Kuznetsova et al. 2017). En este caso “tiempo de detección” y “tiempo de eliminación” fueron las variables de respuesta y “especie” (abundancia media en la carroña) la variable predictora. Además, el grupo de carroñas que se habían colocado juntas se colocó como variable aleatoria. Se realizó un GLMM para cada especie y variable respuesta incluyendo la variable aleatoria. Asimismo, calculamos el R² marginal; que refleja la proporción de la variabilidad explicada solo por los efectos fijos, así como el R² condicional; que representa la variabilidad explicada por los efectos fijos y aleatorios combinados, para cada modelo utilizando la función “r.squaredGLMM” del paquete “MuMIn” (Bartoń 2024). Por otro lado, para estudiar si las mismas variables respuesta variaban según el grupo consumidor de la carroña se repitió el mismo procedimiento utilizando la variable “grupo” como variable predictora. Además, se realizó una prueba post-hoc para realizar comparaciones múltiples entre los grupos utilizando la función ´emmeans´ del paquete ´emmeans´ (Lenth 2024). Las variables respuesta, “tiempo de detección” y “tiempo de eliminación”, se transformaron logarítmicamente para cumplir el supuesto de normalidad y se utilizó una distribución Gaussiana para la realización de los modelos.
Resultados
Comunidad de vertebrados carroñeros
Se detectaron siete especies de vertebrados carroñeros facultativos consumidores de la carroña proveniente de la caza. La curva de acumulación de especies indicó que se realizó un muestreo adecuado donde aparecieron la mayoría de las especies que aprovechan este recurso (Fig. A1 del Apéndice). La riqueza media fue de 1.58 especies/carroña (Tabla 1). Asimismo, la riqueza media de especies de aves y de mamíferos por carroña fue de 1.09 especies/carroña y 1.42 especies/carroña respectivamente (Tabla 1). Entre estas aparecieron cuatro especies de aves: urraca común (Pica pica), aguilucho lagunero occidental (Circus aeruginosus), busardo ratonero (Buteo buteo) y cernícalo vulgar (Falco tinnunculus) y tres especies de mamíferos: zorro rojo (Vulpes vulpes), jabalí (Sus scrofa) y rata parda (Rattus norvegicus) (Fig. 2).
Las especies con una abundancia media por carroña mayor (número mínimo medio de individuos de cada especie por carroña), fueron la rata parda (0.82) y el zorro rojo (0.64). Con una abundancia promedio menor encontramos: el aguilucho lagunero occidental (0.2), el jabalí (0.2), el cernícalo vulgar (0.17), el busardo ratonero (0.05) y la urraca común (0.02) (Fig. 3). Por otra parte, la abundancia media fue de 2.12 individuos/carroña (Tabla 1). La abundancia media de individuos de aves fue menor que la de mamíferos, con valores de 0.46 individuos/carroña y 1.67 individuos/carroña respectivamente (Tabla 1).
Asimismo, se documentó el consumo indirecto de la carroña (consumo de los invertebrados presentes en esta) por parte de tres especies (Fig. 3). El petirrojo europeo realizó un consumo secundario en el 7.69% (n=3) de las carroñas, el alcaudón real (Lanius meridionalis) en el 5.12% (n=2) y el mochuelo común (Athene noctua) en el 2.56% (n=1).
Tabla 1. Comunidad de carroñeros y sus patrones de consumo de carroñas de aves acuáticas simulando eventos de caza en el Parque Natural de El Hondo. Se muestra la riqueza (mamíferos, aves y total), la riqueza/carroña (media ± EE de especies por carroña), la abundancia/carroña (media ± EE de abundancia por carroña), el tiempo medio de detección y de eliminación (media ± EE), la biomasa consumida (porcentaje de carroña consumida por vertebrados, invertebrados y total) y, por último, la presencia de aves y mamíferos (porcentaje de carroñas en las que consumen aves o mamíferos respectivamente). La “n” indica el número de carroñas en las que consumen estas especies.
Table 1. Carrion scavenger community and their carcass consumption patterns of waterfowl simulating hunting events in the El Hondo Natural Park. It shows the richness (mammals, birds, and total), richness/carcass (average species per carcass ± SE), abundance/carcass (average abundance per carcass ± SE), mean detection and removal time (average ± SE), consumed biomass (percentage of carcass consumed by vertebrates, invertebrates, and total), and finally, the presence of birds and mammals (percentage of carcasses in which birds or mammals consume, respectively). "n" indicates the number of carcasses in which these species consume.
|
Variable |
Valor |
|
Riqueza total |
7 |
|
Riqueza de mamíferos |
3 |
|
Riqueza de aves |
4 |
|
Riqueza/carroña |
1.58 ± 0.81 |
|
Abundancia/carroña |
2.12 ± 0.66 |
|
Tiempo de detección (horas) |
55.89 ± 89.74 |
|
Tiempo de detección aves (horas) |
18.03±4.03 |
|
Tiempo de detección mamíferos (horas) |
69.74±16.16 |
|
Tiempo de eliminación (horas) |
98.36 ± 105.77 |
|
Tiempo de eliminación aves (horas) |
42.58±6.19 |
|
Tiempo de eliminación mamíferos (horas) |
112.46±19.04 |
|
Biomasa total consumida (%) |
100 ± 0 |
|
Biomasa consumida por vertebrados (%) |
93.33 ± 23.12 |
|
Biomasa consumida por invertebrados (%) |
6.66 ± 23.12 |
|
Presencia de aves (%) |
28.20 (n=11) |
|
Presencia de mamíferos (%) |
92.30 (n=36) |

Figura 2. Especies consumidoras de carroña proveniente de la caza en El Hondo. Imágenes de las especies consumidoras de carroña obtenidas en este estudio: A) Urraca común (Pica pica), B) Cernícalo vulgar (Falco tinnunculus), C) Busardo ratonero (Buteo buteo), D) Aguilucho lagunero occidental (Circus aeruginosus), E) Zorro rojo (Vulpes Vulpes), F) Jabalí (Sus scrofa) y G) Rata parda (Rattus norvegicus).
Figure 2. Carrion-consuming species from hunting in The Hondo. Images of carrion-consuming species obtained in this study: A) Eurasian Magpie (Pica pica), B) Eurasian Kestrel (Falco tinnunculus), C) Common Buzzard (Buteo buteo), D) Western Marsh Harrier (Circus aeruginosus), E) Red Fox (Vulpes vulpes), F) Wild Boar (Sus scrofa), and G) Brown Rat (Rattus norvegicus).
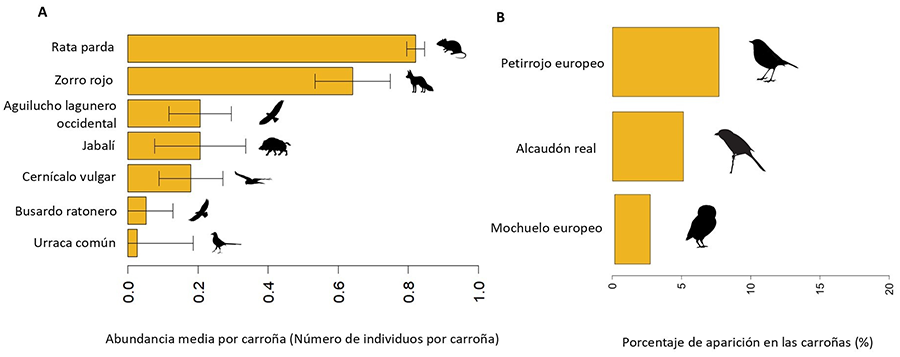
Figura 3. A) Abundancia media de especies por carroña proveniente de la caza. El diagrama de barras muestra la abundancia media por carroña de cada especie (número mínimo medio de individuos de cada especie que aparece por carroña) junto con el error estándar. B) Especies que consumen los invertebrados presentes en la carroña. Se observa el porcentaje (%) de carroñas en que las especies aparecen consumiendo invertebrados presentes en la carroña.
Figure 3. A) Average abundance of species per hunting carcass. The bar chart shows the average abundance per carcass for each species (average minimum number of individuals of each species appearing per carcass) along with the standard error. B) Species performing secondary consumption of the carcass. The percentage (%) of carcasses in which species are observed performing secondary consumption is shown. This refers to the consumption of invertebrates present on the carcass.
Patrones de consumo de la carroña
El 100% de las carroñas fueron consumidas por completo en menos de 14 días (Tabla 1). En cuanto a la biomasa, se pudo observar que los vertebrados consumieron el 93.33%, mientras que los invertebrados únicamente consumieron el 6.66% (Tabla 1). Los mamíferos consumieron en el 92.30% (n=36) de las carroñas, mientras que las aves en el 28.20% (n=11) (Tabla 1). La especie que apareció consumiendo en más carroñas fue el zorro rojo (n=25; 64.10%), seguido de la rata parda (n=22; 56.41%) y el aguilucho lagunero occidental (n=5; 12.80%). Por otro lado, el cernícalo vulgar y el jabalí aparecieron consumiendo en el 10.25% (n=4) de las carroñas, mientras que el busardo ratonero y la urraca común aparecieron consumiendo en el 5.12% (n=2) y 2.56% (n=1) de las carroñas, respectivamente (Fig. 4).
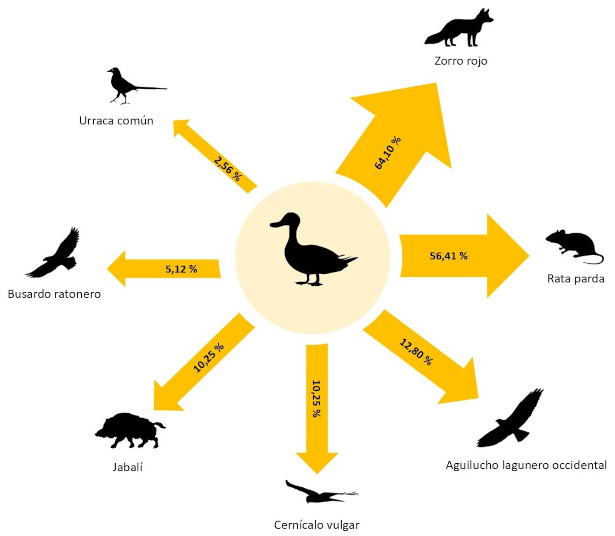
Figura 4. Presencia de cada especie consumiendo en las carroñas. Se representa el porcentaje (%) de carroñas en el que aparece cada especie consumiendo.
Figure 4. Presence of each species consuming carrion. The percentage (%) of carcasses in which each species appears consuming is represented.
Los mamíferos detectaron el 89.74% (n=35) de las carroñas mientras que las aves únicamente detectaron el 10.25% (n=4). Las especies que más carroñas detectaron fueron la rata parda (n=21; 53.84%) y el zorro rojo (n=12; 30.76%), seguidos por el jabalí (n=2; 5.12%). El aguilucho lagunero occidental, el busardo ratonero, el cernícalo vulgar y la urraca común detectaron únicamente una carroña cada uno (Fig. A2 del Apéndice). El tiempo medio de detección fue de 55.89 horas (Tabla 1). El tiempo medio de detección de las carroñas por parte de las aves fue de 18.03 horas y de 69.74 horas el de los mamíferos (Tabla 1). A pesar de ello, no se encontraron diferencias significativas en el tiempo de detección en función del grupo carroñero, así como tampoco se encontraron diferencias entre grupos (Tabla A1 y Tabla A2 del Apéndice). A nivel específico, únicamente se encontraron diferencias significativas en el tiempo de detección entre las distintas especies de carroñeros consumidores de la carroña en el caso del cernícalo vulgar. Se pudo observar que cuando el cernícalo vulgar consumió una carroña, el tiempo de detección fue considerablemente menor en comparación con las demás especies (coeficiente=0.349; p-valor=0.02) (Tabla 2).
Por otra parte, el tiempo medio de eliminación de las carroñas fue de 98.36 horas (Tabla 1). El tiempo medio de eliminación en las carroñas en las que aparecieron las aves fue de 42.58 horas y de 112.46 horas en las que aparecieron los mamíferos (Tabla 1). No obstante, no se encontraron diferencias significativas en el tiempo de eliminación según el grupo carroñero, ni tampoco entre los diferentes grupos (Tabla A1 y Tabla A2 del Apéndice). En cuanto a las diferencias entre los tiempos de eliminación por parte de las diferentes especies, únicamente encontramos diferencias significativas cuando la rata parda aparecía consumiendo en las carroñas. En este caso, se observó que cuando esta consumió la carroña, el tiempo de eliminación fue mayor (coeficiente=0.515; p-valor=0.006) (Tabla 2).
Tabla 2. Resultados de los Modelos Lineales Generalizados Mixtos (GLMMs) que comparan si el tiempo de detección y el tiempo de eliminación varían según la especie consumidora de la carroña. Se observa el coeficiente del modelo, el error estándar (SE), el p-valor; cuyos valores significativos (p-valor<0.05) se indican con un asterisco, el R² marginal, que refleja la proporción de la variabilidad explicada solo por los efectos fijos, así como el R² condicional, que representa la variabilidad explicada por los efectos fijos y aleatorios combinados. Asimismo, se añadió en los modelos un identificador que agrupaba las carroñas que se habían colocado juntas como una variable aleatoria.
Table 2. Results of the Generalized Linear Mixed Models (GLMMs) comparing whether the detection time and the removal time vary according to the carrion-consuming species. The model coefficient, standard error (SE), and p-value are shown; significant values (p-value < 0.05) are indicated with an asterisk. The marginal R² reflects the proportion of variability explained solely by fixed effects, while the conditional R² represents the variability explained by both fixed and random effects combined. Additionally, an identifier that grouped carcasses placed together was added to the models as a random variable.
|
|
Coeficiente |
SE |
p-valor |
Marginal R2 |
Condicional R2 |
|
Tiempo de detección ~ zorro rojo |
0.005 |
0.503 |
0.992 |
2.47E-06 |
0.49 |
|
Tiempo de detección ~ rata parda |
0.052 |
0.250 |
0.834 |
0.001 |
0.49 |
|
Tiempo de detección ~ aguilucho lagunero occidental |
-0.494 |
0.390 |
0.215 |
0.030 |
0.54 |
|
Tiempo de detección ~ busardo ratonero |
-1.700 |
0.892 |
0.090 |
0.058 |
0.54 |
|
Tiempo de detección ~ cernícalo vulgar |
-0.862 |
0.349 |
0.020* |
0.099 |
0.51 |
|
Tiempo de detección ~ urraca común |
-0.926 |
1.306 |
0.484 |
0.008 |
0.53 |
|
Tiempo de detección ~ jabalí |
-0.097 |
0.256 |
0.706 |
0.002 |
0.48 |
|
Tiempo de eliminación ~ zorro rojo |
0.247 |
0.396 |
0.537 |
0.007 |
0.60 |
|
Tiempo de eliminación ~ rata parda |
0.515 |
0.177 |
0.006* |
0.14 |
0.69 |
|
Tiempo de eliminación ~ aguilucho lagunero occidental |
0.254 |
0.337 |
0.455 |
0.012 |
0.56 |
|
Tiempo de eliminación ~ busardo ratonero |
0.098 |
0.737 |
0.133 |
2.0E-04 |
0.57 |
|
Tiempo de eliminación ~ cernícalo vulgar |
-0.393 |
0.286 |
0.180 |
0.029 |
0.57 |
|
Tiempo de eliminación ~ urraca común |
-1.383 |
0.988 |
0.173 |
0.027 |
0.64 |
|
Tiempo de eliminación ~ jabalí |
-0.258 |
0.194 |
0.195 |
0.026 |
0.60 |
Discusión
Este estudio describe por primera vez la comunidad de carroñeros vertebrados terrestres que se beneficia de carroñas de aves acuáticas que simulan actividades cinegéticas en El Hondo. Los vertebrados desempeñaron un papel crucial en la eliminación de las carroñas, consumiendo la mayor parte de su biomasa, lo que destaca su importancia en la eliminación de las carroñas que simulan eventos de caza.
La comunidad de vertebrados carroñeros consumidores de la carroña de caza está formada por siete especies. Los mamíferos detectaron y consumieron en un número mucho mayor las carroñas que simulan eventos de caza que las aves. Estudios previos han observado que las aves son más eficientes localizando carroñas de gran tamaño en áreas con buena visibilidad (Ogada et al. 2012). No obstante, los mamíferos poseen una capacidad olfativa superior a la de las aves, lo que les permite localizar y consumir carroñas de tamaño pequeño a mediano (como las carroñas de aves acuáticas) con mayor rapidez, ya que en estos casos el sentido de la vista no desempeña un papel tan crucial (Olea et al. 2019). Sin embargo, existen otros factores que podrían influir en este patrón, como la abundancia de las poblaciones de las especies de carroñeros en el área o el taxon de la carroña. Los vertebrados carroñeros tienden a evitar el consumo de carroñas filogenéticamente similares para reducir el riesgo de infección por parásitos comunes (Moleón et al. 2017; Muñoz-Lozano et al. 2019). Por ello, es posible que las aves consuman menos carroñas en nuestro estudio debido a su proximidad filogenética con las carroñas de aves acuáticas. No obstante, el tiempo de detección fue significativamente más corto en las carroñas consumidas por el cernícalo vulgar (n=4). Se observó que el cernícalo vulgar siempre consumió las carroñas ubicadas en la misma área, y en el 75% (n=3) de las ocasiones, lo hizo en pareja. Esto sugiere que se trataba del territorio de una misma pareja de individuos, lo que podría explicar su rápida capacidad para detectar las carroñas.
Por otro lado, las especies que aparecieron consumiendo un mayor número de carroñas fueron el zorro rojo y la rata parda. Numerosos estudios demostraron que el zorro rojo es uno de los principales consumidores de carroña en los ecosistemas mediterráneos (Mateo-Tomás et al. 2015; Arrondo et al. 2019; Tobajas et al. 2021) aumentando su densidad en aquellos ecosistemas que carecen de carroñeros obligados o de depredadores apicales (Morales-Reyes et al. 2017; Tobajas et al. 2021), dándose ambas situaciones en El Hondo. Adicionalmente, la carroña representa una parte más significativa de la dieta del zorro rojo durante el invierno en comparación con el verano, debido a que otros recursos alimenticios escasean en invierno (Jędrzejewski y Jędrzejewska 1992; Alvarez et al. 2008; Díaz-Ruiz et al. 2013). De nuevo, esto podría explicar la elevada presencia del zorro rojo en las carroñas de nuestro estudio, situadas en los meses de otoño e invierno. De hecho, en el estudio llevado a cabo por Orihuela-Torres et al. (2023) en la misma área de estudio, pero con carroñas que simulan eventos de mortalidad natural, el zorro también consumió un mayor número de carroñas durante los meses de otoño e invierno. En cambio, en su estudio el zorro rojo apareció en el 40% (n=8) de las carroñas de aves acuáticas, mientras que la rata parda únicamente en el 10% (n=2), cifras considerablemente menores que las obtenidas para las carroñas de caza de nuestro estudio. Esto podría sugerir que la mayor acumulación espacio-temporal de las carroñas en los eventos periódicos (caza), beneficia a las poblaciones de zorro rojo y rata parda (Mundy et al. 1992; Oro et al. 2008). La existencia de una fuente predecible de carroña puede reducir el área de campeo de ambas especies (Margalida et al. 2013) lo que, sumado a una gran capacidad olfativa para detectar carroñas, aumentaría su presencia y consumo de las mismas. Cabe destacar, que esta diferencia en la presencia del zorro rojo y la rata parda entre nuestro estudio y el de Orihuela-Torres et al. (2023) podría deberse también a un cambio de la abundancia relativa de ambas especies en la zona entre los dos años transcurridos entre ambos estudios. También es importante señalar que en nuestro estudio las carroñas se colocaron únicamente en zonas accesibles desde tierra, lo que puede haber limitado el acceso a estas carroñas de ciertas especies carroñeras más especializadas en zonas acuáticas o de difícil acceso (por ejemplo, en cuerpos de agua o pequeñas islas). Esta limitación técnica en nuestro diseño experimental pudo sesgar los resultados hacia especies de hábitos preferentemente terrestres, como es el caso del zorro rojo, en detrimento de otros carroñeros como las aves, que podrían acceder a carroñas en áreas más inaccesibles y zonas acuáticas.
Asimismo, la rata parda es considerada una especie exótica invasora en muchas partes del mundo, entre ellas España, donde ha logrado establecer poblaciones exitosas (IUCN 2023a). La baja presencia de esta especie exótica invasora en carroñas que imitan la mortalidad natural (Orihuela-Torres et al. 2023) en comparación con su elevada presencia en carroñas que simulan la caza sugiere que la mayor acumulación de carroña debida a la caza podría favorecer su establecimiento en los ecosistemas (Benbow et al. 2015). Además, los cotos de caza constituyen lugares de elevada actividad humana, lo que promueve el establecimiento de especies invasoras, ya que toleran mejor la presencia humana y se benefician de esta (Reed y Merenlender 2008; Gilby et al. 2023). Por otra parte, otros carroñeros más evasivos con el ser humano reducen su presencia en estas zonas, aumentando la cantidad de carroña disponible para las especies invasoras y beneficiándolas (Cunningham et al. 2018). Estos resultados apoyan los obtenidos por Orihuela-Torres et al. (2023), que observó que el uso público en El Hondo altera la estructura de la comunidad de carroñeros, así como sus patrones de consumo, promoviendo el establecimiento de especies invasoras. En el estudio, la rata parda apareció consumiendo en una mayor proporción de carroñas situadas en las áreas de acceso al público de El Hondo que en las áreas de acceso restringido (35.6% vs.11.7%). Además, estudios anteriores en humedales mediterráneos evidencian que la rata parda y los roedores, destruyen y depredan sobre nidos de aves acuáticas y otros paseriformes paludícolas (López-Iborra et al. 2004; Angelici et al. 2012). Por lo tanto, si la mayor disponibilidad de carroña procedente de la caza favorece el establecimiento de esta especie, podría suponer un riesgo para ciertas especies de aves acuáticas que se encuentran amenazadas y anidan en El Hondo, como es el caso de la cerceta pardilla y la malvasía cabeciblanca, así como otras especies de paseriformes palustres.
En lo que respecta a las especies que detectaron las carroñas, a pesar de que el zorro rojo consumió en un mayor número de carroñas (n=25; 64.10%), detectó (n=12; 34.76%) un número menor de ellas en comparación con las detectadas por la rata parda (n=21; 53.83%), la cual consumió en un menor número de carroñas (n=22; 56.41%). Esto puede explicarse por el hecho de que cuando la rata parda fue la especie detectora, únicamente el 19.04% (n=4) de las ocasiones consumió totalmente la carroña. El resto de las veces no consumió completamente la carroña tras detectarla, dejando una gran parte de ésta disponible para otras especies. Cuando esto último ocurrió, en el 76.47% (n=13) de los casos, el zorro rojo consumió el resto de la carroña. Por lo contrario, cuando el zorro rojo fue la especie detectora, el 100% de las ocasiones consumió la carroña completamente. Como resultado, aunque la rata parda encontró más carroñas que el zorro rojo, este último consumió en un mayor número de carroñas. Además, la cantidad de biomasa total consumida por el zorro rojo fue muy superior a la consumida por la rata parda. Estos hallazgos concuerdan con el hecho de que el tiempo de eliminación fue significativamente mayor en las carroñas consumidas por la rata parda, debido a la menor eficiencia de consumo y menor tamaño de esta especie en comparación con las demás. Un tiempo de eliminación mayor conlleva una mayor permanencia de la carroña en los ecosistemas, lo que disminuye la velocidad de reciclado de nutrientes y puede aumentar la probabilidad de transmisión de patógenos (Mateo-Tomás et al. 2015). Un aspecto interesante que surge de nuestros hallazgos es la posible interacción entre zorros y ratas en las carroñas. Dado que las ratas forman parte de la dieta de los zorros, se esperaría que la presencia de estos últimos actuara como un factor disuasorio para las primeras, reduciendo así el número y la duración de las visitas de ratas a las carroñas (Moleón y Sánchez-Zapata 2021). Además, la presencia de zorros podría reducir la población de ratas (Coates et al. 2008) y, a su vez, favorecer una eliminación más eficiente de las carroñas. Sin embargo, en muchas áreas del sureste de la Península Ibérica, el control intensivo de predadores, que a menudo incluye la caza de zorros y otros mesocarnívoros, es una práctica común en cotos de caza menor (Virgós y Travaini 2000). Esta práctica puede alterar la estructura de las comunidades de carroñeros, reduciendo la presencia de mesocarnívoros y favoreciendo, potencialmente, la proliferación de especies presa menos eficientes en el consumo de carroñas, como la rata parda. En futuros estudios, sería interesante profundizar en las implicaciones ecológicas de la caza de mesocarnívoros sobre los servicios ecosistémicos relacionados con la eliminación de carroñas del ecosistema. También, es importante destacar que, aunque el uso de munición de plomo en actividades cinegéticas en humedales españoles incluidos en el convenio RAMSAR fue prohibido en el año 2001, hoy en día aún se observa la bioacumulación de este metal en las aves acuáticas (Valverde et al. 2019). Además, evidencias recientes apuntan a que todavía se sigue utilizando de forma ilegal nuestra área de estudio, el Parque Natural de El Hondo (Pérez-García et al. 2020). Suponiendo, por ende, un riesgo para los carroñeros que consumen las aves acuáticas no recuperadas del medio por los cazadores.
Por otro lado, el petirrojo europeo, el mochuelo común y el alcaudón real consumieron invertebrados asociados a la carroña debido a que los insectos constituyen una parte importante de su dieta (Debussche y Isenmann 1985; Goutner y Alivizatos 2003; Nikolov et al. 2004). Cabe destacar que el alcaudón real se encuentra categorizado como “Vulnerable” a nivel global y europeo (IUCN 2023b). Esto evidencia la gran actividad biológica que tiene lugar en torno a este recurso, atrayendo no solo a especies que consumen directamente la carroña, sino también a muchas otras que realizan un uso diferente de la misma (consumo de invertebrados, recogida de pelo y plumas para nidos, etc), creando una gran red de interacciones (Tabor et al. 2005; Carter et al. 2007; Moleón y Sánchez-Zapata 2016). Cabe resaltar que estudios previos han documentado el consumo de carroña por parte del petirrojo europeo y el alcaudón real (Young et al. 2014; Orihuela-Torres et al. 2023).
Además de atraer a especies de vertebrados, las carroñas atraen a un gran número de invertebrados como escarabajos carroñeros (Silphidae), moscas azules (Calliphoridae), escarabajos derméstidos (Dermestidae), escarabajos enterradores (Silphidae) o depredadores de otros invertebrados (Staphylinidae) (Battán-Horenstein y Linhares 2011; Hall 1948; Meierhofer et al. 1999; Smith y Merrick 2001). Sin embargo, en nuestro estudio, los invertebrados consumieron una parte minoritaria de la biomasa de las carroñas. Esto puede deberse a que durante el invierno y el otoño (periodo en el que se llevó a cabo este estudio), los insectos y microorganismos están menos activos. En estas épocas, los carroñeros vertebrados pueden llegar a consumir el 100% de la biomasa de una carroña (Putman 1983). Además, se ha visto que la función de los vertebrados e invertebrados en la eliminación de la carroña varía según la cantidad de biomasa presente. En el caso de las carroñas de tamaño pequeño o mediano, como las que resultan de la caza de aves acuáticas, los vertebrados son los principales consumidores porque consumen la totalidad de la carroña rápidamente, no dejando tiempo a que las larvas de invertebrados se desarrollen (Tomberlin et al. 2017). Así pues, el rápido consumo de las carroñas por parte de los vertebrados combinado con temperaturas más frías podría dificultar el consumo de estas por parte de los invertebrados, especialmente cuando se trata de las larvas de mosca, que son las primeras en eclosionar y requieren varios días o semanas para completar dicho proceso (Parmenter y MacMahon 2009; Muñoz-Lozano et al. 2019).
Una posible limitación de nuestro estudio es que no hemos incluido en los modelos estadísticos algunas variables que podrían influir directamente en la detección (y, por ende, eliminación) de las carroñas por parte de los carroñeros. Factores como la cobertura vegetal o la abundancia relativa de las diferentes especies en el área de estudio, podrían haber mejorado la precisión y robustez de nuestros modelos. Aunque estas variables no se consideraron en el presente trabajo debido a limitaciones logísticas y de diseño experimental, su inclusión en estudios futuros permitiría obtener un modelo predictivo más sólido y con mayor aplicabilidad.
Nuestros resultados muestran que las carroñas simuladoras de los eventos periódicos de agregación espacio-temporal de carroña -en este caso, la caza de aves acuáticas- en humedales mediterráneos son consumidas de manera eficiente y casi por completo por vertebrados carroñeros. Este consumo se ve muy monopolizado por especies generalistas e incluso especies exóticas invasoras, como es el caso de la rata parda. Sin embargo, la rata parda presenta una menor eficiencia en el consumo de carroñas, prolongando su permanencia en los ecosistemas. Debido a las condiciones climáticas y la rápida eliminación de la carroña por los vertebrados, el consumo de estas carroñas por parte de los invertebrados es escaso. Además, las carroñas resultantes de esta actividad cinegética se convierten en puntos de intensa actividad biológica, atrayendo no solo a vertebrados carroñeros, sino también a otras especies que consumen los invertebrados presentes en estas carroñas, como el alcaudón real, una especie globalmente amenazada. Sin embargo, futuros estudios deberían concentrar sus esfuerzos en investigar los cambios inducidos por las actividades cinegéticas sobre la abundancia relativa, la dieta y el uso del espacio de las especies consumidoras de carroña, así como el impacto de estas actividades sobre un ecosistema tan vulnerable y amenazado como los humedales mediterráneos.
Contribución de los autores
Tatiana Pessano-Serrat: Investigation, Methodology, Formal analysis, Writing - Original Draft, Writing - Review & Editing. Esther Sebastián-González: Funding acquisition, Conceptualization, Formal analysis, Supervision, Writing - Review & Editing. Adrian Orihuela-Torres: Conceptualization, Methodology, Data curation, Writing - Review & Editing.
Declaración de disponibilidad de datos
Los datos de este estudio están disponibles en el repositorio digital Figshare https://figshare.com/projects/The_role_of_ vertebrate_scavengers_in_the_utilization_of_waterbirds_hunting_carcasses_in_a_Mediterranean_wetland_El_papel_de_los_carro_eros_vertebrados_en_el_aprovechamiento_de_restos_de_caza_de_an_tidas_en_un_humedal_Mediterr_neo/207097 (Pessano-Serrat et al. 2023).
Financiación, permisos requeridos, potenciales conflictos de interés y agradecimientos
Agradecer al director del Parque Natural de El Hondo por otorgarnos los permisos necesarios para llevar a cabo este trabajo de investigación. ESG recibió las ayudas RYC2019-027216-I y CNS2023-144791, y AOT la TED2021-130890B-C21, financiadas por la Agencia Española de Investigación MCIN/AEI (10.13039/501100011033) y por el ESF Investing in your future. TPS fue apoyado por el Ministerio de Educación y Formación Profesional de España (22CO1/000897).
Los autores/as declaran no tener ningún conflicto de intereses.
Referencias
Abellán-Contreras, F.J. 2019. Gestión hídrica, protección ambiental y aprovechamiento agrario en el entorno del antiguo Sinus Illicitanus: El Hondo y Los Carrizales de Elche. Congreso Nacional del Agua Orihuela: Innovación y sostenibilidad 731-744 https://doi.org/10.14198/Congreso-Nacional-del-Agua-Orihuela-2019
Alvarez, M.B., Zapata, J.A.S., Yelo, N.D., Martínez, S.E., Espadas, I.J. 2008. Dieta del zorro en el Parque Regional de Sierra Espuña: carroñas y dispersión de semillas. En: Actas del IV Congreso de la Naturaleza de la Región de Murcia y I del Sureste Ibérico (pp. 109-116). Asociación de Naturalistas del Sureste (ANSE). Mucria, España. https://www.asociacionanse.org/download/31/
Angelici, C., Marini, F., Battisti, C., Bertolino, S., Capizzi, D., Monaco, A. 2012. Cumulative impact of rats and coypu on nesting waterbirds: first evidence from a small Mediterranean wetland (Central Italy). Vie et milieu-Life and environment 62(3), 137-141.
Arrondo, E., Morales-Reyes, Z., Moleón, M., Cortés-Avizanda, A., Donázar, J.A., Sánchez-Zapata, J.A. 2019. Rewilding traditional grazing areas affects scavenger assemblages and carcass consumption patterns. Basic and Applied Ecology 41, 56-66. https://doi.org/10.1016/j.baae.2019.10.006
Bartoń, K. 2024. MuMIn: Multi-model inference (Version 1.48.4) [R package]. Retrieved from https://CRAN.R-project.org/package=MuMIn
Barton, P.S., Cunningham, S.A., Lindenmayer, D.B., Manning, A.D. 2013. The role of carrion in maintaining biodiversity and ecological processes in terrestrial ecosystems. Oecologia 171(4), 761-772. https://doi.org/10.1007/s00442-012-2460-3
Battán Horenstein, M., Linhares, A.X. 2011. Seasonal composition and temporal succession of necrophagous and predator beetles on pig carrion in central Argentina. Medical and veterinary entomology 25(4), 395-401. https://doi.org/10.1111/j.1365-2915.2011.00969.x
Benbow, M.E., Tomberlin, J.K., Tarone, A.M. (Eds.). 2015. Carrion ecology, evolution, and their applications. CRC press, Boca Ratón, FL. USA.
Blázquez, M., Sánchez-Zapata, J. A., Botella, F., Carrete, M., Eguía, S. 2009. Spatio-temporal segregation of facultative avian scavengers at ungulate carcasses. Acta Oecologica 35(5), 645–650. https://doi.org/10.1016/j.actao.2009.06.002
Carpio, A.J., Queirós, J., Laguna, E., Jiménez-Ruiz, S., Vicente, J., Alves, P.C., Acevedo, P. 2023. Understanding the impact of wild boar on the European wild rabbit and red-legged partridge populations using a diet metabarcoding approach. European Journal of Wildlife Research 69(1), 18. https://doi.org/10.1007/s10344-023-01647-5
Carrión Jaén, S. 2022. Efecto de la presencia de visitantes en la distribución y comportamiento de aves acuáticas en el Parque Natural El Hondo (Elche). [Tesis de Maestría, Universidad de Alicante]. Repositorio Institucional-Universidad de Alicante. Alicante, España. http://hdl.handle.net/10045/125649
Carter, D.O., Yellowlees, D., Tibbett, M. 2007. Cadaver decomposition in terrestrial ecosystems. Naturwissenschaften 94, 12-24. https://doi.org/10.1007/s00114-006-0159-1
Carrete, M., Donázar, J.A., Margalida, A. 2006. Density‐dependent productivity depression in pyrenean bearded vultures: implications for conservation. Ecological Applications 16(5), 1674-1682. https://doi.org/10.1890/1051-0761(2006)016[1674:DPDIPB]2.0.CO;2
Coates, T.D. 2008. The effect of fox control on mammal populations in an outer urban conservation reserve. Australian Mammalogy 30(2), 51-64. https://doi.org/10.1071/AM08007
Cunningham, C.X., Johnson, C.N., Barmuta, L.A., Hollings, T., Woehler, E.J., Jones, M.E. 2018. Top carnivore decline has cascading effects on scavengers and carrion persistence. Proceedings of the Royal Society 285(1892), 20181582. https://doi.org/10.1098/rspb.2018.1582
Darimont, C.T., Codding, B.F., Hawkes, K. 2017. Why men trophy hunt. Biology Letters 13(3), 20160909. https://doi.org/10.1098/rsbl.2016.0909
Debussche, M., Isenmann, P. 1985. Frugivory of transient and wintering European robins Erithacus rubecula in a Mediterranean region and its relationship with ornithochory. Ecography 8(2), 157-163. https://doi.org/10.1111/j.1600-0587.1985.tb01166.x
Dell'Arte, G.L., Laaksonen, T., Norrdahl, K., Korpimäki, E. 2007. Variation in the diet composition of a generalist predator, the red fox, in relation to season and density of main prey. Acta oecologica 31(3), 276-281. https://doi.org/10.1016/j.actao.2006.12.007
DeVault, T.L., Rhodes, Jr, O.E., Shivik, J.A. 2003. Scavenging by vertebrates: behavioral, ecological, and evolutionary perspectives on an important energy transfer pathway in terrestrial ecosystems. Oikos 102(2), 225-234. https://doi.org/10.1034/j.1600-0706.2003.12378.x
Díaz‐Ruiz, F., Delibes‐Mateos, M., García‐Moreno, J.L., María López‐Martín, J., Ferreira, C., Ferreras, P. 2013. Biogeographical patterns in the diet of an opportunistic predator: the red fox Vulpes vulpes in the Iberian Peninsula. Mammal Review 43(1), 59-70. https://doi.org/10.1111/j.1365-2907.2011.00206.x
Donázar, J.A., Cortés-Avizanda, A., Carrete, M. 2010. Dietary shifts in two vultures after the demise of supplementary feeding stations: consequences of the EU sanitary legislation. European Journal of Wildlife Research 56(4), 613-621. https://doi.org/10.1007/s10344-009-0358-0
Evelsizer, D.D., Clark, R.G., Bollinger, T.K. 2010. Relationships between local carcass density and risk of mortality in molting mallards during avian botulism outbreaks. Journal of wildlife diseases 46(2), 507-513. https://doi.org/10.7589/0090-3558-46.2.507
Escuder, J.L.E. 2003. Restauración ecológica de la finca El Rincón (Parque Natural El Hondo, Crevillente, Alicante): creación de un hábitat idóneo para la cerceta pardilla, Marmaronetta angustirostris. En: Paracuellos, M. (Coord.), Ecología, manejo y conservación de los humedales, pp. 139-149. Instituto de Estudios Almerienses. Almería, España. https://dialnet.unirioja.es/descarga/articulo/2244841.pdf
Gangoso, L., Alvarez-Lloret, P., Rodríguez-Navarro, A.A., Mateo, R., Hiraldo, F., Donázar, J.A. 2009. Long-term effects of lead poisoning on bone mineralization in vultures exposed to ammunition sources. Environmental Pollution 157(2), 569-574. https://doi.org/10.1016/j.envpol.2008.09.015
García-Fernández, A.J., María-Mojica, P., Motas-Guzmán, M., Romero, D., Navas, I., Peñalver, J. 1998. High mortality of waterfowl in E l Hondo Natural Park: Botulism and lead poisoning. Toxicology Letters 95(1001), 241-241.
Gilby, B.L., Henderson, C.J., Olds, A.D., Ballantyne, J.A., Cooper, T.K.A., Schlacher, T.A. 2023. Cross‐ecosystem effects of coastal urbanisation on vertebrate assemblages and ecological function. Animal Conservation 26(1), 126-136. https://doi.org/10.1111/acv.12807
Goutner, V., Alivizatos, H. 2003. Diet of the Barn Owl (Tyto alba) and Little Owl (Athene noctua) in wetlands of northeastern Greece. Belgian journal of zoology 133(1), 15-22.
Hall, D.G. 1948. The blowflies of North America. Thomas Say Foundn 4, 469-477.
IUCN 2023a. The IUCN red list of threatened species. Version 2022-1. [Accessed on 24-02-2023] Retrieved from https://www.iucnredlist.org/species/19353/165118026
IUCN 2023b. The IUCN red list of threatened species. Version 2022-1. [Accessed on 24-02-2023] Retrieved from https://www.iucnredlist.org/species/103718932/200213300
Jackson, A.L., Ruxton, G.D., Houston, D.C. 2008. The effect of social facilitation on foraging success in vultures: a modelling study. Biology Letters 4(3), 311-313. https://doi.org/10.1098/rsbl.2008.0038
Jędrzejewski, W., Jędrzejewska, B. 1992. Foraging and diet of the red fox Vulpes vulpes in relation to variable food resources in Biatowieza National Park, Poland. Ecography 15(2), 212-220. https://doi.org/10.1111/j.1600-0587.1992.tb00027.x
Kindt, R., Coe, R. 2005. Tree diversity analysis: A manual and software for common statistical methods for ecological and biodiversity studies (Version 2.16.1). World Agroforestry Centre (ICRAF). http://www.worldagroforestry.org/output/tree-diversity-analysis
Kuznetsova, A., Brockhoff, P.B., Christensen, R.H.B. 2017. lmerTest: Tests in linear mixed effects models (Version 3.1.3) [R package]. Journal of Statistical Software 82(13), 1–26. https://doi.org/10.18637/jss.v082.i13
Lenth, R. 2024. emmeans: Estimated marginal means, aka least-squares means (Version 1.10.1) [R package]. Retrieved from https://CRAN.R-project.org/package=emmeans
Lopez-Iborra, G.M., Pinheiro, R.T., Sancho, C., Martinez, A. 2004. Nest size influences nest predation risk in two coexisting Acrocephalus warblers. Ardea 92(1), 85-92.
Margalida, A., Campión, D., Donázar, J.A. 2011. European vultures' altered behaviour. Nature 480(7378), 457-457. https://doi.org/10.1038/480457b
Margalida, A., Carrete, M., Hegglin, D., Serrano, D., Arenas, R., Donázar, J.A. 2013. Uneven large-scale movement patterns in wild and reintroduced pre-adult bearded vultures: conservation implications. PLoS One 8(6), e65857. https://doi.org/10.1371/journal.pone.0065857
Mateo‐Tomás, P., Olea, P.P., Moleón, M., Vicente, J., Botella, F., Selva, N., Viñuela, J., et al. 2015. From regional to global patterns in vertebrate scavenger communities subsidized by big game hunting. Diversity and Distributions 21(8), 913-924. https://doi.org/10.1111/ddi.12330
Mctee, M., Hiller, B., Ramsey, P. 2019. Free lunch, may contain lead: scavenging shot small mammals. The Journal of Wildlife Management 83(6), 1466-1473. https://doi.org/10.1002/jwmg.21716
Meierhofer, I., Schwarz, H.H., Müller, J.K. 1999. Seasonal variation in parental care, offspring development, and reproductive success in the burying beetle, Nicrophorus vespillo. Ecological Entomology 24(1), 73-79. https://doi.org/10.1046/j.1365-2311.1999.00172.x
Mellanby, K. 1939. Low temperature and insect activity. Proceedings of the Royal Society of London. Series B-Biological Sciences, 127(849), 473-487. https://doi.org/10.1098/rspb.1939.0035
Mithen, S. 1999. The hunter—gatherer prehistory of human—animal interactions. Anthrozoös 12(4), 195-204. https://doi.org/10.2752/089279399787000147
Moleón, M., Sánchez-Zapata, J.A. 2016. Non-trophic functions of carcasses: from death to the nest. The Ecological Society of America, 14(6), 340-341 https://doi.org/10.1002/fee.1306
Moleón, M., Sánchez-Zapata, J.A. 2021. The role of carrion in the landscapes of fear and disgust: a review and prospects. Diversity, 13(1), 28. https://doi.org/10.3390/d13010028
Moleón, M., Sánchez-Zapata, J.A. 2022. Extending the dynamic landscape of fear in a human-dominated world. Trends in Ecology and Evolution, 38(3), 215-216. https://doi.org/10.1016/j.tree.2022.10.001
Moleón, M., Sanchez-Zapata, J.A., Margalida, A., Carrete, M., Owen-Smith, N., Donázar, J.A. 2014. Humans and scavengers: the evolution of interactions and ecosystem services. BioScience 64(5), 394-403. https://doi.org/10.1093/biosci/biu034
Moleón, M., Sánchez‐Zapata, J.A., Sebastián‐González, E., Owen‐Smith, N. 2015. Carcass size shapes the structure and functioning of an African scavenging assemblage. Oikos 124(10), 1391-1403. https://doi.org/10.1111/oik.02222
Moleón, M., Martínez‐Carrasco, C., Muellerklein, O.C., Getz, W.M., Muñoz‐Lozano, C., Sánchez‐Zapata, J.A. 2017. Carnivore carcasses are avoided by carnivores. Journal of Animal Ecology 86(5), 1179-1191. https://doi.org/10.1111/1365-2656.12714
Morales-Reyes, Z., Sánchez-Zapata, J.A., Sebastián-González, E., Botella, F., Carrete, M., Moleón, M. 2017. Scavenging efficiency and red fox abundance in Mediterranean mountains with and without vultures. Acta Oecologica 79, 81-88. https://doi.org/10.1016/j.actao.2016.12.012
Moreno-Opo, R., Trujillano, A., Arredondo, Á., González, L.M., Margalida, A. 2015. Manipulating size, amount and appearance of food inputs to optimize supplementary feeding programs for European vultures. Biological Conservation, 181, 27-35. https://doi.org/10.1016/j.biocon.2014.10.022
Mundy, P., Butchart, D., Ledger, J., Piper, S. 1992. The vultures of Africa. Acorn Books and Russel Friedman Books, Randburg and Halfway House, South Africa.
Muñoz-Lozano, C., Martin-Vega, D., Martínez-Carrasco, C., Sánchez-Zapata, J.A., Morales-Reyes, Z., Gonzalvez, M., Moleon, M. 2019. Avoidance of carnivore carcasses by vertebrate scavengers enables colonization by a diverse community of carrion insects. PloS one 14(8), e0221890. https://doi.org/10.1371/journal.pone.0221890
Naves‐Alegre, L., Morales‐Reyes, Z., Sánchez‐Zapata, J.A., Durá‐Alemañ, C.J., Goncalves Lima, L., Machado Lima, L., et al. 2021. Uncovering the vertebrate scavenger guild composition and functioning in the Cerrado biodiversity hotspot. Biotropica 53(6), 1582-1593. https://doi.org/10.1111/btp.13006
Nikolov, B.P., Kodzhabashev, N.D., Popov, V.V. 2004. Diet composition and spatial patterns of food caching in wintering Great Grey Shrikes (Lanius excubitor) in Bulgaria. Biological Letters 41(2), 119-133.
Ogada, D.L., Torchin, M.E., Kinnaird, M.F., Ezenwa, V.O. 2012. Effects of vulture declines on facultative scavengers and potential implications for mammalian disease transmission. Conservation Biology 26(3), 453-460. https://doi.org/10.1111/j.1523-1739.2012.01827.x
Olea, P.P., Mateo-Tomás, P., Sánchez-Zapata, J.A. 2019. Introduction to the Topic of Carrion Ecology and Management. In: Olea, P., Mateo-Tomás, P., Sánchez-Zapata, J. (Eds.), Carrion Ecology and Managementt, pp. 1-20. Springer, Cham, Switzerland. https://doi.org/10.1007/978-3-030-16501-7_1
Orihuela‐Torres, A., Pérez‐García, J.M., Sánchez‐Zapata, J.A., Botella, F., Sebastián‐González, E. 2022. Scavenger guild and consumption patterns of an invasive alien fish species in a Mediterranean wetland. Ecology and evolution 12(8), e9133. https://doi.org/10.1002/ece3.9133
Orihuela‐Torres, A., Sebastián‐González, E., Pérez‐García, J.M. 2023. Outdoor recreation alters terrestrial vertebrate scavenger assemblage and carrion removal in a protected Mediterranean wetland. Animal Conservation 26(5), 633-641. https://doi.org/10.1111/acv.12848
Oro, D., Margalida, A., Carrete, M., Heredia, R., Donázar, J.A. 2008. Testing the goodness of supplementary feeding to enhance population viability in an endangered vulture. PloS one 3(12), e4084. https://doi.org/10.1371/journal.pone.0004084
Oro, D., Genovart, M., Tavecchia, G., Fowler, M.S., Martínez‐Abraín, A. 2013. Ecological and evolutionary implications of food subsidies from humans. Ecology letters 16(12), 1501-1514. https://doi.org/10.1111/ele.12187
Parmenter, R.R., MacMahon, J.A. 2009. Carrion decomposition and nutrient cycling in a semiarid shrub–steppe ecosystem. Ecological Monographs 79(4), 637-661. https://doi.org/10.1890/08-0972.1
Paul, E.A., Clark, F.E. 1989. Soil microbiology and biochemistry. Academic press. San Diego, USA. 273 p.
Pereira, L.M., Owen-Smith, N., Moleón, M. 2014. Facultative predation and scavenging by mammalian carnivores: Seasonal, regional and intra‐guild comparisons. Mammal review 44(1), 44-55. https://doi.org/10.1111/mam.12005
Pérez-García, J.M., Marco-Tresserras, J., Orihuela-Torres, A. 2020. Winter diet and lead poisoning risk of Greater Spotted Eagles Clanga clanga in southeast Spain. Bird Study 67(2), 224-231. https://doi.org/10.1080/00063657.2020.1810206
Pulido, F. 2007. The genetics and evolution of avian migration. Bioscience 57(2), 165-174. https://doi.org/10.1641/B570211
Putman, R.J. 1983. Carrion and dung: the decomposition of animal wastes. London, UK: Edward Arnold.
R Core Team 2013. R: A language and environment for statistical computing, Version (3.3.3). R Foundation for Statistical Computing, https://www.r-project.org/.
Redondo-Gómez, D., Quaggiotto, M.M., Bailey, D.M., Eguía, S., Morales-Reyes, Z., López-Pastor, B.D.L.N., Martín-Vega, D., et al. 2022. Comparing scavenging in marine and terrestrial ecosystems: a case study with fish and gull carcasses in a small Mediterranean island. Basic and Applied Ecology 59, 92-104. https://doi.org/10.1016/j.baae.2022.01.006
Reed, S.E., Merenlender, A.M. 2008. Quiet, nonconsumptive recreation reduces protected area effectiveness. Conservation Letters 1(3), 146-154. https://doi.org/10.1111/j.1755-263X.2008.00019.x
Ruxton, G.D., Houston, D.C. 2004. Obligate vertebrate scavengers must be large soaring fliers. Journal of Theoretical Biology, 228(3), 431-436. https://doi.org/10.1016/j.jtbi.2004.02.005
Schlichting, P.E., Love, C.N., Webster, S.C., Beasley, J.C. 2019. Efficiency and composition of vertebrate scavengers at the land-water interface in the Chernobyl Exclusion Zone. Food Webs 18, e00107. https://doi.org/10.1016/j.fooweb.2018.e00107
Sebastián‐González, E., Sánchez‐Zapata, J.A., Donázar, J.A., Selva, N., Cortés‐Avizanda, A., Hiraldo, F., Moleón, M., et al. 2013. Interactive effects of obligate scavengers and scavenger community richness on lagomorph carcass consumption patterns. Ibis 155(4), 881-885. https://doi.org/10.1111/ibi.12079
Sebastián-González, E., Moleón, M., Gibert, J.P., Botella, F., Mateo-Tomás, P., Olea, P.P., Guimarães, P.R., et al. 2016. Nested species- rich networks of scavenging vertebrates support high levels of interspecific competition. Ecology 97(1), 95– 105. https://doi.org/10.1890/15-0212.1
Sedín, C.F. 2005. Ecología de la Cerceta pardilla (Marmaronetta angustirostris) y de la Malvasía cabeciblanca (Oxyura leucocephala) en los humedales del Baix Vinalopó, Alicante [Tesis de doctorado, Universidad de Alicante]. Repositorio Institucional de la Universidad de Alicante. Alicante, España. http://hdl.handle.net/10045/11188
Selva, N. 2004. The role of scavenging in the predator community of Bialowieza Primeval Forest (Poland) [PhD thesis], University of Sevilla, Sevilla, España & Polish Academy of Sciences, Białowieża, Poland.
Smith, R.J., Merrick, M.J. 2001. Resource availability and population dynamics of Nicrophorus investigator, an obligate carrion breeder. Ecological Entomology 26(2), 173-180.
Tabor, K.L., Fell, R.D., Brewster, C.C. 2005. Insect fauna visiting carrion in Southwest Virginia. Forensic Science International 150(1), 73-80. https://doi.org/10.1016/j.forsciint.2004.06.041
Tobajas, J., Descalzo, E., Ferreras, P., Mateo, R., Margalida, A. 2021. Effects on carrion consumption in a mammalian scavenger community when dominant species are excluded. Mammalian Biology 101(6), 851-859. https://doi.org/10.1007/s42991-021-00163-w
Tobajas, J., Oliva‐Vidal, P., Piqué, J., Afonso‐Jordana, I., García‐Ferré, D., Moreno‐Opo, R., Margalida, A. 2022. Scavenging patterns of generalist predators in forested areas: the potential implications of increase in carrion availability on a threatened capercaillie population. Animal Conservation 25(2), 259-272. https://doi.org/10.1111/acv.12735
Tomberlin, J.K., Barton, B.T., Lashley, M.A., Jordan, H.R. 2017. Mass mortality events and the role of necrophagous invertebrates. Current Opinion in Insect Science 23, 7-12. https://doi.org/10.1016/j.cois.2017.06.006
USFWS 1975. Issuance of Annual Regulations Permitting the Sport Hunting of Migratory Birds. Final Environmental Statement. US Fish and Wildlife Service, Washington, DC, USA. https://www.fws.gov/sites/default/files/documents/final-supplemental-environmental-impact-statement-issuance-of-annual-regulations-permitting-the-hunting-of-migratory-birds.pdf
Valverde, I., Espín, S., Navas, I., María-Mojica, P., Gil, J.M., García-Fernández, A.J. 2019. Lead exposure in common shelduck (Tadorna tadorna): tracking the success of the Pb shot ban for hunting in Spanish wetlands. Regulatory Toxicology and Pharmacology 106, 147-151. https://doi.org/10.1016/j.yrtph.2019.05.002
Virgós, E., Travaini, A. 2005. Relationship between small-game hunting and carnivore diversity in central Spain. Biodiversity & Conservation 14, 3475-3486. https://doi.org/10.1007/s10531-004-0823-8
Wilson, E.E., Wolkovich, E.M. 2011. Scavenging: how carnivores and carrion structure communities. Trends in Ecology and Evolution 26(3), 129-135. https://doi.org/10.1016/j.tree.2010.12.011
Young, A., Stillman, R., Smith, M.J., Korstjens, A.H. 2014. An experimental study of vertebrate scavenging behavior in a northwest European woodland context. Journal of Forensic Sciences 59(5), 1333-1342. https://doi.org/10.1111/1556-4029.12468
Apéndice / Appendix
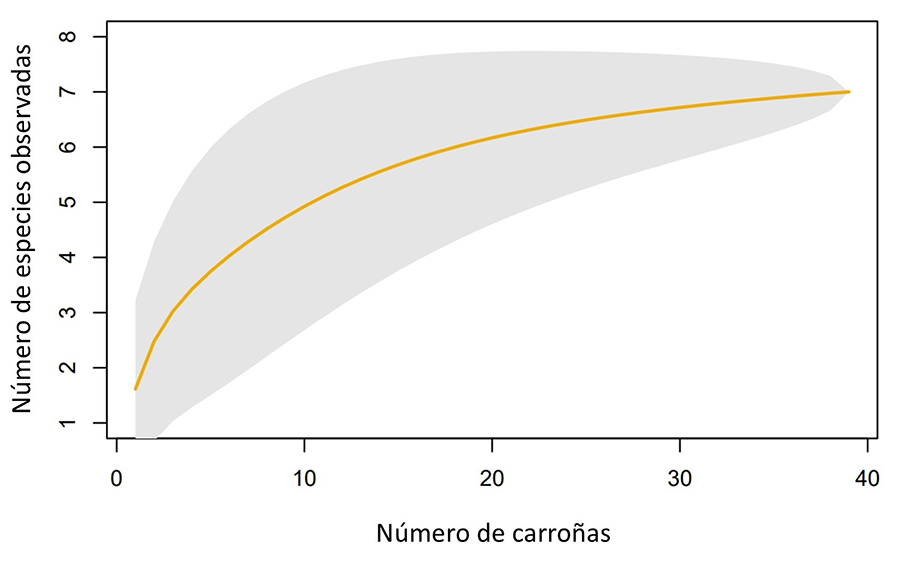
Figura A1. Curva de acumulación de especies. Representa el número acumulado de especies a lo largo del número de carroñas muestreadas acumulado en El Hondo. Se muestra también el error estándar (gris).
Figure A1. Species accumulation curve. It represents the number of accumulated species over the cumulative number of sampled carcasses in the El Hondo. The standard error is also shown (gray).
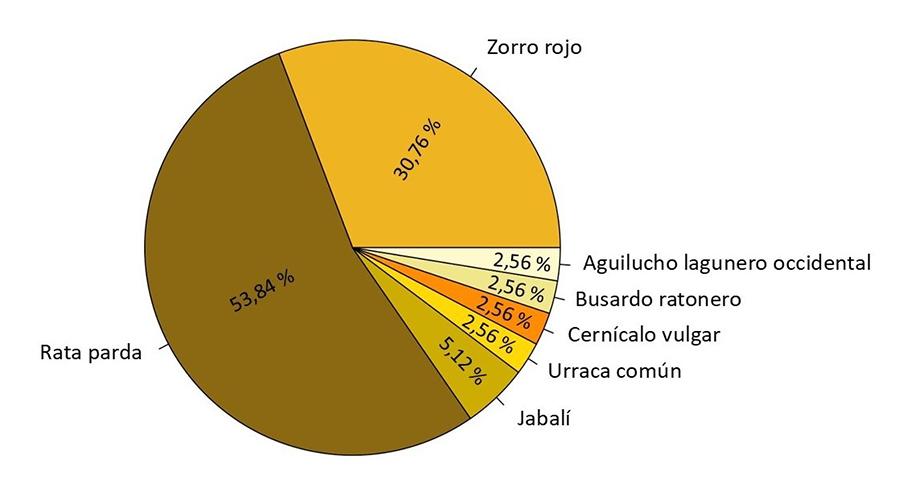
Figura A2. Especies detectoras de la carroña. Se muestra el porcentaje (%) de carroñas detectadas por cada especie. Entendemos como “detección” al primer encuentro y consumo de la carroña.
Figure A2. Carrion detecting species. The percentage (%) of carcasses detected by each species is shown. We understand "detection" as the first encounter and consumption of the carcass.
Tabla A1. Resultados de los Modelos Lineales Generalizados Mixtos (GLMMs) que comparan si el tiempo de detección y el tiempo de eliminación varían según el gremio consumidor de la carroña (aves, mamíferos o aves y mamíferos). Se observa el coeficiente del modelo, el error estándar (SE) y el p-valor; cuyos valores significativos (p-valor<0.05) se indican con un asterisco. Asimismo, se añadió en los modelos un identificador que agrupaba las carroñas que se habían colocado juntas como una variable aleatoria.
Table A1. Results of the Generalized Linear Mixed Models (GLMMs) comparing whether detection time and removal time vary according to the carrion consumer guild (birds, mammals, or both birds and mammals). The model coefficient, standard error (SE), and p-value are reported, with significant values (p-value < 0.05) indicated by an asterisk. Additionally, an identifier that grouped carcasses placed together was added to the models as a random variable.
|
Tiempo de detección |
SE |
p-valor |
|
Coeficiente |
0.104 |
0.917 |
|
Aves |
-0.340 |
0.774 |
|
Mamíferos |
-0.351 |
0.727 |
|
Aves y Mamíferos |
-0.636 |
0.555 |
|
Tiempo de eliminación |
SE |
p-valor |
|
Coeficiente |
0.218 |
0.784 |
|
Aves |
0.444 |
0.633 |
|
Mamíferos |
0.569 |
0.473 |
|
Aves y Mamíferos |
0.249 |
0.766 |
Tabla A2. Resultados del Análisis Post-hoc de los Modelos Lineales Generalizados Mixtos (GLMMs) que comparan si el tiempo de detección y el tiempo de eliminación varían según el gremio consumidor de la carroña (aves, mamíferos o aves y mamíferos). Se observa la diferencia estimada entre los niveles comparados del factor gremio, el error estándar (SE) y el p-valor; cuyos valores significativos (p-valor<0.05) se indican con un asterisco. Asimismo, se añadió en los modelos un identificador que agrupaba las carroñas que se habían colocado juntas como una variable aleatoria.
Table A2. Results of the Post-hoc Analysis of Generalized Linear Mixed Models (GLMMs) comparing whether detection time and removal time vary according to the carrion consumer guild (birds, mammals, or birds and mammals). Estimated difference between compared levels of the guild factor, standard error (SE), and p-value are observed; significant values (p < 0.05) are indicated with an asterisk. Additionally, an identifier grouping carrion placed together was included in the models as a random variable.
|
Tiempo de detección |
Diferencia estimada |
SE |
p-valor |
|
Aves - Mamíferos |
0.010 |
0.838 |
1.000 |
|
Aves - Aves y Mamíferos |
0.296 |
0.937 |
0.989 |
|
Mamíferos - Aves y Mamíferos |
0.285 |
0.552 |
0.954 |
|
Tiempo de eliminación |
Diferencia estimada |
SE |
p-valor |
|
Aves - Mamíferos |
-0.124 |
0.674 |
0.998 |
|
Aves - Aves y Mamíferos |
0.195 |
0.743 |
0.993 |
|
Mamíferos - Aves y Mamíferos |
0.320 |
0.428 |
0.878 |