Introducción
El Cinturón Hortícola Platense (CHP) es una de las
principales regiones hortícolas del país, donde el cultivo de alcaucil (Cynara scolymus L.) sobresale debido al auge que ha
tenido a nivel nacional y regional (García et al.
2017). En Argentina, la superficie del alcaucil es de aproximadamente
1500-1750 has., localizándose un 51 % en el partido (municipio) de La Plata
(provincia de Buenos Aires), 26 % en Cuyo, 14 % en Rosario (provincia de Santa
Fe) y 9 % en la localidad de General Pueyrredón (provincia de Buenos Aires). El
alcaucil o alcachofa se introdujo en la zona rioplatense en el siglo pasado con
los inmigrantes provenientes de la zona Mediterránea, distribuyéndose luego al
resto del país. El partido de La Plata
concentra la mayor parte de la producción de alcauciles a nivel nacional, y la ciudad fue declarada capital del alcaucil (zona de Arana y
Los Hornos con rendimientos de 15 000 kg/ha). Se consume principalmente en
estado fresco (90%) y el resto es procesado. Se lo utiliza como extracto
líquido para bebidas con probadas propiedades curativas. En el año 2015 fue
realizado en esta ciudad el “IX International Symposium on artichoke,
cardoon and their wild relatives”, un importante evento internacional que
congregó a numerosos investigadores y profesionales del sector (García y Cravero
2016).
Las arañas representan uno de los grupos faunísticos más
diversos del reino Animal, actualmente con 51 059 especies (World Spider
Catalog 2021). Son los depredadores generalistas más numerosos en
los ecosistemas terrestres y por ser numérica y funcionalmente importantes en
los agroecosistemas, cumplen un destacado rol como enemigos naturales de
insectos plaga (Green 1996; Mashavakure et al. 2019). Los pulgones
representan las principales plagas del alcaucil en Argentina, siendo sus principales
controladores los coccinélidos (Coleoptera), bracónidos (Hymenoptera) y arañas
(Araneae) (Strassera
et al. 2013). La diversidad de arañas ha sido ampliamente estudiada
en cultivos de soja, alfalfa, trigo y algodón en Argentina (Minervino 1996; Liljesthröm
et al. 2002; Beltramo et al. 2006; González et al. 2009; Armendano y González 2010, 2011; Benamú 2010;
Almada et al. 2012). Existen algunos trabajos en
cultivos hortícolas. (Baloriani et al. 2010; Armendano et al. 2018), siendo el presente
estudio el primer reporte sobre las comunidades de arañas en cultivos de
alcaucil en Argentina. En el mismo se documenta la composición de familias, la
diversidad de especies, abundancia relativa, gremios y las variaciones
estacionales de las arañas en cultivos de alcaucil.
Materiales y métodos
Área de estudio
Se ubicó en el área periurbana de La Plata (Los Hornos,
"Cinturón Hortícola Platense”) (34° 59' S 57° 59' O), Provincia de Buenos
Aires, Argentina. La precipitación media anual es de 1040 mm, las lluvias más
abundantes son en verano y disminuyen hacia los meses más fríos. La temperatura
media anual es de 16.2 °C, siendo enero el mes más cálido y julio el más frio.
El clima de la región se define como Subtropical Húmedo. Respecto a las
características climáticas durante los años de estudio, el más lluvioso fue el
2014 con 1378.4 mm acumulados, en tanto que el 2015 fue el más seco con 874.8
mm acumulados, encontrándose en 2016 una situación intermedia con 1074.6 mm. La
temperatura media anual varió entre 15.7°C (2016), 16.5°C (2015) y 16.6°C
(2014).
Para el estudio se seleccionaron dos cultivos de alcaucil a
cielo abierto (variedad “Romanesco”). Como la edad productiva de la planta de
alcaucil es de aproximadamente 5 años, se trabajó con cultivos de un año (CA1)
y de cuatro años (CA4) (Fig. 1). Existen tres
variedades principales de alcaucil que se cultivan en la región (García et al. 2014). La variedad Romanesco
es la más extendida y cultivada en la zona de La Plata. Se caracteriza por
cabezas semiesféricas, brácteas violetas con esfumaciones verdes y por carecer
de espinas. Su peso varía entre los 200 y 250 g. Su producción comienza a fines
de junio y se extiende hasta finales de agosto. La variedad Ñata, tiene
brácteas violetas con verde, muy compactas. Su peso varía entre los 200 y 300
g. y su producción es entre septiembre y noviembre. La variedad Blanco San
Juan, es de cabeza ovalada, color verde claro, compacto y pequeño, pesa entre
140 a 160 g. La producción es desde principios de marzo a finales de mayo, y de
julio a mediados de septiembre. Es un cultivo de ciclo anual, pero considerado
perenne por mantenerse por períodos de 3 o 5 años, pero presentando bajas en su
rendimiento.
Los cultivos fueron tratados con el insecticida dimetoato
(Perfekthion® S; BASF, Lemvig, Dinamarca) para el control del pulgón del frijol
(Aphis fabae Scopoli; Hemiptera: Aphididae), principal plaga del cultivo
de alcaucil. Se aplicó toda vez que se observó su presencia, principalmente en
el momento de formación del capítulo floral.
Recolección de los ejemplares
Se realizaron 8 muestreos estacionales durante dos años
consecutivos, utilizando transectas lineales paralelas entre sí generando una
malla regular. Las muestras se tomaron cada 26 surcos en CA1 y cada 12 surcos
en CA4, total 20 puntos de muestreo para cada cultivo (Fig.
1).
Las arañas de la vegetación se recolectaron con un aspirador
o G-Vac (ASP) realizando una aspiración en 1m2 durante 1 min
cubriendo dos plantas por punto de muestreo (Benamú 2010;
Almada et al. 2015; Argañaraz
et al. 2018; Gabellone 2019) y para las de
suelo se utilizaron trampas de caída (TRC) construidas con dos recipientes de
plástico, uno dentro del otro, de 9 × 12.5 × 5.5 cm (diámetro superior ×
profundidad × diámetro inferior), uno con agujeros en el fondo y el otro con
agujeros a los lados y a 9 cm del fondo, para evitar que rebalsen. Se utilizó
60 ml de agua salada al 3% con gotas de detergente (para reducir la tensión
superficial) dentro del recipiente interior. Las trampas contaron con una tapa
de poliestireno (25 cm × 15 cm) sostenida por dos palos de madera a 6 cm del
suelo, para evitar la caída de hojas y lluvia y se ubicaron entre dos plantas
durante 15 días consecutivos.

Figura 1. A) Localización e imagen
satelital del cultivo de alcaucil de 1 año (AC1) (izquierda) and 4 años (AC4)
(derecha) en La Plata, Argentina. Los puntos de muestreo se indicaron con
números en cada cultivo. )
Trampa de caída.
Figure 1.A) Location
and satellite image of artichoke cultivation for 1 year (AC1) (left) and 4
years (AC4) (right) in La Plata, Argentina. Sampling points were indicated with
numbers in each crop. B)
Pitfall trap.
Determinación del material de estudio
Los ejemplares recolectados se conservaron en alcohol 70% y
se identificaron mediante claves (Levi y Levi 1962;
Millidge 1991; Ramírez
1999; Grismado et al. 2014) y
consultas a especialistas. Los especímenes comprobantes fueron depositados en
el Centro de Estudios Parasitológicos y de Vectores, Universidad Nacional de La
Plata, Buenos Aires, Argentina.
Análisis de datos
Para el análisis de la diversidad alfa, se estimó la riqueza
de especies, abundancia relativa y los índices paramétricos de Simpson (D),
Shannon-Wienner (H), Pielou (J), Margalef, Equity y dominancia (Magurran 1988; Begon et al.
2006), usando BioDiversity Pro y PAST 3.3 (Hammer
et al. 2001).
Se calcularon, además, estimadores no-paramétricos en el
sentido estadístico (Chao 1, Jackknife de primer orden, y ACE), ya que no
asumen el tipo de distribución del conjunto de datos, no se ajustan a un modelo
determinado y requieren solamente datos de presencia-ausencia. Además, se
realizaron las curvas de estimadores no paramétricos que emplean proporciones
de especies raras (singletons y doubletons, especies que sólo cuentan con uno y
dos individuos respectivamente en todo el inventario) (Magurran
1988). Las curvas de acumulación de especies de los estimadores no
paramétricos (Chao 1984; Colwell y Coddington 1994; Coldwell 2013) se analizaron utilizando EstimateS y
PAST 3.3 (Hammer et al. 2001).
Se utilizó el Método no paramétrico de Olmstead-Tukey (Sokal y Rohlf 1981) para el análisis de abundancia
de cada especie y su frecuencia de aparición, definiendo especies dominantes
(abundantes y frecuentes), especies comunes (poco abundantes y frecuentes), especies ocasionales (abundantes y poco frecuentes) y
especies raras (poco abundantes y poco frecuentes).
Para la comparación de cultivos CA1 y CA4 se analizó la
diversidad beta, mediante los coeficientes de similitud de Jaccard y Sorensen y
análisis multivariante de escalonamiento multidimensional (NMDS) usando el
índice de similitud de Bray-Curtis. El primero, es una técnica multivariante de interdependencia que trata de
representar, en un espacio geométrico de pocas dimensiones, a las proximidades
existentes entre un conjunto de objetos (Guerrero Casas y Ramírez Hurtado 2012). El índice de Bray Curtis es cuantitativo, y se basa en el porcentaje de
similitud, es decir, la diferencia total en la abundancia de
especies entre dos sitios, respecto a la abundancia total en cada sitio.
La estructura de los gremios presentes se estudió según Cardoso et al. (2011).
Vegetación espontánea
La flora observada y presente durante todo el ciclo de las
plantas de alcaucil correspondió a diferentes herbáceas y leguminosas de
diversos órdenes (Lamiales, Fabales, Asterales, Caryophyllales y Poales), todas
de crecimiento anual. El orden más representado fue Lamiales, donde se encontró
Echium plantagineum L., Salvia dudosa L. y Verbena intermedia L.
Otro orden bien representado fue Fabales con leguminosas como Trifolium
repens L. y Vicia angustifolia (L.). Menos representados estuvieron
el O. Poales con Bromus unioloides Kunth, el O. Asterales con Matricaria
chamamilla L. y el O. Caryophyllales con Rumex crispus L.
Resultados
Se recolectaron 3929 arañas incluidas en 19 familias, 41
especies y 24 morfoespecies. Las familias más numerosas fueron Linyphiidae (n=
1509) Lycosidae (n= 805), Oxyopidae (n= 301), Theridiidae (n= 216) y
Anyphaenidae (n= 206). El resto de las familias estuvieron por debajo de los
150 ejemplares. Las menos numerosas fueron Eutichuridae (n= 3), Corinnidae (n=
7), Desidae (n=1) y Dysderidae (n= 1) (Tabla 1).
Tabla 1. Composición
Relativa (%) y abundancia (N) de especies/morfoespecies de arañas capturadas en
cultivos de alcaucil de 1año (AC1) y 4 años (AC4), en Los Hornos (La Plata),
Argentina.
Table
1. Relative composition (%) and abundance (N) of
species/morphospecies of spiders captured in 1-year (AC1) and 4-year (AC4)
artichoke crops, in Los Hornos (La Plata), Argentina.
El mayor número de ejemplares
fue obtenido con ASP (n=2016) con respecto al obtenido con TRC (n=1506). La
especie más abundante fue Laminacauda montevidensis (Keyserling) (Linyphiidae),
seguida por Oxyopes salticus Hentz 1845 (Oxyopidae) y Euryopis
msp. (Theridiidae). Los juveniles fueron abundantes, la mayoría indeterminados
y algunos identificados como morfoespecies de las familias Linyphiidae (n= 520)
y Lycosidae (n= 516). La riqueza específica (S) total fue de 65
especies/morfoespecies (Tabla 2) y las familias
con mayor riqueza específica fueron Linyphiidae (S=11), Lycosidae (S=10) y
Theridiidae (S=10).
Análisis de diversidad alfa
Teniendo en cuenta la
totalidad de individuos recolectados en los dos años y en los dos cultivos y
discriminado por el método de muestreo (ASP y TRC), se obtuvieron valores
moderados en los índices de diversidad, si se considera que en la mayoría de
los casos los valores para estos índices se ubican entre 1.5 y 3.5, raramente
excediendo 4.5 (Magurran 1988) (Tabla
2). La riqueza específica presentó valores similares, mientras que los
valores de abundancia fueron mayores en el muestreo con ASP en el cultivo de un
año. Los mayores valores del índice de diversidad de Simpson se correspondieron
con el muestreo realizado mediante TRC, con valores muy cercanos a 1.
Tabla 2. Riqueza específica,
abundancia, dominancia, índice de diversidad de Simpson, índice de Shannon,
índice de Margalef, índice de equidad y Chao-1 para el total de las arañas
capturadas en todos los muestreos, discriminando el año del cultivo (CA1 y CA4)
y el método de muestreo (ASP y TRC) en cultivos de alcaucil en La Plata,
Argentina.
Table 2. Specific richness, abundance,
dominance, Simpson diversity index, Shannon index, Margalef index, equity index
and Chao-1 for the total number of spiders captured in all samplings,
discriminating the year of cultivation (CA1 and CA4) and the sampling method
(ASP and TRC) in artichoke crops in La Plata, Argentina.
Método de Olmstead-Tukey
Se analizó por un lado la totalidad de individuos
muestreados en los dos cultivos y unificando los dos tipos de muestreo, y, por
otro lado, se analizó separadamente los cultivos CA1 y CA4 uniendo los dos
tipos de muestreos (Tabla 3). Los juveniles de
Lycosidae fueron los únicos que aparecieron en todos los muestreos y los
juveniles más numerosos correspondieron a las familias Linyphiidae (n=520) y
Araneidae (n=80). Las especies dominantes fueron: Erigone sp., Laminacauda montevidensis (Linyphiidae); Alopecosa moesta (Lycosidae), y Glenognatha
lacteovittata (Tetragnathidae) (Tabla 1).
Tabla 3. Resumen de
los análisis realizados mediante el método Olmstead-Tukey de las arañas
colectadas utilizando el método del aspirador (ASP) y trampas de caída (TRC) en
cultivos de alcaucil (Cynara scolymus) de 1 año (CA1) y 4 años (CA4) de
edad, por estación (I, P, V, O). Su aparición está representada según las
siguientes categorías: ocasionales (blanco con círculos), raras (negras),
comunes (gris oscuro), dominantes (gris claro) y ausentes (blanco).
Table
3. Summary of the analyzes carried out using the
Olmstead-Tukey method of spiders collected using the vacuum cleaner method
(ASP) and pitfall traps (TRC) in artichoke (Cynara scolymus) cultures of
1 year (CA1) and 4 years (CA4) of age, by season (I, P, V, O). Their appearance
is represented according to the following categories: occasional (white with
circles), rare (black), common (dark gray), dominant (light gray) and absent
(white).
Análisis estacional
Teniendo en cuenta los dos métodos de muestreo y la
totalidad de las muestras, la mayor cantidad de individuos se registró en
primavera y la menor en verano, ambas en el 2015 (1207 individuos y 123
individuos respectivamente) (Fig. 2).
En los dos años de muestreos con aspirador los valores más
altos de diversidad correspondieron a primavera y otoño, mientras que los
valores más bajos se observaron en verano, especialmente del año 2015 (Fig. 3a y b). En los muestreos con trampas de
caída la mayor diversidad correspondió a los meses de primavera y no se
registraron bajas tan marcadas como mostró el método del aspirador (otoño
2015-2016) (Fig. 3c y d).
En invierno dominaron los Linyphiidae, especialmente Laminacauda
montevidensis, Erigone sp. y sus juveniles, así como Alopecosa
moesta (Tabla 3). Dos especies se consideraron
ocasionales: Hahniidae Morfo Sp.1 y Euryopis sp., debido a que fueron
abundantes, pero sólo se registraron en el CA4. En sentido opuesto, Mermessus
sp., aunque presente en ambos cultivos, predominó en el CA1. Del total de
especies registradas en este estudio, 11 taxa fueron exclusivas del verano y 18
no se encontraron en esta estación del año. En primavera se registraron cerca
de tres veces más individuos que en cualquiera de las otras estaciones del año,
dominando Laminacauda montevidensis y los juveniles de Linyphiidae y
Lycosidae. Las dos especies consideradas ocasionales lo fueron por distinta
situación: Negayan puno sólo se registró en el CA1, y Oxyopes
salticus sólo en el año 2015. Del total de especies, 6 taxa fueron
exclusivas y 15 no se hallaron en esta estación del año. En verano dominaron
los juveniles de Lycosidae, Oxyopes salticus y Euryopis sp. La
mayoría de los taxones fueron catalogados como raros debido a la mayor riqueza
y abundancia registrada en el verano 2016 respecto al año precedente. Del total
de especies, sólo Hogna variolosa (Lycosidae) fue exclusiva y 30 taxones
no se hallaron en esta estación del año. En otoño dominó Oxyopes salticus,
encontrándose con mayor abundancia en el año 2016. Otros dominantes fueron los
juveniles de Linyphiidae, Erigone sp. (que predominó en el CA4). Se
observó una sola especie dentro del grupo de las ocasionales, Misumenoides
athleticus, encontrada en otoño 2016 en ambos cultivos. Del total de
especies presentes en los cultivos, dos especies fueron exclusivas: Dipoena
granulata y Metaltellia simonii, y 23 taxones no se hallaron
en el otoño (Tabla 3).
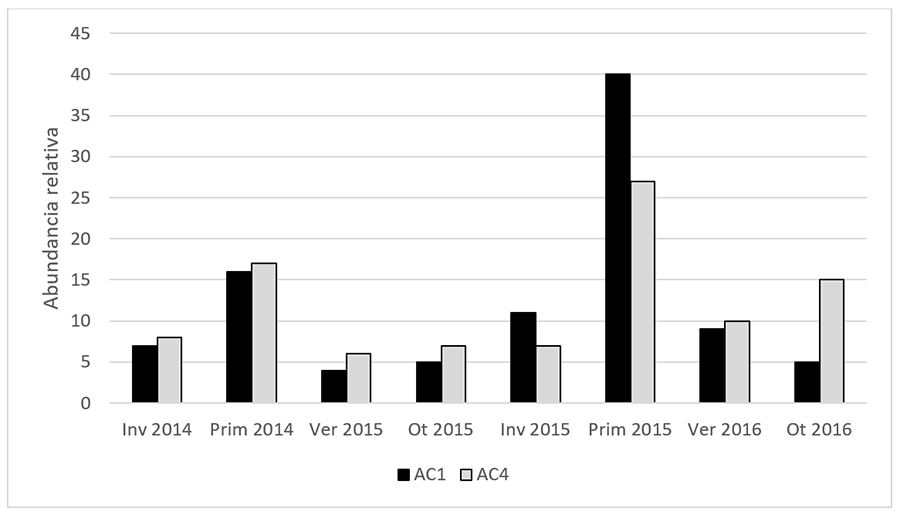
Figura 2. Abundancia
Relativa del total de arañas recolectadas durante los dos años de estudio
(2014-2016) en cultivos de alcaucil de 1 año (AC1) y 4 años (AC4) en La Plata,
Argentina.
Figure 2. Relative Abundance of the total spiders collected during the two
years of study (2014-2016) in artichoke crops of 1 year (AC1) and 4 years (AC4)
in La Plata, Argentina.
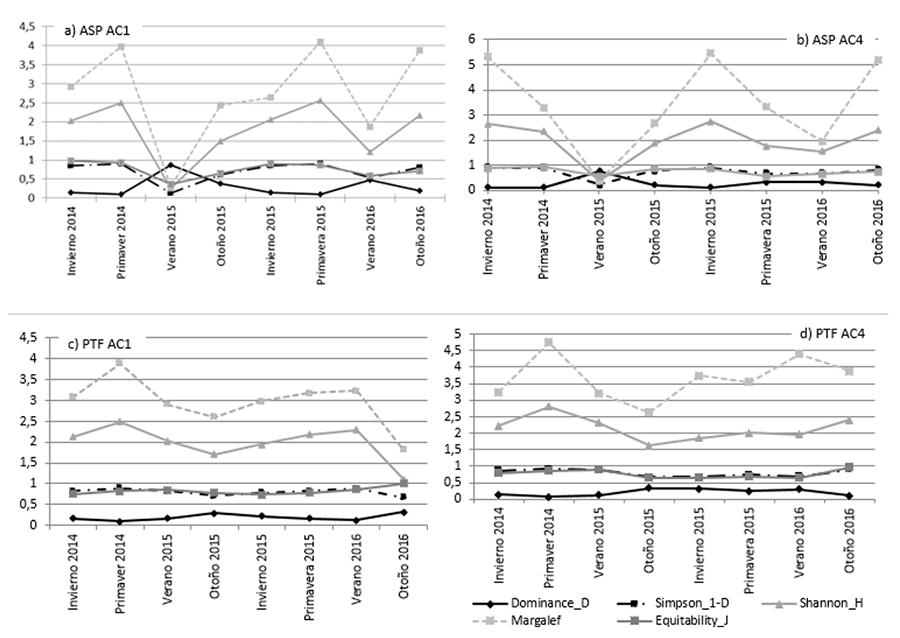
Figura 3. Riqueza de Especies (S) del total de
arañas recolectadas con los dos tipos de muestreo (ASP = aspirador y PTC =
trampas de caída) durante todas las estaciones en cultivos de alcaucil de 1 año
(AC1) y 4 años (AC4) en La Plata, Argentina.
Figure
3. Species Richness (S) of the total spiders
collected with the two types of sampling (ASP = vacuum cleaner and PTC =
pitfall traps) during all seasons in 1-year (AC1) and 4-year (AC4) artichoke
crops in La Plata, Argentina.
Comparación entre
cultivos de alcaucil de distintas edades
El mayor registro de arañas capturadas en todos los
muestreos se observó en el cultivo CA1, excepto en otoño de 2016 (Fig. 2). El muestreo con ASP mostró mayor número de
individuos recolectados (N=2411), mientras que el muestreo con trampas de caída
registró un total de (N=1518) para ambas parcelas. Tanto para el CA1 como para
el CA4 las familias Linyphiidae y Lycosidae fueron las de mayor abundancia,
donde la primera tuvo una fuerte presencia en el cultivo de un año (Tabla 1). Las familias Oxyopidae (sólo representada
por la especie Oxyopes salticus Hentz), Gnaphosidae, Hahniidae y
Theridiidae tuvieron mayor presencia en el CA4, mientras que Anyphaenidae se
destacó en el CA1 (Tabla 1).
Del total de especies/morfoespecies capturadas en todos los
muestreos, Laminacauda montevidensis, Oxyopes salticus y juveniles de
Linyphiidae y Lycosidae tuvieron un importante aporte en ambos cultivos,
mientras que Euryopis sp. (Theridiidae) y la msp. 1 de la familia
Hahniidae tuvieron abundante representación en el CA4 (Tabla
1).
Las curvas correspondientes a los índices de riqueza no
paramétricos (Chao 1, Jackknife de primer orden, y ACE) fueron asintóticas
únicamente en el CA1 mediante el método de ASP (Fig. 4).
Los valores de los estimadores no paramétricos indicarían que aún falta
registrar más especies para completar el inventario de arañas en el CA4.
El número de “singletons y doubletons” fue similar para
ambos cultivos, siendo levemente mayor en el CA4 mediante el uso del ASP (Fig. 4a y b). En el CA1, las especies
representadas por un solo individuo fueron Tetragnathidae msp., Theridiidae
msp. 1 y 2, Dysdera crocata C.L. Koch (Dysderidae), cf. Ligarina
msp. (Linyphiidae) y Eustala msp. (Araneidae), mientras que en el CA4
fueron cf. Sitticus msp. (Salticidae), Theridion
tinctorium Keyserling, Diponea granulata (Keyserling) y Diponea
msp. (Theridiidae), Alpaida cf. leucogramma (White) (Araneidae) y Metaltellia
simonii (Keyserling) (Desidae).
Las especies representadas por dos individuos en CA1 fueron Diapontia
cf. uruguayensis Keyserling (Lycosidae), Thymoites puer
(Mello-Leitão) (Theridiidae) y cf. Psilocymbium msp. (Linyphiidae) y en
CA4 fueron Hahniidae msp. 2 y Apopyllus cf. silvestrii (Simon)
(Gnaphosidae).
El índice que más se ajustó a la riqueza de especies real
fue el estimador Jackknife 1 para CA1 mediante ASP y para el CA4 por TRC. En el
caso de los muestreos realizados en el CA1 el estimador que más se acercó a la
riqueza real fue Chao 2 mediante TRC y en el CA4 fue Chao 1 mediante ASP (Fig. 4).
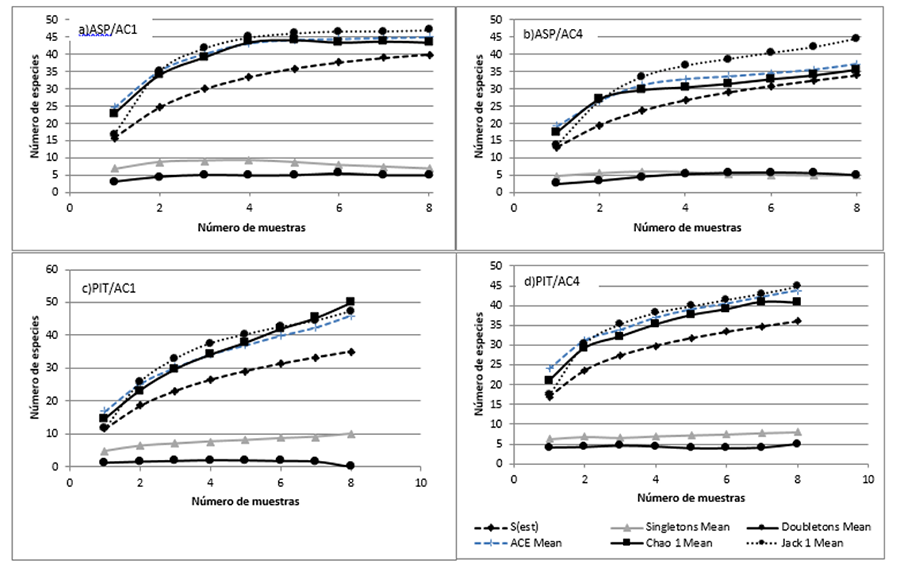
Figura 4.Curva de
acumulación de especies por los estimadores no paramétricos y curvas de
“singletons y doubletons”, para la totalidad de los individuos muestreados en
cultivo de 1 año de edad (CA1), y 4 años de edad (CA4), con el método del
aspirador (ASP) y trampas de caída (TRC) (La Plata, Argentina).
Figure 4. Species accumulation curve by non-parametric estimators and
“singletons and doubletons” curves, for all individuals sampled in culture at 1
year of age (CA1), and 4 years of age (CA4), with the vacuum cleaner method
(ASP) and pitfall traps (TRC) (La Plata, Argentina).
Análisis de diversidad beta
Los índices de Jaccard y Sorensen mostraron los valores más
altos mediante ASP en primavera 2015 y otoño 2016 (Jaccard= 54% y 53%
respectivamente y Sorensen= 70% en las dos estaciones mencionadas) (Tabla 4); para el muestreo mediante TRC, los
porcentajes más altos de los índices de Jaccard y Sorensen fueron en verano
2016, primavera 2014 y verano 2015 (Jaccard= 67%, 64%, 60% respectivamente y
Sorensen= 80%, 78%, 75% respectivamente) (Tabla 4).
Al analizar la riqueza específica (S) obtenida por los
diferentes métodos de muestreo, se pudo observar la presencia de algunas
especies/morfoespecies que solo aparecieron en uno de los dos cultivos (Tabla 5). Ambos cultivos compartieron 51 taxones,
exceptuando a Scolecura parilis Millidge (Linyphiidae), presente sólo en
el CA1 con 9 individuos y a Guaraniella mahnerti Baer (Theridiidae) y Araneus
msp. (Araneidae), presentes sólo en el CA4 con 4 individuos cada una, el resto
de los ejemplares por especie/morfoespecie obtenidos exclusivamente para cada
edad de cultivo, no superaron los 3 ejemplares cada una. Las familias
Dysderidae y Desidae, estuvieron representadas por una sola especie con un solo
individuo en CA1 y CA4 respectivamente.
Tabla 4. Diversidad
beta estacional en cultivos de alcaucil (Cynara scolymus) de 1 (CA1) y 4
años (CA2), con el método de muestreo mediante aspirador y trampas de caída (La
Plata, Argentina).
Table 4. Seasonal beta diversity in artichoke (Cynara scolymus)
crops of 1 (CA1) and 4 years (CA2), with the sampling method using vacuum
cleaner and pitfall traps (La Plata, Argentina).
Tabla 5.
Especies/morfoespecies presentes sólo en el cultivo de 1 año (CA1) y en el de 4
años (CA4) (La Plata, Argentina).
Table
5. Species/morphospecies present only in the 1-year
(CA1) and 4-year (CA4) crops (La Plata, Argentina).
Análisis multivariados
El análisis de la matriz de similitud del total de muestreos
para todas las estaciones y para ambos cultivos, muestra una gran similitud
entre las asociaciones de especies correspondientes a cada estación, excepto en
el otoño 2015 en el CA1 con ASP (Fig. 5a) y en el
otoño 2016 en el CA1 con TRC (Fig. 5b).
Estructura de gremios
Las arañas muestreadas durante
todo el período estudiado fueron agrupadas en siete gremios en el CA1 y seis en
CA4 por estar ausente el gremio especialista (Tabla
5).
En ambos cultivos el gremio con
mayor presencia fue el de tejedoras de tela sábana, con un alto porcentaje de
Linyphiidae, seguido por cazadoras de suelo, donde Lycosidae fue la más
abundante. Dentro del gremio otras cazadoras, Anyphaenidae es la familia con
mayor porcentaje en el CA1 y Oxyopidae en el CA4 y dentro de tejedoras de telas
espaciales, Theridiidae lo fue en el CA4. (Tabla 5).
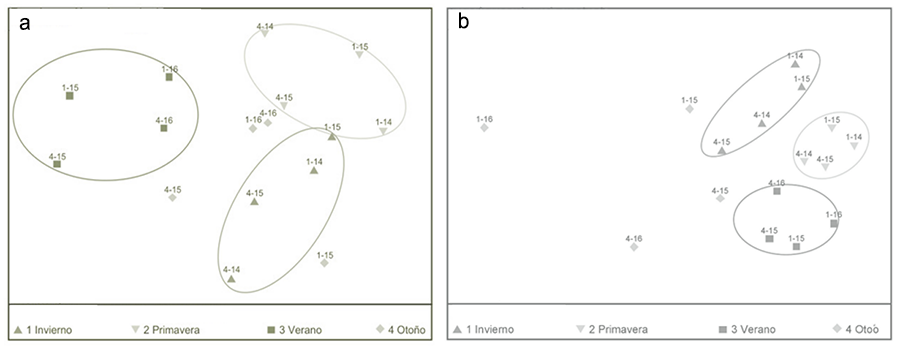
Figura 5. Matriz de similitud en base a
Bray-Curtis para los muestreos realizados mediante aspirador y trampas de
caída, por cada estación y edad del cultivo de alcaucil (Cynara scolymus)
(La Plata, Argentina). a: Aspirador, b: Trampas de caída.
Figure 5. Similarity matrix based on Bray-Curtis for sampling carried out by
vacuum cleaner and pitfall, for each season and age of the artichoke (Cynara scolymus) crop (La Plata,
Argentina). a: Vacuum cleaner, b: Pitfall traps.
Discusión
El total de familias encontrado en los cultivos de alcaucil
representó el 27.94 % del total de familias presentes en Argentina según datos
del World Spider
Catalog (2021). El valor de porcentaje bajo es esperable tratándose
de un monocultivo, donde se reduce drásticamente la diversidad de la vegetación
ofreciendo menos lugares para el establecimiento de las arañas, y donde, además
suelen aplicarse pesticidas de manera regular (Altieri
1995; Pengue y Altieri 2005; Yong 2010; Blanco-Valdes 2016;
Gabellone 2019). De las 19 familias presentes,
cinco de ellas representaron el 62,93% del total de arañas recolectadas
(Linyphiidae, Lycosidae, Oxyopidae, Theridiidae y Anyphaenidae), al igual que
en cultivos de soja, algodón, girasol y sandía según Almada
et al. (2012) y Cunha et al. (2015), donde
solamente 4 familias representaron entre el 72% y 95% respectivamente.
La familia de mayor abundancia en ambos cultivos fue
Linyphiidae (31.27%), siendo la segunda de mayor riqueza del mundo (WSC 2021), y está ampliamente distribuida
en ambientes agropastoriles debido a su capacidad de adaptarse a sistemas con
alto grado de perturbación (Schmidt y
Tscharntke 2005). Nyffeler y Sunderland
(2003) compararon las comunidades de arañas en cultivos de Estados Unidos y
de Europa, y obtuvieron altos porcentajes de Linyphiidae para Europa y bajos
para Estados Unidos, llegando a la conclusión de que estos valores coinciden
con latitudes por debajo o por encima del Ecuador respectivamente. Respondiendo
a esta tendencia, en varios trabajos realizados en cultivos de Argentina, la
presencia de esta familia se mantuvo en porcentajes bajos (Armendano 2007; Benamú et
al. 2010; Ávalos et al. 2013; Almada et al. 2015). Sin embargo, Argañaraz et al. (2018) encontraron un porcentaje
del 33.9% en sitios urbanos de la ciudad de Córdoba (Argentina), coincidiendo
con su adaptación a sistemas con alto grado de perturbación y dando un
resultado semejante al de este trabajo.
En importancia numérica le siguieron las familias Lycosidae
(16.68%), Oxyopidae (6.24%), Theridiidae (4.48%) y Anyphaenidae (4.27%),
familias que también aparecen en porcentajes semejantes en muestreos realizados
en otros cultivos (Armendano 2007; Armendano y González 2009; González et al. 2009; Armendano y González 2011; Ávalos et al. 2013; Almada
et al. 2015). Las familias Linyphiidae y Lycosidae se las considera como
las primeras colonizadoras de campos cultivados (Bishop
y Riechert 1990; Minervino 1996).
Con respecto a la abundancia de arañas capturadas en cada
cultivo, se reflejó una amplia diferencia (CA1= 2411, CA4=1518), siendo la
riqueza específica total de 65 sp/msp. Estos valores de riqueza superaron
valores encontrados en otros cultivos de Argentina (Armendano
2007; Armendano y González 2010, 2011; Benamú 2010;
Almada et al. 2012) pudiendo deberse en gran
medida a la variedad de flora espontánea que dejan crecer entre las plantas de
alcaucil. Los ejemplares juveniles de las familias Lycosidae (arañas errantes,
cazadoras que viven en madrigueras) y Linyphiidae (tejedoras de telas sábanas),
superaron ampliamente los valores de los adultos, coincidiendo con varios
trabajos realizados en otros cultivos (Armendano
y González 2010, 2011; Almada et al. 2015). El alto porcentaje del total de
los juveniles capturados en este monocultivo es coincidente con lo manifestado
por otros autores como Danisman et al. (2007), Rodrigues et al. (2008), Armendano y González (2009), Ávalos et al. (2013). Esto último, con
relación al tipo de supervivencia que evidencian las arañas, con una alta tasa
reproductiva, alto número de descendientes con una mortalidad temprana intensa, mientras que, los individuos
que logran sobrevivir tienen una elevada tasa de supervivencia.
Tanto la abundancia como la riqueza de arañas se encuentran
mayormente relacionadas con características de la vegetación que le puedan
proveer de áreas de refugio, sitios de reproducción y disponibilidad de alimento
(Rypstra y Carter 1995; Samu y Lovei 1995; Rypstra
et al. 1999). El CA1 está formado por plantas jóvenes, de mayor porte y más
vigorosas, poseen hojas más anchas, más verdes y mayor cantidad lo que favorece
la presencia de arañas, sobre todo las pertenecientes a los gremios de
tejedoras. En el CA4, las plantas, al tener mayor antigüedad, tienen un menor
porte, hojas más pequeñas y menos numerosas, e incluso, se forman baches en
lugares donde algunas plantas ya murieron, lo que disminuye los sitios
favorables para la instalación de las arañas. Una mayor vigorosidad de las
plantas sin duda atrae más cantidad de presas y más refugios para los enemigos
naturales.
Gran parte de las fincas hortícolas de la zona de La Plata
poseen parches de vegetación semi-natural rodeando los cultivos, formados por
una mezcla de vegetación típica de la zona y vegetación plantada por el
productor como parte de su manejo, generando ambientes heterogéneos en
estructura y composición (Paleologos et al. 2008).
Este puede ser otro de los motivos posibles en la diferencia del total de
arañas, considerando a los diferentes ambientes que rodean a cada cultivo,
posibles zonas de recolonización.
Los valores de diversidad fueron altos. Según Magurran (1988), valores mayores a 5.0 en el índice
de Margalef, que para este estudio oscilaron entre 5.1 y 5.8, indican una alta
diversidad y los valores para Shannon-Wiener (H´) varían entre 1.5 y 3.5, rara
vez excediendo el valor de 4.5. La riqueza específica fue más alta para el ASP
en el CA1, pero fue muy pareja en el resto de los análisis. Los cultivos
hortícolas presentan un tiempo de permanencia en el sistema, actividades y
técnicas de manejo propias, que se traducen en disturbio, reduciendo las
poblaciones de muchos artrópodos, alterando microclimas y la disponibilidad
para asentar telas o comunidades estables (Thomas
y Jepson 1997; Sunderland y Samu 2000).
La alta heterogeneidad de la flora existente en los cultivos de alcaucil, que
proporciona mayor variedad de microhábitats y microclimas (Begon et al. 2006), se contrapone en parte, al
disturbio ocasionado por la antropización, aumentando los recursos y
favoreciendo así la biodiversidad.
Los gráficos de análisis estacional correspondientes a los
individuos obtenidos a través del método del ASP en ambos cultivos muestran
valores bajos para el verano de los años 2015 y 2016 (Fig.
3a y b), lo que puede explicarse debido al tratamiento habitual
con plaguicidas para el pulgón, que se realiza entre finales del mes de febrero
y principios del mes de marzo. Esto fue más notorio en el verano del 2015, y
podría deberse a que en esa estación hubo escasos mm de precipitación, evitando
el lavaje del plaguicida. Es de destacar, que el uso de pesticidas en el
cultivo de alcaucil contribuye al detrimento de la biodiversidad de la
artropofauna y en particular a las comunidades de arañas, que evidencian una
mayor susceptibilidad entre los ejemplares adultos (Gabellone
2019). El uso de plaguicidas para tratar al pulgón afectó de manera
importante a las arañas del estrato herbáceo capturadas por el ASP, mientras
que no ocurrió lo mismo con las arañas del estrato suelo. Luego de la
postcosecha en la estación de primavera crecen tanto las plantas de alcaucil
como la flora espontánea, dando los valores más altos de ejemplares colectados
y la aparición de arañas raras, “singletons” y “doubletons”.
Los gráficos obtenidos mediante el NMDS muestran una clara
similitud entre las estaciones climáticas, formando grupos bien marcados. Esta
similitud entre las asociaciones de especies para cada estación del año puede
estar dada por condiciones meteorológicas de cada estación, sumado a las
prácticas relacionadas al cultivo y al estado de desarrollo de la planta.
Los índices no paramétricos mostraron valores muy similares,
siendo el Jackknife, el Chao1 y el Chao2 los que más se ajustaron a la riqueza
de especies. Estos resultados son similares a los registrados por Armendano (2007), Almada
(2014) y Marfil et al. (2015).
Las curvas de acumulación de especies resultaron
asintóticas, lo que es esperable para las arañas de distintos estratos
(herbáceo y suelo) ya que conforman grupos ecológicamente distintos y a lo que
se suma la gran cantidad de especies raras (singletons y doubletons). En los
inventarios de arañas cuantas más especies raras o especies nuevas provenientes
de otros lugares haya, mayor será el número de especies que queden por
encontrarse (Jiménez-Valverde y Hortal
2003).
La diversidad beta se incrementa con la variabilidad
ambiental. Koleff (2005) postula que al haber una
alta diversidad de hábitat y de variación en las condiciones ambientales,
existen altas tasas de recambio de especies. Los valores obtenidos al comparar
ambos cultivos dieron valores de Jaccard y Sorensen similares, rondando el 50%
para las estaciones de otoño del 2016 y primavera del 2015, estaciones en las
cuales ambos cultivos compartirían mayor cantidad de especies. Al analizar los
listados de especies no compartidas entre ambos cultivos, se observa que la
mayoría pertenece a los singletons y doubletons, con excepción de Scolecura
parilis (9 individuos), Castianeira sp. (7 ind.), Apopyllus cf.
Silvestrii (5 indv.), Araneus sp. (4 indv.), Thymoites cf.
Cristal (3 indv.) y Hogna variolosa (3 indv.).
Con respecto a los gremios, los más representados fueron las
tejedoras de tela sábana y las cazadoras de suelo. A pesar de tratarse de un
monocultivo, al igual que lo observado en Almada 2014,
se vieron bien representados los estratos, permitiendo una repartición espacial
de los nichos, favoreciendo la coexistencia de diferentes especies asociadas a
presas similares.
Este trabajo es el primero para Argentina referido a la
comunidad de arañas presente en cultivos de alcaucil. Estudios sobre arañas de
este cultivo para otros países son escasos. Larco
Aguilar (2018) analizó cultivos de alcaucil de Perú donde registra también
un alto porcentaje de Linyphiidae, cuyos géneros son coincidentes con los
encontrados por nosotros (Mermessus, Laminacauda, Agyneta y Erigone),
pero con especies diferentes. Goh y Lange (1989)
y Solomou et al. (2015) realizaron muestreos de
la artropofauna de cultivos de alcaucil en California y en el Mediterráneo
respectivamente, pero solo a nivel del orden Araneae.
La información obtenida en este análisis, junto a la de
otros estudios realizados en cultivos diferentes permitirá profundizar el
conocimiento de la araneofauna adaptada a ambientes agrícolas con alto grado de
perturbación antrópica. A través de este estudio, se demuestra que su
abundancia y presencia a lo largo del desarrollo fenológico del cultivo de
alcaucil, les otorga potencialidades como posibles reguladoras de poblaciones
de insectos y evitar la colonización de plagas del cultivo.
Disponibilidad de datos
Este artículo no utiliza conjuntos
de datos.
Agradecimientos
Este trabajo fue apoyado por becas de la Universidad
Nacional de La Plata a AG, PICT 2011-1752 de la Agencia Nacional de Promoción
de la Ciencia y la Tecnología (ANPCyT), PIP 0205 del Consejo Nacional de
Investigación Científica y Tecnológica (CONICET), PUE 00036 de CONICET, y becas
doctorales y posdoctorales de CONICET a CG. Los autores quieren agradecer a los
propietarios del cultivo de alcachofa su buena voluntad, ayuda y hospitalidad.
Cristian Grismado y Martín Ramírez (MACN, Museo Argentino de Ciencias
Naturales, Buenos Aires, Argentina) ayudaron en la identificación de arañas.
Contribución de los autores
Cecilia Gabellone análisis e investigación. Andrea Armendano redacción, revisión y
edición. Alda González supervisión, metodología, redacción.
Referencias
Almada, M. 2014. Biodiversidad
y densidad de arañas (Araneae) en un sistema agropastoril, tendientes a mejorar
el impacto de los enemigos naturales sobre insectos plaga. Tesis de
Doctorado, Universidad Nacional de La Plata, Buenos Aires, Argentina. Disponible
en: https://sedici.unlp.edu.ar/handle/10915/34072
Almada M., Sosa M., González
A. 2012. Araneofauna (Arachnida, Araneae) en cultivos de algodón (Gossypium
hirsutum L.) transgénicos y convencionales en el Norte de Santa Fé,
Argentina. Revista de Biología Tropical 60: 611-623.
Almada, M., González, A.,
Corronca, A.J. 2015. Cambios en la comunidad de arañas (Arachnida: Araneae) en
períodos de barbecho y de cultivos de soja en el Norte de Santa Fe, Argentina.
Universidad Nacional de La Plata. Facultad de Agronomía; Revista de la
Facultad de Agronomía 115: 55-65. http://hdl.handle.net/11336/58483
Altieri, M.A. 1995. Agroecology: the Science of Sustainable Agriculture.
Westview Press, Boulder, CO, USA.
Argañaraz, C.I., Rubio, G., Gleiser, R.M. 2018. Spider
communities in urban green patches and their relation to local and landscape
traits. Biodiversity and Conservation 27: 981-1009. https://doi.org/10.1007/s10531-017-1476-8
Armendano, A. 2007. Estudio
de la araneofauna presente en agroecosistemas de importancia económica (trigo y
alfalfa). Tesis de Doctorado, Universidad Nacional de La Plata, Argentina.
Disponible en: https://sedici.unlp.edu.ar/handle/10915/4368
Armendano, A., González,
A. 2009. Comunidad de arañas (Arachnida, Araneae) del cultivo de alfalfa (Medicago
sativa) en Buenos Aires, Argentina. Revista de Biología Tropical 58:
747-757.
Armendano, A.,
González, A. 2010. Estudio de la comunidad de arañas (Arachnida, Araneae) del
cultivo de alfalfa en la provincia de Buenos Aires, Argentina. Revista de Biología Tropical 58:
747-757.
Armendano, A., González, A. 2011. Spider fauna associated to wheat crops and
adjacent habitats in Buenos Aires, Argentina. Revista Mexicana de
Biodiversidad 82: 1176-1182
Armendano, A., Rouaux, J., Salazar Martínez, A. 2018. Fauna
edáfica asociada a un cultivo hortícola convencional de tomate (Lycopersicum
Esculentum Mill.) en La Plata (Buenos Aires, Argentina). Acta zoológica
mexicana 34.
Ávalos, G., Bar, M.E.,
Oscherov, E., González, A. 2013. Diversidad de Araneae en cultivos de Citrus
sinensis (Rutaceae) de la Provincia de Corrientes, Argentina. R Revista
de Biología Tropical 61: 1243-1260.
Baloriani, G.I., Marasas, M., Benamú, M.A., Sarandón, S.J. 2010.
Estudio de la macrofauna edafica (Orden Araneae). Su riqueza y abundancia en
invernáculos sujetos a un manejo convencional y en transición agroecológica.
Partido de La Plata, Argentina. Agroecología 5, 33-40.
Beltramo, J., Berolaccini,
I., González, A. 2006. Spiders of soybean crops in Santa Fe
Province, Argentina: Influence of surrounding spontaneous vegetation on lot
colonization. Brazilian Journal of Biology 66: 891-898.
Begon, M., Townsend, C.R., Harper, J.L. 2006. Ecology: From
individuals to ecosystems, Blackwell Publishing Ltd,
Oxford, UK.
Benamú, M. 2010. Composición
y estructura de la comunidad de arañas en el sistema de cultivo de soja
transgénica. Tesis de Doctorado, Universidad Nacional de La Plata,
Argentina. Disponible en: https://sedici.unlp.edu.ar/handle/10915/82345
Benamú, M., Schneider, M., Sánchez, N. 2010. Effects
of the herbicide glyphosate on biological attributes of Alpaida veniliae
(Araneae, Araneidae), in laboratory. Chemosphere 78: 871-876.
Bishop,
L., Riechert, S. 1990. Spider colonization of
agroecosystems: Mode and source. Environmental Entomology 19:
1738-1745.
Blanco Valdes, Y. 2016. El
rol de las arvenses como componente en la biodiversidad de los
agroecosistemas. Cultivos Tropicales 37(4), 3456. https://doi.org/10.13140/RG.2.2.10964.19844
Cardoso, P., Pekár, S.,
Jocqué, R., Coddington, J. 2011. Global patterns of guild
composition and functional diversity of spiders. PLoS ONE 6(6) https://doi.org/10.1371/journal.pone.0021710
Chao, A. 1984. Nonparametric estimation of the number of classes in a
population. Scandinavian Journal of Statistics 11: 265-270.
Coldwell, R.K. 2013. EstimateS: Statistical estimation of
species richness and shared species from samples. Version 9. User’s
Guide and Application. http://purl.oclc.org/estimates [accessed 16 September 2021].
Colwell,
R., Coddington, J. 1994. Estimating terrestrial
biodiversity through extrapolation. Philosophical Transactions of the Royal
Society of London. Series B, Biological Sciences 345: 101-118.
Cunha, J., Andrade, E., Silva,
P., Barros, R. 2015. Araneofauna (Arachnida, Araneae) in
conventional and organic crops of watermelon (Citrullus lanatus) in
northeastern Brazil. Revista Colombiana de
Entomología 41 (1): 68-75.
Danisman, T., Bayram, A.,
Corak, I., Yigit, N. 2007. An investigation on spider fauna of
cereal fields in Antalya (Araneae). International Journal of Natural
and Engineering Sciences 1: 17-23.
Gabellone, C. 2019. Estudio
de la comunidad de arañas en alcaucil y su rol como bioindicadoras de
disturbios ecológicos a través de su susceptibilidad a plaguicidas. Tesis
de Doctorado, Universidad Nacional de La Plata, Argentina. Disponible en: https://sedici.unlp.edu.ar/handle/10915/73591
García, S.M., Cravero, V.P.
2016. Proceedings of the IX International Symposium on
Artichoke, Cardoon and Their Wild Relatives. ISHS Acta Horticulturae 1147.
Available at https://www.ishs.org/ishs-book/1147
García, E., Cravero, V.,
López Anido, F., Cointry, E. 2014. El cultivo de la alcachofa en Argentina.
Serie Documentos. Facultad de Ciencias Agrarias. Universidad Nacional de
Rosario-Argentina. Rosario, Argentina y Grupo THM. http://www.poscosecha.com/es/publicaciones/
García, S.M., Cravero, V.,
López Anido, F., Cointry, E. 2017. El cultivo de la alcachofa en Argentina. En:
Namensy, A., Delgado, A., Pasasseit, P., Conesa, C., Namensy, C., Rodríguez, M.
(Coord.), Info espárrago y alcachofa 2017, pp. 6-20. SPE 3, Especialistes
en Serveis per a la Producció Editorial SL, Valencia, España. Disponible en: https://issuu.com/horticulturaposcosecha/docs/info_esparrago_alcachofa_2016-17
Goh, K., Lange,
W. 1989. Microarthropods Associated with
Insecticide-Treated and Untreated Artichoke Fields in California. Journal of
Economic Entomology 82(2): 621-625.
González, A., Liljesthröm, G., Castro, D., Armendano, A. 2009. Development and recruitment of Misumenops pallidus
(Keyserling) (Araneae: Thomisidae), and its synchrony with three potential prey
species in soybean cultures from Argentina. Entomological
News 120: 41- 52 https://doi.org/10.3157/021.120.0110
Green, J. 1996. Spiders in biological control - An Australian
perspective. Revue suisse de Zoologie 1: 245-253.
Grismado, C., Ramírez
M.J., Izquierdo, A. 2014. Araneae: taxonomía, diversidad y clave de
identificación de familias de la Argentina. Pp. 55-94. En:
Roig-Juñent, S., Claps, L.E., Morrone, J.J. (Directores). Biodiversidad
de Artrópodos Argentinos, volumen 3. Editorial INSUE - UNT, San Miguel de
Tucumán, Argentina.
Guerrero Casas, F., Ramírez Hurtado, J. 2012. El análisis de escalamiento
multidimensional: una alternativa y un complemento a otras técnicas
multivariantes. La Sociología En Sus Escenarios 25. Recuperado a
partir de https://revistas.udea.edu.co/index.php/ceo/article/view/11450
Hammer, Ø, Harper, D.A., Ryan, P. 2001. PAST:
Paleontological Statistics software package for education and data analysis. Palaeontologia
Electronica 4: 4.
Jiménez Valverde,
A., Hortal, J. 2003. Las curvas de acumulación de especies y la necesidad
de evaluar la calidad de los inventarios biológicos. Revista Ibérica de
Aracnología 8: 151-161.
Koleff, P. 2005. Conceptos y
medidas de la diversidad beta. En: Halffter, G., Soberón, J., Koleff, P.,
Melic, A. (Eds.), Sobre diversidad biológica: el significado de las
diversidades alfa, beta y gamma, pp. 19-40. m3m-Monografías 3ercer
Milenio, vol. 4. SEA, CONABIO, Grupo DIVERSITAS y CONACYT, Zaragoza, España.
Larco Aguilar, A.V. 2018. Entomofauna
predadora de suelo en alcachofa (Cynara scolymus L.) y palta (Persea americana
M.) en Vegueta, provincia Huaura- Lima. Universidad Nacional Agraria la
Molina. Lima. Perú.
Levi, H., Levi, L. 1962. The genera of the spiders family Theridiidae. Bulletin of the Museum of Comparative Zoology 127: 1-71.
Liljesthröm, G., Minervino, E., Castro, D., González, A. 2002. La
comunidad de arañas del cultivo de soja en la provincia de Buenos Aires,
Argentina. Neotropical Entomology 31: 197-209. https://doi.org/10.1590/S1519-566X2002000200005
Magurran, A.E. 1988. Ecological diversity and its measurement.
Princeton University Press, New York, USA.
Marfil, M.F., Scioscia, C.L.,
Armendano, A., González, A. 2015. Diversity of Salticidae
(Arachnida: Araneae), in the historical and natural reserve “Martín Garcia
Island”, Argentina. Journal of Natural History 50: 689-700.
Mashavakure, N., Mashingaidze, A., Musundire, R., Nhamo, N., Gandiwa, E.,
Thierfelder, C., Muposhi, V. 2019. Spider community shift in response to
farming practices in a sub-humid agroecosystem of southern Africa. Agriculture, Ecosystems & Environment
272: 237-245.
Millidge, A. 1991. Further linyphiid spiders (Araneae) from South America. Bulletin of the American Museum of Natural History 205: 1-199.
Minervino, E. 1996. Estudio biológico y ecobiológico de arañas
depredadoras de plagas de soja. Tesis de Doctorado, Universidad Nacional de
La Plata, Argentina. Disponible en: http://sedici.unlp.edu.ar/handle/10915/4758
Nyffeler,
M., Sunderland, K. 2003. Composition, abundance and
pest control potential of spider communities in agroecosystems: a comparison of
European and US studies. Agriculture, Ecosystems & Environment
95: 579-612.
Paleologos, M.F., Flores,
C., Sarandon, S., Stupino, S., Bonicatto, M. 2008. Abundancia y diversidad de
la entomofauna asociada a ambientes seminaturales en fincas hortícolas de La
Plata, Buenos Aires, Argentina. Revista Brasileira de Agroecologia 3:
28-40.
Pengue, W., Altieri, M.A.
2005. La soja transgénica en América Latina. Una maquinaria de hambre,
deforestación y devastación socio ecológica. Ecología política
(30), 87-94. Disponible en: https://www.ecologiapolitica.info/wp-content/uploads/2017/06/030_Altierietal_2006.pdf
Ramírez, M.J. 1999. Clave para
familias de Arañas Argentinas. En: Roig-Juñent S.L., Claps L.E., Morrone J.J.
(eds.), Biodiversidad de artrópodos argentinos. Universidad Nacional de
Tucumán, San Miguel de Tucumán, Argentina. p. 90-94.
Rodrigues, E.N., Mendonça,
L., Ott, R. 2008. Fauna de aranhas (Arachnida, Araneae) em diferentes estágios
do cultivo do arroz irrigado em Cachoeirinha, RS, Brasil. Iheringia.
Série Zoologia 98 (3): 362-371. https://doi.org/10.1590/S0073-47212008000300011
Rypstra,
A.L., Carter, P. 1995. Top-down
effects in soybean agroecosystems: Spider density affects herbivore damage. Oikos
72: 433-439. https://doi.org/10.2307/3546129
Rypstra, A.L., Carter, P., Balfour, R., Marshal, S. 1999. Architectural
features of agricultural habitats and their impacts on the spider inhabitants. Journal of Arachnology 27(1):
371-377. Available at: https://www.jstor.org/stable/3706009
Samu, F.,
Lövei, G. 1995. Species richness of a spider
community (Araneae): extrapolation from simulated increasing sampling effort. European Journal of Entomology 92(4):
633-638. Available at: https://www.eje.cz/pdfs/eje/1995/04/06.pdf
Schmidt,
M., Tscharntke, T. 2005. The role of perennial
habitats for Central European farmland spiders. Agriculture,
Ecosystems & Environment 105: 235- 242. http://dx.doi.org/10.1016/j.agee.2004.03.009
Sokal, R.,
Rohlf, F.J. 1981. Biometry. W.H. Freeman and Company, San Francisco, CA, USA.
Solomou, A.D., Molla, A., Skoufogianni, E., Pavlocek, T., Nicholaor, G.
2015. Environmental responses of soil arthropod
communities to low input cultivation of Cynara cardunculus in the
mediterranean region. Journal of Advanced Studies in Agricultural,
Biological and Environmental Sciences 2(4). Available at: http://jabe.in/2.4.15/71-82%20ALEXANDRA%20D.%20SOLOMOU.pdf
Strassera, M.E., Schneider, M., Pretti Slanco, V., Caballero, E., Kuzmanich,
R., Mirande, L., Haramboure, M., et al. 2013. Enemigos naturales
asociados al cultivo de alcaucil en el Cinturón Hortícola Platense. [Comunicación
en congreso] XXXVI Congreso Argentino de Horticultura,Tucumán, Argentina. Horticultura Argentina 32 (79): 73.
Sunderland, K., Samu, F. 2000. Effects of agricultural diversification on the
abundance, distribution, and pest control potential of spiders: a review. Entomologia
Experimentalis et Applicata 91(1): 1-13 https://doi.org/10.1046/j.1570-7458.2000.00635.x
Thomas, C.F., Jepson, P.C.
1997. Field‐scale effects of farming
practices on linyphiid spider populations in grass and cereals. Entomologia
Experimentalis et Applicata 84(1): 59-69. https://doi.org/10.1046/j.1570-7458.1997.00198.x
Yong, A. 2010. La biodiversidad
florística en los sistemas agrícolas. Cultivos tropicales 31(4).
Recuperado de: https://ediciones.inca.edu.cu/index.php/ediciones/article/view/71
World
Spider Catalog 2021. World Spider Catalog,
Version 22.0. Natural History Museum, Bern, Germany. [online] (Accesed on
2 July 2021). Available at: http://wsc.nmbe.ch
![]() , Andrea Armendano1,*
, Andrea Armendano1,* ![]() , Alda González1
, Alda González1 ![]()




